IFN-γ抗鹦鹉热衣原体急性感染保护作用研究
唐国芳,陈丽丽,刘良专,王 川,卢兰芬,吴移谋
IFN-γ抗鹦鹉热衣原体急性感染保护作用研究
唐国芳1,2,陈丽丽1,刘良专1,王 川1,卢兰芬3,吴移谋1
工作单位:1.南华大学医学院病原生物学研究所,衡阳 421001; 2.广州市第八人民医院传染病研究所,广州 510060; 3.中山市人民医院检验医学中心,中山 528403
目的 探讨IFN-γ对鹦鹉热衣原体(Chlamydiapsittaci,Cps)的抗感染作用,为进一步阐明机体抗衣原体免疫机制提供参考数据。方法 不同浓度的重组人IFN-γ(5 ng/mL、25 ng/mL和50 ng/mL)作用于感染Cps6BC的HeLa细胞,48 h后计数包涵体数量,并观察包涵体形态的改变。2×106IFUs Cps 6BC滴鼻感染C57BL/6J小鼠,于感染前、后24 h腹腔内注射10 μg重组鼠IFN-γ,观察小鼠体重、活动状态、生存率等一般指标,分别于感染后5 d和10 d处死小鼠,取肝、肺组织进行HE染色检测其病理变化;并取感染后5 d的肺组织,匀浆,计数其中Cps包涵体数量。结果 感染48 h后,Cps 6BC在5 ng/mL、25 ng/mL、50 ng/mL重组人IFN-γ处理的HeLa细胞中包涵体数量低于对照组(包涵体数分别为(23.8±5.1)×106,(10±3.58)×106,(8.0±2.22)×106,(43.3±11.05)×106,衣原体包涵体形状不规则,体积变小。小鼠实验显示,腹腔注射IFN-γ可明显提高Cps6BC感染小鼠生存率,并减轻急性临床表现及脏器病变。结论 IFN-γ可发挥早期抗Cps感染的保护作用。
干扰素-γ;鹦鹉热衣原体;急性感染;免疫保护
鹦鹉热衣原体(Chlamydiapsittaci,C.psittaci,Cps)为革兰阴性胞内寄生菌,主要感染家禽和宠物鸟,可经气溶胶吸入或密切接触传染给人[1-2]。依据Cps菌株和宿主类型的不同,其临床疾病表现多种多样。禽类和牲畜类主要表现为肺炎和慢性肠炎表现,人类主要表现为呼吸系统感染,也可累及身体其他脏器,如心包炎、心内膜炎、脑炎、肝脾肿大、眼附属器淋巴瘤等,重者可发生多脏器功能衰竭或死亡[2-3]。
IFN-γ生物学活性十分广泛,在免疫应答和免疫调节过程中发挥重要作用。系列实验研究发现,IFN-γ可抑制衣原体生长,但IFN-γ浓度不同,对衣原体生长的抑制程度不同[4-5]。IFN-γ对不同衣原体菌株的作用也有一定的差异,如Nelson[6-10]等报道CD4+ T细胞分泌的IFN-γ能有效清除沙眼衣原体(C.trachomatis,Ct),但清除鼠衣原体(MoPn)的作用却较小。Cps不管从基因组同源性、感染的宿主范围、引发的宿主免疫反应还是引起的疾病类型,均与其他衣原体存在较大的差异[11]。而IFN-γ对Cps的作用未见系统研究报道。本文拟从细胞实验及动物体内实验初步研究IFN-γ对Cps的作用,为进一步阐明机体抗衣原体免疫机制提供参考数据。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞Cps6BC菌株(ATCC VR-125)受赠于美国德克萨斯大学圣安东尼奥健康科学中心(UTHSCSA)钟光明教授;HeLa细胞购自上海中国科学院细胞库。
1.1.2 主要试剂 RPMI 1640培养液和胎牛血清购自GIBCO公司;兔抗Cps一抗受赠于美国德克萨斯大学圣安东尼奥健康科学中心(UTHSCSA)钟光明教授;FITC 标记山羊抗兔IgG 购自上海碧云天生物技术有限公司;重组鼠IFN-γ和重组人IFN-γ购自PeproTech公司。
1.1.3 实验动物 动物近交系6~8周龄SPF级雌性C57BL/6J小鼠购自湖南斯莱克景达实验动物有限公司。
1.2 方法
1.2.1 细胞和衣原体培养 HeLa细胞培养于含10%胎牛血清的RPMI 1640培养基中,以1×105个/孔的细胞数接种于24 孔板内(提前铺好直径为13 mm的圆盖玻片),37 ℃,5%CO2温箱培养至细胞密度大约在80%时,感染2×106IFUsCps6BC,低速离心30 min,再37 ℃,5%CO2温箱培养2 h后,更换含2 mg/L放线菌酮的衣原体分离培养基继续培养至实验所需时间。
1.2.2 衣原体包涵体定量检测 间接免疫荧光法检测衣原体包涵体数量。感染细胞经甲醇∶丙酮=1∶1固定液固定后,以兔抗Cps抗血清为一抗,FITC标记的山羊抗兔IgG为二抗(绿色),用Hoechst 33258进行细胞核染色。用荧光显微镜计数其中衣原体包涵体数量。实验重复三次,取三次实验的平均值。
1.2.3 重组人IFN-γ抗Cps6BC感染体外实验 2×106IFUSCps6BC感染HeLa细胞,2 h后弃衣原体感染液,PBS清洗两次,分别更换含5 ng/mL、25 ng/mL、50 ng/mL重组人IFN-γ(recombinant human IFN-γ,rhIFN-γ)的衣原体生长培养基,同时设不加rhIFN-γ对照组。37 ℃、5% CO2恒温细胞培养箱中培养48 h后,进行荧光抗体染色,计数各组衣原体包涵体数量。
1.2.4 重组鼠IFN-γ抗Cps6BC感染体内实验 SPF级6~8周龄雌性C57BL/6J小鼠32只,体重18~20 g,分成四组,每组8只。2×106IFUsCps6BC鼻内感染小鼠,实验组在感染衣原体前24 h(rmIFN-γ+Cps组)和后24 h(Cps+ rmIFN-γ组)内腹腔注射重组鼠IFN-γ(recombinant murine IFN-γ,rmIFN-γ)10 μg/只,同时设非处理Cps感染小鼠对照和PBS滴鼻非感染组对照。每天观察小鼠食欲情况、活动状态,动态监测生长状况、体重及生存率等。
1.2.5 鼠肺、肝组织的病理检测 于感染Cps后的第5 d和第10 d处死小鼠,分离肺、肝组织,甲醛固定,石蜡包埋,切片行HE染色,观察并记录其病变程度。
1.2.6 鼠肺组织匀浆中衣原体计数 处死小鼠后,取肺组织加入5 mL预冷的SPG,匀浆,短暂超声,系列稀释后取合适稀释度的稀释液感染HeLa单层细胞,进行间接免疫荧光染色计数衣原体数量。
2 结 果
2.1 IFN-γ对Cps6BC在体外生长的影响Cps6BC感染HeLa细胞后,分别用5 ng/mL、25 ng/mL、50 ng/mL的rhIFN-γ处理,48 h后经免疫荧光染色。结果表明,rhIFN-γ处理的3组衣原体包涵体形状不规则,体积变小,释放到细胞外的原体(elementary bodies,EBs)数量较对照组减少,尤以50 ng/mL的高剂量组表现最为明显(图1)。3个剂量组包涵体数量分别为(23.8±5.1)×106,(10±3.58)×106,(8.0±2.22)×106,对照组为(43.3±11.05)×106。经统计学分析,rhIFN-γ处理组包涵体数量明显高于非处理组(P<0.05),且呈一定的剂量依赖性(图2)。
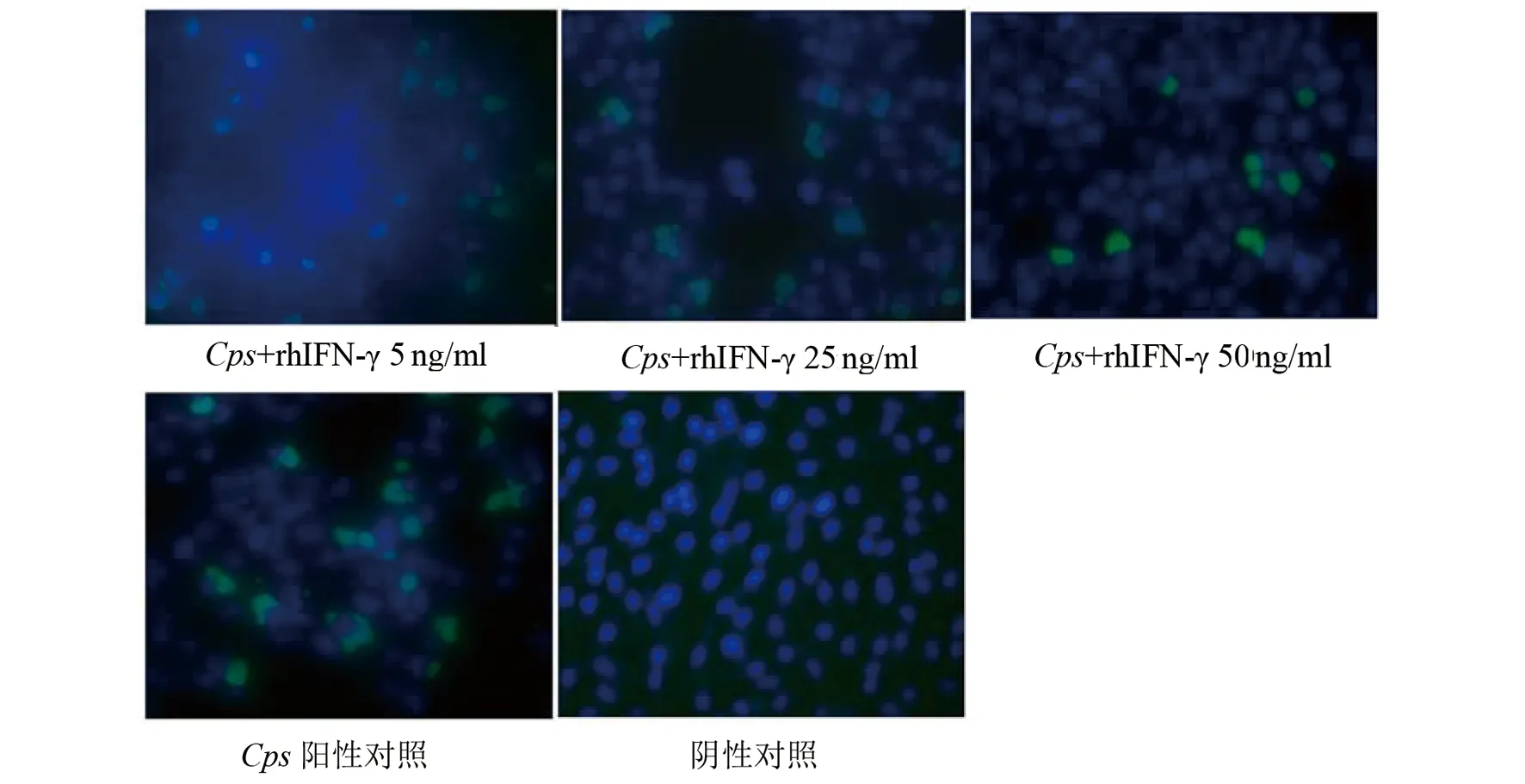
图1 rmIFN-γ抑制HeLa细胞内Cps 6BC的生长(×400)Fig.1 Recombinant human IFN-γ inhibited C. psittaci 6BC growth in Hela cells
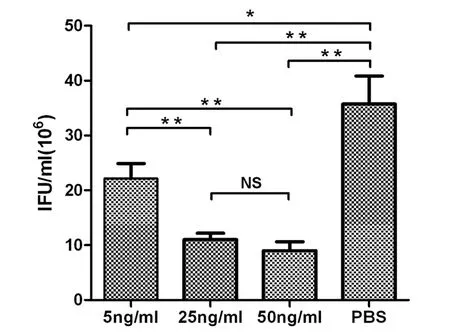
Statistical significance was determined by Unpaired t test (* P<0.05; ** P<0.01)图2 rmIFN-γ抑制Cps 6BC包涵体增殖Fig.2 Recombinant human IFN-γ inhibited C. psittaci 6BC inclusions proliferation
2.2 IFN-γ对Cps感染小鼠体重的影响 2×106IFUSCps 6BC鼻内感染C57BL/6J小鼠后,第2 dCps感染组小鼠精神倦怠,双眼半睁,眼角有黄色分泌物,背部蜷缩,步态趔趄。而在感染衣原体前、后24 h经rmIFN-γ处理的实验组小鼠精神较PBS组略差外,其饮食、活动均未受明显影响。
每日记录4组小鼠体重变化,感染后第2 d,Cps感染组体重下降(2.75±0.89)g,rmIFN-γ+Cps组下降(1.00±1.07)g,Cps+ rmIFN-γ组下降(1.88±1.36)g;而PBS对照组体重增加(0.13±0.99)g,经统计学分析,rmIFN-γ+Cps组体重下降程度显著低于Cps感染组,差异有统计学意义(P<0.05),但Cps+ rmIFN-γ组与Cps感染组相比,差异无统计学意义(P>0.05)。感染后5 d,Cps感染组体重下降为(3.75±0.88)g,rmIFN-γ+Cps组下降(1.25±0.89)g,Cps+rmIFN-γ组下降(1.5±1.82)g,rmIFN-γ+Cps、Cps+rmIFN-γ组与Cps感染组比较差异均有统计学意义(P<0.01)。但无论是感染后2 d还是5 d,rmIFN-γ+Cps与Cps+rmIFN-γ组间差异均无统计学意义(P>0.05)(图3)。2.3 IFN-γ对Cps感染小鼠生存率的影响 感染后5 d,rmIFN-γ+Cps、Cps+mIFN-γ、Cps、PBS组小鼠生存率分别为100.0%、87.5%、37.5%、100.0%;感染后10 d,分别为75.0%、43.75%、12.5%、100.0%。rmIFN-γ+Cps、Cps+rmIFN-γ组与Cps感染组比较差异均有统计学意义(P<0.01),而rmIFN-γ+Cps与Cps+rmIFN-γ组间差异无统计学意义(P>0.05)(图4)。
2.4 IFN-γ对衣原体所致小鼠肺、肝组织病变的影响 分别于感染后第5 d和10 d处死小鼠,分离肺脏和肝脏。HE染色后,可见经rmIFN-γ处理的小鼠肺泡腔清亮,肺泡间隔增宽,细支气管肺泡上皮增生,有多形核白细胞(polymorphonuclear leukocyte,PMN)浸润,感染后10 d肺部炎症几乎完全清除。而未经rmIFN-γ处理的Cps感染小鼠肺组织出现重度肺炎的改变,肺泡间隔模糊不清,肺泡腔内充血,肺泡间隔毛细血管充血伴浆液渗出,支气管见炎性渗出液,大量淋巴细胞增生(图5)。经rmIFN-γ处理的Cps感染小鼠肝组织病变不明显,仅见少量的炎性细胞,而未经rmIFN-γ处理的Cps感染小鼠肝组织有大量的淋巴细胞、PMNs和单核细胞浸润,部分肝细胞坏死(图6)。
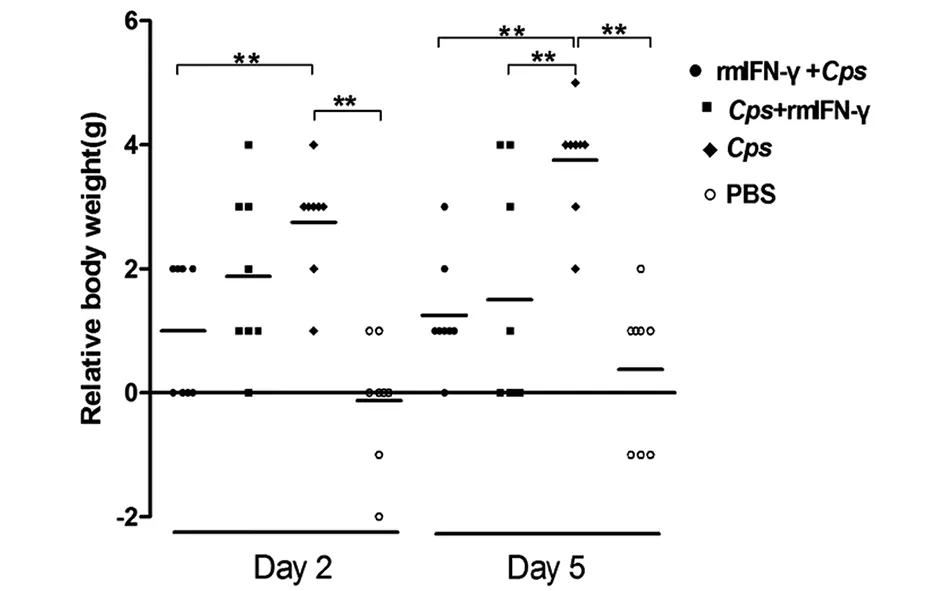
Statistical significance was determined by Log-rank Test (* P<0.05; ** P<0.01)图3 rmIFN-γ对Cps 6BC感染小鼠体重的影响Fig.3 Influence of rmIFN-γ on body weight of C. psittaci-infected mice
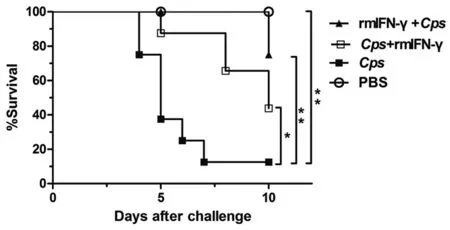
Statistical significance was determined by Log-rank test (* P<0.05; ** P<0.01)图4 rmIFN-γ对Cps 6BC感染小鼠生存率的影响Fig.4 Influence of rmIFN-γ on survival rate of C. psittaci-infected mice
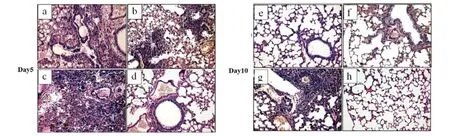
a,e: rmIFN +Cps; b,f: Cps +rmIFN; c,g: Cps control; d,h: PBS图5 rmIFN-γ对C. psittaci 6BC 感染小鼠肺病理损伤的影响(×200)Fig.5 Influence of rmIFN-γ on lung pathology of C. psittaci-infected mice
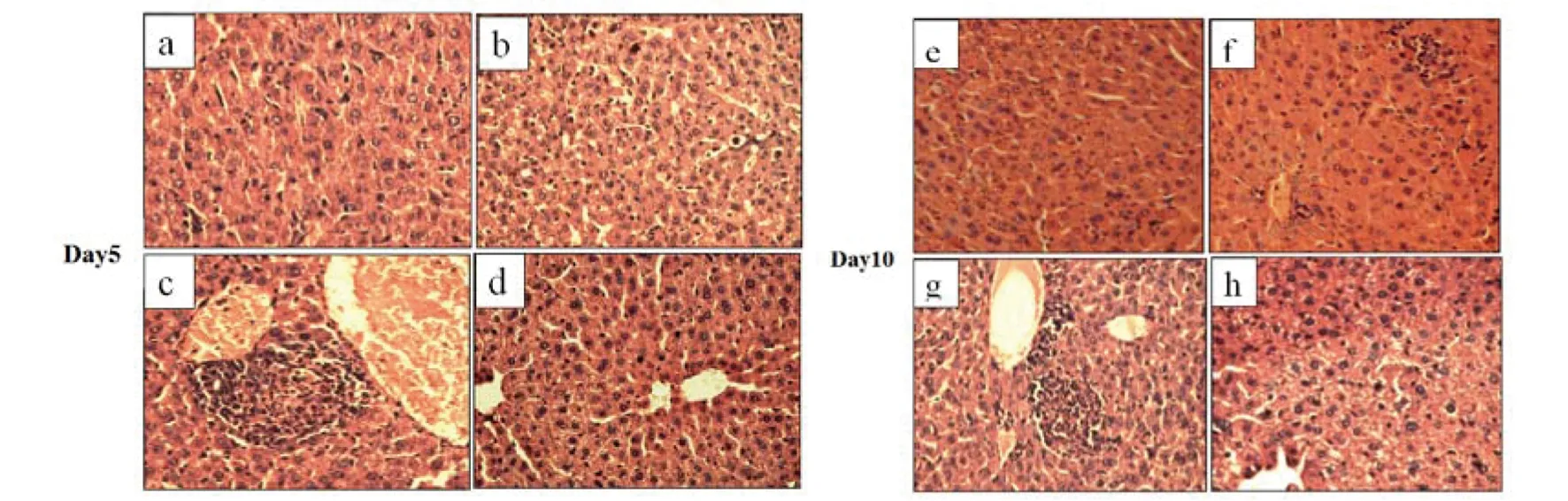
a,e: rmIFN +Cps; b,f: Cps +rmIFN; c,g: Cps control; d,h: PBS图6 rmIFN-γ处理感染Cps 6BC 5天、10天的鼠肝组织HE染色图(×400)Fig.6 Influence of rmIFN-γ on liver pathology of C. psittaci-infected mice
2.5 IFN-γ对Cps在小鼠肺组织中清除速度的影响 rmIFN-γ处理Cps6BC感染小鼠5 d后,无菌取鼠肺组织,SPG匀浆并取合适稀释度的稀释液感染HeLa单层细胞,于5% CO2恒温箱中培养72 h后计数各组肺组织包涵体数量。rmIFN+Cps、Cps+rmIFN、Cps感染组包涵体数量分别为(5.25×103)±(1×102),(3.60×104)±(2.5×102),(9.80×108)±(3.0×102)。经统计学分析,发现两rmIFN-γ处理组小鼠肺组织中包涵体数量明显低于Cps感染组(P<0.05);而rmIFN +Cps与Cps+rmIFN两组间差异无统计学意义(P>0.05)(图7)。
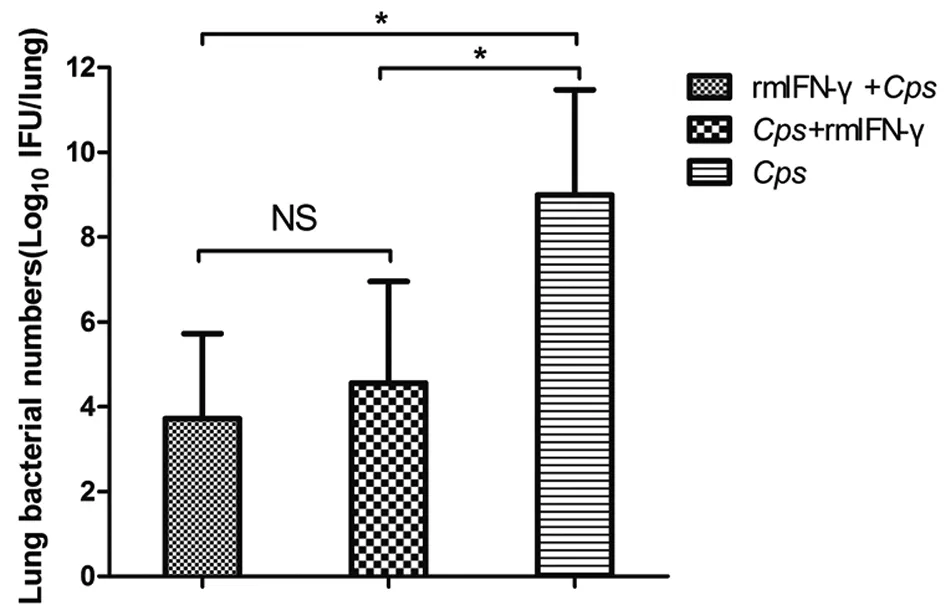
Statistical significance was determined by Unpaired t test (* P<0.05)图7 小鼠肺组织Cps 6BC包涵体数量Fig.7 Effect of rmIFN-γ on the number of inclusion bodies in lung tissues of C. psittaci 6BC infected mice
3 讨 论
IFN-γ是宿主抵御细胞内病毒、细菌和原虫感染的主要细胞因子,在抗衣原体早期感染中也发挥着举足轻重的作用。由于IFN-γ介导的抗衣原体的敏感性因衣原体菌种、菌株的不同而有所差异,IFN-γ对Cps的作用尚未见系统报道。本文从细胞和小鼠体内实验初步研究了IFN-γ在Cps感染过程中的作用。
不同浓度的rmIFN-γ作用于感染Cps 6BC的HeLa细胞,5.0 ng/mL rmIFN-γ即可抑制C.psittaci在感染细胞中的增殖,且随着IFN-γ剂量的加大,抗衣原体作用越来越明显。50 ng/mL rmIFN-γ处理的衣原体包涵体体积明显缩小,约为对照组的1/3~1/4大小,形态不规则,释放到细胞外的EBs亦明显减少,这与文献报道一致[12]。Munir A等用100U/mL 的外源性IFN-γ作用于Ct感染的THP-1细胞,发现其EBs数量仅为对照组的一半,电镜下见EBs表面覆盖有两层包膜,难以释放到细胞外,始体形状不规则,不能发育成新的EB,囊泡液明显增多[13]。
为进一步证实IFN-γ抗Cps的保护作用,本研究成功构建了小鼠鼻腔感染Cps模型。动物实验结果显示,经IFN-γ处理的实验小鼠与未处理的Cps感染小鼠相比,体重下降幅度小,死亡率降低,肺组织内衣原体包涵体数量明显少于对照组,肝肺组织病理病变亦明显减轻,再次证明IFN-γ具有抗Cps急性感染保护作用。Zhong等也报道,在感染衣原体前24 h用外源性rmIFN-γ能显著抑制CtL1血清型菌株在BALB/c小鼠体内增殖[14-15]。
关于IFN-γ对抗衣原体感染的作用机制目前还没有统一的观点。有学者认为IFN-γ介导抗衣原体感染的效应机制主要有诱导激活吲哚胺2,3二氧化酶(indoleamine 2,3-dioxygenase,IDO)途径[16-17]、激活诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)途径[18]及诱导铁缺失途径[19]。另外IFN-γ可介导激活hGBP1和hGBP2,引发吞噬有衣原体包涵体的溶酶体降解和抑制巨噬细胞自噬潮被激活;或介导衣原体DNA复制、转录以及细胞壁生物合成的ftsW和amiA基因显著下调,发挥抗衣原体感染效应机制[13, 20-21],也可通过诱导p47 GTPase、65-kD GTPase家族蛋白和Irga6蛋白的表达,修饰衣原体包涵体促进溶酶体溶菌从而抵御衣原体感染[21-23]。尽管IFN-γ能够通过多种途径发挥抗衣原体感染效应,但衣原体同样可以逃避宿主IFN-γ对自身的干扰,如鼠衣原体限制GTPases家族蛋白Irgb10或其它成员进入包涵体逃避IFN-γ诱导的宿主抗衣原体作用[24];降解上游转录刺激因子-1(upstream stimulatory factor-1,USF-1)阻断IFN-γ信号通路,进而抑制IFN-γ诱导的MHCⅡ类分子的表达,以逃避CD4+T细胞介导的免疫应答[25];肺炎衣原体也可通过诱导激活多胺信号通路抑制iNOS转录,减少NO的生成,从而逃避宿主的固有免疫应答[26]。因此,IFN-γ介导的抗衣原体作用大小与衣原体种型、作用剂量等密切相关。
本文在细胞水平及体内实验初步证实了IFN-γ可在一定程度上发挥抗BALB/c小鼠感染作用,但具体机制仍有待进一步深入研究。
[1] Harkinezhad T, Verminnen K, De Buyzere M, et al. Prevalence ofChlamydophilapsittaciinfections in a human population in contact with domestic and companion birds[J]. J Med Microbiol, 2009, 58(Pt 9): 1207-1212.DOI: 10.1099/jmm.0.011379-0
[2] Knittler MR, Sachse K.Chlamydiapsittaci: update on an underestimated zoonotic agent[J]. Pathog Dis, 2015, 73(1): 1-15.DOI: 10.1093/femspd/ftu007
[3] Sliwa-Dominiak J, Suszynska E, Pawlikowska M, et al.Chlamydiabacteriophages[J]. Arch Microbiol, 2013, 195(10-11): 765-771.DOI: 10.1007/s00203-013-0912-8
[4] Wyrick PB.Chlamydiatrachomatis persistenceinvitro: an overview[J]. J Infect Dis, 2010, 201 Suppl 2: S88-95.DOI: 10.1086/652394
[5] Jerchel S, Kaufhold I, Schuchardt L, et al. Host immune responses after hypoxic reactivation of IFN-gamma induced persistentChlamydiatrachomatis infection[J]. Front Cell Infect Microbiol, 2014, 4: 43.DOI: 10.3389/fcimb.2014.00043
[6] Beatty WL, Morrison RP, Byrne GI. Reactivation of persistentChlamydiatrachomatis infection in cell culture[J]. Infect Immun, 1995, 63(1): 199-205.DOI: 0019-9567/95/$04.0010
[7] Pantoja LG, Miller RD, Ramirez JA, et al. Characterization ofChlamydiapneumoniae persistence in HEp-2 cells treated with gamma interferon[J]. Infect Immun, 2001, 69(12): 7927-7932.DOI: 10.1128/IAI.69.12.7927-7932.2001
[8] Nelson DE, Virok DP, Wood H, et al.ChlamydialIFN-gamma immune evasion is linked to host infection tropism[J]. Proc Natl Acad Sci U S A, 2005, 102(30): 10658-10663.DOI: 10.1073/pnas.0504198102
[9] Morre SA, Lyons JM, Ito JI, Jr. Murine models ofChlamydiatrachomatis genital tract infection: use of mouse pneumonitis strain versus human strains[J]. Infect Immun, 2000, 68(12): 7209-7211.
[10] Roshick C, Wood H, Caldwell HD, et al. Comparison of gamma interferon-mediated antichlamydial defense mechanisms in human and mouse cells[J]. Infect Immun, 2006,74(1): 225-238.DOI: 10.4049/jimmunol.180.9.6237
[11] Knittler MR, Berndt A, Bocker S, et al.Chlamydiapsittaci: new insights into genomic diversity, clinical pathology, host-pathogen interaction and anti-bacterial immunity[J]. Int J Med Microbiol, 2014, 304(7): 877-893.DOI: 10.1016/j.ijmm.2014.06.010
[12] Beatty WL, Byrne GI, Morrison RP. Morphologic and antigenic characterization of interferon gamma-mediated persistentChlamydiatrachomatis infection in vitro[J]. Proc Natl Acad Sci U S A, 1993, 90(9): 3998-4002.
[13] Al-Zeer MA, Al-Younes HM, Lauster D, et al. Autophagy restrictsChlamydiatrachomatis growth in human macrophages via IFNG-inducible guanylate binding proteins[J]. Autophagy, 2013, 9(1): 50-62.DOI: 10.4161/auto.22482
[14] Zhong GM, de la Maza LM. Activation of mouse peritoneal macrophages in vitro orinvivoby recombinant murine gamma interferon inhibits the growth of Chlamydia trachomatis serovar L1[J]. Infect Immun, 1988, 56(12): 3322-3325.DOI:0019-9567/88/123322-04$02.00/0
[15] Zhong GM, Peterson EM, Czarniecki CW, et al. Recombinant murine gamma interferon inhibitsChlamydiatrachomatis serovar L1 in vivo[J]. Infect Immun, 1988, 56(1): 283-286.DOI :0019-9567/88/010283-04$02.00/0
[16] Muramatsu MK, Brothwell JA, Stein BD, et al. Beyond tryptophan synthase: identification of genes that contribute toChlamydiatrachomatis survival during IFN-gamma induced persistence and reactivation[J]. Infect Immun, 2016, 84(10): 2791-2801.DOI: 10.1128/IAI.00356-16
[17] Aiyar A, Quayle AJ, Buckner LR, et al[J]. Front Cell Infect Microbiol, 2014, 4: 72.DOI: 10.3389/fcimb.2014.00072
[18] Johnson RM, Kerr MS, Slaven JE. Plac8-dependent and inducible NO synthase-dependent mechanisms clearChlamydiamuridarum infections from the genital tract[J]. J Immunol, 2012, 188(4): 1896-1904.DOI: 10.4049/jimmunol.1102764
[19] Thompson CC, Carabeo RA. An optimal method of iron starvation of the obligate intracellular pathogen,Chlamydiatrachomatis[J]. Front Microbiol, 2011, 2: 20.DOI: 10.3389/fmicb.2011.00020
[20] Tietzel I, El-Haibi C, Carabeo RA. Human guanylate binding proteins potentiate the anti-chlamydia effects of interferon-gamma[J]. PLoS One, 2009, 4(8): e6499.DOI: 10.1371/journal.pone.0006499
[21] Burian K, Endresz V, Deak J, et al. Transcriptome analysis indicates an enhanced activation of adaptive and innate immunity by chlamydia-infected murine epithelial cells treated with interferon gamma[J]. J Infect Dis, 2010, 202(9): 1405-1414.DOI: 10.1086/656526
[22] Kim BH, Shenoy AR, Kumar P, et al. A family of IFN-gamma-inducible 65-kD GTPases protects against bacterial infection[J]. Science, 2011, 332(6030): 717-721.DOI :10.1126/science.1201711
[23] Al-Zeer MA, Al-Younes HM, Braun PR, et al. IFN-gamma-inducible Irga6 mediates host resistance againstChlamydiatrachomatis via autophagy[J]. PLoS ONE, 2009, 4(2): e4588.DOI: 10.1371/journal.pone.0004588
[24] Coers J, Bernstein-Hanley I, Grotsky D, et al.Chlamydiamuridarum evades growth restriction by the IFN-gamma-inducible host resistance factor Irgb10[J]. J Immunol,2008, 180(9): 6237-6245. DOI: 10.4049/jimmunol.180.9.6237
[25] Zhong G, Fan T, Liu L.Chlamydiainhibits interferon gamma-inducible major histocompatibility complex class II expression by degradation of upstream stimulatory factor 1[J]. J Exp Med, 1999, 189(12): 1931-1938.DOI: 10.1084/jem.189.12.1931
[26] Abu-Lubad M, Meyer TF, Al-Zeer MA.Chlamydiatrachomatis inhibits inducible NO synthase in human mesenchymal stem cells by stimulating polyamine synthesis[J]. J Immunol, 2014, 193(6): 2941-2951.DOI: 10.4049/jimmunol.1400377
DOI:10.3969/j.issn.1002-2694.2017.02.003
Protective effect of interferon-γ onChlamydiapsittaciacute infection
TANG Guo-fang1,2, CHEN Li-li1, LIU Liang-zhuan1, WANG Chuan1, LU Lan-fen3, WU Yi-mou1
(1.PathogenicBiologyInstitute,UniversityofSouthChina,Hengyang421001,China;
2.InstituteofInfectiousDiseases,GuangzhouEighthPeople'sHospital,Guangzhou510060,China;
3.MedicalLaboratoryCenterofZhongshanPeople'sHospital,Zhongshan528403,China)
We investigated the effects of IFN-γ onChlamydiapsittaci(Cps) infection. HeLa cells were treated with different concentrations of recombinant human IFN-γ (5 ng/mL, 25 ng/mL, 50 ng/mL) after infecting withC.psittaci6BC, then the number and morphology ofC.psittaciinclusion bodies were examined after 48 hours. C57BL/6J mice were intranasally infected with 2×106IFUsC.psittaci6BC, and intraperitoneally administrated with 10 μg recombinant murine interferon-γ 24 hours prior or post infection, then body weight, activity and survival rate were recorded. The histopathology of mice livers and lungs was analyzed by HE staining on day 5 or day10 post infection. And the chlamydial inclusion bodies were titrated in the lung homogenates of mice sacrificed on day 5 after infection. The inclusion body numbers of recombinant human IFN-γ treated groups (by 5ng/mL, 25ng/mL, 50ng/mL) were significantly less than that in the control group (23.8±5.1)×106, (10±3.58)×106, (8.0±2.22)×106, (43.3±11.05)×106, respectively). And the morphology of inclusion bodies in IFN-γ treated HeLa cells was irregular and much smaller. We also found that IFN-γ could significantly improve the survival rate, reduce acute clinical manifestations and pathological injurery of lung and liver inC.psittacirespiratory tract infected mice model. So we summarized that IFN-γ can mediate strong immunological protection during acuteC.psittaciearly infection.
interferon-γ;Chlamydiapsittaci; acute infection; immune protection
s:Wu Yi-mon,Email:yimouwu@sina.com
10.3969/j.issn.1002-2694.2017.02.002
国家自然科学基金(No.31270218);中山市卫生局科研基金(No.J2012002);中山市科技计划项目(No.2015B1025)联合资助
吴移谋,Email:yimouwu@sina.com
R374
A
1002-2694(2017)02-0098-06
2016-10-25 编辑:李友松
This study supported by National Natural Science Foundation (grant No.31270218);Zhongshan Municipal Health Bureau Research Foundation (Grant No.J2012002);Zhongshan science and technology plan project (Grant No.2015B1025)

