新西兰牛结核病区域化防控与启示
王 昱,陈 俊,陈 枫,王新武,窦树龙
(1.重庆出入境检验检疫局检验检疫技术中心,国家质检总局牛病检测重点实验室,重庆进境陆生动物疫病防控研究工程技术中心,重庆 400020;2.宁波出入境检验检疫局,浙江宁波 315000;3. 乐山市农业质量检验检测中心,四川乐山 614000;4.湖南出入境检验检疫局,湖南长沙 410000;5.国家质量监督检验检疫总局,北京 100020)
新西兰牛结核病区域化防控与启示
王 昱1,陈 俊2,陈 枫3,王新武4,窦树龙5
(1.重庆出入境检验检疫局检验检疫技术中心,国家质检总局牛病检测重点实验室,重庆进境陆生动物疫病防控研究工程技术中心,重庆 400020;2.宁波出入境检验检疫局,浙江宁波 315000;3. 乐山市农业质量检验检测中心,四川乐山 614000;4.湖南出入境检验检疫局,湖南长沙 410000;5.国家质量监督检验检疫总局,北京 100020)
近年来,新西兰牛结核病防控取得了关键性进展,全国牛群期间感染率连续三年维持在0.2%左右,提前18个月实现了防控目标。通过资料分析以及走访调查,新西兰牛结核防控的成效,得益于政府的持续投入、第三方机构的科学落实以及养殖行业的全民参与,其监测计划、区域化管控措施和野生宿主清除措施对我国的牛结核防控具有较高的借鉴价值。
牛结核;防控;区域化管理;产地检疫
新西兰的牛结核病(TB)历史可以追溯到19世纪中叶,到上世纪80年代 ,北岛、塔拉纳基和中坎特伯雷的牛群基本实现了牛结核的根除。但由于澳大利亚短尾负鼠种群的不断扩大和跨地域迁徙,使得牛结核病的流行出现新的特点。1994年,新西兰1 700余头牛和鹿感染结核病[1],达历史新高。为此,新西兰政府根据流行状况实施了极具特色的牛结核病根除计划,到2011年12月,新西兰感染牛群的期间感染率低于0.2%,提前18个月实现了控制目标。但由于出现了新的受感染牛群,2012—2013年感染率上升至 0.21%。据最新数统计,2015—2016年新西兰牛群感染率为0.09%,若在2017年保持感染率低于0.2%,就能达到世界动物卫生组织(OIE)的牛结核病官方无疫要求[2]。为此,笔者收集并整理了近年来新西兰牛结核病监测和防控方面的信息,并结合进口种牛规定疫病的检出情况,分析该病的发展规律,辨别产地预检的侧重点及关注点,进一步指导工作开展。
1 新西兰牛结核病的区域化防控
1.1 实施机构
牛结核病是由牛结核分枝杆菌引起的重要人兽共患传染病,在某些种群中病死率高达40%~60%。19世纪中期,殖民者船舱中的负鼠可能是最早的牛结核病携带者。从上世纪70年代开始,新西兰就启动了全国性的牛结核病防控计划。1998年,新西兰发布了牛结核病害虫管理战略生物安全命令,规定牛结核病是新西兰须通报的动物疫病。目前,该病被列入国家有害生物防控计划(NPMS)[3]。起初,该计划由农业部(即现在的初级产业部)牵头落实。2013年7月,新西兰政府初级产业部(AHB)重组,建立了第三方性质的牛结核病防控组织——TBfree,其成为牛结核病防控和根除的实施机构。该机构从属于非盈利性组织OSPRI New Zealand Ltd,除政府提供的部分资金外,还得到了DairyNZ、Beef+Lamb New Zealand和Deer Industry New Zealand等产业组织和企业的支持。TBfree主要致力于实施NPMS,并以根除牛结核病为最终目的。TBfree的目标有以下几点:一是到2026年,实现家养牛和鹿的牛结核病根除;二是到2040年,实现牛结核病在负鼠中的根除;三是到2055年,实现牛结核病的生物学根除[4]。
TBfree的主要职能包括:一是控制易感动物,包括牛场注册、结核病染疫状态分级、牛和鹿的结核病检测、屠宰染疫动物以及监督农场主执行等;二是控制传播途径,防止该病由染疫动物向无疫区传播,控制该病从染疫农场或高风险地区向外移动,监测和强制执行添加标识、检测及动物状态声明;三是控制野生动物,调查野生动物(负鼠,野猪和雪貂)种群,确定结核病的野生分布情况[4]。新西兰计划在未来15年内,实现至少25 000 000公顷范围内野生动物媒介风险区的减少,同时维持现有的无媒介风险区的无疫状况,把牛结核病疫情控制在较低水平。随着在牛结核病防控经费的持续增加,该病在牛群和鹿群的感染率稳步降低,到目前已经成功控制群体感染率在0.2%以内(图1)。
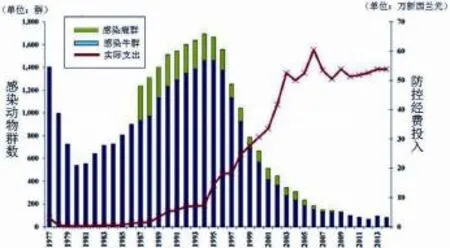
图1 1977—2014年感染牛结核病的家养牛群和鹿群数量及控制野生动物传播媒介的经费支出
1.2 区域化分类管理
根据新西兰NPMS全国操作指导书的要求[3],基于不同牛结核病感染风险状况,可将动物个体划分为:密切接触动物、反应动物、阳性动物、阴性动物和感染动物。其中,反应动物是指检测结果阳性需要立即屠宰的动物;阳性动物是指筛查检测为阳性且需要进一步确诊或屠宰的动物;符合下述情况之一的为牛结核病感染动物:一是屠宰后发现有特征性病理变化的,二是样本培养或PCR阳性,三是至少两种认可检测方法阳性,四是检测阳性后没有在认可的兽医检查的情况下屠宰或死亡的。
根据牛结核病风险水平的不同,可将畜群划分为:感染群、无疫群和处于暂停状态的感染状况不明群(S)。在出口检疫过程中常见到C1、C2、C10和CM的农场:C1代表1年内标准监测无疫;C2代表18个月内(或C1后1年内)连续监测无疫;C10是指10年连续监测无疫,C后面的数字代表无疫的年份长短;CM表示非种用牛群(成年种牛少于25%)的无疫状态,圈养控制下的无牛结核病鹿群也可以用CM表示。对于新建的牛群在疫情状况不明前,默认暂停(S)状态。如果新建牛群有来自感染区的牛,状态将调整为感染。
根据新西兰最新发布的消息,所有的肉用牛群将由C2状态更改为CM状态。所有进入屠宰场的CM牛将接受牛结核病屠宰检测,新注册的肉用和种用牛都将赋予感染状况不明(S)状态。新注册牛群需要在12个月内完成牛结核病检测,一旦检测证明无疫,将更改为C2状态。对于无疫牛群,一旦发现牛结核病可疑牛,或者有来自感染群、来源不明或来自农场监测工作有问题的牛,其状态将改为感染状况不明群(S)。
基于监测结果,TBfree将不同牛结核病风险程度的地理区域划分为:移运控制区、特别检测区和常规监测区。移运控制区主要指牛群感染率不低于1%的区域,通常以64 km2为一个单元。如果移运控制区在之后12个月内感染率下降到1%以下,将考虑取消移运控制。特殊检测区是指同感染区或者是有感染牛结核病的野生动物媒介的区域毗邻,其牛群感染率没达到移运控制区的水平,年均发病率在0.2%~1%之间。常规监测区一般位于无野生动物媒介区,年均牛结核病流行率不超过0.2%。除移运控制区在移运前60天需要进行牛结核病检测外,其他区域不需要移运前检测。新西兰牛结核病风险区域划分见图2[5]。
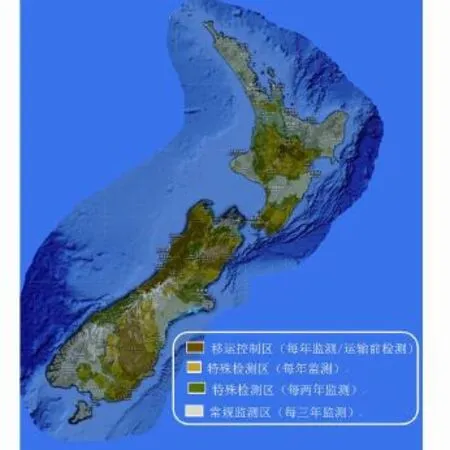
图2 新西兰牛结核病风险区域划分
1.3 野生动物媒介的区域化控制
在新西兰,负鼠、雪貂和野猪是牛结核杆菌的野生宿主和传播媒介。一旦从这些野生动物检出牛结核病,这些动物的活动区域就将被认定为牛结核病媒介风险区(VRA),VRA内70%的牛结核病新疫情均与负鼠和雪貂的病原传播有关。对于野生动物的监测,主要包括按计划主动采样监测和发现可疑动物后进行剖检和实验室检测。新西兰40%的领土为VRA,其余的60%为无媒介风险区(VFAs)(图3)[6]。通过减少VRAs来实现牛结核病的根除是TBfree的另一项重要工作。预计到2026年,25%的VRAs将被消除。

图3 新西兰牛结核病野生动物传播载体的风险区域划分
2 牛结核的监测与检测
2.1 不同群体的分级监测
新西兰的牛结核病监测非常全面,对象覆盖家养牛、家养鹿、围猎鹿群等,内容包括常规屠宰后尸检、阳性动物屠宰后尸检、特定野生动物监测以及全民(包括注册兽医、诊断实验室、农场、猎人和其他公民)疫情报告等[2]。2010—2016年监测情况见表1。感染状态农场的全部牛群每年至少进行2次检测,发现阳性个体后进行屠宰后尸检或采血做确诊试验。移运控制区、特别检测区或常规监测区的C1状况牛群2次检测间隔不超过12个月;移运控制区C2或CM状况的牛群每年进行1次检测;特别检测区的C2或CM状况的牛群每年(12月龄以上牛)或每2年(24月龄以上牛)检测1次;常规检测区的C2(及更高)或CM状况的牛群每3年检测1次;S状况的牛群的监测频率根据实际情况制定,在牛结核病感染状况不明前,动物严禁移运(表2)。
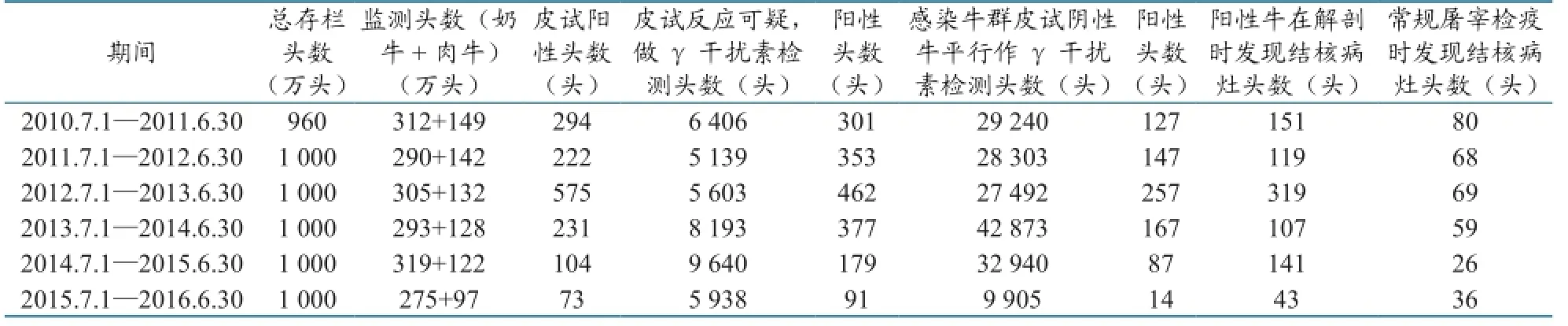
表1 2010—2016年新西兰牛结核病监测情况

表2 不同牛结核病风险水平的动物亚群及农场监测要求
当发现阳性动物后,工作人员会立即加上指示牛结核病阳性的黄色标签,并通知牛群所有人,等待主管部门的处理意见和血液测试的结果。阳性动物在获得移运许可前,不能离开当前饲养农场,也不能送去屠宰场,在血液检测结果证明无病或屠宰前,均不能擅自将黄色标签去掉,否则将追究法律责任。对于需要直接屠宰的阳性牛,政府将按照当前的补贴政策进行经济补偿。移运30日龄以上的牛和鹿必须填写并签署动物状态申明(30日龄内的乳畜除外)[3]。根据官方提供的数据,2010—2016年,牛群的群体感染率已经控制在0.2%以内(表3)[2]。
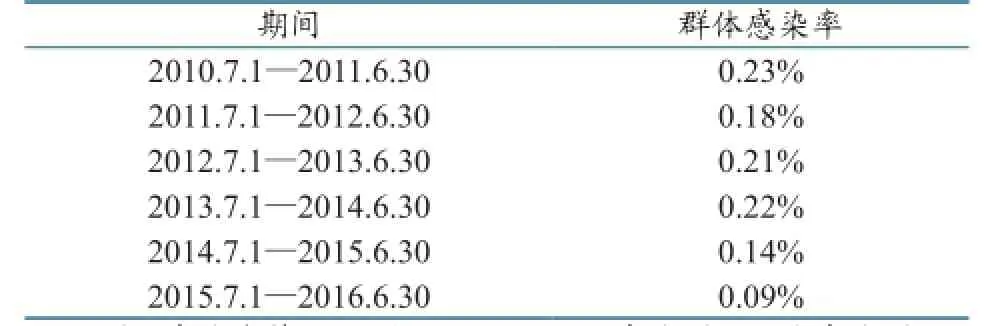
表3 2010—2016年新西兰牛结核病群体感染率(牛群和鹿群)
2.2 监测方法
官方认可的牛群结核病初筛检测为皮肤PPD测试包括尾根褶皱测试(CFT)和比较性颈部测试(CCT)。用于对PPD阳性进行进一步确认的系列辅助测试包括标准Bovigam γ-IFN检测和特定抗原Bovigam(ESAT-6/CFP10)γ-IFN检测;用于对PPD试验进行平行补充测试的辅助测试主要指平行Bovigam γ-IFN测试(禽型结核菌素和牛型结核菌素)。而对于鹿群,初筛方法为结核菌素颈部注射测试和颈部多点注射测试,系列辅助测试包括:IgG1 ELISA(ETB)和改进型ETB测试。CFT注射的标准做法是:用专用PPD注射器将0.1 mL的PPD注射到牛尾根褶皱皮内,注射后30秒内含PPD的小泡可见不消失,注射后(72±6)小时后观察结果,任何可触诊或可见的皮肤反应视为阳性。皮肤PPD测试的缺陷是在上一次注射60天内不能进行第2次皮肤PPD试验,PPD阳性动物、进行系列辅助检测或直接标识为反应动物需要在地区疫病主管的监督下屠宰[3]。对新西兰红鹿的研究表明,CFT的特异性只有45.9%,而血液γ-IFN抗体测试的特异性达到98%[7],CFT也被证明可能不足以发现所有的牛结核病阳性动物。为此,新西兰采用系列辅助测试用以排除假阳性,采用平行试验用以排除假阴性。值得注意的是,Bovigam测试结果为阳性的牛不一定存在病理变化。此外,分离株的分析和基于基因组测序(WGS)的病原溯源也在牛结核病的防控中开始被采用[2]。
3 产地检疫情况
新西兰是我国进口种牛的主要来源地之一。根据双边议要求,出口到中国的活动物必须在出口前完成不少于30天的农场检疫和不少于30天的隔离检疫。产地检疫工作主要包括召开检疫前会谈、制定检疫计划、进行牛结核菌素PPD试验、采集农场和隔离场的动物血液、收集农场资质证明、对牛地方流行性白血病进行临床检查、疫苗免疫、规定项目的实验室检测、体内外寄生虫药物治疗或预防、制作检疫证书以及动物装运前临床检查。出口动物在农场检疫和隔离检疫阶段,需要分别采血并进行实验室检测,检测项目根据不同动物种类而有所不同。牛结核病是产地预检的重点疫病之一,除现场进行PPD皮下接种试验外,还需对皮试阳性动物单独采血,并进行实验室IFN-γ 测试(BOVIGAM test),目前该实验主要由AgResearch集团下属Hopkirk Research Institue实验室完成。据不完全统计,2013—2015年共检出牛结核病15批次,全部在农场检疫环节检出,共计113头(参考进境动物检疫管理信息系统),且均为结核菌素CFT阳性,后经Bovigam干扰素测试验证全部均为阴性(表4)。

表4 近3年内新西兰出口种牛结核病检出情况
4 对策和建议
我国针对该病主要采取“检疫、监测、扑杀”的防控手段[8],经过多年努力,我国牛结核病阳性率呈逐年下降趋势。杜艳芬等[9]研究发现,目前我国牛结核病感染率大约为1.3%,但由于该研究采用的方法是分离培养法,若采用PPD变态,反应测试感染率应在2%以上。以新疆的调查结果为例,1956—1989 年累计检疫牛1 550 054头,检出阳性33 007头,阳性率为2.13%[10]。相对于新西兰牛结核病的成功防控经验而言,我国有诸多问题尚未解决:一是没有全国性的牛结核病监测计划和根除计划;二是市面上无国产化的牛结核γ-干扰素检测试剂盒;三是不确定是否存在类似负鼠的中间宿主或传播媒介,野生动物感染和传播该病的情况不明。为此,建议从以下几个方面采取措施:一是适时提出我国的牛结核病根除计划和措施,实现有“纲”可循;二是研发有自主知识产权的适合于牛结核病初筛、确诊的血清学和(或)分子生物学检测试剂盒,考虑改进现有技术或多方法联用,克服皮内变态反应的假阴性和假阳性的技术难题;三是加强野生动物牛结核病的监测和研究,探明牛结核病在我国的分布和传播规律,严格控制野生动物的屠宰和交易,防范野生动物结核感染家养动物;四是加强屠宰检疫和主动监测,结合家养动物的监测结果建立风险等级不同的动物亚群和分区,加强动物的移运控制;五是加强进口动物的检疫,严格防范外来牛结核病的引入;六是建立1~2个全国性的牛结核病参考实验室,统领全国的监测工作以及标准化试剂研究工作;七是加强经费投入,落实责任主体。
[1] TBfree New Zealand Ltd. A brief history of bovine TB[EB/ OL]. (2014-3-1)[2016-12-20]. http://www.tbfree.org.nz/whatis-bovine-tuberculosis-2-3.aspx.
[2] Ministry for Primary Industries. Surveillance. Volume 43-37(2016—2010)[EB/OL]. (2016-11-1)[2016-12-20]. http:// www.sciquest.org.nz/surveillance.
[3] TBfree New Zealand Ltd. National Bovine Tuberculosis Pest Management Plan:National Operational Plan. Part B:Operational Policies. November 2013[EB/OL]. (2016-12-1)[2016-12-20]. http://www.tbfree.org.nz/.
[4] TBfree New Zealand Ltd. Strategy overview[EB/OL].(2014-3-1)[2016-12-20].http://www.tbfree.org.nz/.
[5] TBfree New Zealand Ltd. Disease control areas[EB/OL].(2014-3-1)[2016-12-20]. http://www.tbfree.org.nz/dcamap.
[6] TBfree New Zealand Ltd. Pest management detail[EB/OL].(2014-3-1)[2016-12-20]. http://www.tbfree.org.nz/where-pestcontrol-is-needed.aspx.
[7] GRIFFIN J F,CROSS J P,CHINN D N,et al. Diagnosis of tuberculosis due to Mycobacterium bovis in New Zealand red deer(Cervus elaphus)using a composite blood test and antibody assays[J]. N Z Vet J,1994,42(5):173-179.
[8] 甘海霞. 广西奶牛结核病的监测与防制[D]. 南宁:广西大学,2008.
[9] 杜艳芬. 牛结核病病原学调查及分子流行病学研究[D].北京:中国农业科学院,2009.
[10] 李舵. 新疆部分地区牛结核病监测与防治策略研究[D].杨凌:西北农林科技大学,2005.
(责任编辑:杜宪)
Regional Prevention and Control of Bovine Tuberculosis in New Zealand
Wang Yu1,Chen Jun2,Chen Feng3,Wang Xinwu4,Dou Shulong5
(1. Technical Center of Chong-qing entry-exit inspection and Quarantine Bureau, R.P.C,State Key Laboratories for Cattle Disease Testing (Chongqing),Research and Engineering Center for the Control of Imported Terrestrial Animal Diease of Chong qing,Chongqing 400020;2. Ningbo Entry-exit Inspection and Quarantine Bureau,Ningbo,Zhejiang 315000;3. Leshan Agricultural Products Quality Inspection and Testing Center,Leshan,Sichuan 614000;4. Hunan Entry-exit Inspection and Quarantine Bureau,Changsha,Hunan 410000;5. General Administration of Quality Supervision,Inspection and Quarantine of China,Beijing 100020)
In recent years,signi fi cant progress has been made in the prevention and control of Bovine Tuberculosis(TB)in New Zealand,where the herd prevalence rate was maintained at a low level of about 0.2% for three successive years. Targets of TB control were achieved 18 months ahead of schedule. On the basis of data analysis,interviews and investigations,the achievement was bene fi ted from sustained government investment,scienti fi c implementation of the independent third-party organization,as well as participation of the whole people in breeding industry. For TB prevention and control in China,some measures adopted by New Zealand may provide certain reference,such as its scienti fi c surveillance plan,regional management and effective eradication of wild-type hosts.
TB;prevention and control;regional management;inspection and quarantine at the place of origin
S855.2
A
1005-944X(2017)03-0070-05
10.3969/j.issn.1005-944X.2017.03.019
质检总局2015年度科技攻关项目(2015IK331)

