iRGD-外泌体-阿霉素抑制恶性黑色素瘤体外增殖的研究
赵莉娟 郑江红 柳向东 茅广宇 邓辰亮 杨松林
iRGD-外泌体-阿霉素抑制恶性黑色素瘤体外增殖的研究
赵莉娟 郑江红 柳向东 茅广宇 邓辰亮 杨松林
目的探讨应用iRGD-外泌体-阿霉素抑制人恶性黑色素瘤细胞系A375体外增殖的有效性及其靶向性。方法体外转染iRGD,并提取外泌体,通过电穿孔包裹阿霉素,利用流式细胞仪检测iRGD-外泌体-阿霉素对A375细胞的亲和力,并对iRGD-外泌体-阿霉素抑制A375细胞的增殖能力进行分析。结果iRGD-外泌体-阿霉素与A375细胞的结合率高于空白转染-外泌体-阿霉素;iRGD-外泌体-阿霉素可明显抑制A375细胞的增殖,空白转染-外泌体-阿霉素未观察到明显的抑制情况。结论iRGD-外泌体-阿霉素能通过靶向作用于A375细胞,并抑制其增殖。
恶性黑色素瘤靶向治疗外泌体阿霉素
恶性黑色素瘤(Malignant melanoma,MM)是起源于皮肤黑色素细胞的高度恶性肿瘤,占体表恶性肿瘤的7%~20%,仅次于皮肤鳞癌和基底细胞癌,居第三位[1]。恶性黑色素瘤的发病机制尚未明确,黑色素细胞痣恶变、病毒感染、紫外线照射等多种因素均与其发生有关[2],传统的手术及放、化疗治疗效果有限。近年来,外泌体作为一种包裹药物的特异性载体,可包裹阿霉素等化疗药物,靶向作用于恶性黑色素瘤细胞,降低传统化疗的副作用[3]。其靶向治疗优势明显[4],免疫原性低、无毒副作用;且来源广,具有磷脂双分子层结构,易于与靶细胞的细胞膜融合[5];分子结构小,纳米级分子量(10~100 nm),可避免单核细胞的吞噬作用,且易于穿透肿瘤组织毛细血管向深层组织浸润[6]。本实验根据iRGD可与恶性黑色素瘤表面的αν整合素特异性结合的原理,体外设计iRGD-外泌体,经电穿孔包装阿霉素后靶向结合恶性黑色素瘤细胞表面,经胞吞作用将阿霉素摄入肿瘤细胞内,直接有效地起到抗肿瘤效果,并减少对正常细胞的损伤。
1 材料与方法
1.1 主要试剂和仪器
人恶性黑色素瘤细胞系A375(以下简称为A375),人肾上皮细胞系293T(以下简称为293T),均购于中科院上海细胞所;胎牛血清(浙江天杭生物科技有限公司);DMEM培养液、胰酶、PBS(江苏凯基生物技术股份有限公司);外泌体提取试剂(美国Invitrogen公司);阿霉素(美国Sigma公司);荧光染剂DIO(美国Invitrogen公司)。
电穿孔仪(美国Invitrogen公司);FACS Calibur型流式细胞仪(美国Becton Dickinson公司)。
1.2 方法
1.2.1 细胞培养
含10%小牛血清的DMEM培养基在37℃、5% CO2培养箱中培养293T细胞,待细胞融合至85%~90%时,传代培养,收集第6~8代293T细胞用于下一步实验研究。
1.2.2 质粒构建与细胞转染
293T细胞接种至六孔板,细胞85%~90%融合时,按Lipofectamine 2000说明书配置溶液A:240 μL无血清DMEM+10 μL Lipofectamine2000;溶液B:233 μL无血清DMEM+17 μL pcDNA3.1(+)-hLAMP2b-CysiRGD质粒。质粒序列:TGCTGTAGAGGTGACAAAGGCCCAGATTGTGGTGGATCATGC。将A、B在5 min内混匀,室温放置20 min后,每孔各加入2 mL DMEM,A、B混匀后悬滴加入培养液中,标记为空白转染组(对照组)、iRGD转染组(实验组)。摇动培养板轻轻混匀,放置在37℃、5%CO2培养箱中培养。6 h后更换含10%胎牛血清的FBS培养液,24 h后收集上清,提取外泌体。
1.2.3 外泌体的提取
细胞转染收集上清,2 000 g离心30 min,离心后收集1 mL上清,加入500 μL Total Exosome Isolation reagent,4℃过夜,10 000 g 4℃离心1 h,弃上清,分别获得空白转染-外泌体(blank-exo,对照组)、iRGD-外泌体(iRGD-exo,实验组),沉淀,-20℃保存。
1.2.4 药物包装
将0.2 μL外泌体+50 μg阿霉素用buffer混匀(200 μL体系),常温下1 KV、20 ms电穿孔后4℃保存,分别获得空白转染-外泌体-阿霉素(blankexo-dox,对照组)与iRGD-外泌体-阿霉素(iRGD-exo-dox,实验组)。
1.2.5iRGD的RT-PCR检测
取冻存外泌体抽提RNA,并将其转合成为cDNA,进行PCR反应,GAPDH设为管家基因。PCR反应条件:94℃预变性5 min,94℃变性40 sec,40℃退火40 sec,72℃延伸1 min。将EP管放入仪器扩增,循环35次;72℃延伸10 min。4℃储存。用1%琼脂糖凝胶进行电泳,并检测拍照。
GAPDH引物序列:上游5’-CATGAGAAGTATGACAACAGCCT-3’,下游5’-AGTCCTTCCACGATACCAAAGT-3’;iRGD引物序列:上游TCGATGTTAGACCTGGAAATAGTGGTGCTGTG,下游CCGGCACAGCACCACTATTTCCAGGTCTAACA。
1.2.6A375细胞染色
用含10%胎牛血清的FBS培养液在37℃、5% CO2培养箱中培养两组A375细胞,待细胞65%~70%左右融合时,使用试剂Dio进行细胞染色。使用DMSO配置成1 mM浓度作为储存液,PBS稀释200倍至5 μM工作液,将稀释好的Dio染料悬滴加入A375细胞培养皿中,37℃、5%CO2孵育1 h。PBS溶液清洗染剂,在细胞培养皿中加入10 mL含10%胎牛血清的FBS培养液。
1.2.7 外泌体结合
将获取的blank-exo-dox、iRGD-exo-dox悬液分别悬滴加入已Dio染色的A375细胞培养皿中,37℃、5%CO2孵育1 h后,PBS清洗3次,去除多余的外泌体,分别得到A组(blank-exo-dox-A375,实验组)、B组(iRGD-exo-dox-A375,对照组)细胞,分别进行流式细胞仪检测和细胞增殖检测。
1.2.8 流式细胞仪检测
胰酶消化后分别获取A组和B组细胞悬液,1 000 g离心3 min,弃上清,获取细胞沉淀,将两组细胞沉淀分别加入0.9%NaCl,稀释至1 mL,用于流式细胞仪检测,并记录数据。
1.2.9 细胞增殖检测
取96孔板,分别用于检测A、B组细胞,每孔加入100 μL的A或B细胞悬液(1×104个/孔)。将培养板置于37℃、5%CO2的条件培养箱中分别孵育0、24、48、72、96 h,向待测孔加入10 μL CCK-8溶液。每组细胞、每个时间点取3个样品检测,将培养板在培养箱内孵育1~4 h。用酶标仪测定在450 nm处的吸光度。
2 结果
2.1iRGD-外泌体的鉴定
我们通过RT-PCR对iRGD mRNA的表达水平进行评估。结果显示相较于blank-exo,iRGD-exo具有较高水平的iRGD mRNA表达(图1)。

图1RT-PCR检测iRGD的mRNA表达Fig.1The mRNA expression of iRGD detected by RT-PCR
2.2iRGD-外泌体-阿霉素靶向于A375细胞的研究
为了确认iRGD是否靶向于A375细胞上的αν整合肽,我们将blank-exo-dox、iRGD-exo-dox悬液分别悬滴加入已Dio染色的A375细胞培养皿中。流式细胞检测证实,iRGD-exo-dox与A375细胞的结合效率高于blank-exo-dox(分别为41.5%、8.4%),表明iRGD可特异性结合于A375细胞表面的αν整合素(图2)。
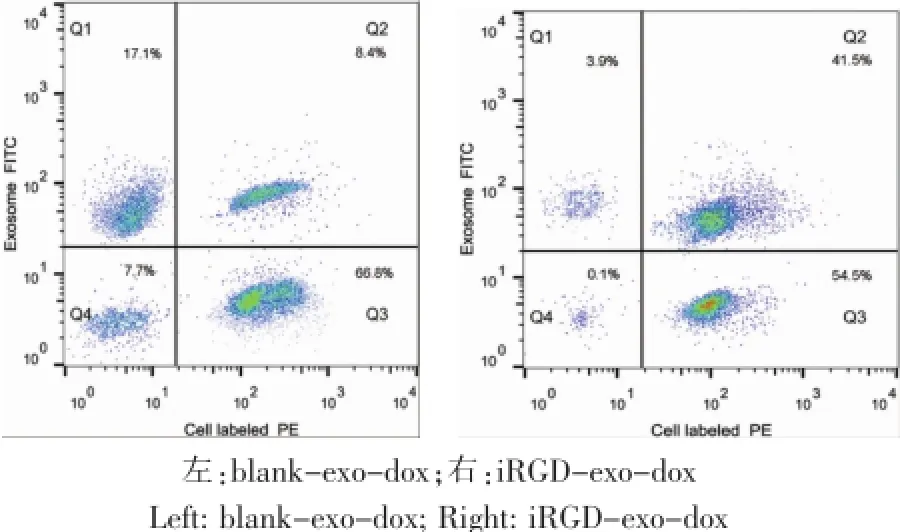
图2 流式细胞仪检测结果Fig.2Results of flow cytometry
2.3iRGD-外泌体抑制A375细胞的效果
使用iRGD-exo-dox与blank-exo-dox对A375细胞进行24、48、72、96 h存活能力分析。CCK-8检测显示iRGD-exo-dox抑制了细胞的增殖,但在blank-exo-dox中并没有观察到明显的抑制情况,表明iRGD-exo-dox对A375细胞的增殖有明显的抑制作用(图3)。

图3A375细胞增殖曲线Fig.3The curve of cell proliferation in A375 cells
3 讨论
近年的研究认为,靶向治疗可直接高效地起到抗肿瘤作用,但靶向治疗的瓶颈在于发现的相关肿瘤的细胞表面特异性抗原有限。目前已发现的恶性黑色素瘤标志物有:黑色素瘤细胞分化抗原糖蛋白(Glycoprotein,gp)100、黏附分子L1-CAM、人内源性逆转录病毒K包膜蛋白(HERV-K)等[7]。这些标志物在多种实体瘤,如恶性黑色素瘤、乳腺癌、卵巢癌、膀胱癌中均有过度表达,而在正常细胞中表达量极低,它们的相对特异性表达是当前治疗相关肿瘤的重要靶点[8-13]。Krishnamurthy等[7]利用HERV-K的肿瘤特异性,构建相关嵌合抗原受体修饰的T细胞(CAR-T),特异性识别HERV-K并与其结合,起到了限制肿瘤生长的效果。
αν整合素是细胞表面的一种黏附分子,主要通过介导细胞与细胞外基质的黏附作用,而影响细胞的生物学行为,在正常细胞表面呈低表达水平,同样在多种实体瘤细胞表面呈高表达水平,与肿瘤的侵袭、转移密切相关[14]。乳腺癌、卵巢癌、膀胱癌、恶性黑色素瘤等肿瘤细胞表面均过度表达αν整合素,Tian等[3]利用αν整合素表达的相对特异性,联合设计体内和体外实验,将化疗药物靶向作用于乳腺癌细胞,取得显著疗效。本实验针对恶性黑色素瘤细胞表面αν整合素的高水平表达,体外构建iRGD-exo-dox颗粒,将阿霉素特异性作用于恶性黑色素瘤细胞(A375细胞),观察对恶性黑色素瘤体外增殖的影响。
外泌体是由内皮细胞和造血干细胞产生的磷脂双分子层囊泡,可经胞吞作用被细胞摄取,是运输化疗药物的理想载体[15]。与传统化疗方法相比,经外泌体转载的化疗药物可特异性作用于肿瘤细胞,其纳米级(10~100 nm)结构可避免体内单核巨噬细胞的吞噬[6],可以提高抗肿瘤的效能;同时还能避免对正常细胞的损伤,降低化疗的副作用。目前,大量的化疗药物因剂量依赖性副作用而导致应用受限。阿霉素是常见的临床化疗药物,对肿瘤生长控制有显著效果,但同时也可广泛作用于全身正常细胞,而引起心血管系统损伤[16]。本研究在体外构建运载化疗药物(阿霉素)的载体,通过载体与细胞之间的靶向结合直接将药物作用于肿瘤细胞,安全高效地遏制恶性黑色素瘤的增殖。我们在体外培养293T细胞,待细胞融合率达80%~90%时,体外转染iRGD,提取外泌体,通过电穿孔包裹阿霉素,利用流式细胞仪检测iRGD-外泌体-阿霉素对A375细胞的亲和力,并对iRGD-外泌体-阿霉素抑制A375细胞的增殖能力进行分析。结果显示,iRGD-外泌体-阿霉素与A375细胞的结合率高于空白转染-外泌体-阿霉素,且iRGD-外泌体-阿霉素可明显抑制A375细胞的增殖,而空白转染-外泌体-阿霉素未观察到明显的抑制作用,说明表达iRGD蛋白的外泌体携载阿霉素能更有效地抑制细胞增殖,起到抗肿瘤作用。
近年来,恶性黑色素瘤的发病率逐渐增加,80%皮肤癌的死亡与恶性黑色素瘤相关。常隐匿起病,但进展速度快,早期易发生转移,恶性度高,预后差,生存中位数只有6个月左右[17]。传统的手术切除、放化疗对恶性黑色素瘤的治疗效果均不明显,且截肢术及放化疗的毒副作用增加了患者的痛苦。应用外泌体作为药物载体的靶向治疗在提高抗肿瘤效能的同时,也降低了患者放化疗的痛苦。外泌体来源广、免疫原性低,在靶向治疗领域中具有广阔的应用前景。相信随着更为深入的研究,有望为包括恶性黑色素瘤在内的肿瘤治疗,开辟一条高效可行的新途径。
[1]Egberts F,Bohne AS,Kruger S,et al.Varying mutational alterations in multiple primary melanomas[J].J Mol Diagn,2016,18(1):75-83.
[2]Reichrath J,Reichrath S.Sunlight,vitamin D and malignant melanoma:an update[J].Adv Exp Med Biol,2014,810:390-405.
[3]Tian Y,Li S,Song J,et al.A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy[J].Biomaterials,2014,35(7):2383-2390.
[4]Alvarez-Erviti L,Seow Y,Yin H,et al.Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J].Nat Biotechnol,2011,29(4):341-345.
[5]Jang SC,Kim OY,Yoon CM,et al.Bioinspired exosome-mimetic nano vesiclesfortargeteddeliveryofchemotherapeuticsto malignant tumors[J].ACS Nano,2013,7(9):7698-7710.
[6]van den Boorn JG,Schlee M,Coch C,et al.SiRNA delivery with exosome nanoparticles[J].Nat Biotechnol,2011,29(4):325-326.
[7]Krishnamurthy J,Rabinovich BA,Mi T,et al.Genetic engineering of T cells to target HERV-K,an ancient retrovirus on melanoma [J].Clin Cancer Res,2015,21(14):3241-3251.
[8]Reiche J,Pauli G,Ellerbrok H.Differential expression of human endogenous retrovirus K transcripts in primary human melanocytes and melanoma cell lines after UV irradiation[J].Melanoma Res, 2010,20(5):435-440.
[9]Wang-Johanning F,Liu J,Rycaj K,et al.Expression of multiple human endogenous retrovirus surface envelope proteins in ovarian cancer[J].Int J Cancer,2007,120(1):81-90.
[10]Jones RB,Garrison KE,Mujib S,et al.HERV-K-specific T cells eliminate diverse HIV-1/2 and SIV primary isolates[J].J Clin Invest,2012,122(12):4473-4489.
[11]Contreras-Galindo R,Kaplan MH,Leissner P,et al.Human endogenous retrovirus K(HML-2)elements in the plasma of people with lymphoma and breast cancer[J].J Virol,2008,82(19): 9329-9336.
[12]Wang-Johanning F,Radvanyi L,Rycaj K,et al.Human endogenous retrovirus K triggers an antigen-specific immune response in breast cancer patients[J].Cancer Res,2008,68(14):5869-5877.
[13]Schmitt K,Reichrath J,Roesch A,et al.Transcriptional profiling of human endogenous retrovirus group HERV-K(HML-2)loci in melanoma[J].Genome Biol Evol,2013,5(2):307-328.
[14]Sugahara KN,Teesalu T,Karmali PP,et al.Tissue-penetrating delivery of compounds and nanoparticles into tumors[J].Cancer Cell,2009,16(6):510-520.
[15]Tan L,Wu H,Liu Y,et al.Recent advances of exosomes in immune modulation and autoimmune diseases[J].Autoimmunity, 2016,49(6):357-365.
[16]Li HQ,Wu YB,Yin CS,et al.Obestatin attenuated doxorubicininduced cardiomyopathy via enhancing long noncoding Mhrt RNA expression[J].Biomed Pharmacother,2016,81:474-481.
[17]Mar VJ,Liu W,Devitt B,et al.The role of BRAF mutations in primary melanoma growth rate and survival[J].Br J Dermatol, 2015,173(1):76-82.
The Inhibition of iRGD-Exosomes-Doxorubicin on the Proliferation of Malignant Melanoma in Vitro
ObjectiveTo investigate the effect and targeting of iRGD-exosomes-doxorubicin(iRGD-exo-dox)on the inhibition of A375 cell line.MethodsThe exosomes were extracted from the iRGD-transfected A375 cells.The doxorubicin was wrapped by electroporation.Flow cytometry was used to detect the affinity of iRGD-exo-dox to A375 cells.The ability of iRGD-exo-dox on inhibiting the proliferation of A375 cells was analyzed.ResultsThe affinity of iRGD-exo-dox to A375 cells was higher than the blank-exo-dox.The proliferation of A375 cells was obviously inhibited by iRGD-exo-dox.The inhibition effect was not observed in blank-exo-dox group.ConclusioniRGD-exo-dox can inhibit the proliferation of A375 cells by targeting function.
Malignant melanoma;Targeted therapy;Exosome;Doxorubicin
R739.5
B
1673-0364(2017)01-0025-04
ZHAO Lijuan,ZHENG Jianghong,LIU Xiangdong,MAO Guangyu,DENG Chenliang,YANG Songlin.
Department of Plastic Surgery, Shanghai Sixth People's Hospital,Shanghai Jiaotong University,Shanghai 200233,China.Corresponding author:YANG Songlin(E-mail:slyang@sjtu.edu.cn).
16日;
2017年1月22日)
10.3969/j.issn.1673-0364.2017.01.007
200233上海市上海交通大学附属第六人民医院整形外科。
杨松林(E-mail:slyang@sjtu.edu.cn)。

