含羟基离子液体催化CO2环加成反应的研究
代淑梅,李秋园,吴超勇
(中溶科技股份有限公司,河北 唐山 064000)
CO2具有量大、无毒无害、不燃烧、廉价易得等特点,是重要的碳氧资源,能够转化成多种化学物质[1-4]。其中通过环氧化合物与CO2反应生成环状碳酸酯是一个非常重要的反应[1,4]。反应底物环氧化合物廉价易得,反应过程中没有其它副产物,原子利用率100%,符合绿色化学和原子经济性的理念。产物环状碳酸酯是一种重要的有机化学品,主要应用于有机反应中的非质子型溶剂、脱CO2溶剂、锂离子电池的电解液,用于制备碳酸二甲酯、碳酸二乙酯、碳酸二苯酯等。
迄今为止,该方向已有多种催化剂被研究开发出来,如各种金属配合物[2]、不同类型的离子液体[5]、季铵盐[6-7]、季鏻盐[8-9]等。金碧[10]等研究了一系列的胍盐离子液体,当以氨基功能化FGBILs([TMGC2H4NH2]Br)为催化剂时,在较温和的条件下(130 ℃,2.5 MPa)反应2 h后,底物环氧丙烷基本可反应完全。进一步研究了功能化的季鏻盐离子液体,其中以羧基功能化的[Ph3PC2H4COOH]Br为催化剂时,在较温和的条件下反应3 h后,环氧丙烷可基本反应完全。
离子液体是一类在室温或低温下呈液体状态的盐,具有熔点低、溶解能力强、蒸气压低、热稳定性好等优点,并且通过在其结构上连接不同的功能团,能够得到不同结构不同性质可满足不同需要的离子液体。三乙烯二胺(DABCO)是一类重要的有机碱,基于DABCO为母体形成的离子液体在催化领域得到了广泛的应用。如刘玉婷等使用羟基功能化的DABCO型离子液体催化了Knoevenagel缩合反应[11],反应条件温和,操作简单,收率高,催化剂可以循环使用。冯子娟等制备了新型离子液体[DABCO-PDO][BF4]催化剂用于氮杂Michael加成反应[12],反应条件温和,催化剂循环使用6次后仍保持82%的活性。
作者前期研究制备了含有氢键的1,8-二氮杂二环十一碳-7-烯(DBU)基离子液体[13],该离子液体制备简单,催化活性高,能够在相对温和的条件下催化CO2与环氧化合物反应生成环状碳酸酯,且催化剂具有广泛的底物普适性,催化剂中羟基的引入能够促进此反应的进行。进一步制备了以DABCO为母体的含羟基的离子液体,考察了反应的参数,找到了最优的反应条件,考察了底物的适用性并进一步考察了此反应的机理。
1 实验部分
1.1 试剂与仪器
三乙烯二胺、环氧丙烷、环氧氯丙烷、1,2-环氧戊烷、环氧环己烷:分析纯,阿拉丁化学试剂有限公司;环氧苯乙烯、异丙基缩水甘油醚:分析纯,国药化学试剂有限公司;苯基缩水甘油醚、2-溴乙醇:分析纯,sigma-aldrich公司;CO2:体积分数99.999%,天津东洋特种气体有限公司。
不锈钢高压反应釜:GFY-1,海安县石油科研仪器有限公司;集热式恒温加热磁力搅拌器:DF-101S,邦西仪器科技(上海)有限责任公司;气相色谱:7890B,色谱柱为毛细管柱HP-5,30 m×0.32 mm×0.50 μm,安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 催化剂制备
使用100 mL圆底烧瓶,向其中加入乙醇50 mL,三乙烯二胺100 mmol,然后缓慢滴加2-溴乙醇100 mmol,并于80 ℃下冷凝回流过夜,然后旋转蒸发除掉乙醇,得到产品[DABCO-HE]Br,用乙醚洗三次,并于50 ℃烘干,称量得到产品收率为87.6%。催化剂合成方法见图1。

图1 催化剂羟乙基三乙烯二铵溴盐 ([DABCO-HE]Br)的合成方法
1.2.2 环加成反应
首先向反应釜内加入一定量的催化剂,并加入100 mmol环氧化合物,拧紧反应釜的釜盖,用(1.0~1.2)MPa的CO2吹扫3次,将反应釜放入油浴锅中,升至反应温度,然后打开钢瓶阀门,调节稳压阀,向其中充入CO2至设定压力,并使整个反应过程中都维持在此压力。反应完成后关闭进气阀门,将反应釜从油浴锅中取出,放入冰水浴中冷却至0 ℃,打开阀门缓慢放出未反应的CO2,取出产物用气相色谱进行分析。环氧化合物与CO2反应生成环状碳酸酯的机理见图2。
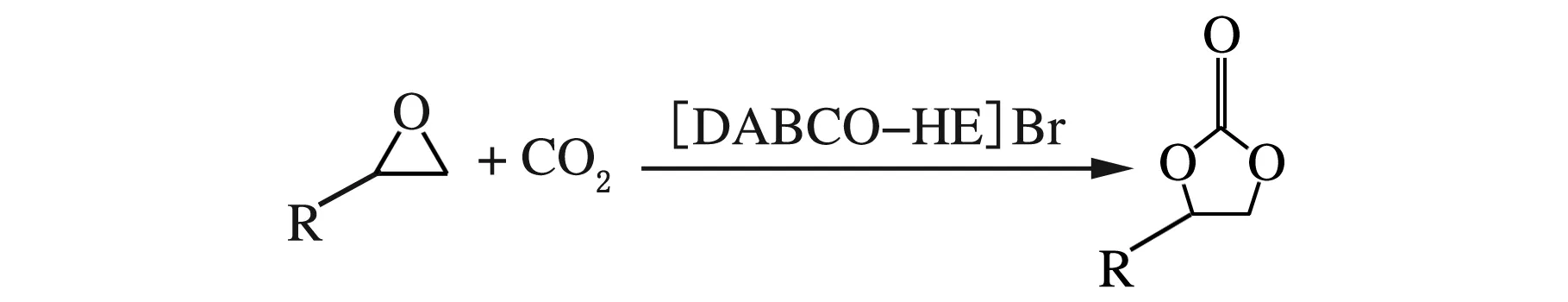
图2 环氧化合物与CO2反应生成环状碳酸酯机理
1.3 性能测试
气相色谱进样口为300 ℃,检测器为300 ℃,柱箱采用程序升温,起始温度60 ℃,10 ℃/min升温至230 ℃,保留3 min;进样量1 μL,分析方法:面积归一化法。
2 结果与讨论
2.1 实验参数的影响
2.1.1 催化剂的添加量对收率的影响
在100 mL的反应釜中加入100 mmol环氧丙烷,温度为100 ℃,压力为2.0 MPa,反应时间为4 h,考察了催化剂的添加量对于反应的影响,结果见表1。

表1 催化剂的添加量对收率的影响
当n(催化剂)∶n(环氧丙烷)=0.5∶100和1.0∶100时,收率分别为58.4%和98.2%。进一步提高n(催化剂)∶n(环氧丙烷)=1.5∶100和2.0∶100时,收率分别达到99.4%和99.7%。综合考虑成本和收率,认为最优的n(催化剂)∶n(环氧丙烷)=1∶100。
2.1.2 反应压力对收率的影响
在100 mL的反应釜中加入100 mmol环氧丙烷,n(催化剂)∶n(环氧丙烷)=1∶100,温度为100 ℃,反应时间为4 h,考察了压力对于反应的影响,结果见表2。

表2 反应压力对收率的影响
在反应过程中反应釜和钢瓶之间是连通的,能够确保反应过程中CO2的量足够使用。不同的压力提供了不同的反应环境。在100 ℃下,当压力为1.0 MPa时,收率为92.4%,当压力为2.0、3.0 MPa时,收率分别为98.2%、99.1%。随着反应压力的升高,碳酸丙烯酯的收率逐渐增加,继续增大压力,收率增加值不是很明显。压力升高时充入的CO2分子增多,能够促进此反应向右进行。最佳的反应压力为2.0 MPa。
2.1.3 反应时间对收率的影响
在100 mL的反应釜中加入100 mmol环氧丙烷,n(催化剂):n(环氧丙烷)=1∶100,温度为100 ℃,压力为2.0 MPa,考察了反应时间对于环氧丙烷与CO2的反应情况,结果见表3。

表3 反应时间对收率的影响
当反应时间为1 h和2 h,收率分别为67.3%和85.5%;随着反应时间的延长,碳酸丙烯酯的收率也逐渐升高,当达到4 h时收率达到98.2%,因此最优的反应时间为4 h。
2.1.4 反应温度对收率的影响
在100 mL的反应釜中加入100 mmol环氧丙烷,n(催化剂)∶n(环氧丙烷)=1∶100,压力为2.0 MPa,反应时间为4 h条件下,考察了不同的反应温度对于反应的影响,结果见表4。

表4 反应温度对收率的影响
当温度为60 ℃时,收率为68.5%;当温度升高到100 ℃时,收率迅速增加到98.2%。继续升高温度到120、140 ℃,收率分别达到99.5%、99.7%。由此可见温度对于此反应的影响很大,低温时收率较低,随着温度升高,收率迅速增加。此种现象是因为升高温度能够促进环氧化合物的开环,加快此反应的进行。综合考虑碳酸丙烯酯的收率及生产成本,认为最优并且最经济的反应温度为120 ℃。
综上,最优的反应工艺参数约为n(催化剂):n(环氧丙烷)=1∶100,压力2.0 MPa,时间4 h,温度120 ℃。
2.2 其它环氧化合物与CO2的反应
通过以上实验的考察,得到了最优的反应工艺参数,在此参数下进一步考察了催化剂的适用性。不同的环氧化合物与CO2反应的情况见表5。

表5 不同的环氧化合物与CO2反应的情况1)
1) 反应条件为n(环氧化合物)=100 mmol;n([DABCO-HE]Br)=1 mmol;t=120 ℃;p=2.0 MPa;t=4 h。
由表5可知,在最优的工艺参数下,考察了6种不同的环氧化合物与CO2的反应情况,都能够得到相应的环状碳酸酯,且都具有较高的收率,说明该催化剂对CO2环加成反应具有广泛的普适性。1,2-环氧戊烷与CO2反应得到1,2-碳酸戊烯酯的收率为95.6%,收率较环氧丙烷稍低,可能因为分子中碳链比环氧丙烷长导致空间位阻较大,进一步导致产率较低。环氧苯乙烯与CO2反应生成苯基碳酸乙烯酯的收率为90.7%,可能因为苯环的共轭作用且位阻较大,导致收率较其它底物低。
2.3 可能的反应机理
根据以上实验结果推测此反应的反应机理,见图3。

图3 可能的反应机理
环氧化合物与催化剂[DABCO-HE]Br中的羟基相互作用形成氢键,见结构A。该氢键能够使电子云向氧原子偏移,使碳氧键容易断裂,促进环氧化合物的开环。溴离子在环氧化合物位阻较小的一端进攻相应的碳原子,促使环氧化合物将环打开。催化剂[DABCO-HE]Br中的三价氮原子由于具有很强的碱性,很容易吸附显酸性的CO2,形成氨基甲酸盐。环氧丙烷中的氧负离子进攻CO2中的碳原子,CO2中碳氧双键的电子云向氧原子偏移,见结构B。最终氧负离子与CO2中的碳原子结合,将碳氧双键打开,CO2中的氧负离子进一步闭环,将溴离子游离出来,同时生成相应的环状碳酸酯,见结构C。此过程中,环氧化合物的开环是反应的决速步骤,催化剂中的羟基与环氧化合物形成氢键降低了开环反应的活化能,促进了此反应的进行。
3 结 论
将羟基引入到三乙烯二胺分子中,制备成含羟基的离子液体[DABCO-HE]Br,反应过程中不添加有机溶剂及其它添加剂。反应的最佳参数为n(催化剂)∶n(环氧化合物)=1∶100,压力2.0 MPa,反应时间4 h,温度120 ℃。此参数相对温和,目标产物收率较高。此催化剂能够应用于多种环氧化合物与CO2的反应中,具有广泛的适用性。羟基的引入能够与环氧化合物作用形成氢键,促进环氧化合物的开环,降低反应的活化能,促进反应的进行。
[1] SAKAKURA T,KOHNO K.The synthesis of organic carbonates from carbon dioxide[J].Chemical Communications,2009,11:1312-1330.
[2] DECORTES A,CASTILLA A M,KLEIJ A W.Salen-complex-mediated formation of cyclic carbonates by cycloaddition of CO2to epoxides[J].Angewandte Chemie,2010,49:9822-9837.
[3] OLAH G A,PRAKASH G K,GOEPPERT A.Anthropogenic chemical carbon cycle for a sustainable future[J].Journal of the American Chemical Society,2011,133:12881-12898.
[4] NORTH M,PASQUALE R,YOUNG C.Synthesis of cyclic carbonates from epoxides and CO2[J].Green Chemistry,2010,12:1514.
[5] SUN J,FUJITA S,ARAI M.Development in the green synthesis of cyclic carbonate from carbon dioxide using ionic liquids[J].Journal of Organometallic Chemistry,2005,690:3490-3497.
[6] DHARMAN M M,YU J I,AHN J Y,et al.Selective production of cyclic carbonate over polycarbonate using a double metal cyanide-quaternary ammonium salt catalyst system[J].Green Chemistry,2009,11:1754.
[7] WANG J Q,KONG D L,CHEN J Y,et al.Synthesis of cyclic carbonates from epoxides and carbon dioxide over silica-supported quaternary ammonium salts under supercritical conditions[J].Journal of Molecular Catalysis A:Chemical,2006,249:143-148.
[8] WU S S,ZHANG X W,DAI W L,et al.Au,ZnBr2-Ph4PI as highly efficient catalyst for cyclic carbonates synthesis from terminal epoxides and carbon dioxide[J].Applied Catalysis A:General,2008,341:106-111.
[9] SAKAI T,TSUTSUMI Y,EMA T.Highly active and robust organic-inorganic hybrid catalyst for the synthesis of cyclic carbonates from carbon dioxide and epoxides[J].Green Chemistry,2008,10:337-342.
[10] 金碧.新型离子液体催化剂的制备及其在CO2及环氧化合物合成环状碳酸酯中的应用[D].南昌:南昌航空大学,2014.
[11] LIU Y T,LI R,XING Y J.Synthesis of novel hydroxyl-functionalized ionic liquids and application in Knoevenagel condensation[J].Chinese Journal of Organic Chemistry,2015,35:1520-1525.
[12] FENG Z J,HOU H L,LI Z F,et al.Aza-Michaeladdition reaction of cyclic secondary amines catalyzed by novel DABCO based ionic liquid[J].Chemical Research,2014,4:366-372.
[13] YANG C H.[HEDUB]Br catalyzed conversion of epoxides and CO2to cyclic carbonates[J].Speciality Petrochemicals,2016,5:69-73.

