EGFR基因21外显子L858R突变肺腺癌患者化疗和靶向治疗疗效的回顾性分析
罗萌 徐瑜 胡义德
·论著·
EGFR基因21外显子L858R突变肺腺癌患者化疗和靶向治疗疗效的回顾性分析
罗萌1徐瑜2胡义德1
目的探讨EGFR基因21外显子L858R突变肺腺癌患者使用化疗和EGFR-TKI靶向治疗疗效的差异。方法回顾性分析,收集第三军医大学新桥医院2010年1月至2015年12月间EGFR基因检测为21外显子L858R突变的病例资料完整的ⅢB/Ⅳ期一线接受化疗或EGFR酪氨酸激酶抑制剂(EGFR-TKI)靶向治疗的肺腺癌患者作为研究对象,将患者根据一线治疗方式分为化疗组和靶向治疗组,对两组患者近期疗效(客观缓解率ORR、疾病控制率DCR)及生存期(无进展生存期PFS、总生存期OS)进行回顾性研究。结果①共收集符合纳入标准的EGFR基因21外显子L858R突变的肺腺癌患者68例,其中化疗组患者40例(58.8%),靶向治疗组患者28例(41.2%),两组患者在性别、年龄、吸烟史、PS评分和临床分期等临床资料基线水平一致(P>0.05);②化疗和靶向治疗组ORR分别为45.0%和17.9%(P=0.020);DCR分别为95.0%和71.4%(P=0.012),PFS分别为9.901个月和6.746个月(P=0.045);OS分别为21.738个月和23.611个月(P=0.378)。结论与靶向治疗相比,EGFR基因21外显子L858R突变肺腺癌患者化疗治疗在近期疗效及PFS上较有优势,OS未见明显获益。
EGFR基因突变; 肺腺癌; 化疗; 靶向治疗; 临床疗效; 回顾性分析
肺癌是常见恶性肿瘤,是世界首位肿瘤性死亡原因,全球每年大约有150万人死于肺癌[1-3]。肺癌早期临床表现缺乏特异性,65%患者就诊时已处于晚期,失去手术根治的机会。表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)是EGFR常见突变(19del和L858R)肺癌的一线治疗方案[4],对于未检测到突变的肺癌患者,则推荐含铂联合化疗作为一线治疗[5]。Kuan等[6]指出19del突变及L858R突变是属于两种不同类型的肺癌,已有研究证实19外显子缺失突变(19del)对EGFR-TKI治疗的反应及PFS较21外显子替代突变(L858R突变)有明显优势[7],但对于21外显子L858R突变肺癌患者化疗与靶向治疗的疗效一直存在争议,有研究发现L858R突变患者含铂类化疗方案的mOS较阿法替尼更长,认为对于L858R突变患者靶向治疗和化疗效果相似甚至化疗有更好的效果[8-9]。目前针对21外显子突变肺腺癌患者进行EGFR-TKI与化疗疗效评估的研究较少,本研究拟采用回顾性分析评估在L858R突变亚组中TKI治疗与化疗治疗疗效的差异。
资料与方法
一、一般资料
筛选新桥医院2010年1月至2015年12月间收治的EGFR基因检测为EGFR21外显子L858R突变,且一线治疗为化疗或EGFR-TKI治疗的肺腺癌患者68例作为研究对象。
二、纳入标准及排除标准
纳入标准:①年龄大于18岁;②肿瘤组织或细针穿刺活检或细胞学行直接测序或ARMS法检测EGFR基因呈21外显子突变的术后复发或ⅢB/Ⅳ期的肺腺癌患者;③经诊断临床分期为ⅢB期或Ⅳ期,ECOG PS评分为0~2分;④EGFR突变者一线治疗为仅口服EGFR-TKI(厄洛替尼、吉非替尼)一月以上(1月以内出现疾病进展患者死亡的可纳入病例)或一线治疗为以铂类为基础的的双药化疗方案2个周期以上(两周期以内出现疾病快速进展并出现死亡的可纳入病例); ⑤均有可追踪疗效的影像学依据;⑥肺外无原发肿瘤;⑦治疗前血常规、肝肾功能、心电图检查达治疗要求,无严重合并症。排除标准:①无病理学诊断,突变类型不详;②治疗时间短,未达到以上标准或拒绝继续治疗者;③同时接受放疗或其他全身抗肿瘤治疗,同时存在其他恶性肿瘤;④患者目前有影响研究结果评价及可能危及生命的器官疾病或合并严重感染或可控性差的心脏病病史(充血性心衰、不稳定性心绞痛、临床症状明显的心包积液或不稳定型心律不齐)或合并及控制不佳的糖尿病。
三、 治疗方法
1. 靶向治疗组:使用吉非替尼250 mg,1次/d或厄洛替尼150 mg,1次/d,30 d为一个周期。
2.化疗组:采用铂类结合第三代细胞毒性药物的双药联合化疗方案,每3周为一个周期进行治疗,直到出现进展或不能耐受的不良反应,疾病进展后按患者情况更改或联合其他抗肿瘤治疗。
四、评价标准
随访截止至2016年7月1日,主要观察终点为疾病进展,次要观察终点为死亡。化疗组每2个周期复查,EGFR-TKI组治疗一个周期后复查,以后每2个周期复查,复查指标包括查体、影像学检查和生化检查。根据实体瘤疗效评价标准RECIST1.1对患者治疗效果进行评价,CR:完全缓解,全部病灶消失,至少持续4周;PR:部分缓解,基线病灶最大径之和缩小至少30%,至少持续4周;SD:病变稳定,介于PR与PD之间; PD:病变进展,基线病灶最大径之和增大至少20%,或出现新病灶。客观缓解率(ORR)=(完全缓解+部分缓解)/总数×100%,疾病控制率(DCR)=(完全缓解+部分缓解+疾病稳定)/总数×100%,患者生存期;无进展生存期(PFS)为开始用药至疾病进展。在随访截止时,患者未发生疾病进展或死亡的时间;总生存期(OS)为开始用药至患者出现死亡或最后一次随访或失访日期。
五、统计学方法
数据分析采用SPSS19.0统计软件。对ORR、DCR的分析采用卡方检验或Fisher确切概率法;采用 Kaplan-Meier法对生存情况进行对比并绘制生存函数曲线,对各组患者的PFS、OS的比较采用Log-rank检验法;P<0.05具有统计学意义。
结 果
一、患者临床基本资料
共收集符合纳入标准的患者68例,其中化疗组40例(58.8%),靶向治疗组28例(41.2%),年龄范围为27~76岁,中位年龄58岁,两组合计男性37例(54.41%),女性31例(45.59%),吸烟患者23例(33.82%),不吸烟患者45例(66.18%),ECOG PS评分0、1、2分患者分别为8例(11.76%)、58例(85.28%)、2例(2.9%),临床分期ⅢB、Ⅳ期分别为5例(7.35%)、63例(92.65%),两组患者在年龄、性别、吸烟状况、PS评分及临床分期的临床资料基线水平一致(P>0.05),见表1。

表1 两组患者基本临床资料(例)
二、近期疗效
化疗组40例患者中,PR18例(45.0%),SD20例(50.0%),PD2例(5.0%);靶向治疗组28例患者中,PR5例(17.85%),SD15例(53.57%),PD8例(28.57%),两组患者均无CR。客观缓解率化疗组和靶向治疗组分别为45%和17.86%,P=0.020;疾病控制率化疗组和靶向治疗组分别为95%和71.43%(P=0.012)。将化疗组和靶向治疗组客观缓解率和疾病控制率相比较P值均小于0.05,客观缓解率和疾病控制率组间比较均有统计学差异,见表2。

表2 L858R突变患者化疗及靶向治疗疗效比较[n(%)]
三、无进展生存期比较
化疗组及靶向治疗组PFS分别为9.901个月[95%CI(7.258,11.142)]和7.253个月[95%CI(4.793,10.207)],组间差异有统计学意义(P=0.045),见图1。

图1 L858R突变患者化疗及靶向治疗无进展生存期曲线
四、总生存期比较
到随访截止时止,两组患者均达中位生存时间,化疗组21例(52.5%),靶向治疗组16例(57.1%)。化疗及靶向治疗OS分别为21.738个月[95%CI(18.079,25.397)]和23.611个月[95%CI(18.761,28.462)],组间无统计学差异(P=0.378),见图2。
讨 论
肺癌作为世界首位肿瘤性死亡原因,组织学分类主要有非小细胞肺癌(NSCLC)(80%)和小细胞肺癌(SCLC)(20%)两大类,NSCLC主要包括腺癌(≥40%)、鳞癌(30%)、大细胞癌(10%)[10]。目前肺癌诊疗已经进入分子病理、多学科联合诊治的时代[11-12]。
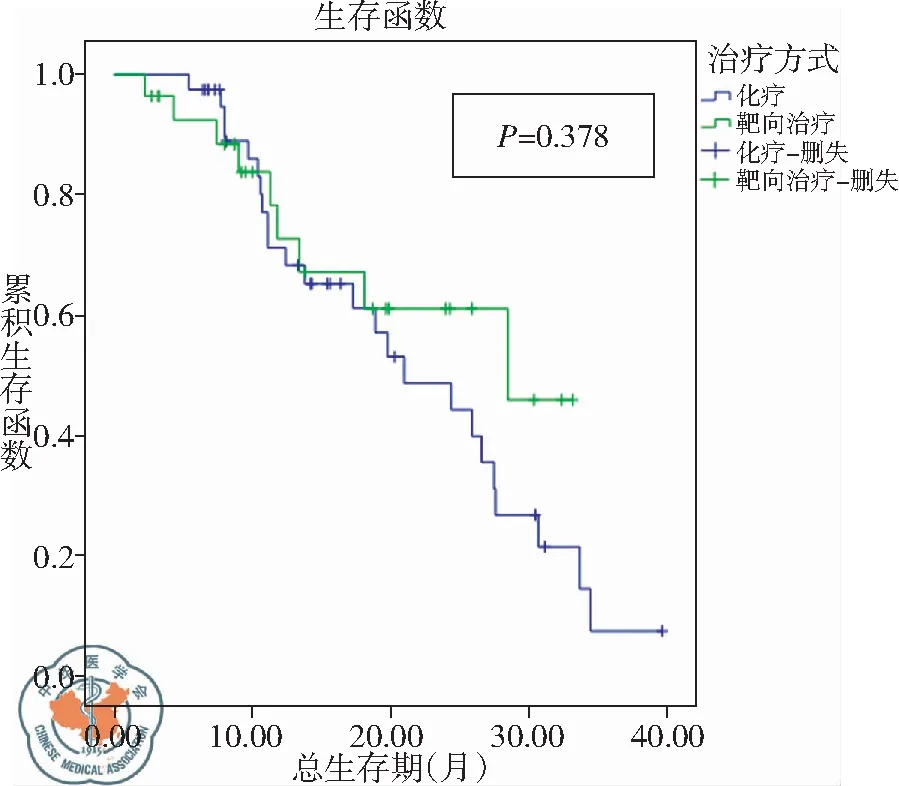
图2 L858R突变患者化疗及靶向治疗总生存期曲线
肺癌中存在k-RAS、EGFR、ALK、 ROS1、 c-MET等驱动基因,这些驱动基因是导致肺癌发生、发展的关键分子事件。其中,EGFR基因突变率17%,主要发生在18-21外显子区,分为常见突变(19del和L858R)和罕见突变。外显子19区的19del和外显子21区的L858R突变最为常见,占所有EGFR突变的85%~90%[13]。19del突变主要是第747-752位密码子碱基的缺失,这种缺失突变造成EGFR蛋白中氨基酸序列丢失并改变了受体酪氨酸激酶ATP结合槽的角度,从而使细胞对EGFR-TKIs治疗敏感性增加;L858R突变主要是第858位密码子的点突变,出现T→G转换,造成EGFR蛋白中该位点的亮氨酸转变为精氨酸,此种结构改变也使细胞对EGFR-TKI的治疗敏感[14]。目前临床认为,对于19、21外显子突变首选EGFR-TKI作为一线治疗方案[4],外显子20区的T790M为耐药突变,不推荐使用一代TKI治疗。对于没有检测到有效驱动基因的患者,含铂联合化疗方案仍是标准的一线治疗方案[5]。
有研究表明,EGFR-TKI治疗19del突变和L858R突变患者,两组间在PFS上有明显差异,提示19del突变与L858R突变对于TKI反应可能存在差异[7]。目前临床研究并没有将EGFR不同突变位点单独列出对化疗与靶向治疗进行疗效评估比较,这可能是因为存在L858R突变亚组对TKI治疗敏感性较化疗差的风险。本研究采用回顾性研究,收集比较68例L858R突变肺腺癌患者一代TKI靶向治疗与化疗疗效,目的在于评估在L858R突变亚组中TKI治疗与化疗治疗的差异。
本研究发现对于L858R突变肺腺癌患者,化疗治疗的近期疗效及无进展生存期优于靶向治疗组,疾病总生存期未见明显差异,即客观缓解率45%vs. 17.86%,(P=0.020),疾病控制率95%vs. 71.43%,(P=0.012),无进展生存期 9.901个月vs. 7.253个月,(P=0.045),总生存期 21.738个月vs. 23.611个月,(P=0.378)。由此可见,对于EGFR21外显子L858R突变肺腺癌患者化疗治疗效果不一定劣于靶向治疗,其机制可能与以下几个方面有关[13]:①21外显子位于EGFR分子的A-loop 区,其与ATP结合的关键位点关系不如EGFR催化位点(αC-helix区域)紧密,造成L858R突变患者EGFR与TKI的结合不及19del突变的结合紧密,从而造成治疗效果不及19del突变; ②80%的L858R突变与EGFR-TKI获得性耐药相关的基因突变T790M共存[15],耐药基因的出现使靶向治疗药物难以发挥正常作用,这一特点可能导致L858R突变患者对EGFR-TKI治疗反应性差甚至不及传统双药联合化疗;③L858R突变与其他可能影响EGFR-TKI敏感性的不常见突变共存,发生率最高的是G719S突变,这些不常见突变可降低L858R突变对EGFR-TKI的敏感性,使靶向治疗效果差[16-18],因而对于这些不常见突变患者应首选治疗方案为化疗[19-21]。本研究中化疗与靶向治疗比较OS未见明显统计学差异,其原因很大程度上可能是由于疾病进展后患者多更换治疗方案或采用化疗联合靶向治疗的方案或联合放射治疗,综合治疗使两者在总生存期上的差异不明显。
本回顾性分析中,靶向治疗患者例数28例,病例数较少,可能使统计结果出现偏倚,应继续收集符合条件的病例扩大样本量,并行前瞻性随机对照研究,才能使实验结果更加真实有效。下一步应根据此结果行进一步基础研究,以明确L858R突变肺腺癌患者化疗治疗效果优于靶向治疗的机制,从而为临床上不同突变类型肺腺癌患者选择最适的治疗方式提供依据,才能患者有最大获益并实现治疗的个体化。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-5.
2 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
3 Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
4 2015美国国家综合癌症网络 (NCCN) 指南: 肺癌的全身治疗[J].中国全科医学, 2015(18): 2126.
5 Gridelli C, Ardizzoni A, Douillard JY, et al. Recent issues in first-line treatment of advanced non-small-cell lung cancer: Results of an international expert panel meeting of the Italian association of thoracic oncology[J]. Lung cancer, 68(3): 319-331.
6 Kuan FC, Kuo LT, Chen MC, et al. Overall survival benefits of first-line EGFR tyrosine kinase inhibitors in EGFR-mutated non-small-cell lung cancers: a systematic review and meta-analysis[J]. Br J Cancer, 2015, 113(10): 1519-1528.
7 Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med, 2009, 361(10): 958-967.
8 Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials[J]. Lancet Oncol, 2015, 16(2): 141-151.
9 Jackman DM, Yeap BY, Sequist LV, et al. Exon 19 deletion mutations of epidermal growth factor receptor are associated with prolonged survival in non-small cell lung cancer patients treated with gefitinib or erlotinib[J]. Clin Cancer Res, 2006, 12(13): 3908-3914.
10 Travis WD, Brambilla E, Muller-Hermelink HK, et al. World Health Organization classification of tumours. Pathology and genetics of tumours of the lung pleurthymus and heart[M]. Lyon: IARC Press, 2004.
11 钱桂生. 为提高我国呼吸系统疾病的诊治水平而努力[J/CD]. 中华肺部疾病杂志(电子版), 2012, 5(1): 1-3.
12 邹晶, 徐兴祥, 王大新, 等. 肺癌放化疗“实时”疗效评估方法的研究进展[J/CD]. 中华肺部疾病杂志(电子版), 2013, 6(4): 360-363.
13 Zhang Y, Sheng J, Kang S, et al. Patients with exon 19 deletion were associated with longer progression-free survival compared to those with L858R mutation after first-line EGFR-TKIs for advanced non-small cell lung cancer: a meta-analysis[J]. PLoS One, 2014, 9(9): e107161.
14 Gazdar AF, Shigematsu H, Herz J, et al. Mutations and addiction to EGFR: The achilles ‘heal’ of lung cancers[J]. Trends Mol Med, 2004, 10(10): 481-486.
15 Yu HA, Arcila ME, Hellmann MD, et al. Poor response to erlotinib in patients with tumors containing baselineEGFR T790M mutations found by routine clinical molecular testing[J]. Ann Oncol, 2014, 25(2): 423-428.
16 Chou TY, Chiu CH, Li LH, et al. Mutation in the tyrosine kinase domain of epidermal growth factor receptor is a predictive and prognostic factor for gefitinib treatment in patients with non-small cell lung cancer[J]. Clin Cancer Res, 2005, 11(10): 3750-3757.
17 Mitsudomi T, Yatabe Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer[J]. Cancer Sci, 2007, 98(12): 1817-1824.
18 Wu JY, Wu SG, Yang CH, et al. Lung cancer with epidermal growth factor receptor exon 20 mutations is associated with poor gefitinib treatment response[J]. Clin Cancer Res, 2008, 14(15): 4877-4882.
19 Arrieta O, Cardona AF, Corrales L, et al. The impact of common and rare EGFR mutations in response to EGFR tyrosine kinase inhibitors and platinum-based chemotherapy in patients with non-small cell lung cancer[J]. Lung Cancer, 2015, 87(2): 169-175.
20 Ellis PM, Coakley N, Feld R, et al. Use of the epidermal growth factor receptor inhibitors gefitinib, erlotinib, afatinib, dacomitinib, and icotinib in the treatment of non-small-cell lung cancer: a systematic review[J].Curr Oncol, 2015, 22(3): 183-215.
21 Shi L, Tang J, Tong L, et al. Risk of interstitial lung disease with gefitinib and erlotinib in advanced non-small cell lung cancer: a systematic review and meta-analysis of clinical trials[J]. Lung Cancer, 2014, 83(2): 231-239.
(本文编辑:张大春)
罗萌,胡义德. EGFR基因21外显子L858R突变肺腺癌患者化疗和靶向治疗疗效的回顾性分析[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(1): 20-24.
Retrospective study on the differences of efficacy of chemotherapy and epidermal growth factor receptor-tyrosine kinase inhibitor treatment in advanced lung adenocarcinoma patients harboring L858R mutation
LuoMeng1,XuYu2,HuYide1.
InstituteofCancer1,InstituteofBreath2,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China
HuYide,Email:huyide_mit@yahoo.com.cn
Objective To explore the differences of efficacy of the chemotherapy and epidermal growth factor receptor-tyrosine kinase inhibitor treatment in advanced lung adenocarcinoma patients harboring exon 21 mutation. Methods The clinical characteristic of advanced lung adenocarcinoma harboring EGFR 21 L858R mutation receiving first-line chemotherapy and EGFR-TKI treatment in Xinqiao hospital from Jan 2010 to Dec 2015 were studied. The differences between the clinical indicators of the two groups, such as objective response rates (ORR), disease control rates(DCR), progression free survival(PFS), overall survival(OS) were analyzed. Results ①The data of 68 patients were collected including 40 chemotherapy and 28 EGFR-TKI. Baselines of sex, age, smoking status, ECOG PS between the two groups were consistent (P>0.05) . ②The ORR of the two groups were 45% and 17.9%(P=0.020), the DCR of the two groups were 95% and 71.4%(P=0.012). The PFS of the two groups were 9.901 and 6.746 months (P=0.045), the OS of the two groups were 21.738 and 23.611 months (P=0.378). Conclusions Compared with EGFR-TKI, the patients of advanced lung adenocarcinoma treated with chemotherapy had significant advantage of ORR, DCR and PFS, no difference on OS.
Epidermal growth factor receptor mutation; Lung adenocarcinoma; Chemotherapy; Targeted molecular therapy; Clinical efficacy; Retrospective analysis
10.3877/cma.j.issn.1674-6902.2017.01.005
国家自然科学基金资助项目(81372340)
400037 重庆,第三军医大学新桥医院肿瘤科·全军肿瘤研究所1全军呼吸研究所2
胡义德,Email: huyide_mit@yahoo.com.cn
R734.2
A
2016-08-25)

