创伤弧菌产铁载体菌株的筛选及其诱导条件的响应面优化
杨常娥,鲁艳莉,倪捍成,周 咏,宁喜斌,*
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306;2.大连金州新区水产服务管理站,辽宁大连 116100)
创伤弧菌产铁载体菌株的筛选及其诱导条件的响应面优化
杨常娥1,鲁艳莉2,倪捍成1,周 咏1,宁喜斌1,*
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306;2.大连金州新区水产服务管理站,辽宁大连 116100)
创伤弧菌是一种重要的人鱼共患致病菌,根据目前已报道的致病因子,产铁载体是其主要的致病因子之一。以海水中筛选分离出的创伤弧菌为实验菌株,通过改良金氏培养基(Modified King B,MKB)筛选产铁载体菌株,通过平板覆盖法筛选高产铁载体菌株及紫外可见分光光度计法测定铁载体活性单位(siderphore units,SU)。基于MKB培养基,选取产铁载体能力最高的V.vulnificusY8菌株,利用响应面法对其铁载体活性单位的显著影响因素包括初始pH、装液量及碳氮比(C/N)进行优化。响应面优化结果表明:在初始pH7.84、装液量81.53 mL及碳氮比(C/N)3.06的条件下,铁载体活性单位预测值为90.7404%,并通过三次平行验证实验证明,实际平均SU值和预测SU值接近,较优化前提高了23.73%。响应面优化了MKB诱导产铁载体条件,实现铁载体的高效诱导,为日后的进一步研究奠定基础。
创伤弧菌,产铁载体,MKB培养基,响应面优化
创伤弧菌广泛存在于海水及海产品中,感染水产品不仅增加了水产养殖业经济损失,而且存在严重的水产品食用安全隐患;感染人类,导致严重的败血症和胃肠炎。创伤弧菌的确切致病机制至今尚未完全明了。目前认为该菌可以产生众多的致病相关物质,其中铁载体是其主要致病因子之一,另外还包括溶细胞素、金属蛋白酶、荚膜多糖[1]等。
铁载体(Siderophore)是生长在低铁环境中的细菌、真菌合成的一类具有高度专一性的低分子量的铁螯合剂[2-4]。铁是微生物生长的必须微量元素,在缺铁条件下,微生物一般依赖其分泌的螯合剂来溶解、运输环境中的难溶性铁。根据目前已分离鉴定的铁载体类型主要可归为3类:异羟肟酸类(hydroxmate)、儿茶酚类(cateolate)和羧酸类[5]。
MKB培养基产生铁载体的主要诱导条件,包括碳氮比(C/N)、初始pH、温度、初始盐度及装液量等,如何确定显著因子及最适范围非常重要。通过单因素实验确定在只改变单一变量的情况下,确定各变量最适范围,利用Plackett-Burman设计实验可以从众多的因素中筛选出显著影响因素[6],响应面法对关键因子进行优化,获得目的菌株的最佳产铁载体能力。
目前关于创伤弧菌诱导铁载体条件的研究甚少,国内外研究关于细菌铁载体的诱导合成主要是通过培养基诱导和联铁物质。其中培养基包括改良蔗糖-天冬氨酸培养基(Modified sugar-aspartic acid,MSA)[7]、改良金式培养基(Modified King B,MKB)[8]、琥珀酸钠培养基(Succinate medium,SM)[9]、精氨酸培养基(Arginine medium,AM)[10]和柠檬酸盐培养基(Citrate medium,CM)等;联铁物质是指一些铁的螯合物如2-2′联吡啶[11-13]、8-羟基喹啉[14],主要是通过极强的螯合作用,使得微生物生长环境处于低铁或无铁环境下。联铁物质具有极强的毒性且在高温灭菌前处理中可能释放致癌物质,因此不利于普通实验室开展对铁载体的研究。培养基诱导具有安全、稳定的优点,但是其诱导产量一般较低。基于MKB培养基通过改变培养基碳氮源及外界环境条件,利用响应面优化实验获得最佳铁载体诱导条件,实现铁载体的高效诱导,为日后的进一步研究奠定基础。
1 材料与方法
1.1 材料与仪器
创伤弧菌V.vulnificusY2、V.vulnificusY3、V.vulnificusY4、V.vulnificusY5、V.vulnificusY8,为本实验室从东海海水筛选所得;
铬天青(Chrome azuorl S,CAS)、氯化钠、甘油、七水硫酸镁、α-乳糖 均为分析纯国药集团试剂有限公司;十六烷基三甲基溴化铵(hexadecyltrimethylammonnium,HDTMA)、磷酸氢二钾、三氯化铁、磷酸二氢钠、磷酸氢二钠 均为分析纯上海凌峰有限公司;胰蛋白胨大豆肉汤、蛋白胨、酵母浸出粉 上海华康科技开发公司(上海疾控)。
增菌培养基-3% NaCl胰蛋白胨大豆肉汤
诱导培养基:MKB培养基(g/L)(其组成如下:MgSO4.7H2O 2.5 g/L;K2HPO42.5 g/L;甘油 0.5 g/L;蛋白胨5 g/L;pH7-7.2;3% NaCl等),主要用于合成铁载体,MKB固体培养基添加2%琼脂。
CAS蓝色检测液:其制备如下:溶液A:将0.079 g的CAS,溶于50 mL去离子水中,再加入10 mL 1 mmol/L的FeCl3溶液(含有10 mmol/L的HCl);溶液B:将0.069 g的HDTMA,溶于40 mL的去离子水中;溶液C:将A溶液沿着烧杯的壁缓缓加入到B溶液中,轻轻晃动,使溶液AB混匀,得到溶液C:CAS蓝色检测液[15]。
改进CAS蓝色固体检测平板:参考文献[8],将MM9缓冲液换为pH6.8的磷酸盐缓冲液。
MKB-CAS固体检测培养基:底层为MKB固体培养基,上层覆盖一层CAS固体蓝色检测培养基。利用CAS平板覆盖法[16]筛选产铁载体菌株。
紫外可见光分光光度计UV-VIS 2300 上海天美科学仪器有限公司;台式pH730精密测试仪 德国WTW;台式离心机TGL-16G 上海安亭科学仪器厂。
实验过程中用到的所有玻璃器皿均用6 mol/L HCl浸泡过夜,然后用去离子水冲洗三遍,从而去除附着在容器上的痕量铁,避免实验数据的系统误差。实验过程中所用试剂及培养基均由去离子水配制,培养基配制器皿均为总体积250 mL的锥形瓶。
1.2 实验方法
1.2.1 产铁载体创伤弧菌的筛选 将活化好的实验菌株用接种针点种于MKB培养基,在恒温培养箱中37 ℃培养24 h,然后利用 MKB-CAS固体检测培养基筛选出高产铁载体菌株,观察菌落周围颜色变化,15 min内与CAS发生颜色变化的菌株被定义为潜在型高产铁载体菌株(Potentially strong siderophore producers,PSSP);而颜色变化不完全或者颜色变化时间超过12 h的菌株被定义为边缘型产铁载体菌株(Bordierline siderophore producers,BSP)[17]。
1.2.2 产铁载体能力的测定 挑取单菌落于MKB培养基中,28 ℃、150 r/min培养24 h后,12000 r/min常温离心5 min,取等体积无细胞上清液与等体积的MKB培养液(空白对照),同时与CAS检测液混合,稀释10倍,室温下静置1 h,紫外可见光分光光度计UV-VIS 2300测定其相对OD630。铁载体活性单位(Sideropphore units,SU)表示铁载体的产量,SU(%)=[(Ar-As)/Ar]×100,其中Ar是未接种的培养基与等体积CAS混合OD630,As是菌株上清与等体积CAS混合OD630。对细菌产铁载体能力进行划分,As/Ar从1.0~0之间以0.2为间隔,每减小0.2增加一个“+”,一般产铁载体能力较高的细菌其As/Ar低于0.5[18]。
1.2.3 产铁载体菌株诱导条件的单因素实验 以铁载体活性单位为指标,研究最佳碳源、氮源及其初始碳氮比、初始pH、初始盐度、温度、装液量的最佳诱导条件。
1.2.3.1 碳源、氮源对铁载体活性单位的影响 配制MKB培养基100 mL,碳源分别用葡萄糖、蔗糖、可溶性淀粉、乳糖、纤维二糖、甘露醇、无水碳酸钠、碳酸氢钠替代甘油,氮源分别用硫酸铵、氯化铵、酵母浸出粉、磷酸氢二铵、草酸铵、酸水解酪蛋白替代蛋白胨。其他条件不变,培养24 h后,按照1.2.2方法测定相对OD630值。
1.2.3.2 初始碳氮比对铁载体活性单位的影响 在确定最佳碳源、氮源分别为乳糖、酵母浸出粉。分别最佳碳氮比例为1∶1、1∶2、1∶3、1∶4、2∶1、3∶1、4∶1、5∶1。其他条件不变,150 r/min摇床振荡培养24 h后,测定相对OD630值。
1.2.3.3 初始pH对铁载体活性单位的影响 配制MKB培养基100 mL,利用台式pH精密测试仪分别调节其pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,其他条件不变,CAS蓝色检测液自身颜色的变化易受到pH的影响,150 r/min摇床振荡培养24 h后,将培养基pH调至中性后,测定相对OD630值。
1.2.3.4 初始盐度对铁载体活性单位的影响 配制MKB培养基100 mL,分别用NaCl调节其盐度为1%、2%、3%、4%、5%、6%、7%、8%、9%,其他条件不变,150 r/min摇床振荡培养24 h后,测定相对OD630值。
1.2.3.5 温度对铁载体活性单位的影响 MKB培养基100 mL,其他条件不变,置于摇床中,分别调节其温度为20、25、30、35、40 ℃,150 r/min摇床振荡培养24 h后,其他条件不变,测定相对OD630值。
1.2.3.6 装液量对铁载体活性单位的影响 配制MKB培养基20、40、60、80、100、120 mL,其他条件不变,150 r/min摇床振荡培养24 h后,测定相对OD630值。
1.2.4 Plackett-Burman设计实验 在单因素实验的基础上,利用Plackett-Burman筛选出显著影响因素。选用N=15设计实验,设定三个中心点,对初始pH、温度、初始盐度、装液量及最佳碳氮比5个因素进行实验,每个因素分别取低(-1)和高(+1)两个水平,其中高水平大约为低水平的1.5倍[19],以铁载体活性单位(SU)为响应值。
1.2.5 中心组合Box-Behnken响应面实验 根据Plackett-Burman实验筛选的结果,以铁载体活性单位为响应值,根据Box-Behnken的中心组合设计原理,设计三因素三水平的响应面实验(见表1),初始盐度及温度分别设为初始值3%和28 ℃。
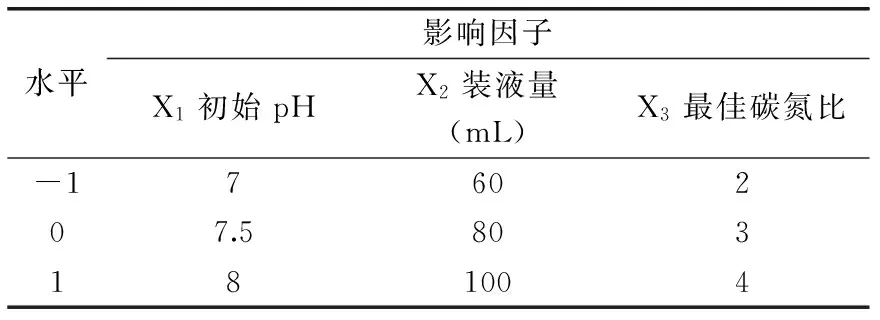
表1 Box-Behnken实验设计因子及水平Table 1 Factors and levels of Box-Behnken
1.2.6 数据处理 本实验用Excel进行单因素实验数据分析和制图,利用Minitab17设计Plackett-Burman实验和分析实验数据。利用Design-Expert8.0.6设计中心组合Box-Behnken响应面实验和分析结果。
2 结果与分析
2.1 创伤弧菌产铁载体菌株的筛选
利用MKB-CAS固体双层平板覆盖法筛选出高产铁载体菌株,并根据颜色变化快慢表明仅V.vulnificusY8菌株为PSSP菌株,而V.vulnificusY2、V.vulnificusY3、V.vulnificusY4、V.vulnificusY5菌株为BSP菌株,待继续培养3~4 d后出现桔黄色晕圈。典型的产铁载体菌株出现桔黄色晕圈见图1A,继续在室温条件下放置数个星期后菌株出现明显红色晕圈见图1B,且周围培养基都变红。通过测定实验菌株相对吸收波长OD630值的大小计算出铁载体活性单位和As/Ar值,并根据As/Ar值确定各个菌株分泌铁载体能力的等级,如表2所示,其中V.vulnificusY8产铁载体能力为++++,铁载体活性单位最大达到65.95%。
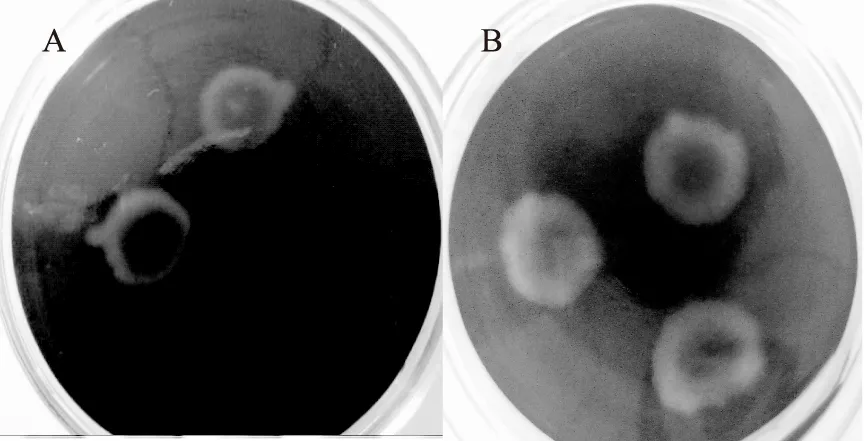
图1 MKB-CAS平板筛选产铁载体菌株Fig.1 Screening of siderophore-producing strains by MKB-CAS overlay plate method

表2 PSSP菌株产铁载体能力Table 2 Capacity of PSSP strains producing siderophores
2.2 单因素实验结果
2.2.1 最佳初始碳氮比的确定 考察不同的碳氮源对V.vulnificusY8菌株铁载体活性单位的影响,结果分别见图2和图3。实验结果表明在以无水碳酸钠、碳酸氢钠作为碳源的培养基中,V.vulnificusY8菌株没有生长,在以葡萄糖、蔗糖、甘露醇作为碳源的培养基中V.vulnificusY8菌株生长良好,但没有产生铁载体,在以可溶性淀粉、乳糖和纤维二糖作为碳源的培养基中生长良好且产生铁载体,产铁载体能力如图2所示,其中在乳糖作为碳源的培养基中铁载体活性单位达到最高,为86.88%,确定为最佳碳源。在以草酸铵作为氮源的培养基中V.vulnificusY8菌株未生长,在以硫酸铵、氯化铵、磷酸氢二铵作为氮源的培养基中V.vulnificusY8菌株生长良好,但未产生铁载体,在以酵母浸出粉、酸水解酪蛋白为氮源的培养基中生长良好且产生铁载体,产铁载体能力如图3所示,其中在酵母浸出粉作为氮源的培养基中铁载体活性单位达到最高,为86.52%,确定为最佳氮源。
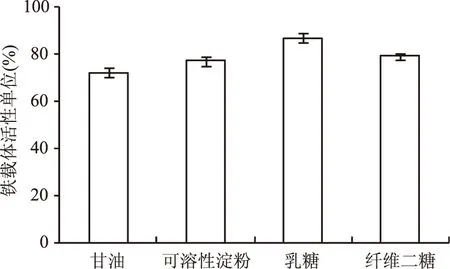
图2 碳源对铁载体活性单位的影响Fig.2 Effects of carbon sources on siderphore units
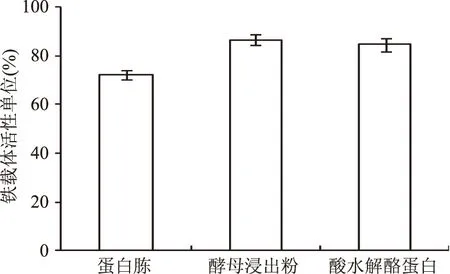
图3 氮源对铁载体活性单位的影响Fig.3 Effects of nitrogen sources on siderphore units
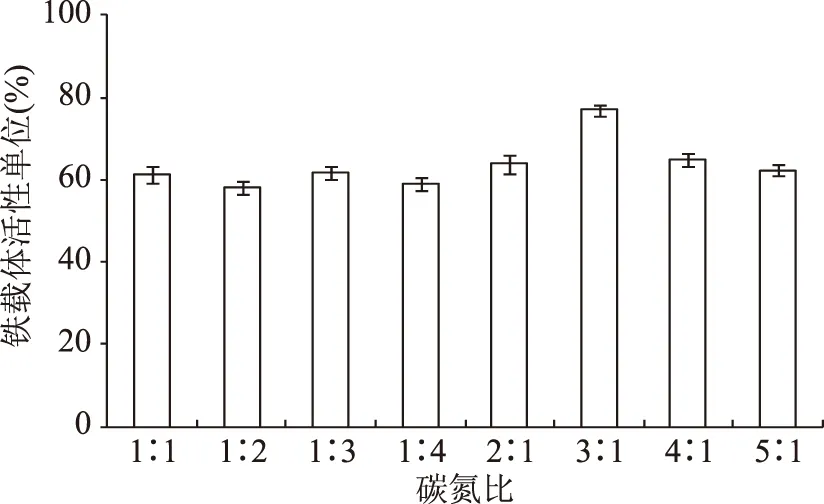
图4 初始碳氮比对铁载体活性单位的影响Fig.4 Effects of initial carbon-nitrogen ration on siderphore units
其次考察不同的碳氮比对V.vulnificusY8菌株铁载体活性单位的影响,结果见图4。增加氮源的比例未能明显地增加V.vulnificusY8菌株的产铁载体能力;增加碳源的比例时,其产铁载体能力提高,变化明显,当碳氮比为3∶1时,铁载体活性单位达到最高,为76.95%。因此考虑氮源成本因素,确定最适碳氮比范围为2∶1~4∶1。
2.2.2 最佳初始pH的确定 考察不同的pH条件对V.vulnificusY8菌株铁载体活性单位的影响,结果见图5。由图5可知,铁载体活性单位在酸性条件下比中性和碱性条件下要低,在pH<5.5显著降低,pH5.5~pH7时铁载体活性单位缓慢增加,pH7~pH8.5铁载体活性单位基本达到最大值,保持稳定状态。而在pH>8.5铁载体活性单位有明显下降趋势,因此pH7~pH8.5时为最佳铁载体诱导条件。培养基酸性太高,菌体自身无法生长。邓曦等[20]通过单因素实验研究表明创伤弧菌在pH6~pH8时生长最佳,本实验研究发现的最佳铁载体诱导条件与创伤弧菌生长pH基本上相一致。
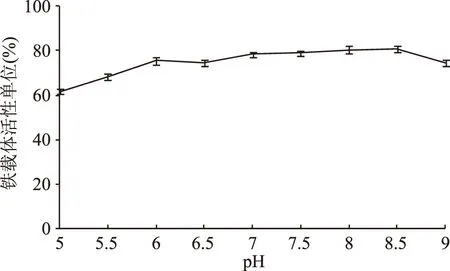
图5 初始pH对铁载体活性单位的影响Fig.5 Effects of initial pH value on siderphore units
2.2.3 最佳初始盐度的确定 考察不同的盐度对V.vulnificusY8菌株铁载体活性单位的影响,结果见图6。由图6可知,铁载体活性单位在盐度为3%时达到最高,当盐度为1%~3%时,铁载体活性单位逐渐增长,高于3%后,铁载体活性单位显著下降。创伤弧菌是一种嗜盐性海洋细菌,生长需要一定的盐度,在盐度为0%,创伤弧菌将无法生长。对V.vulnificusY8菌株的嗜盐性实验(未发表)发现V.vulnificusY8菌株在TSB培养基生长的最适盐度为3%。同时在MKB培养基3%盐度时菌株生长良好,铁载体活性单位达到最大值。因此确定其铁载体最佳诱导盐度为1%~3%。
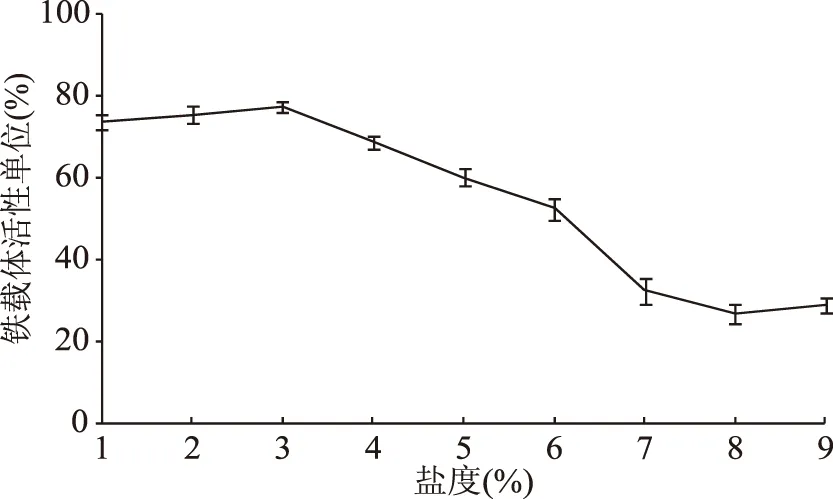
图6 初始盐度对铁载体活性单位的影响Fig.6 Effects of initial salinity on siderphore units
2.2.4 最佳温度的确定 考察不同的温度对V.vulnificusY8菌株铁载体活性单位的影响,结果见图7。在V.vulnificusY8菌株的最适生长温度实验中(未发表)发现当温度为20~40 ℃时,随着温度的升高,V.vulnificusY8菌株生长速率不断增加,菌株最适生长温度范围为35~37 ℃。由图7可知,在温度20~35 ℃时,菌株铁载体活性单位不断增加;在温度高于35 ℃时,菌株生长迅速,但铁载体活性单位并未增加。因此确定最佳铁载体活性单位温度为25~35 ℃。
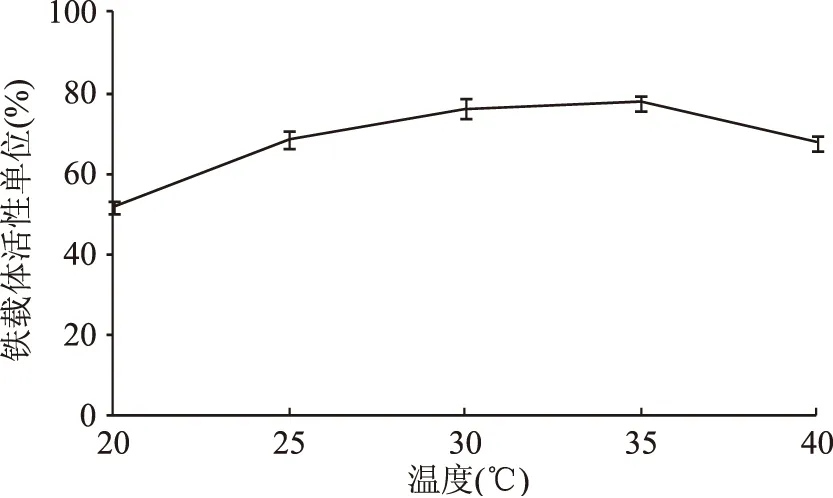
图7 温度对铁载体活性单位的影响Fig.7 Effects of temperature on siderphore units
2.2.5 最佳装液量的确定 考察不同的装液量对V.vulnificusY8菌株铁载体活性单位的影响,结果见图8。由图8可知最佳装液量为60~100 mL。当装液量为20~40 mL时,铁载体活性单位无明显变化;当装液量为40~60 mL时,铁载体活性单位增加。当装液量60~80 mL,铁载体活性单位增加缓慢;当装液量80~120 mL时,铁载体活性单位逐渐减少。装液量的高低表示培养基中含氧量的多少,培养基中适当的氧含量有利于创伤弧菌的生长。
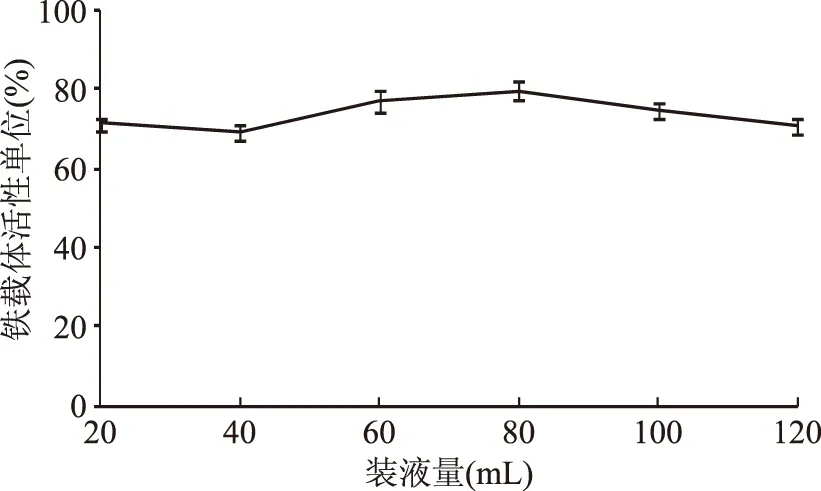
图8 装液量对铁载体活性单位的影响Fig.8 Effects of medium capacity on siderphore units
2.3 Plackett-Burman设计法
在单因素实验的基础上,确定各水平最佳产铁载体范围:确定最佳碳氮比为2∶1~4∶1;最佳盐度为1%~3%;最佳装液量为60~100 mL。初始pH为7~8.5,同时考虑乳糖在pH较高时,高温灭菌时可能发生异构化,因此确定最佳初始pH为7~8;最佳温度为25~35 ℃,考虑培养基初始培养温度(未优化前)和正负因子水平,最终确定为28~35 ℃。
利用Plackett-Burman法筛选出最显著因素,实验设计及结果见表3。利用Minitab17对表3 数据回归方程分析,结果表明回归方程显著(p=0.001),R2=0.9001表明该模型可信。Plackett-Burman实验各因素主效应分析如表4所示,显著性排序为:初始pH>碳氮比>装液量>温度>初始盐度,确定初始pH、碳氮比及装液量为显著影响因素。
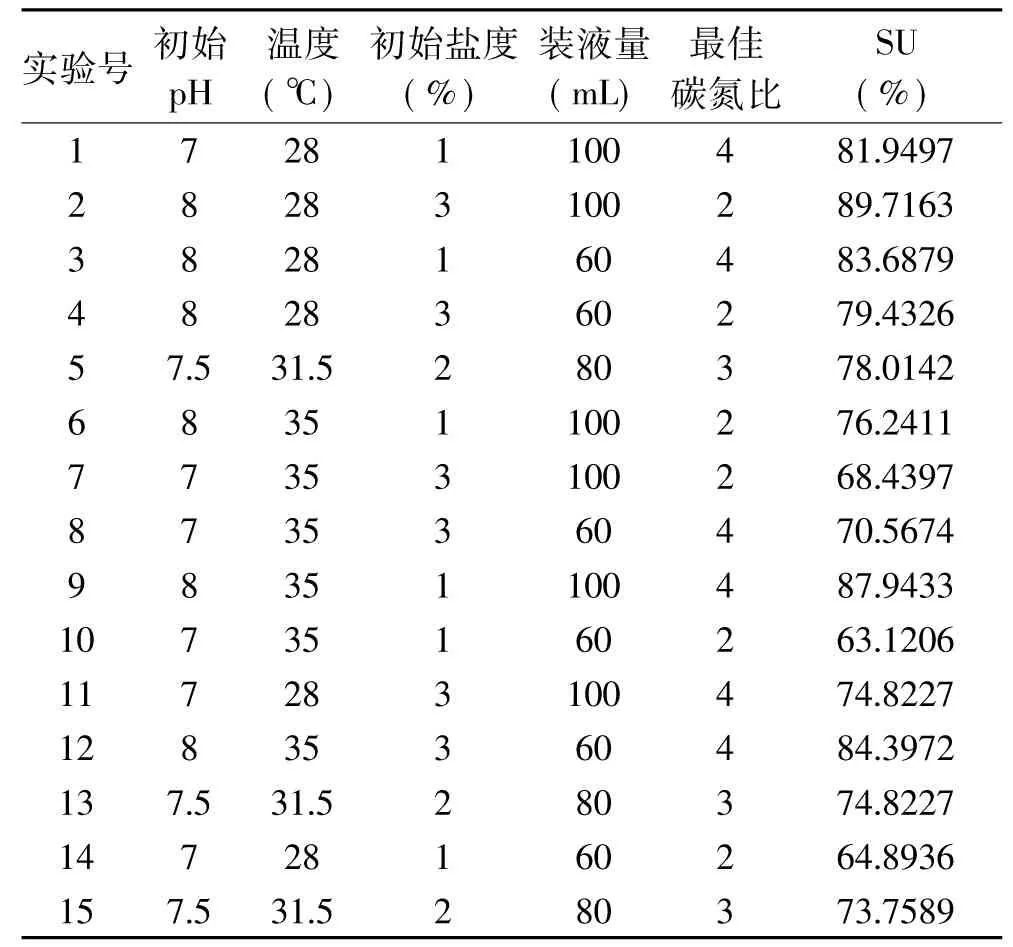
表3 的Plackett-Burman实验设计及其响应值表(N=15)Table 3 Experimental design and response value of Plackett-Burman(N=15)
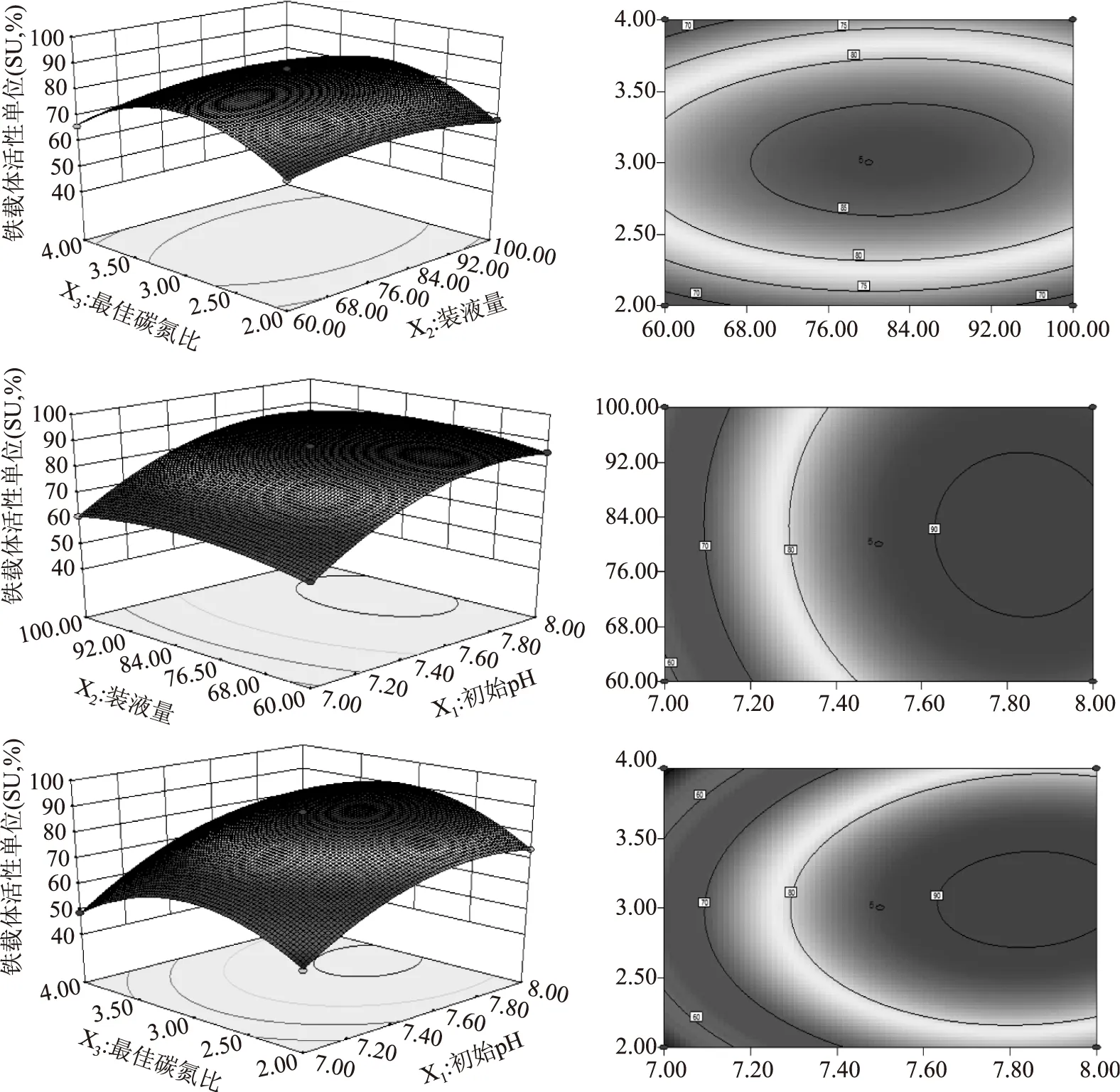
图9 显著影响因子对铁载体活性单位的响应面Fig.9 Response surface methodology of siderphore units by significant factor
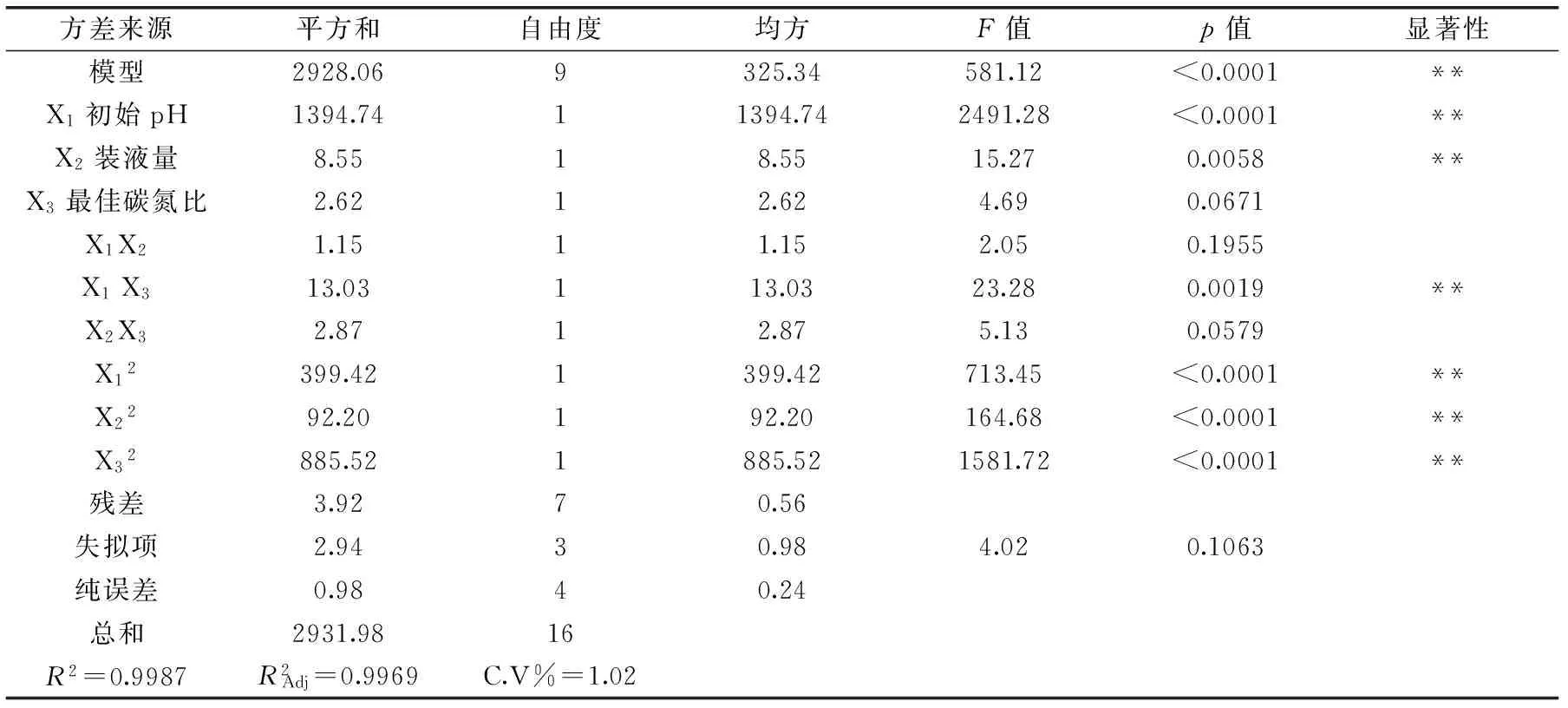
表6 响应面回归模型ANOVA分析结果Table 6 ANOVA for Response Surface Quadratic Model analysis of variance table
注:**表示影响极其显著,p<0.01;*表示影响显著,p<0.05。
2.4 三因素三水平的响应面实验设计
Box-Behnken设计结果分析见表5、表6。该二次模型的多元相关系数R2=0.9987,表明仅有0.13%的变异不能由该模型解释。对表6构建多元回归拟合方程,得到初始pH(X1)、装液量(X2)、最佳碳氮比(X3)与响应值铁载体活性单位(Y)的关系,其方程式表达为铁载体活性单位(SU,%)=87.18+13.20X1+1.03X2+0.57X3-0.54X1X2+1.80X1X3+0.85X2X3-9.74X12-4.68X22-14.50X32。
根据回归方程得出三种显著影响因素初始pH、碳氮比及装液量的响应面和等高线结果见图9。结果表明:初始pH(X1)和装液量(X2)、装液量(X2)和最佳碳氮比(X3)交互作用不显著,初始pH(X1)和最佳碳氮比(X3)交互作用显著。利用Design-Expert8.0.6分析得到铁载体活性单位最优条件:初始pH为7.84,装液量为81.53 mL,最佳碳氮比为3.06∶1,预测铁载体活性单位(SU)可高达90.7404%。考虑实际操作,设定初始pH为8,装液量为82 mL,最佳碳氮比为3∶1。
2.5 验证实验
按照DesignExpert8.0.6确定的最佳优化条件,进行三次平行实验,得到铁载体活性单位为89.2311%、90.0127%、89.7842%,平均铁载体活性单位为89.676%,实测值与模型预测值相对误差为0.752%,说明模型预测效果良好。
3 结论
本文以海水中分离出的5株创伤弧菌为实验菌株,基于MKB培养基,筛选出其中铁载体活性单位最高的V.vulnificusY8菌株进行响应面优化并得到最佳诱导条件,同时结合实际优化条件,得到优化条件:分别以乳糖和酵母浸出粉作为碳氮源且碳氮比3、初始pH8及装液量82 mL。对于MKB培养基,优化前的参数:以甘油和蛋白胨作为碳氮源且碳氮比为1、初始pH6.8~7.0及装液量100 mL,得出的平均铁载体活性单位为69.95%。经过优化后的实验验证V.vulnificusY8的平均铁载体活性单位为89.676%,较优化前提高了23.73%。利用响应面法优化创伤弧菌产铁载体诱导条件,实现了铁载体的高效诱导,解决了传统培养基诱导率不高,联铁物质毒性大,不利于广泛使用等问题,为日后的铁载体进一步研究奠定基础。
[1]武静,刘晓斐,胡成进,等.创伤弧菌流行病学调查及致病机制研究现状[J].医学研究杂志,2015,14(3):166-168.
[2]Tan W Z,Verma V k,Jeong K J,et al.Molecular characterization of vulnibactin biosynthesis inVibriovulnificusindicates the existence of an alternative siderophore[J].Frontiers in Microbiology,2014,5(1):1-11.
[3]Kim S M,Park J H,Lee H S,et al.LuxR Homologue SmcR is Essential forVibriovulnificusPathogenesis and Biofilm Detachment,and its Expression is induced by Host Cells[J]. Infection and Immunity,2013,81(10):3721-3730.
[4]Ledala N,Pearson S L,Wilkinson Brian J,et al.Molecular characterization of the Fur protein ofListeriamonocytogenes[J]. Microbiology,2007,153(4):1103-1111.
[5]Maurice P A,Haack EA,Mishra B.Siderophore sorption to clays[J]. Biometals,2009,22(4):649-658.
[6]李梅青,张瑜,代蕾莉,等.Plackett-Burman实验设计及响应面法优化超声辅助提取明绿豆SOD工艺[J].食品科学,2015,36(2):69-74.
[7]Scher F M,Baker R.Effect of Pseudomonas putida and synthetic iron chelator on induction of soil suppressiveness to Fusarium wilt pathogens[J]. Phytopathology,1982,72(7):1567-1573.
[8]王平,董飚,李阜棣,等.小麦根圈细菌铁载体的检测[J]. 微生物学通报,1994,21(6):323-326
[9]Rachid D,Ahmed B.Effect of iron and growth inhibitors on sidorophores production byPseudomonasfluorescens[J].African Journal of Biotochnology,2005,4(7):697-702.
[10]Lin Y,Du D L,Si C C,et al. Potential biocontrol Bacillus sp. strains isolated by an improved method from vinegar waste compost exhihit antibiosis against fungal pathogens and promote growth of cucumbers[J].Biological Control,2014,71:7-15.
[11]Kawano H,Miyamoto K,Sakaguchi I,et al. Role of periplasmic binding proteins,FatB and VatD,in the vulnibactin utilization system of Vibrio vulnificus M2799[J].Microbial Pathogenesis,2013,65:73-81.
[12]Kim I H,Wen Y C,Son J S,et al.The Fur-Iron Complex Modulates Expression of the Quorum-Sensing Master Regulator,SmcR,To Control Expression of Virulence Factors in Vibrio vulnificus[J].Infection and Immunity,2013,81(8):2888-2898.
[13]Tanabe T,Kato A,Shiuchi K,et al.Regulation of the Expression of the Vibrio parahaemolyticus peuA Gene Encoding an Alternative Ferric Enterobactin Receptor[J].PLOS ONE,2014,9(8):1-13.
[14]朱慧明,张彦,杨洪江.高产铁载体假单胞菌的筛选及其对铁氧化物的利用[J].生物技术通报,2015,31(9):177-182.
[15]陈绍兴.细菌铁载体检测方法[J].红河学院学报,2005,3(6):16-18.
[16]王卫星,周晓伦,李忠玲,等.CAS平板覆盖法检测氢氧化细菌铁载体[J].微生物学通报,2014,41(8):1692-1697.
[17]Lee J,Postmaster A,Soon H P,et al.Siderophore production by actinomycetes isolates from two soil sites in Western Australia[J].Biometals,2012,25(2):285-296.
[18]赵翔,陈绍兴,谢志雄,等.高产铁载体荧光假单胞菌Pseudomonasfluorescenssp-f的筛选鉴定及其铁载体特性研究[J].微生物学,2006,46(5):691-695.
[19]郭磊,吴鹤云,张成林,等.利用响应面法优化枯草芽孢杆菌产尿苷发酵培养基[J].食品与发酵工业,2015,41(6):94-98.
[20]邓曦,唐书泽,周鹏飞,等.创伤弧菌的优化培养及快速检测[J].食品工业科技,2014,35(6):197-201.
Screening of siderophore-producingVibriovulnificusand optimization of induction conditions using response surface methodology
YANG Chang-e1,LU Yan-li2,NI Han-cheng1,ZHOU Yong1,NING Xi-bin1,*
(1.Shanghai Engineering Research Center of Acquatic-Processing and Preservation,College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2.Dalian Jinzhou District Fisheries Service station,Liaoning Province,Dalian 116100,China)
Vibriovulnificusis an important pathogen. When eating infected fish,human will suffer from serious disease. To date,many potential virulence factors ofVibriovulnificushave been identified. Among the reported factors,Siderophore is a well-known crucial virulence factor. In this study,the siderophore-producing strains were screened by using MKB(Modified King B)medium which isolated from the seawater. MKB-CAS(Chrome azuorl S)overlay plate method and UV-VIS Spectrophotometer were used for the screening of high yield siderophore-producing strain and detection of SU(siderphore units)respectively.V.vulnificusY8 strain was optimized which had the highest siderophore-producing capacity. The optimization of significant factors on SU including the initial pH,medium capacity and nitrogen ratio(C/N)was determined by response surface methodology. These results indicated that the value of SU was expected to 90.7404% under the optimum condition of initial pH7.84,medium capacity of 81.53 mL and C/N of 3.06. Three parallel verification results indicated that the maximum SU value was consistent with the mean SU value and the optimized SU value was increased by 23.73% compared to the previously measured value. The best optimization conditions was obtained by using response surface methodology which would lay the foundation of the further study in the future.
Vibriovulnificus;Siderophore;MKB medium;response surface methodology
2016-07-26
杨常娥(1990-),女,硕士研究生, 研究方向:食品微生物,E-mail:18704491561@163.com。
*通讯作者:宁喜斌(1964-),男,博士,教授,研究方向:食品微生物、食品安全,E-mail:xbning@shou.edu.cn。
上海市科委工程中心建设(11DZ2280300)。
TS201.3
A
:1002-0306(2017)03-0159-07
10.13386/j.issn1002-0306.2017.03.022

