饲料中精氨酸水平对杂交鲟幼鱼肠道消化酶活性及形态结构的影响
王连生,吴俊光、2,徐奇友,王常安,李晋南,赵志刚,罗亮,都雪
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
饲料中精氨酸水平对杂交鲟幼鱼肠道消化酶活性及形态结构的影响
王连生1,吴俊光1、2,徐奇友1,王常安1,李晋南1,赵志刚1,罗亮1,都雪1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
为研究饲料中不同水平精氨酸 (arginine,Arg)对杂交鲟Acipenser schrenckii♀×Acipenser baeri♂幼鱼肠道消化酶活性及形态结构的影响,以0.3%为梯度,配制精氨酸水平为1.74%~3.54%(干物质)的7种等氮、等能饲料,实际精氨酸水平分别为1.76%、2.05%、2.36%、2.64%、2.93%、3.24%和3.53%。选取初始体质量为 (3.63±0.08)g的健康杂交鲟幼鱼630尾,随机分成7组,每组设3个平行,每缸30尾鱼,养殖周期为8周。结果表明:与1.76%精氨酸对照组相比,2.64%和2.93%精氨酸组杂交鲟前肠蛋白酶活力显著提高 (P<0.05),2.36%、2.64%、2.93%和3.24%精氨酸组前肠淀粉酶活力显著提高 (P<0.05),2.36%、2.64%和2.93%精氨酸组中肠蛋白酶活力显著提高 (P<0.05),各肠段中脂肪酶活力随饲料中精氨酸水平的增加均表现出升高趋势,但无显著性差异 (P>0.05);与1.76%精氨酸组相比, 2.36%、2.64%和2.93%精氨酸组前肠皱襞高度和肌层厚度显著增加 (P<0.05),2.93%精氨酸组前肠绒毛高度显著增加 (P<0.05),2.64%、2.93%和3.24%精氨酸组中肠皱襞高度显著增加 (P<0.05)。研究表明,饲料中添加适宜水平的精氨酸,对提高杂交鲟幼鱼肠道内消化酶活性和促进肠道形态结构发育均具有积极作用,可提高营养物质在杂交鲟幼鱼肠道内的消化和吸收,并促进其生长。
精氨酸;杂交鲟;消化酶;肠道形态
对多种鱼类的研究已经证明,精氨酸是鱼类10种必需氨基酸之一[1]。饲料中缺少任何一种必需氨基酸均会影响蛋白的合成,抑制鱼类生长[2]。精氨酸作为鱼类中功能性的必需氨基酸,在鱼类的生长发育过程中起着非常重要的作用。精氨酸是肌酸、多胺、一氧化氮 (NO)等活性物质合成的前体物,同时,它还参与尿素循环中的氮代谢,并能刺激生长激素和胰岛素分泌[1,3]。在对硬骨鱼类的研究中发现,其体内存在完整的尿素循环体系[4],这表明硬骨鱼类自身存在合成精氨酸的潜力[5]。
肠道中的消化酶分为蛋白酶、脂肪酶和淀粉酶3种。肠道作为鱼类消化和吸收营养物质的主要场所,其消化酶活性的高低和形态结构发育直接影响鱼类的生长速度。近年来研究表明,精氨酸及代谢产物能提高肠道中消化酶的活性、促进肠道形态结构的发育,从而提高鱼类的生长速度[6-8]。Zhou等[7]在对黑鲷Acauthopagrus schlegelii幼鱼的研究中发现,精氨酸可以促进鱼体前肠胰蛋白酶和淀粉酶的活力,以及中肠胰蛋白酶活力。Cheng等[8]在对石首鱼Sciaenops ocellatus的研究中发现,饲料中添加1%精氨酸可以提高鱼体前肠皱襞高度、上皮细胞高度和微绒毛高度,以及中肠皱襞高度和微绒毛高度。目前,关于精氨酸能提高肠道消化酶活性和促进肠道形态结构发育的研究,在哺乳动物和一些鱼类中已经得到证明,但对鲟鱼的研究尚未见报道。鲟鱼是世界上最古老的硬骨鱼类之一,全身是宝,味道鲜美,是一种非常珍贵的水产品,用其卵做成的鱼籽酱更是世界名肴,鲟鱼具有较高的营养价值。当前,鲟鱼养殖总产量也在逐年上升。本研究中,以西伯利亚鲟和施氏鲟的杂交鲟Acipenser schrenckii♀×Acipenser baeri♂幼鱼为研究对象,研究了饲料中不同水平精氨酸对鱼体肠道消化酶活性及肠道形态结构的影响,以期为鲟鱼人工饲料的科学配制提供理论依据。
1 材料与方法
1.1 材料
试验鱼购自北京房山鲟鱼繁育中心,养殖于基地车间内可控温水循环系统中。
精氨酸购自上海鼓臣生物技术有限公司,纯度≥98%。组氨酸、异亮氨酸、赖氨酸、蛋氨酸、苏氨酸、缬氨酸、胱氨酸、天冬氨酸、甘氨酸、丙氨酸和丝氨酸均购自北京惠康源生物科技有限公司,纯度≥98%。所有氨基酸均为L-型氨基酸。
1.2 方法
1.2.1 试验设计 饲料配方中蛋白源为进口鱼粉、次粉、豆粕和玉米蛋白粉,主要脂肪源为鱼油、大豆磷脂和豆油,用非必需氨基酸混合物来替代精氨酸,配制成7种粗蛋白质水平为40%、粗脂肪水平为10%的等氮、等能饲料。L-精氨酸的添加量分别为0(对照)、0.3%、0.6%、0.9%、1.2%、1.5%和1.8%,测得7种饲料中精氨酸水平分别为 1.76% (对照)、2.05%、2.36%、2.64%、2.93%、3.24%和3.53%。试验饲料配方组成见表1,营养成分见表2。先将饲料原料粉碎过80目筛,称重,按照配方先将大料混合均匀,再加入小料混合,然后加入油脂混合均匀,最后加入适宜比例的水,混合均匀后用小型制粒机挤压成颗粒饲料,风干后装袋,于冰箱 (-20℃)中保存备用。
1.2.2 饲养管理 试验缸水容量为160 L,用增氧机增氧,保证溶解氧大于5 mg/L,保持自然光照,试验期间水温控制在 (22±1)℃。试验前,先用3%盐水对鱼体消毒3~5 min,然后放入暂养池中驯化2周,从中挑选体表无伤、活力旺盛、平均体质量为 (3.63±0.08)g的杂交鲟幼鱼630尾,随机分成7组,每组设3个平行,每缸放30尾鱼。每天人工饱食投喂4次,并记录投喂量,每次投喂结束半小时后,吸取水体中的残饵和粪便,以保持水质清澈,养殖试验周期为2周。

表1 饲料配方 (干物质基础)[9]Tab.1 Formulation of trial diets(dry matter basis)[9]w/%
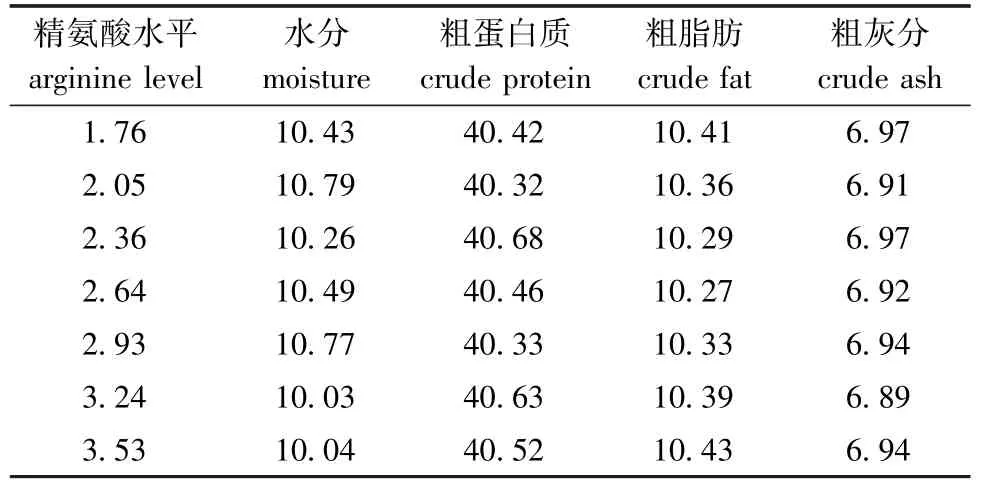
表2 饲料营养成分 (风干基础)Tab.2 Proximate composition of the trial diets(air dry basis) w/%
1.2.3 样品的采集与处理 试验结束后停止喂食24 h,从每缸随机取3尾鱼于冰盘上解剖,分离肠道 (前肠是胃和幽门盲囊与十二指肠连接处,呈“乙”状弯曲,先从右往左拐,后又形成一个弯曲为中肠部分,中肠与前肠相比比较细且较短,肠管的最后一个弯曲处为中肠和后肠的分界点,十二指肠后面较粗的瓣肠部分即为后肠[9-11]),将样品暂存于冰箱 (-20℃)中用于肠道消化酶活力的测定。另从每组取3尾鱼分离肠段,并从各肠段中部取1 cm左右放入Bouin固定液中,制作肠道切片。
1.2.4 指标的测定
(1)肠道消化酶活性的测定。先将各肠道组织称重,再加入9倍生理盐水后用匀浆机磨成匀浆,之后用离心机分离上清液,即得待测样品。
采用福林-酚 (Folin-phenol)法[12]测定蛋白酶活性。采用南京建成生物工程有限公司试剂盒测定淀粉酶和脂肪酶活性。在测定消化酶活性时,每个平行做一次重复以减少误差。
(2)肠道切片的制作及形态结构观察。将Bouin氏液中固定的肠道样本依次通过石蜡包埋、切片机切片、H.E染色等步骤制成组织切片,再用Motic显微图像系统 (Motic Images Plus 2.0软件)观察肠道形态结构变化[13](单位μm)。
1.3 数据处理
试验数据采用 SPSS 22.0软件进行单因素(ANOVA)方差分析,用Duncan's方法对组间差异进行多重比较,试验结果以平均值±标准差(mean±S.D.)来表示。显著性水平设为0.05。
2 结果与分析
2.1 不同精氨酸水平下杂交鲟幼鱼肠道消化酶活力的变化
从表3可见:不同水平的精氨酸中,与1.76%精氨酸对照组相比,2.64%精氨酸组显著提高了前肠蛋白酶活力 (P<0.05),2.64%、2.93% 和3.24%精氨酸组显著提高了前肠淀粉酶活力(P<0.05);2.36%、2.64%和2.93%精氨酸组显著提高了中肠蛋白酶活力 (P<0.05);饲料中精氨酸水平对中肠淀粉酶活力、后肠蛋白酶活力和淀粉酶活力均无显著性影响 (P>0.05);各段肠道中脂肪酶活力随饲料中精氨酸水平的增加均表现出升高的趋势,但无显著性差异 (P>0.05)。

表3 饲料中精氨酸水平对杂交鲟幼鱼肠道消化酶活力的影响 (n=9)Tab.3 Effects of dietary arginine levels on intestinal digestive enzyme activities of juvenile hybrid sturgeon U/g
2.2 不同精氨酸水平下杂交鲟幼鱼肠道形态结构的变化
从表4可见:与1.76%精氨酸对照组相比, 2.36%、2.64%和2.93%精氨酸组显著增加了杂交鲟幼鱼前肠皱襞高度和肌层厚度 (P<0.05), 2.64%精氨酸组显著增加了前肠绒毛高度 (P<0.05);2.64%、2.93%和3.24%精氨酸组显著提高了中肠皱襞高度 (P<0.05);饲料中不同水平的精氨酸对杂交鲟幼鱼中肠绒毛高度、肌层厚度和后肠的形态结构均未有显著影响 (P>0.05)。
3 讨论
3.1 精氨酸对杂交鲟幼鱼肠道消化酶活力的影响
鱼类消化食物和吸收营养物质的主要场所是肠道,机体正常的生长代谢和饲料中营养物质的消化与肠道中消化酶活性的高低关系密切[14]。相关研究也指出,动物机体生长与消化酶活性存在一定的正相关关系[15]。本研究表明,饲料中适宜的精氨酸水平显著提高了杂交鲟幼鱼前肠和中肠蛋白酶活力,以及前肠淀粉酶活力。Zhou等[7]对黑鲷幼鱼的研究发现,外源精氨酸能提高胃、前肠和中肠胃蛋白酶和胰蛋白酶的活力,同时可以提高胃和前肠中淀粉酶的活力,进而提高饲料的消化和吸收率。Lin等[16]在对建鲤幼鱼的研究中发现,谷氨酰胺可以促进鱼体肠道中蛋白酶和脂肪酶的活性。本试验结果与其相近,这说明饲料中适宜水平的精氨酸可以提高肠道内消化酶的活性,促进肠道对营养物质的消化吸收,进而促进鱼体的生长。
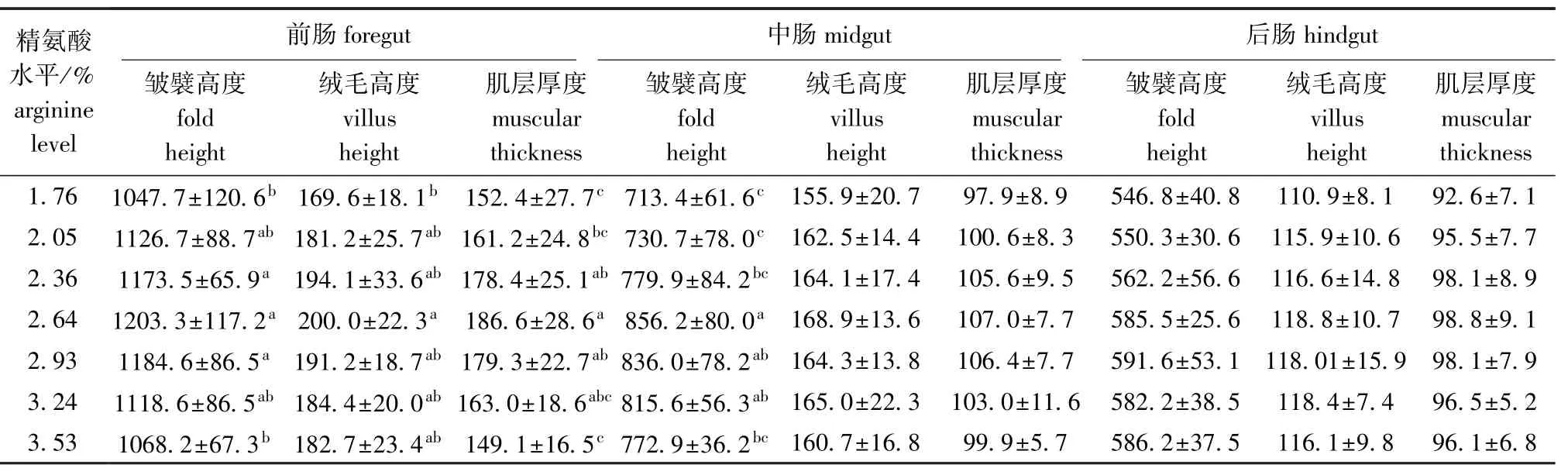
表4 饲料中精氨酸水平对杂交鲟幼鱼肠道形态结构的影响 (40×10倍光镜)(n=9)Tab.4 Effects of dietary arginine levels on intestine morphology of juvenile hybrid sturgeon(40×10) μm
3.2 精氨酸对杂交鲟幼鱼肠道形态结构的影响
鱼体的生长状况不仅仅取决于肠道内消化酶的活性,其肠道本身形态结构的发育也是至关重要的。肠道绒毛高度和皱襞高度越高,表明吸收养分的表面积越大,越有利于鱼体的生长。因此,肠道的绒毛高度和皱襞高度是反映机体肠道发育状况和吸收功能的重要指标[17]。
饲料中添加外源性精氨酸促进鱼类的生长,一方面是由于精氨酸能提高胃和肠道中消化酶的活性,进而提高饲料的消化和吸收率,另一方面是由于精氨酸能够改善鱼肠道的形态结构。Cheng 等[18]对杂交条纹鲈的研究表明,添加1%外源精氨酸能提高肠道末端绒毛高度和肠上皮细胞高度,添加2%精氨酸能提高肠道中段和末端褶皱高度。叶沙舟等[19]对黄颡鱼幼鱼的研究表明,饲料中添加0.2%和0.4%的谷氨酰胺,鱼体肠道绒毛高度和皱襞高度增加,但肌层厚度降低。在对美国红鱼的研究中发现,1%精氨酸可提高鱼体前肠皱襞高度、上皮细胞和微绒毛高度,以及中肠皱襞和微绒毛高度[8]。本研究表明,饲料中添加适宜水平的精氨酸能显著提高杂交鲟幼鱼中肠的皱襞高度和前肠的绒毛高度、皱襞高度和肌层厚度。已有研究表明,谷氨酰胺可以促进鱼体的肠道发育,增加肠道的绒毛高度[13],而谷氨酰胺是精氨酸在体内分解代谢的产物,由此可知,精氨酸促进鱼体肠道形态结构的发育与谷氨酰胺有关[20]。谷氨酰胺是肠道细胞发育的能量代谢底物,具有维持肠道免疫、防止肠绒毛萎缩、改善肠道健康和促进生长的作用[21-22]。肠黏膜需要谷氨酰胺来支持其代谢活动,从而维持小肠结构的完整性和功能的正常发挥[23-25]。在适宜范围内,随着饲料中精氨酸的增加,其代谢产生的谷氨酰胺含量也相应增加,从而增加肠黏膜的功能性表面积,提高营养物质的吸收率,促进鱼类生长。
综上所述,饲料中精氨酸水平为 2.36%、2.64%和2.93%时,对提高杂交鲟幼鱼肠道消化酶活性和形态结构发育均有促进作用,且添加水平为2.64%时效果最佳。
[1] NRC.Nutrient Requirements of Fish and Shrimps[M].Washington,DC,USA:National Academy Press,2011:67-68.
[2] Masagounder K,Hayward R S,Firman J D.Comparison of dietary essential amino acid requirements determined from group-housed versus individually-housed juvenile bluegill,Lepomis macrochirus [J].Aquaculture Nutrition,2011,17(2):e559-e571.
[3] 万军利,麦康森,艾庆辉.鱼类精氨酸营养生理研究进展[J].中国水产科学,2006,13(4):679-685.
[4] Huggins A K,Skutsch G,Baldwin E.Ornithine-urea cycle enzymes in teleostean fish[J].Comparative Biochemistry and Physiology,1969,28(2):587-602.
[5] Chiu Y N,Austic R E,Rumsey G L.Effect of feeding level and dietary electrolytes on the arginine requirement of rainbow trout (Salmo gairdneri)[J].Aquaculture,1988,69(1-2):79-91.
[6] 谭碧娥,李新国,孔祥峰,等.精氨酸对早期断奶仔猪肠道生长、组织形态及IL-2基因表达水平的影响[J].中国农业科学,2008,41(9):2783-2788.
[7] Zhou F,Zhou J,Shao Q J,et al.Effects of arginine-deficient and replete diets on growth performance,digestive enzyme activities and genes expression of black sea bream,Acanthopagrus schlegelii,juveniles[J].Journal of the World Aquaculture Society,2012,43 (6):828-839.
[8] Cheng Z Y,Buentello A,Gatlin III D M G.Effects of dietary arginine and glutamine on growth performance,immune responses and intestinal structure of red drum,Sciaenops ocellatus[J].Aquaculture,2011,319(1-2):247-252.
[9] 张小谷,洪一江,汪洪.四种淡水鱼类前肠的组织学比较研究[J].南昌大学学报:理科版,1999,23(4):339-342.
[10] 曲秋芝,华育平,曾朝辉,等.史氏鲟消化系统形态学与组织学观察[J].水产学报,2003,27(1):1-6.
[11] 徐雪峰.中华鲟消化系统的发育及消化酶活性变化的研究[D].武汉:华中农业大学,2006.
[12] 中山大学生物系生化微生物学教研室.生化技术导论[M].北京:人民教育出版社,1979:53-54.
[13] 李晋南,徐奇友,王常安,等.谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J].动物营养学报, 2014,26(5):1347-1352.
[14] Pinkus L M,Berkowitz J M.Utilization of glutamine by canine pancreas in vivo and acinar cells in vitro[J].Fed Proc,1980,39: 1902-1903.
[15] 叶元土,张勇,张宇,等.酶制剂EA-II和生物制剂BA-I对鲤肠道、肝胰脏的蛋白酶和淀粉酶活力的影响[J].大连水产学院学报,1993,8(1):79-82.
[16] Lin Y,Xiao Q Z.Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture,2006,256(1-4):389-394.
[17] 王蕾,刘坚,侯永清,等.α-酮戊二酸对LPS慢性应激仔猪小肠黏膜形态与功能的影响[J].畜牧兽医学报,2010,41(1): 46-52.
[18] Cheng Z Y,Gatlin III D M,Buentello A.Dietary supplementation of arginine and/or glutamine influences growth performance,immune responses and intestinal morphology of hybrid striped bass (Morone chrysops×Morone saxatilis)[J].Aquaculture,2012, 362-363:39-43.
[19] 叶沙舟,张杰,陈海敏,等.谷氨酰胺对黄颡鱼幼鱼生长性能、肠道形态及非特异性免疫相关基因表达的影响[J].动物营养学报,2016,28(2):468-476.
[20] 陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015, 30(4):363-368.
[21] 张军民,高振川,王连娣,等.谷氨酰胺对饲喂生大豆的仔猪抗氧化能力和肝、肠组织中γ-谷氨酰转肽酶活性的影响[J].中国农业科学,2003,36(5):567-572.
[22] 郭荣富.谷氨酰胺对隔离早期断奶仔猪的营养生理效应研究[D].雅安:四川农业大学,2003.
[23] 于永祥,杨乃众,王杉,等.胃肠道手术后肠内、肠外营养的疗效对比[J].普外临床,1995,10(2):87-89.
[24] 周玉香,张培松,卢德勋,等.谷氨酰胺对犊牛骨骼肌和小肠黏膜蛋白质及其DNA和RNA含量的影响[J].畜牧与兽医, 2010,42(1):17-20.
[25] Inoue Y,Grant J P,Snyder P J.Effect of glutamine-supplemented total parenteral nutrition on recovery of the small intestine after starvation atrophy[J].Journal of Parenteral and Enteral Nutrition,1993,17(2):165-170.
Effects of dietary arginine levels on intestinal digestive enzyme activity and morphology in juvenile hybrid sturgeon
WANG Lian-sheng1,WU Jun-guang1,2,XU Qi-you1,WANG Chang-an1,LI Jin-nan1, ZHAO Zhi-gang1,LUO Liang1,DU Xue1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
A total of 630 juvenile hybrid sturgeon Acipenser schrrenckii♀×A.baeri♂with an average initial body weight of(3.63±0.08)g were randomly divided into 7 groups with 3 replicates per group and 30 fish per replicate and fed seven isonitrogenous and isolipidic diets containing arginine levels ranging from 1.74%to 3.54%(dry matter)in approximately 0.3%increments,and actual dietary arginine levels of 1.76%,2.05%,2.36%, 2.64%,2.93%,3.24%and 3.53%for 8 weeks to study the effects of dietary arginine levels on intestinal digestive enzyme activities and morphology of juvenile hybrid sturgeon.The results showed that there was significantly higher activity of foregut protease in 2.64%and 2.93%groups than that in 1.76%group(P<0.05),and that significantly higher activity of foregut amylase in 2.36%,2.64%,2.93%and 3.24%groups than that in 1.76% group(P<0.05).The activity of midgut protease in 2.36%,2.64%and 2.93%groups was shown to be increased with increase in dietary arginine levels,without significant difference(P>0.05).The hybrid sturgeon in 2.36%,2.64%and 2.93%groups had significantly higher fold height and muscular thickness of foregut than the hybrid sturgeon in 1.76%group(P<0.05),with significantly higher villus width in foregut of the juveniles in 2.93%group(P<0.05).The hybrid sturgeon in 2.64%,2.93%and 3.24%groups had significantly higher fold height in midgut than the juveniles in 1.76%group did(P<0.05).In conclusion,appropriate dietary arginine level leads to improve the digestion and absorption of intestinal nutrients due to increase in intestinal digestive enemy activity and to improvement of intestinal morphology.
arginine;hybrid sturgeon;digestive enzyme;intestinal morphology
S963.7
:A
10.16535/j.cnki.dlhyxb.2017.01.009
2095-1388(2017)01-0051-05
2016-04-27
中国水产科学研究院黑龙江水产研究所基本科研业务费专项 (HSY201408);国家公益性行业 (农业)科研专项 (201003055)
王连生 (1984—),男,博士,助理研究员。E-mail:liansheng0429@163.com

