凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征
高欣,景泓杰,赵文,孟凡明,郭长江,刘青
(1.大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023;2.凌海市金海水产有限公司,辽宁锦州121000)
凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征
高欣1,景泓杰1,赵文1,孟凡明2,郭长江1,刘青1
(1.大连海洋大学水产与生命学院,辽宁省水生生物学重点实验室,辽宁大连116023;2.凌海市金海水产有限公司,辽宁锦州121000)
为研究在中国北方凡纳滨对虾Penaeus vannamei海水高位养殖池塘中浮游生物的群落结构和水质特征,采用高位池养殖的常规方法进行了相关试验。结果表明:高位池的平均水温为23.45℃、pH为8.16、盐度为23.1,叶绿素含量在养殖过程中呈现先上升后稳定的趋势;浮游植物种类组成以硅藻、裸藻和绿藻为主,所占比例分别为39.58%、20.83%和18.75%,甲藻、蓝藻和隐藻只占少数;浮游植物密度平均为111×106cells/L,生物量平均为22.39 mg/L,密度和生物量均以绿藻和硅藻占优势,浮游植物多样性指数(H)平均为0.46,均匀度指数 (J)平均为0.13;浮游动物以桡足类为主,浮游动物密度平均为27.04 ind./L,生物量平均为0.629 mg/L,浮游动物多样性指数 (H)平均为0.68,均匀度指数 (J)平均为0.52;典范对应分析 (CCA)显示,影响浮游植物优势种的主要驱动因子为盐度、PO3-4-P、总氮、总磷、NO-2-N、NO-3-N,影响浮游动物优势种的主要驱动因子为盐度、PO3-4-P、pH、总氮、NO-2-N和NH+4-N。研究表明,凡纳滨对虾高位养殖池中后期水质已处于富营养化状态,浮游生物群落不稳定。
凡纳滨对虾;海水高位池;浮游植物;浮游动物;群落结构
凡纳滨对虾Penaeus vannamei又称南美白对虾,原产于南美,1988年引进中国,因其具有含肉率高、抗逆性强、生长快、适盐性广等特点,迅速成为中国最重要的对虾养殖品种之一,占中国对虾养殖总产量的80%左右。高位池养殖[1]是中国南方沿海地区凡纳滨对虾养殖的主要模式,因其高产值、高经济效益而备受养殖户推崇,并对沿海地区的经济发展起到一定的推动作用[2],但这种养殖模式在北方还未大规模推广。
水质管理是对虾养殖的重要环节,是水体中生物赖以生存的基本保障,水质的优劣受水中生物、水量、饵料和生物代谢废物等综合因素的影响。因此,保持水环境稳定、有效管理水质是凡纳滨对虾健康生长的关键。浮游生物的变化特征与环境因子密切相关,其群落结构特征在一定程度上反映出水体生态环境状况。目前,国内外有关凡纳滨对虾养殖池塘中浮游生物群落结构的研究已有很多,何京等[3]研究了凡纳滨对虾养殖池塘中浮游生物的群落结构,魏小岚等[4]研究了凡纳滨对虾高位池循环水养殖水体浮游动物的生态特征,张汉华等[5]研究了有益微生物对海水养虾池浮游生物生态特征的影响,但对中国北方地区凡纳滨对虾海水高位池中浮游生物群落结构特征的研究尚未见报道。辽宁是中国水产养殖业重要的省份之一,有着得天独厚的自然条件,锦州地处辽宁省西南部,北依松岭山脉,南邻渤海辽东湾,其海水和淡水资源均非常丰富。为探究在北方地区海水高位池大规模养殖凡纳滨对虾的可行性,本试验中对锦州某凡纳滨对虾高位养殖池中的浮游生物群落结构及水质特征进行了研究,旨在为凡纳滨对虾在北方地区的养殖模式提供指导和参考。
1 材料与方法
1.1 材料
试验用凡纳滨对虾虾苗由辽宁省锦州凌海市繁育中心提供,体长3 cm左右,共36万尾。养殖饵料主要为虾片、卤虫和配合饵料。试验所用饵料、药物、增氧装置均由凌海市金海水产有限公司提供。
1.2 方法
1.2.1 对虾养殖与管理
(1)池塘结构。试验用高位池塘共2个,南高位池为0.089 hm2,北高位池为0.097 hm2,呈长方形,池底呈锅形,深2.5 m。池塘进排水全部为直径16 cm的聚乙烯管,池塘内部铺有塑料膜。另建造配水消毒池塘1个,储水池中的水经初步过滤后送至配水消毒池,经过盐度调节、水质消毒、生物水处理后进入养殖池塘。
(2)准备工作。放苗前先清洗池塘、试水并检查设备,再用30 mg/L漂白粉消毒,余氯曝尽后施肥、接藻种和菌种,2~3 d达到放苗标准。
(3)苗种放养。2个高位池均放养规格为1.0 cm的凡纳滨对虾幼苗18万尾 (3.75 kg)。
(4)水质调控。pH控制在7.6~8.5,如果pH明显下降时,可通过泼洒生石灰或接种一定密度的藻类以稳定pH。当水色变黑变红,CODMn有机耗氧量值超过15 mg/L时,多为水质老化和藻类过多,应减少投饵量,添加新水并施用黑腐植酸钠和枯草芽孢杆菌调节水质。施药时停止充氧2~4 h, 2 d内不换水,3~5 d后可恢复正常水色。养殖后期,水体氨氮和亚硝酸氮指标过高时,使用沸石粉和过硫酸氢钾改底剂改善水质,待指标下降后再施用微生态制剂来稳定环境。
(5)饵料投喂。放苗6 h后投喂少量虾片, 2~14 d时,虾苗体长未达到3 cm时投喂虾片、卤虫,日投喂量为虾苗体质量的7%~10%。养殖过程中可根据实际情况灵活掌握,整个周期定期添加VC、VE、多糖、大蒜素以增强抗病能力和体质。
(6)增氧机的使用及池塘排污。放苗1~30 d时每天开机增氧2~3次,中午和黎明前各开机3~4 h;30~40 d后延长开机时间,40 d后随饵料投喂量的增加水体污染加重,一般全体开机。雨天、阴天、暴热无风天气均增加开机时间及次数,使溶解氧达到4~5 mg/L以上。
养殖期间尤其是中后期,用水车式增氧机使水形成环流,把污垢聚集到池塘中心,然后打开排污口排污,排污次数随养殖时间的延长而增加,后期1 d排污5~10次,排污所需时间以不出污水为准。
1.2.2 水质及浮游生物的监测 每个池塘选取两个采样点,分别在东南角和西北角,放苗前一天进行第一次水样采集,之后每隔半个月采集1次水样,直到凡纳滨对虾养成出塘,共采集7次。浮游植物测定需采集水样1 L,用1.5%的鲁哥氏液[6]固定。浮游动物测定需采集水样50 L,并用浮游动物网进行过滤,将采得的水样用5%甲醛[6]固定,并对采集到的浮游生物进行定性、定量监测。pH、温度 (temperature,T)、盐度 (salinity,S)均在采集水样现场测定及记录;分别采用酸碱滴定法、EDTA络合滴定法、碱性高锰酸钾法、硝酸银滴定法、次溴酸盐氧化法、萘乙二胺分光光度法、锌镉还原法、磷钼蓝分光光度法法、过硫酸盐联合硝化法,对碱度 (ALK)、硬度 (TH)、CODMn、氯离子 (Cl-)、氨氮 (NH+4-N)、亚硝酸氮 (NO-2-N)、硝酸氮 (NO-3-N)、活性磷 (PO3-4P)、总氮(TN)、总磷 (TP)进行测定[7]。
1.2.3 数据统计分析与计算 运用Excel和Canoco软件对数据进行处理和统计分析。运用Canoco软件对浮游动植物进行趋势对应分析 (Detrended correspondence analysis,DCA),通过单峰响应梯度值 (SD)进行分析,若SD>2,则采用典范对应分析 (Canonical correspondence analysis,CCA),若SD<2,则采用冗余分析 (Redundance analysis, RDA),对数据进行999次蒙特卡洛置换检验,同时对所有数据进行lg(x+1)处理,从而判断出影响浮游动植物群落结构的主要驱动因子。
香农-威纳多样性指数 (H)和均匀度指数(J)计算公式为

其中:Pn为第n种的个体数与该群落中总个体数之比;S为总种数。
2 结果与分析
2.1 高位池水体的理化因子及叶绿素a含量
试验期间高位池塘的水质指标均处于动态变化中。从表1可见,pH、水温、盐度、碱度、硬度基本在正常范围内波动。但 NO-2-N、NH+4-N、NO-3-N、PO3-4-P、TN、TP呈逐渐增大趋势,后期值较高,CODMn含量试验后期亦较高。这表明试验后期,高位池塘已处于极富营养化水平。
高位池水体中的叶绿素a含量平均值为193.79 μg/L,变化范围为0.026~659.29 μg/L(表1)。
2.2 浮游植物群落结构
从表2可见,浮游植物共出现48种 (观察中仅鉴定到属的按一个种算),隶属于6个门。其中硅藻门种类最多,19种,占总种数的39.58%;裸藻门次之,10种,占20.83%;绿藻门9种,占18.75%;甲藻门7种,占14.58%;蓝藻门2种, 占4.17%;隐藻门1种,占2.08%。
高位池浮游植物密度的变化情况如图1所示,其平均值为111×106cells/L,变化范围为 (2~382)×106cells/L,其中绿藻占优势,硅藻次之。
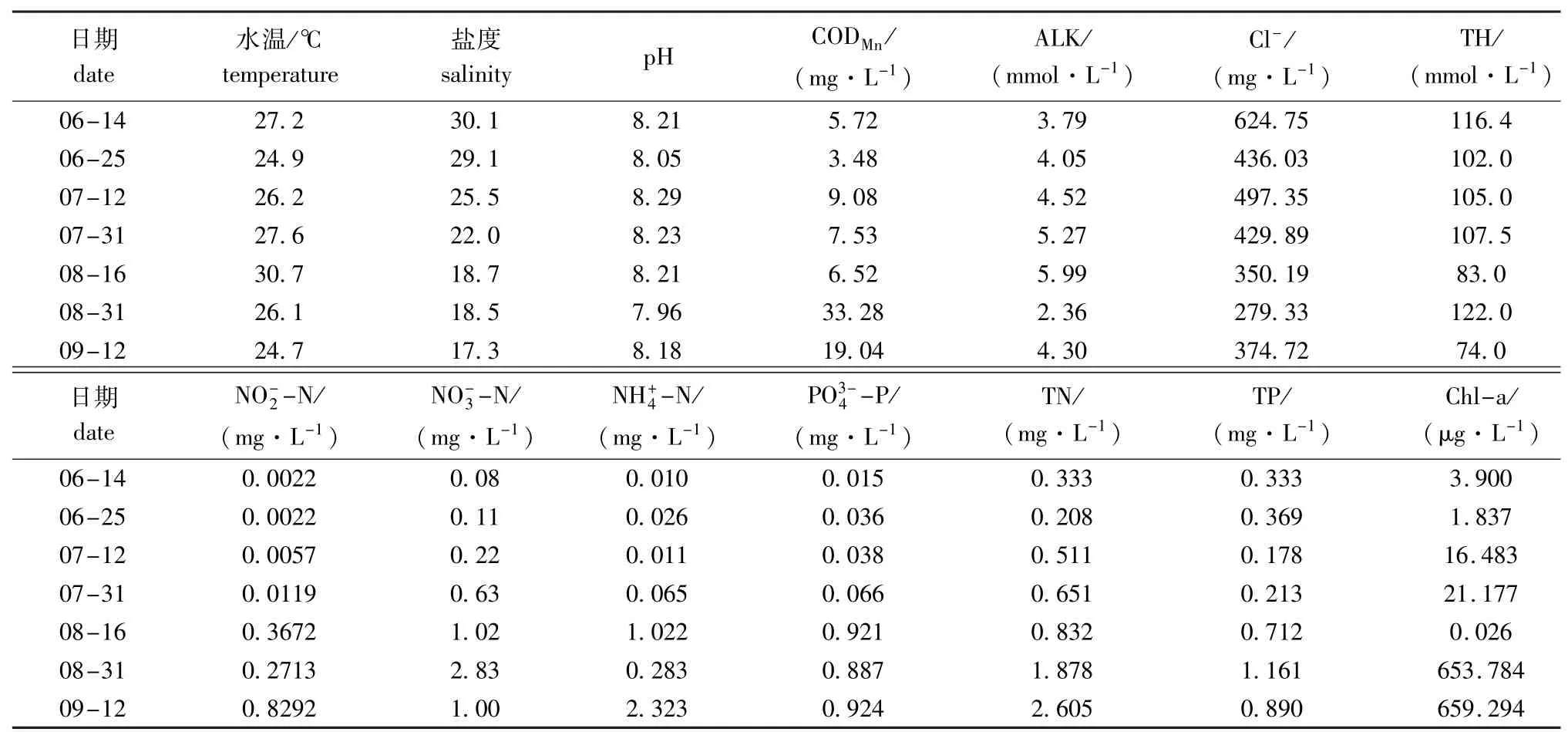
表1 高位池塘水质指标变化情况Tab.1 Variations in water quality indices in high-place shrimp ponds
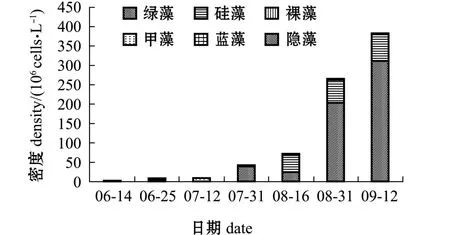
图1 高位池浮游植物密度变化Fig.1 Variations in phytoplankton density in highplace shrimp ponds
高位池浮游植物生物量的变化情况如图2所示,其平均值为22.39 mg/L,变化范围为1.01~57.62 mg/L,其中硅藻占优势,绿藻次之。
高位池浮游植物多样性指数 (H)的平均值为0.46,变化范围为0.33~0.84,均匀度指数 (J)的平均值为0.13,变化范围为0.08~0.23(图3)。浮游植物多样性指数越低,则虾池水环境中浮游植物生物群落构成越简单,优势种越单一,且演替速度就越快,也说明养殖虾池中浮游植物群落的不稳定性,此现象是由该养殖模式的特点所决定。
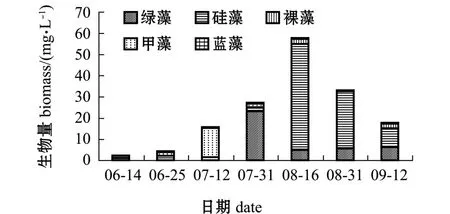
图2 高位池浮游植物生物量变化Fig.2 Variations in phytoplankton biomass in highplace shrimp ponds
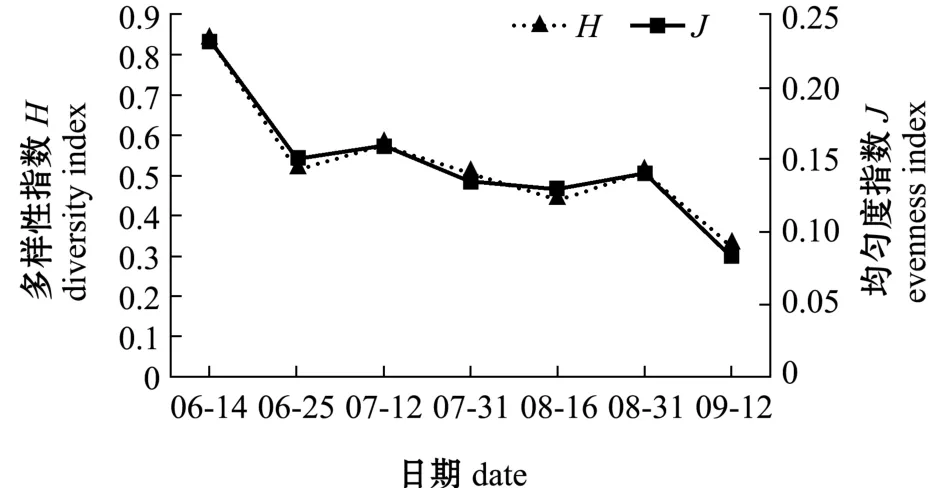
图3 高位池浮游植物多样性指数及均匀度指数变化Fig.3 Variations in diversity index and evenness index of phytoplankton in high-place shrimp ponds
根据DCA结果显示,单峰响应梯度值为3~4 (SD=3.398),故选用CCA分析浮游植物密度与水环境因子间的关系。浮游植物优势种与水环境因子的CCA结果如图4所示,其中B1、B2、B3分别代表绿藻门的硬弓形藻Schrosderia robusta、小球藻Chlorella vulgaris、小形平藻Pedinomonas minor,C1、C2、C3、C4、C5、C6、C7、C8分别代表硅藻门的条纹小环藻Cyclotella striata、最小舟形藻Navicula minima、科曼小环藻Cyclotella comensis、短纹异极藻Gomphonema abbreviatum、嗜盐舟形藻Navicula halophila、新月拟菱形藻Nitzschia closterium、具星小环藻Cyclotella stelligera、翼状茧形藻Amphiprora alata。

表2 高位池浮游植物种类分布Tab.2 Distribution of phytoplankton in high-place shrimp ponds
CCA分析结果显示,影响浮游植物优势种的主要驱动因子为盐度 (S)、-P、TN、TP、-N和-N。其中,B2与-N呈显著正相关 (P<0.05),与 pH呈显著负相关 (P<0.05),与4-P、TN、TP、-N呈正相关,但相关均不显著 (P>0.05);B3与-P呈显著负相关 (P<0.05),与盐度、pH呈正相关,但相关不显著 (P>0.05);C4与盐度呈显著正相关(P<0.05),与-N呈显著负相关 (P<0.05); C6与TN呈显著正相关 (P<0.05),C7与-P呈显著正相关 (P<0.05)。
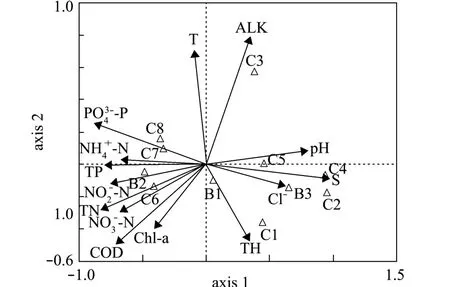
图4 高位池浮游植物优势种与水环境因子的CCA分析Fig.4 Canonical correspondence analysis of the dominant phytoplankton species-environmental relationship
2.3 浮游动物群落结构
高位池浮游动物种类组成及分布如表3所示。试验期间共出现浮游动物8种,其中桡足类7种,轮虫1种,试验期间未发现枝角类。
高位池的浮游动物密度平均为27.04 ind./L,变化范围为2.5~109.75 ind./L(图5)。

表3 高位池浮游动物种类分布Tab.3 Species profiles of zooplankton in high-place ponds
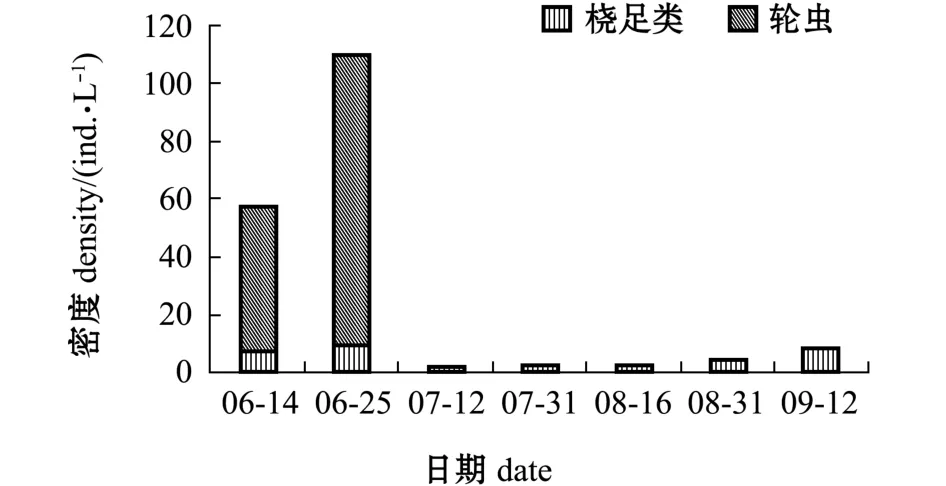
图5 高位池浮游动物密度变化Fig.5 Variations in zooplankton density in high-place shrimp ponds
高位池的浮游动物生物量平均为0.629 mg/L,变化范围为0.042~2.674 mg/L(图6)。高位池的浮游动物多样性指数 (H)平均为0.68,变化范围为0.29~1.20,均匀度指数 (J)平均为0.52,变化范围为0.21~0.69(图7)。
根据DCA结果显示,单峰响应梯度值为3~4 (SD=3.125),故选用CCA分析浮游动物密度与水环境因子间的关系。浮游动物优势种与水环境因子的CCA分析结果如图8所示,其中D1、D2、D3、D4分别代表无节幼体、克氏纺锤水蚤Acartia clausi、刺尾纺锤水蚤Acartia spinicauda、大同长腹剑水蚤Oithona similis。
CCA分析结果显示,影响浮游动物优势种的主要驱动因子为盐度、-P、pH、TN、-N 和-N。其中,D4与-N和-N呈显著正相关 (P<0.05);D2与盐度、pH呈显著正相关(P<0.05),与COD、-P呈显著负相关 (P<0.05)。
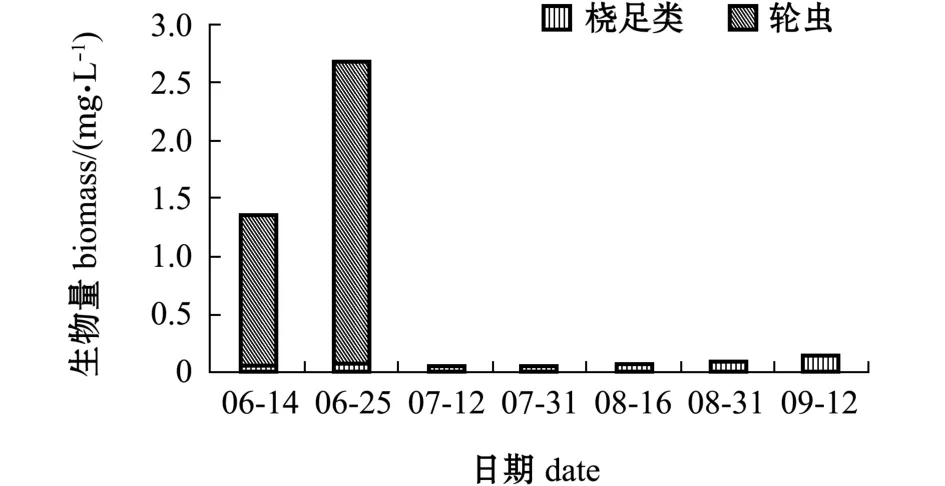
图6 高位池浮游动物生物量变化Fig.6 Variations in zooplankton biomass in high-place shrimp ponds
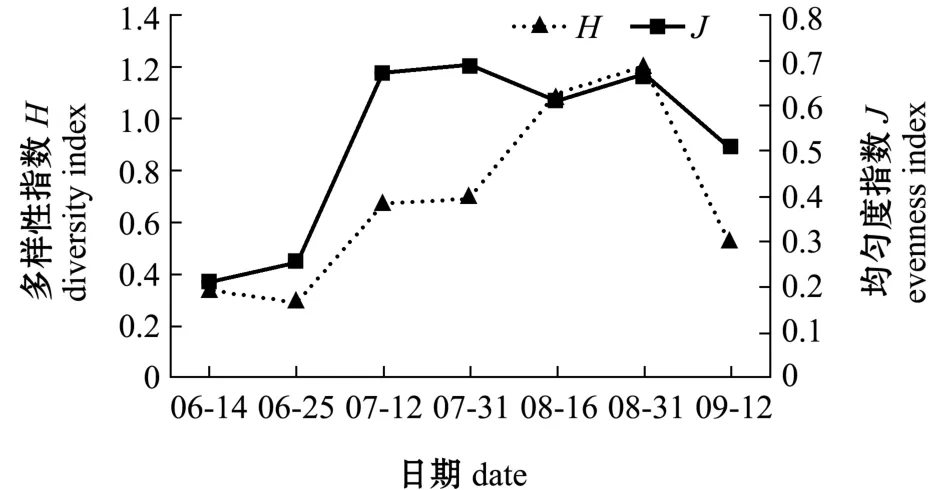
图7 高位池浮游动物多样性指数及均匀度指数变化Fig.7 Variations in zooplankton diversity index and evenness index in high-place shrimp ponds
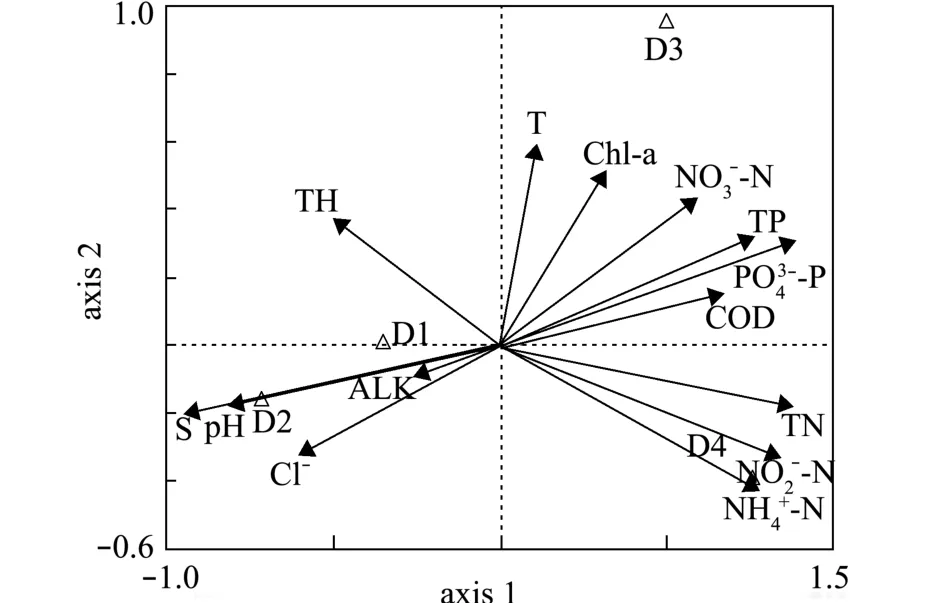
图8 高位池浮游动物优势种与水环境因子的CCA分析Fig.8 Canonical correspondence analysis of the dominant zooplankton species-environmental relationship in high-place ponds
3 讨论
3.1 高位养殖池塘的水质特征
本试验结果表明,凡纳滨对虾海水养殖高位池塘水体的pH、温度、盐度、碱度、硬度基本稳定在正常范围内波动。但NH+4-N、NO-3-N、NO-2-N、PO3-4-P和CODMn含量均随养殖时间的延长而增加,在试验中后期已超出渔业水质标准要求。众所周知,氮、磷是反映水体富营养化水平和污染水平的重要指标,本试验表明,高位池塘已处于极富营养化水平。李卓佳等[8]研究凡纳滨对虾海水高位池养殖水体时也得出相似的结果。通常养殖水体由于磷的不足而使浮游植物生长受到限制,Reynolds[9]认为,N/P>15时,浮游植物生长受营养盐磷的限制。本试验中,北高位池的 N/P值变化范围为0.56~2.93,南高位池为0.41~2.86,两个池塘的N/P值都远远小于15,故磷没有成为本试验高位池中浮游植物生长的单一限制因子。
3.2 高位养殖池塘的浮游生物群落结构
郭丰等[10]、矫小阳[11]研究表明,海水虾池中硅藻占优势,与本试验结果中硅藻占优势的现象一致。本试验养殖过程中,浮游植物的密度呈逐渐升高的趋势,这与吴斌等[12]研究得出的对虾地膜养殖池中养殖前期浮游植物密度随时间的变化趋势相同,其原因可能是养殖池中各种营养盐含量增高促进了浮游植物的生长,同时投饵量的增大也加速了浮游植物的生长。CCA分析显示,影响浮游植物优势种的主要驱动因子为盐度、-P、总氮、总磷、NO-2-N、NO-3-N,其中,小球藻同NO-2-N、NO-3-N呈正相关,欧腾等[13]的研究曾表明,小环藻、小球藻与水体中的NO-2-N、NO-3-N、pH呈正相关。闵文武等[14]的研究也表明,氮、磷含量的变化对藻类的生长繁殖有很大的影响;邓文丽等[15]研究得出,总氮含量是影响北京野鸭湖浮游植物群落结构的主要因素;孟睿等[16]研究表明,总磷是影响长江中下游4个典型草型湖泊的主要因子。上述学者的研究结果与本试验结果有相同之处,证明总氮、总磷含量对浮游植物的群落结构有较大影响。
李灼等[17]研究表明,夏季南海北部微型浮游动物群落中桡足类为主要种类,白海峰等[18]研究表明,流沙湾海草床海域中的浮游动物以桡足类为主,上述研究结果均与本试验结果相似。水温是影响浮游动物生长发育、群落组成和数量变化等最重要的环境因子之一,也是影响浮游动物分布的重要因素[19],本试验中的水温也是浮游动物以桡足类为主的主要原因。CCA分析显示,克氏纺锤水蚤与盐度、pH呈显著正相关,与-P呈显著负相关性,这与Badosa等[20]的研究结果一致。李灼等[17]采用CCA分析发现,温度和盐度是影响浮游动物群落的重要因素;白海锋等[18]研究得出,浮游动物群落结构的主要驱动因子是水温;杜明敏等[21]研究得出,水温和盐度是影响浮游动物群落结构最重要的环境因子。结合本试验结果,表明水温为24.7~30.7℃、盐度为17.3~30.1适合大同长腹剑水蚤、克氏纺锤水蚤等桡足类及其幼体生存。另外,因为本试验过程中凡纳滨对虾饵料供应充足,所以凡纳滨对虾对浮游动物的捕食作用可忽略不计。
何京等[3]分析得出,凡纳滨对虾海水养殖池塘浮游植物的多样性指数为0~3.17;魏小岚等[4]分析得出,凡纳滨对虾循环水养殖水体浮游动物的多样性指数为0.76~2.08;张瑜斌等[22]研究得出,海水高位池养殖凡纳滨对虾池塘的浮游植物多样性指数为0.80~3.82。本试验中浮游植物多样性指数为0.33~0.84,浮游动物多样性指数为0.29~1.20。孙儒泳等[23]指出,群落物种多样性受多种因素 (水温、空间、时间、竞争和捕食、水体条件、初级生产力等)影响,因此,本试验中的生物多样性和其他试验的研究结果有差异。
养殖后期的水质较难调控是高位池养殖面临的一个问题,这也是高位池养殖有待改进和提升之处。为避免养殖后期氨氮、亚硝酸氮、硝酸氮、总氮、总磷含量超标,今后在高位池养殖过程中可加大排污和换水量,同时泼洒一些调节水质的微生态制剂。本试验结果可为研究海水养殖凡纳滨对虾高位池水质指标和浮游生物群落结构变化提供参考,也可为北方地区海水高位池养殖凡纳滨对虾提供技术参考。但由于高位池养殖环境情况较复杂,其水质指标和浮游生物群落结构均会受到人为以及生物和非生物因素等影响,在较短时间内发生较大的波动,池塘生态很难维持在稳定的状态,而浮游生物群落结构受理化因子的影响情况还需进一步研究。
[1] 谢立民,林小涛,许忠能,等.不同类型虾池的理化因子及浮游植物群落的调查[J].生态科学,2003,22(1):34-37.
[2] 迟宝兴.南美白对虾高位池高产稳产养殖技术研究[J].齐鲁渔业,2006,23(3):22-24.
[3] 何京,陈晨,王一农,等.凡纳滨对虾设施养殖池塘浮游生物群落结构及多样性研究[J].生物学杂志,2015,32(3):58-62,67.
[4] 魏小岚,李纯厚,颉晓勇,等.对虾高位池循环水养殖水体浮游动物生态特征研究[J].农业环境科学学报,2013,32(1):141-152.
[5] 张汉华,李卓佳,郭志勋,等.有益微生物对海水养虾池浮游生物生态特征的影响研究[J].南方水产,2005,1(2):7-14.
[6] 赵文.水生生物学[M].北京:中国农业出版社,2005:510-511.
[7] 雷衍之.养殖水环境化学实验[M].北京:中国农业出版社, 2006:1-85.
[8] 李卓佳,李奕雯,曹煜成,等.凡纳滨对虾海水高位池养殖水体理化因子变化与营养状况分析[J].农业环境科学学报,2010, 29(10):2025-2032.
[9] Reynolds C S.The Ecology of Freshwater Phytoplankton[M]. Cambridge:Cambridge University Press,1984:180-182.
[10] 郭丰,林均民,黄凌风,等.厦门潘涂对虾养殖垦区浮游植物的生态特征[J].台湾海峡,2002,21(4):469-482.
[11] 矫晓阳.东小磨虾池及其沿岸浮游植物群落物种多样性[J].生物多样性,1996,4(1):7-13.
[12] 吴斌,廖思明.广西北海凡纳滨对虾养殖池塘中微型藻类组成调查[J].广西科学,2009,15(4):452-455.
[13] 欧腾,李秋华,王安平,等.贵州高原三板溪水库浮游植物群落动态与环境因子的关系[J].生态学杂志,2014,33(12): 3432-3439.
[14] 闵文武,王培培,李丽娟,等.渭河流域浮游植物功能群与环境因子的关系[J].环境科学研究,2015,28(9):1397-1406.
[15] 邓文丽,刘均平,王晓星,等.北京野鸭湖浮游植物群落结构与水质关系研究[J].湿地科学,2013,11(1):27-34.
[16] 孟睿,何连生,过龙根,等.长江中下游草型湖泊浮游植物群落及其与环境因子的典范对应分析[J].环境科学,2013,34 (7):2588-2596.
[17] 李灼,孙军,刘海娇,等.夏季南海北部微型浮游动物群落[J].海洋学报,2016,38(4):31-42.
[18] 白海锋,李丽娟,项珍龙,等.泾河水系浮游动物群落结构及其与环境因子的关系[J].大连海洋大学学报,2015,30(3): 291-297.
[19] Dumont H J.Biogeography of rotifers[J].Hydrobiologia,1983, 104(1):19-30.
[20] Badosa A,Boix D,Brucet S,et al.Zooplankton taxonomic and size diversity in Mediterranean coastal lagoons(NE Iberian Peninsula):influence of hydrology,nutrient composition,food resource availability and predation[J].Estuarine,Coastal and Shelf Science,2007,71(1-2):335-346.
[21] 杜明敏,刘镇盛,王春生,等.中国近海浮游动物群落结构及季节变化[J].生态学报,2013,33(17):5407-5418.
[22] 张瑜斌,龚玉艳,陈长平,等.高位虾池养殖过程浮游植物群落的演替[J].生态学杂志,2009,28(12):2532-2540.
[23] 孙儒泳.动物生态学原理[M].3版.北京:北京师范大学出版社,2001.
Community structure of plankton and water quality in marine high-place ponds with Pacific white leg shrimp Litopenaeus vannamei culture
GAO Xin1,JING Hong-jie1,ZHAO Wen1,MENG Fan-ming2,GUO Chang-jiang1,LIU Qing1
(1.College of Fisheries and Life Science,Key Laboratory of Hydrobiology in Liaoning Province,Dalian Ocean University,Dalian 116023,China; 2.Linghai Jinhai Fisheries Limited Company,Jinzhou 121000,China)
The changes in plankton structure and water quality indices were studied in marine high-place ponds with Pacific white leg shrimp Litopenaeus vannamei culture in Linghai coast,Liaoning province.It was found that average water temperature was 23.45℃,pH 8.16,and salinity 23.1,and that chlorophyll-a concentration showed a first elevated and then stable trend.The members in Bacillariophyta(accounting for 39.58%),Euglenophyta(20.83%),and Chlorophyta(18.75%)were the dominant species in phytoplankton and some species in Pyrrophyta,Cyanophyta and Cryptophyta were also observed in the high-place ponds.The phytoplankton in the highplace Pacific white leg shrimp ponds had density of 111×106cells/L,and biomass of 22.39 mg/L,with dominant members in Chlorophyta and Bacillariophyta,and different biodiversity including Shannon-Weiner index(H)of 0.46,and evenness index(J)of 0.13.For the zooplankton with dominant species in copepoda,there was density of 27.04 ind./L,and biomass of 0.629 mg/L,with Shannon-Weiner index(H)of 0.68,and evenness indexes (J)of 0.52.Canonical correspondence analysis(CCA)revealed that salinity,and PO3-4-P,total nitrogen content, total phosphorus,NO-2-N and NO-3-N contents were the main factors affecting the dominant phytoplankton community structure,and that salinity,pH,PO3-4-P,total nitrogen,NO-2-N and NH+4-N contents were the main factors influencing the dominant zooplankton community structure in the marine high-place ponds.The findings showed that the water quality in the marine high-place shrimp ponds was eutrophic,and instable community structure in the late culture period.
Litopenaeus vannamei;high-place pond;phytoplankton;zooplankton;community structure
S955.7;Q145
A
10.16535/j.cnki.dlhyxb.2017.01.008
2095-1388(2017)01-0044-07
2016-10-20
国家海洋公益性行业科研专项 (201305005)
高欣 (1990—),女,硕士研究生。E-mail:1534743930@qq.com
刘青 (1965—),女,副教授。E-mail:liuqing@dlou.edu.cn

