当归多糖对点带石斑鱼Toll样受体22信号通路相关基因表达的影响
马淑芳,王庆奎,戴伟,孙学亮,陈成勋,邢克智
(天津农学院水产学院,天津市水产与养殖生态重点实验室,天津300384)
当归多糖对点带石斑鱼Toll样受体22信号通路相关基因表达的影响
马淑芳,王庆奎,戴伟,孙学亮,陈成勋,邢克智
(天津农学院水产学院,天津市水产与养殖生态重点实验室,天津300384)
为研究当归多糖Angelica sinensis polysaccharide(ASP)对点带石斑鱼Epinephelus malabaricus Toll样受体22(Toll-like receptor 22,TLR22)信号通路相关基因表达的影响,以当归多糖体外孵育点带石斑鱼头肾白细胞,采用实时荧光定量PCR(qPCR)方法检测了不同时间点 (3、6、12、24、48 h)TLR22信号通路相关基因mRNA相对表达量的变化。结果表明:TLR22及与其接头的Toll样接头蛋白1(TIR-domaincontaining adaptor inducing interferon-β,TRIF)的表达量均随时间的延长逐渐升高,分别于24、12 h达到峰值;TRIF下游的干扰素调节因子 (Interferon regulatory factor 3,IRF3)在24 h表达量达到最大值,此时主要组织相容性复合体 (Major histocompatibility complex,MHC)与肿瘤坏死因子 (Tumor necrosis factor-α, TNF-α)的表达量也开始到达峰值;白介素-8(Interleukin-8,IL-8)的表达量在48 h达到最高。研究表明:当归多糖可激活TLR22及其下游相关基因,并在免疫调节过程中起到重要作用。
点带石斑鱼;当归多糖;TLR22信号通路;基因表达
1 材料与方法
1.1 材料
试验用点带石斑鱼由天津市海发珍品实业发展有限公司提供,选取30尾体质健壮、规格为(218.45±0.35)g的鱼用于试验。当归多糖按王庆奎[7]的方法提取获得。
1.2 方法
1.2.1 试验设计 试验中随机选取点带石斑鱼30 尾,分成3组,每组10尾。用MS-222将鱼麻醉后从尾柄处取血,然后解剖取出头肾,经分离得到头肾白细胞。用RPMI-1640培养液将细胞浓度调至6×106cells/L,并分装于细胞培养瓶中,每瓶10 mL,于27℃、5%CO2培养箱中培养3 h贴壁。贴壁完成后,弃掉原培养液,收集细胞(记为0 h)。根据前期预试验得到当归多糖最佳孵育浓度为800 μg/mL,试验组中加入该浓度的当归多糖培养液,对照组加入RPMI-1640培养液,分别于培养后3、6、12、24、48 h弃掉上层培养液,收集细胞。使用qPCR法检测贴壁细胞中TLR22、TRIF、IRF3、MyD88、TNF-α、IL-8、MHCⅡ-β基因的表达。1.2.2 白细胞的分离 在超净工作台上,用小剪刀将点带石斑鱼的头肾剪成5~10 mm3的小块,置于150目无菌不锈钢细胞筛中,用研钵棒轻轻研磨,并不断用RPMI-1640维持液 (含2%胎牛血清、100 U/mL青链霉素、10 U/mL肝素)冲洗。将获得的细胞液离心10 min(4℃,400×g)后,再用PBS平衡盐溶液洗涤离心10 min(4℃,400× g),重复3次,再将获得的细胞悬液加到提前配制的不连续的34%/51%的细胞分离液Percoll溶液中,并离心25 min(4℃,400×g)。用巴斯德吸管小心吸出Percoll液最上层的灰白色细胞带,再用RPMI-1640培养液调节悬液,于显微镜下计数,用台盼蓝染色测定细胞成活率 (要求大于95%)。1.2.3 总RNA的提取 向细胞培养瓶中加入3.0 mL Rnaiso Plus试剂 (TaKaRa),将细胞刮起,用移液枪反复吹打使细胞充分裂解,采用氯仿抽提方法提取RNA。使用超微量紫外分光光度计在260、280 nm波长下测定RNA的吸光度,比值为1.8~ 2.0的用于后续试验。
1.2.4 cDNA的合成 依照反转录试剂盒 (TaKa-Ra)说明书进行试验,在200 μL离心管中加入4 μL的5×PrimeScript RT Master Mix和2 μL提取的RNA模板溶液,用去离子水 (ddH2O)将溶液定容到20 μL,在37℃水浴锅中反应15 min后,在85℃水浴中反应5 s,放入冰箱 (4℃)中15 min,最后将得到的cDNA产物放入冰箱 (-20℃)中保存备用。
1.2.5 实时荧光定量PCR TLR22、TRIF、IRF3、MyD88、TNF-α、IL-8、MHCⅡ-β和内参基因βactin引物序列见表 1。根据 Real Master Mix (SYBR Green I)试剂盒 (天津沙船生物科技有限公司)说明书设计反应体系,对 β-actin (HQ007251)、TLR22(HQ456304)、TRIF(HQ880-668)、IRF3(JX975468)、MyD88(JF271883)、TNF-α(FJ009049)、IL-8[21](FJ913064)、MHCⅡ-β[22](FJ598318)进行qPCR。PCR反应体系 (共20 μL) 为:ddH2O 7 μL,正、反向引物各0.5 μL,模板2 μL,LSYBR 10 μL。PCR反应程序为:95℃下预变性3 min;95℃下变性15 s,60℃下退火30 s, 72℃下延伸30 s,共进行30个循环。
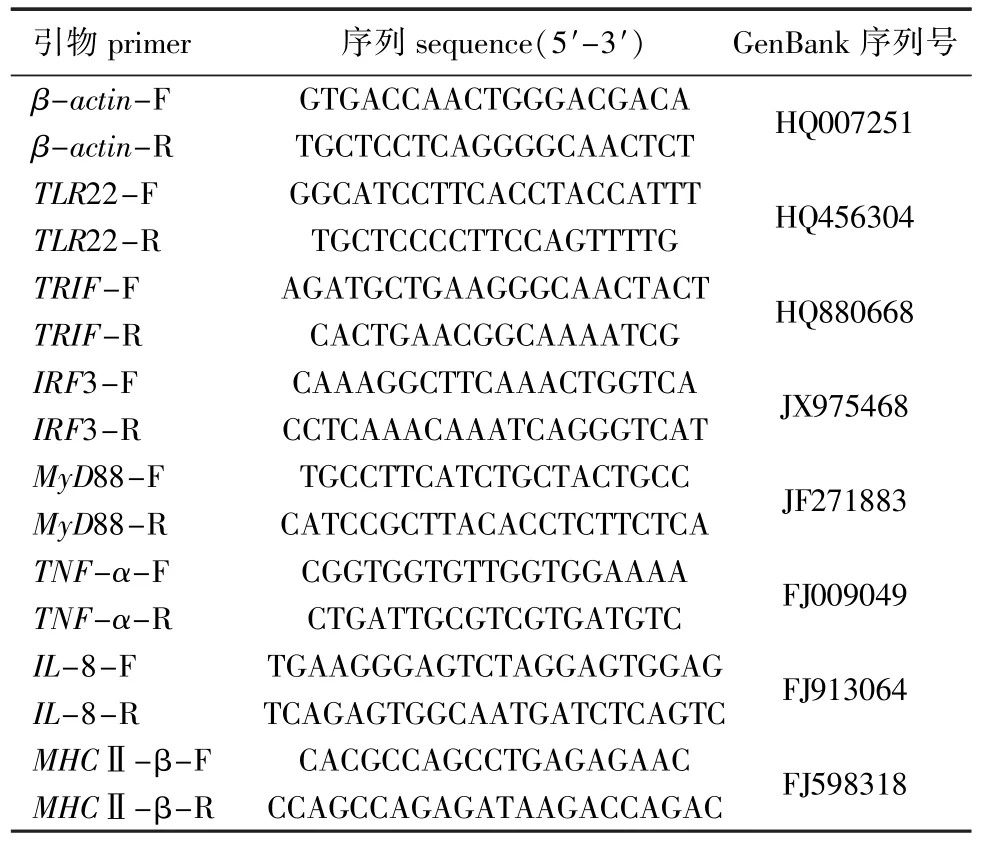
表1 试验用引物序列Tab.1 Sequences of the primers used in the experiment
1.3 数据处理
荧光定量PCR所得数据按照2-△△Ct法进行处理,所有数值均用平均值±标准差表示。利用Excel软件作图,用SPSS 18.0软件对同一基因不同时间的相对表达量进行单因素方差分析,对同一时间当归多糖组和对照组的同一基因相对表达量进行独立样本T检验,显著性水平设为0.05。
2 结果与分析
2.1 RNA电泳结果
点带石斑鱼头肾白细胞体外孵育24 h的总RNA样本,经10 g/L琼脂糖凝胶电泳检测显示(图1),RNA无明显降解,每个 RNA样本的OD260 nm/OD280 nm值均为1.8~2.0,说明 RNA纯度较好,可用于后续试验。
2.2 当归多糖对TLR22及其信号通路中相关基因表达的影响
从图2可见:当归多糖组TLR22随着孵育时间的延长表达量显著上调,在24 h达到峰值且显著高于对照组 (P<0.05);与其接头的MyD88基因的表达量则随着时间的变化显著下调,当归多糖组显著低于对照组 (P<0.05);而TRIF基因的表达趋势与TLR22一致,在12 h达到峰值且显著高于对照组 (P<0.05);IRF3基因在3、24 h表达量达到峰值且显著高于对照组 (P<0.05),其他时间点与对照组无显著性差异 (P>0.05)。
图1 点带石斑鱼头肾白细胞RNA电泳结果Fig.1 The RNA electrophoresis of head kidney leukocytes in Epinephelus malabaricus
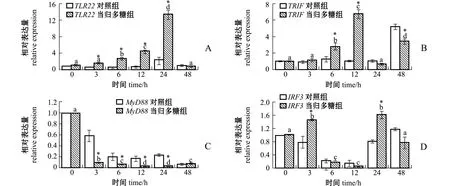
图2 当归多糖对点带石斑鱼头肾白细胞TLR22、TRIF、MyD88、IRF3表达量的影响Fig.2 Effects of ASP on expression of TLR22,TRIF,MyD88,and IRF3 in head kidney leukocytes of Epinephelus malabaricus
从图3可见:当归多糖组TNF-α基因表达量在24 h达到峰值且显著高于对照组 (P<0.05);当归多糖组MHCⅡ-β表达量也在24 h达到峰值,较对照组显著上调 (P<0.05),在3、12 h表达量显著增高且显著高于对照组 (P<0.05);IL-8基因的表达趋势与MHCⅡ-β基本一致,但在48 h表达量达到峰值且显著高于对照组 (P<0.05)。
3 讨论
TLR22作为水产动物特有的TLRs家族成员,在免疫应答反应中发挥着重要作用,TLR22可通过识别病原微生物保守组分 (PAMPs),激活MyD88 和TRIF依赖型信号通路[22]。MyD88是TLR非常重要的接头蛋白之一,含有N端的death结构域(DD)和C端TIR结构域。MyD88一般通过TIR结构域募集下游IL-1R相关激酶 (IRAK)-4,再由IRAK-4激活其他IRAK家族蛋白,被活化的IRAK蛋白复合物与肿瘤坏死相关因子6(TRAF6)相互作用,从而激活TAK1,TAK1再活化IκB激酶 (IκB kinase,IKK)复合体和MAPK家族。同时,磷酸化后被激活的MAPKs还会激活MAPK通路,从而导致某些转录因子的释放。MyD88依赖型途径可通过再活化NF-κB、MAPKs等通路来促进一些免疫因子,如IFN、IL-8等的分泌到胞外,从而起到增强免疫的作用[23-24]。TRIF作为另一类重要的接头蛋白,在TRIF依赖型信号通路中发挥着关键作用。当病原体入侵机体TLR被激活后,开始募集下游一系列接头蛋白进而引起免疫反应, 如TLR3和TLR4识别相应的配体后就会通过TRIF直接激活TAK1和TBK1,然后TAK1将会激活MAPKs和NF-κB这两条信号通路,如抗菌肽、炎性因子、MHC、共刺激分子和趋化因子等[25-26]。
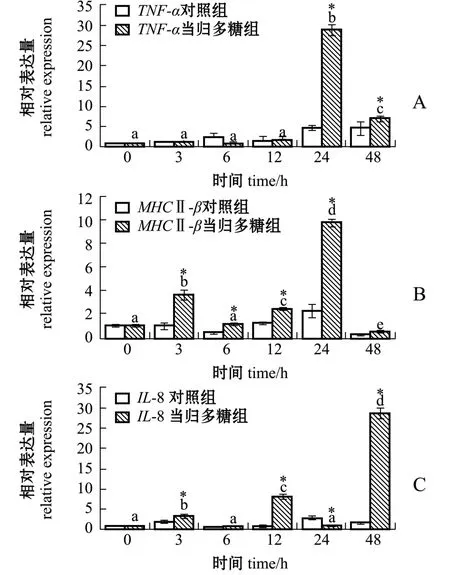
图3 当归多糖对点带石斑鱼TNF-α、MHCⅡ-β、IL-8基因表达量的影响Fig.3 Effects of ASP on expression of TNF-α,MHC Ⅱ-β,and IL-8 in head kidney leukocytes of Epinephelus malabaricus
研究发现,多聚肌苷酸-胞苷酸 (Poly I:C)、LPS和刺激隐核虫等能诱导鱼类TLR22通路及通路相关基因的表达量上调。丁旭[27]研究发现,用Poly I:C刺激后,斜带石斑鱼头肾白细胞的TLR22基因在被刺激1.5 h后表达量被显著诱导,并在刺激3 h甚至6 h后依然维持表达量升高趋势。用Poly I:C与LPS刺激斜带石斑鱼之后,TLR22下游的TRIF及MyD88的表达量分别在6.0、1.5 h显著升高,而转录因子IRF3的表达量也有显著上调的趋势。大菱鲆受到Poly I:C刺激6 h后,头肾中的TLR22表达量显著上调[28];石斑鱼被隐核虫感染后,TNF-α表达量上调,作为一种重要的CXC型趋化因子IL-8,在皮肤和鳃中表达量上调量较高,而在脾脏和头肾中表达量波动不大[21]。
本研究中发现:经当归多糖孵育点带石斑鱼头肾白细胞后,TLR22的表达量从6 h开始逐渐呈现上调趋势,24 h达到峰值;与其接头的TRIF表达量开始上调,12 h达到峰值;而TRIF下游的转录因子IRF3在24 h表达量达到峰值,此时,MHCⅡ-β与TNF-α的表达量也达到峰值;48 h IL-8的表达量较0 h显著升高。综上所述,当归多糖孵育点带石斑鱼头肾白细胞后,可激活TLR22,并使其募集进而激活接头蛋白TRIF,TRIF被激活后,通过激活下游通路蛋白,从而激活转录因子 IRF3, IRF3被激活后进入核内促进细胞免疫因子释放,进而起到免疫作用。但同为TLR22下游募集蛋白的MyD88,随着孵育时间的增加表达量呈显著下调,但IRF3、IL-8等基因表达量在各时间点呈现不规律性。作者认为,出现此结果的原因有:(1) 在TLR22募集下游蛋白时TRIF可能与MyD88存在竞争,或TLR22识别当归多糖后可能直接募集下游蛋白TRIF; (2)细胞内信号通路错综复杂, IRF3及IL-8等的表达可能还受其他通路或蛋白的调控,或与其他蛋白发生互作作用。
[1] 宓慧菁.中草药在水产动物中的应用研究现状[J].科技创新导报,2011(31):250.
[2] 罗正全.中草药在鱼类无公害养殖中的应用[J].中国水产, 2014(1):64-65.
[3] 戈贤平,缪凌鸿,刘波.中草药增强水生动物免疫和抗病能力的研究进展[J].中国渔业质量与标准,2015,5(6):1-7.
[4] 吴旋.四种中草药多糖对黄颡鱼生长、体成分及部分生理生化指标的影响[D].天津:天津农学院,2011.
[5] 张伟妮,林旋,王寿昆,等.黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J].动物营养学报,2010,22(2):401-409.
[6] 刘红柏,张颖,杨雨辉,等.5种中草药作为饲料添加剂对鲤肠内细菌及生长的影响[J].大连水产学院学报,2004,19(1): 16-20.
[7] 王庆奎.当归多糖对点带石斑鱼非特异性免疫力的影响[D].青岛:中国海洋大学,2012.
[8] 丛方地,王庆奎,周文礼,等.水产养殖中多糖的非特异性免疫研究[J].饲料工业,2014,35(19):65-69.
[9] 杨兴斌.当归多糖的组成分析及其激活腹腔巨噬细胞的免疫机制[D].西安:第四军医大学,2004.
[10] 程安玮,金征宇,王家启.功能性多糖免疫调节机理的研究进展[J].食品科技,2006,31(12):4-8.
[11] 邹云,谢红兵,贺建华.中草药多糖的免疫调节作用及其受体的研究[J].中国饲料,2013(5):22-25.
[12] Leung M Y K,Liu C,Koon J C M,et al.Polysaccharide biological response modifiers[J].Immunology Letters,2006,105(2):101-114. [13] Patel M V,Kumar P,Das H,et al.Evaluation of the constitutive expression levels of ch-TLR 3,ch-TLR 4,ch-TLR 15 and ch-TLR 21 genes in the peripheral blood mononuclear cells of native Indian poultry breeds,Aseel and Kadaknath[J].Veterinary World,2013,6(8):568-572.
[14] 王轶南,于卓,刘洋,等.虾夷马粪海胆TLR基因cDNA克隆及表达分析[J].大连海洋大学学报,2014,29(4):329-335.
[15] 隗黎丽,吴华东,熊六凤.柱状黄杆菌对草鱼TLRs基因表达水平的影响[J].大连海洋大学学报,2013,28(4):378-382.
[16] Hirono I,Takami M,Miyata M,et al.Characterization of gene structure and expression of two Toll-like receptors from Japanese flounder,Paralichthys olivaceus[J].Immunogenetics,2004,56 (1):38-46.
[17] Rebl A,Siegl E,Köllner B,et al.Characterization of twin Tolllike receptors from rainbow trout(Oncorhynchus mykiss):evolutionary relationship and induced expression by Aeromonas salmonicid salmonicida[J].Developmental&Comparative Immunology,2007,31(5):499-510.
[18] Xiao Xiaoqiang,Qin Qiwei,Chen Xinhua,et al.Molecular characterization of a Toll-like receptor 22 homologue in large yellow croaker(Pseudosciaena crocea)and promoter activity analysis of its 5’-flanking sequence[J].Fish&Shellfish Immunology, 2011,30(1):224-233.
[19] Sundaram A Y M,Consuegra S,Kiron V,et al.Positive selection pressure within teleost Toll-like receptors tlr21 and tlr22 subfamilies and their response to temperature stress and microbial components in zebrafish[J].Molecular Biology Reports,2012,39 (9):8965-8975.
[20] Sahoo B R,Dikhit M R,Bhoi G K,et al.Understanding the distinguishable structural and functional features in zebrafish TLR3 and TLR22,and their binding modes with fish dsRNA viruses:an exploratory structural model analysis[J].Amino Acids,2015,47 (2):381-400.
[21] 李言伟.石斑鱼TLRs功能及刺激隐核虫感染后免疫相关基因表达分析[D].广州:中山大学,2012.
[22] Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nature Immunology,2010,11(5):373-384.
[23] Brickey W J,Neuringer I P,Walton W,et al.MyD88 provides a protective role in long-term radiation-induced lung injury[J]. International Journal of Radiation Biology,2012,88(4):335-347.
[24] Into T,Inomata M,Niida S,et al.Regulation of MyD88 aggregation and the MyD88-dependent signaling pathway by sequestosome 1 and histone deacetylase 6[J].The Journal of Biological Chemistry,2010,285(46):35759-35769.
[25] Piao Wenji,Ru L W,Piepenbrink K H,et al.Recruitment of TLR adapter TRIF to TLR4 signaling complex is mediated by the second helical region of TRIF TIR domain[J].Proceedings of the National Academy of Sciences of the United States of America, 2013,110(47):19036-19041.
[26] Choi Y J,Im E,Chung H K,et al.TRIF mediates Toll-like receptor 5-induced signaling in intestinal epithelial cells[J].The Journal of Biological Chemistry,2010,285(48):37570-37578.
[27] 丁旭.斜带石斑鱼Toll样受体22基因的cDNA克隆、表达模式分析及其信号通路的初步探讨[D].海口:海南大学,2012. [28] 张守锋.大菱鲆Toll样受体22(TLR22)全长基因的克隆及表达分析[D].青岛:中国海洋大学,2014.
Effects of Angelica sinensis polysaccharides on expression of TLR22 pathway-related genes in malabar grouper Epinephelus malabaricus
MA Shu-fang,WANG Qing-kui,DAI Wei,SUN Xue-liang,CHEN Cheng-xun,XING Ke-zhi
(College of Fisheries,Tianjin Key Laboratory of Aqua-Ecology and Aquaculture,Tianjin Agricultural University,Tianjin 300384,China)
Head kidney leucocytes of malabar grouper Epinephelus malabaricus were cultured in Angelica sinensis polysaccharides(ASP)in vitro for 3,6,12,24 and 48 h,and changes in mRNA levels of Toll-like receptor 22 (TLR22)pathway-related genes were analyzed by quantitative real-time PCR to investigate effects of ASP on the expression of TLR22 signal pathway-related genes in malabar grouper.The results showed that mRNA levels of TLR22 and TIR-domain-containing adaptor inducing interferon-β(TRIF)were up-regulated gradually with time, with the maximum TLR22 value in 24 h and the maximum TRIF value in 12 h.The peak expression of downstream transcription factor IRF3(interferon regulatory factor 3)was observed in 24 h,and the peak expression of major histocompatibility complex(MHC)and tumor necrosis factor-α(TNF-α)genes was found in 24 h.The maximal expression of interferon-8(IL-8)mRNA appeared in 48 h.These findings indicate that ASP leads to activate TLR22 and its downstream genes which play an important role in malabar grouper immune regulation.
Epinephelus malabaricus;Angelica sinensis polysaccharide;TLR22 signal pathway;gene expression
10.16535/j.cnki.dlhyxb.2017.01.006
2095-1388(2017)01-0033-05
S942.1< class="emphasis_bold">文献标志码:A
A研究较少,且当归多糖对TLR22及其信号通路中相关基因表达的影响尚未见报道。为此,本研究中检测了当归多糖对点带石斑鱼胞膜TLR22及其信号通路中相关基因表达的影响,旨在为研究当归多糖提高点带石斑鱼免疫力机理提供参考。
2016-04-11
国家自然科学基金资助项目 (31270456,31402313);国家 “星火计划”重大项目 (2013GA610002);天津市科技支撑计划重大项目 (12ZCDZNC05900,13ZCZDNC00700);国家农业科技成果转化项目 (2014GB2A100528);天津市应用基础与前沿技术研究计划项目 (15JCZDJC33600,15JCZDJC34000)
马淑芳 (1990—),女,硕士研究生。E-mail:13820289483@163.com
邢克智 (1956—),男,教授。E-mail:kzxing6668@126.com
中草药多糖具有生物可降解性和环境安全性,且药源广、成本低、不易产生耐药性和药物残留,在水产养殖中的应用越来越广泛[1-3]。通过在饲料中添加中草药多糖提高水产动物免疫力、抗病力,降低发病率,已成为近几年研究的热点[4-6]。当归多糖作为一种重要的中草药多糖,在水产养殖中已得到广泛关注,有研究发现,腹腔注射当归多糖及其亚组分能显著提高点带石斑鱼Epinephelus malabaricus体表黏液溶菌酶和血清溶菌酶活力,血液白细胞数和NBT阳性细胞数[7]。然而,中草药多糖是一类分子量大且复杂的化合物,多糖的质量控制和作用机理仍是有待解决的棘手问题[8]。中草药多糖通过多途径、多环节、多靶点来发挥免疫调节功能,对多糖免疫调节机理的阐明是糖生物学的重要研究内容之一[9-10]。目前,较为公认的多糖免疫调节机制是:中草药多糖通过与细胞表面模式识别受体结合后,影响细胞的信息传递过程,进而影响细胞基因表达,起到调节机体免疫功能的作用[11]。中草药多糖可被模式识别受体和血浆蛋白识别,模式识别受体是一种可以识别病原相关分子模式结构的非特异性免疫蛋白,其中Toll样受体 (TLR)和清道夫受体是两种不同的可以识别多糖的模式识别受体[12]。关于中草药多糖的免疫调节机理可以从模式识别受体方向着手研究。
Toll样受体 (Toll-like receptors,TLR)是一类重要的跨膜蛋白质分子,可识别微生物具有保守结构的分子,并激活机体产生免疫应答。目前,对作为模式识别受体之一的TLRs调控免疫反应的研究已成为分子免疫学领域的研究热点[13-16],TLR信号途径有MyD88依赖型和TRIF依赖型两种。
TLR22是水产动物特有的TLRs家族成员,且在多种鱼类中均有发现并已报道[17-18]。有研究表明,TLR22位于细胞膜表面可识别LPS、多聚肌苷酸-胞苷酸 (Poly I:C)、长片段的双链RNA等,其功能与TLR3相似[19-20]。当前,大量研究均集中于对TLR22基因的研究,而对其下游相关基因的

