低频电针对2型糖尿病神经痛大鼠DRG P2X3受体的抑制作用
寿升芸,魏骏骏,何晓芬,吴媛媛,方剑乔,蒋永亮
(浙江中医药大学第三临床医学院,杭州 310053)
低频电针对2型糖尿病神经痛大鼠DRG P2X3受体的抑制作用
寿升芸,魏骏骏,何晓芬,吴媛媛,方剑乔*,蒋永亮*
(浙江中医药大学第三临床医学院,杭州 310053)
目的 观察低频电针(electroacupuncture,EA)对2型糖尿病神经痛(diabetic neuropathic pain,DNP)模型大鼠的痛阈以及L5背根神经节(dorsal root ganglion,DRG)的P2X3受体表达的影响。方法 实验一:将50只SD大鼠随机分为对照组8只和造模组42只。造模组给予高脂高糖饮食联合小剂量链脲佐菌素(streptozotocin,STZ,35 mg/kg)腹腔注射建立大鼠DNP模型,对照组以常规饲料喂养并给予相同剂量的柠檬酸缓冲液注射。造模组中模型成功的大鼠进一步分为模型组(DNP group)与低频电针治疗组(DNP + EA group)。电针治疗选用双侧“足三里”、“昆仑”穴,频率2 Hz,强度1 mA治疗15 min,后2 mA 治疗15 min,每日1次,共治疗7次。观察大鼠高脂高糖饲养0、5 周的胰岛素敏感指数(insulin sensitivity index,ISI)及0、5、7 周空腹血糖(fasting plasma glucose,FPG)水平变化;采用动态足底触觉仪检测大鼠高脂高糖饲养0、5、7 周及电针3、5、7 d 6个时间点双后足缩腿阈(paw withdrawal thresholds,PWTs)的变化;采用免疫荧光法测定L5 DRG P2X3受体表达。实验二:将DNP造模成功的大鼠分为电针组(EA + Vehicle group)和P2X3激动剂组(EA + αβ-meATP group)。电针干预同上。EA + αβ-meATP group于每次电针干预前在大鼠足趾下注射αβ-meATP(0.6 μmol/L,100 μL)。EA + vehicle group大鼠注射等剂量的PBS缓冲液,其余干预相同。检测机械痛阈。结果 ①与对照组大鼠比较,模型组大鼠高脂高糖饲养5 周后ISI均明显降低(P< 0.01),高脂高糖饲养7 周后 FPG明显升高(P< 0.01),说明成功建立2型糖尿病模型(造模成功率为69.04%);②PWTs:与对照组比较,模型组大鼠双侧PWTs明显降低(P< 0.01),说明2型DNP造模成功;与模型组比较,低频电针治疗组大鼠在治疗后各时点均出现双侧PWTs的显著增加(P< 0.01);而与电针组比较,P2X3激动剂组双侧PWTs均明显降低(P< 0.01)。③免疫荧光法检测结果显示:与对照组比较,模型组大鼠L5 DRG P2X3阳性细胞表达明显增加(P< 0.01);与模型组比较,低频电针治疗组大鼠L5 DRG P2X3阳性细胞表达均明显减少(P< 0.01)。结论 低频电针能通过下调L5 DRG P2X3受体有效改善2型DNP。
2型糖尿病,神经痛;电针;P2X3
据WHO统计,目前全球共有3.47亿人疾患糖尿病[1],糖尿病是继肿瘤、心脑血管疾病之后第三位威胁人类健康的慢性非传染性疾病。而糖尿病神经病理痛(diabetic neuropathic pain,DNP)作为糖尿病最常见的并发症之一,其发病率高达32.7%[2],主要表现为自发性烧灼样疼痛、痛觉过敏和痛觉超敏,严重影响了患者的生存质量。目前临床上DNP的药物治疗效果不稳定且毒、副作用明显。因此,寻找能有效控制DNP且毒副作用少的方法,并阐明其机理,是糖尿病并发症防治中的一个重要问题。
电针(electroacupuncture,EA)能减轻神经病理痛,且低频电针的镇痛效果优于高频电针的现象[3]。研究表明背根神经节(dorsal root ganglion,DRG)P2X3受体水平表达上调在大鼠DNP发生中起着重要的作用[4]。电针可能通过下调DRG P2X3受体的功能与表达减轻坐骨神经慢性压榨性损伤(chronic constriction injury,CCI)诱导的神经病理痛[5]。但关于电针治疗DNP是否也与调节DRG P2X3受体有关尚不明确,其作用机理有待阐述。因此,本实验拟通过观察低频电针对2型DNP模型大鼠的痛阈干预以及对L5背根神经节(dorsal root ganglion,DRG)的P2X3受体表达的影响,探讨电针治疗DNP的可能机制。
1 材料与方法
1.1 实验动物
选用SPF级雄性SD大鼠50只,体重(150±10)g,购自中国科学院上海实验动物中心【SCXK(沪)2008-0016】,由浙江中医药大学动物实验研究中心饲养[SYXK(浙)2013-184]。饲养期间正常大鼠给予啮齿类动物标准颗粒饲料(由实验动物中心提供),造模大鼠给予高脂高糖饲料,均自由饮水,昼夜明暗周期:12 h/12 h。
1.2 造模与分组
将50只SD大鼠用完全随机分组法分为对照组(n=8)与造模组(n=42)。对照组以普通饲料喂养。造模组以高脂高糖饲料(72.5%普通饲料 + 10%猪油 + 10%蔗糖 + 2%胆固醇 + 0.5%胆酸钠 + 5%蛋黄粉)喂养5周诱发胰岛素抵抗。于实验开始前即0周、高脂高糖喂养5周后测大鼠空腹血糖(fasting plasma glucose,FPG),并取血测空腹胰岛素(fasting plasma insulin,FINS)评估胰岛素敏感性,胰岛素敏感指数(insulin sensitive index,ISI)下降的大鼠继以小剂量链脲佐菌素(streptozotocin,STZ,35 mg/kg)腹腔注射1次,对照组仅给予相同剂量的柠檬酸缓冲液注射。于7 周分别测FPG和大鼠痛阈,血糖稳定且11.1 mmol/L,同时痛阈下降15%者入选实验,表示大鼠糖尿病神经病理痛模型(diabetic neuropathic pain,DNP)制备成功。造模成功的大鼠将进一步随机分为模型组(DNP group,n=8)和低频电针治疗组(DNP + EA group,n=9)。其余未达到此标准者予以剔除。
1.3 电针干预
低频电针治疗组:大鼠固定后,电针治疗取双侧“足三里”、“昆仑”穴(参照华兴邦大鼠穴位图谱),采用0.25 mm × 13 mm毫针,进针后连接韩氏穴位暨神经刺激仪,频率2 Hz,强度先1 mA治疗15 min,后2 mA 治疗15 min,共30 min。电针治疗于高脂高糖饲养第7周,每天1次,共治疗7次。对照组、模型组仅给予同低频电针治疗组相同的固定。
1.4 空腹血糖的测定
分别于高脂高糖饲养0、5、7 周这3个时间点将大鼠于前天晚上8点禁食不禁水,进行剪尾取血,采用罗氏卓越型血糖仪(Roche ACCU-CHEK Performa)测定空腹血糖值(FPG,mmol/L)。
1.5 胰岛素测定
分别于高脂高糖饲养0 周、5 周这两个时间点,将大鼠禁食不禁水12 h 后,眼眶取血约2 mL,室温静止约30 min,于4℃、3500 r/min离心10 min,取上清液血清,采用双抗体夹心ELISA 法测定胰岛素浓度,根据不同浓度标准血清的A450值作标准曲线,计算待测标本血清胰岛素浓度。胰岛素敏感性指数的计算:胰岛素敏感性指数(insulin sensitivity index,ISI)=1 /(空腹血糖 × 空腹胰岛素)=1 /(FPG×FINS),此值为非正态分布,故计算时取其自然对数。
1.6 机械痛阈测定
分别于高脂高糖饲养0、5、7 周及电针治疗3、5、7 d这6个时间点,采用动态足底触觉仪检测大鼠双侧足跖缩腿阈(paw withdrawal thresholds,PWT),取双侧平均值作为大鼠机械痛觉异常的指标,即机械痛阈。测量前,将大鼠置于塑料盒内适应环境10 min。待大鼠安静后(停止梳理毛发和探索性活动),将连于机械泵上的类Von Frey丝的金属丝(0.5 mm)置于大鼠后足中央,避开足垫;启动机械泵,金属丝即以恒定速度自动上台,对大鼠足底施加机械刺激。刺激力量从0 g开始以2.5 g/s递增(Ramp=20 sec),直至大鼠产生缩腿反应;最大刺激力量为50 g,以免大鼠足爪受损;连续测量5次,去最大、最小值,取3次平均值,每次间隔5 min。
1.7 免疫荧光方法检测L5 DRG P2X3 阳性细胞表达情况
(1) 样本采集
大鼠用10%(0.35 mL / 100 g)水合氯醛腹腔麻醉,开胸暴露心脏,生理盐水(4 ℃预冷)经左心室、升主动脉快速灌注,直至流出液为澄清液体,再缓慢推注4%多聚甲醛150 mL,随后用500 mL 4%多聚甲醛溶液先快后慢滴注,快速取出大鼠L5 DRG,4%多聚甲醛溶液中后固定3 h,15%、30%蔗糖溶液梯度脱水,液氮速冻,-80 ℃保存备用。
(2) 免疫荧光单标法检测大鼠L5 DRG 的P2X3 阳性细胞表达情况
L5 DRG进行冰冻切片(14 μm),将切片贴于涂有多聚赖氨酸的载玻片上,PBS洗10 min × 3次;滴加10%山羊血清37 ℃孵育1 h以封闭非特异性位点;加兔抗大鼠P2X3抗体(1∶2000)4℃孵育过夜;PBS洗10 min × 3次,滴加Alexa Fluor® 488山羊抗兔 IgG (H + L) 37℃孵育(避光)1 h(1∶800),PBS洗10 min × 5次(避光),擦干玻片后滴加抗荧光猝灭剂封片,荧光显微镜下观察并拍片。
1.8 检测P2X3 激动剂 αβ-meATP对低频电针镇痛作用的影响
该部分为验证实验,进一步验证低频电针对DNP的镇痛作用是否与下调DRG P2X3受体有关。动物来源以及造模方法同上。将模型成功的12只DNP大鼠随机分为电针组(EA + vehicle group,n=6)和P2X3激动剂组(EA + αβ-meATP group,n=6)。电针干预同上。EA + αβ-meATP 组于每次EA治疗前于大鼠足趾下注射αβ-meATP(0.6 μmol/L,100 μL)。EA + Vehicle组注射等剂量的PBS缓冲液,其余干预同前。检测机械痛阈。
1.9 统计学处理
2 结果
2.1 大鼠STZ注射前不同时间点胰岛素敏感指数变化
与对照组比较,造模组大鼠ISI均降低(P< 0.01)。见表1。
2.2 大鼠STZ注射前后不同时间点空腹血糖变化
与对照组比较,STZ注射3 d及STZ注射2周后造模组大鼠FPG均升高(P< 0.01)。见表2。
2.3 低频电针对DNP大鼠痛阈的影响
与对照组比较,造模后模型组大鼠PWT降低(P< 0.01);与模型组比较,低频电针治疗组大鼠 PWT升高(P< 0.01)。见图1。

表1 大鼠STZ注射前ISI变化
注:与对照组比较:**P< 0.01。(下表同)。
Note.**P< 0.01, versus the normal group.(The same as in the following tables)
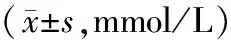
表2 大鼠STZ注射前FPG变化

注:与对照组比较:**P < 0.01;与模型组比较:##P < 0.01。图1 低频电针对DNP大鼠PWT的影响Note:**P < 0.01, versus the normal group; ##P < 0.01, versus the DNP group.Fig.1 Effects of 2 Hz electroacupuncture on bilateral paw withdrawal thresholds of the DNP rats.
2.4 大鼠L5 DRG P2X3受体阳性细胞表达情况
如图2所示,与对照组比较,模型组大鼠L5 DRG中P2X3受体表达增多(P< 0.01);与模型组比较,低频电针治疗组大鼠 L5 DRG中P2X3受体表达减少(P< 0.01)。
2.5 P2X3受体激动剂αβ-meATP对低频电针镇痛作用的影响
与电针组比较,P2X3激动剂组大鼠双侧PWT降低(P< 0.01)。见图3。
3 讨论
糖尿病是严重危害人类健康的慢性疾病之一,目前全球糖尿病患者超过7亿,而2型糖尿病占了90%[6]。2型糖尿病后期常出现神经病变、眼部病变、肾脏病变以及心血管病变等,这些并发症比糖尿病本身更进一步危害着人类的健康。神经病理痛是2型糖尿病常见并发症,因其顽固、难治而越来越受到人们的关注。目前临床一线用药抗惊厥药、三环类抗抑郁药疗效不稳定且存在严重毒副作用,长期应用受到限制;传统的非甾体类、吗啡类镇痛药物常常难以凑效[7]。针刺是控制慢性疼痛的主要手段之一[8],在治疗DNP方面有良好的应用前景,电针作为针刺的主要手段已开始用于治疗DNP[9, 10],但由于临床系统观察较少、作用机理不明确,目前DNP治疗在针灸临床所占比例不高,有必要开展针灸治疗DNP的机制研究,促进针灸更好地治疗DNP。本实验首次开展低频电针对DNP大鼠的DRG P2X3受体干预作用研究。

注:与对照组比较:**P < 0.01;与模型组比较:##P < 0.01。图2 大鼠L5 DRG P2X3受体阳性细胞的表达Note.**P < 0.01, versus the normal group;##P < 0.01, versus the DNP group.Fig.2 P2 X3 receptor positive expression cells in L5 DRG of the DNP rats

注:与电针组比较:△△P < 0.01。图3 P2X3受体激动剂对电针干预DNP大鼠PWT的影响Note.△△P < 0.01, versus the EA + vehicle group.Fig.3 Effect of P2X3 agonist on the analgesic effect of electroacupuncture on bilateral paw withdrawal thresholds of the DNP rats
2 型糖尿病的发病机理主要为胰岛素抵抗与胰岛功能受损,而胰岛素抵抗则为其始动因素[11]。本实验采用的高脂高糖饲养联合小剂量STZ注射造模法是目前最符合人类2型糖尿病临床特征的方法,具有方法简单、成本低廉、模型稳定等优点,适合糖尿病本身及其多种并发症的研究[12,13]。该方法通过高糖高脂饮食诱导大鼠胰岛素抵抗,联合注射低剂量STZ损伤胰岛功能,进而引起血糖升高,模拟了2型糖尿病的临床发病过程[14-16]。已有研究表明[17]高脂高糖饲养联合小剂量STZ注射成功制备2型糖尿病后2周可诱发神经病理痛,从而制备DNP模型。而本实验中高脂高糖饲养大鼠5周后,造模组大鼠胰岛素敏感指数明显下降,说明诱发了胰岛素抵抗,再予以腹腔注射STZ(35 mg/kg)后,空腹血糖明显上升,成功建立2型糖尿病模型。STZ注射2周后,造模组大鼠出现机械痛阈明显下降,表明2型糖尿病诱发了神经病理痛,与以往建立的DNP模型相似[17]。对DNP大鼠进行电针治疗,结果显示低频电针治疗后,低频电针治疗组大鼠的机械痛阈值明显高于模型组(P< 0.01),说明低频电针能够明显改善DNP。
DNP与周围感觉神经兴奋性增强有关,涉及多种离子通道、受体在背根神经节神经元上的表达、功能上调[4,18-19]。嘌呤受体P2X家族是当前生物医学研究领域的一个热点,激活后可使Ca2+、Na+、K+通过,其中P2X3受体高选择性地表达于感受伤害性信息的中小DRG神经元上[20, 21],参与多种神经病理痛过程[5, 22-25]。研究显示,在链脲佐菌素(streptozotocin,STZ)诱导的大鼠DNP模型中,P2X3受体介导的DRG神经元快反应电流增强,细胞膜P2X3受体表达上调[4],而P2X3受体拮抗剂PPADS、TNP-ATP均能抑制DNP大鼠痛敏反应[4, 22];用siRNA干扰P2X3受体基因表达也能减轻P2X3受体激动剂αβ-meATP引起的大鼠痛敏反应[26]。在本实验中,我们也发现DNP模型大鼠DRG P2X3受体表达明显高于对照组。这些结果表明DRG神经元P2X3受体在DNP中起着重要作用。
Tu等[5]在CCI诱导的神经病理痛模型中发现电针能够提高模型大鼠的机械痛阈和热痛阈,并减少DRG P2X3受体的表达,减弱P2X3受体激动剂诱发的电流改变,表明电针能通过抑制DRG P2X3受体的功能和表达参与CCI神经病理痛的镇痛过程。但目前尚不清楚电针干预DNP是否存在同样的机制。在本研究中,我们发现2 Hz 电针在降低DNP大鼠痛阈的同时,可进一步降低模型大鼠DRG P2X3受体的表达水平,且2 Hz 电针对DNP大鼠的镇痛作用能被P2X3受体激动剂αβ-meATP拮抗,以上结果表明低频电针对DNP的干预作用与其抑制DRG 神经元P2X3受体的表达有关。
本研究通过观察低频电针对DNP大鼠的干预作用和对DRG P2X3受体的调控效应,并进行P2X3受体激动剂的验证实验,发现低频电针对DNP具有良好的治疗作用,与其下调DRG P2X3受体密切相关。本研究阐释了电针治疗DNP的部分机制,同时也为电针治疗DNP提供了科学依据。
[1] World Health Organization.Fact sheet No. 312.Available from http://www.who.int.Accessed 13 January 2013.
[2] Candrilli SD,Davis KL,Kan HJ,et al.Prevalence and the associated burden of illness of symptoms of diabetic peripheral neuropathy and diabetic retinopathy[J].J Diab Complicat,2007,21(5): 306-314.
[3] 孙瑞卿, 王贺春, 王韵, 等.不同频率的电针对大鼠神经源性痛的治疗作用[J].中国应用生理学杂志,2002,18(2): 128-131.
[4] Xu GY, Li GW,Liu NG,et al.Mechanisms underlying purinergic P2X3 receptor mediated mechanical allodynia induced in diabetic rats [J].Mol Pain,2011,7: 60.
[5] Tu WZ,Cheng RD,Cheng B,et al.Analgesic effect of electroacupuncture on chronic neuropathic pain mediated by P2X3 receptors in rat dorsal root ganglion neurons [J].Neurochem Int,2012,60(4): 379-386.
[6] 陈 嘉,张永斌,桑传兰,等.SD大鼠2型糖尿病模型的建立及相关指标的测定 [J].动物医学进展,2012,33(6): 91-95.
[7] Li J.Pharmacotherapy of diabetic peripheral neuropathy [J].Clin Medicat J,2012,10(4): 49-51.
[8] Berman BM,Langevin HM,Witt CM,et al.Acupuncture for chronic low back pain [J].N Engl J Med,2010,363(5): 454-461.
[9] 严洁,朱兵.针灸治疗糖尿病周围神经病变的研究 [M].针灸基础与临床,2010,湖南科学技术出版社,p422.
[10] 金泽,张边防,尚丽霞,等. 电针配合穴位注射治疗糖尿病周围神经病 [J].中国针灸 2011,31(7):613-616.
[11] Spady DK,Dletschy SM.Dietary saturated triacylglycerols suppress hepatic low density lipoprotein receptor activity in the hamster [J].Proc Natl Acad Sci U S A,1985,82: 4526-4530.
[12] 刘德慧,邢翔飞.2型糖尿病大鼠模型的特点及评价 [J].中国实验方剂学杂志.2010,16(12): 212-214.
[13] Rodrigues Filho OA, Fazan VP.Streptozotocin induced diabetes as a model of phrenic nerve neuropathy in rats [J].J Neurosci Methods,2006,151: 131.
[14] Negis Y,Aytan N,Ozer N,et al.The effect of tocopheryl phosphates on atherosclerosis progression in rabbits fed with a high cholesterol diet [J].Arch Physiol Biochem,2006, 450(1): 63-66.
[15] 杨架林,李果,刘优萍,等.长期高脂饮食加小剂量链脲佐菌素建立人类普通2型糖尿病大鼠模型的研究 [J].中国实验动物学报, 2003, 11(3): 138-1411.
[16] 郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点 [J].中国糖尿病杂志,2002,10(5): 290-2941.
[17] Dang JK,Wu Y,Cao H,et al.Establishment of a rat model of type II diabetic neuropathic pain[J].Pain Med,2014,15: 637-646.
[18] Chattopadhyay M,Mata M,Fink DJ.Continuous delta-opioid receptor activation reduces neuronal voltage-gated sodium channel (NaV1.7) levels through activation of protein kinase C in painful diabetic neuropathy [J].J Neurosci,2008, 28(26): 6652-6658.
[19] Hong S, Wiley JW.Early painful diabetic neuropathy is associated with differential changes in the expression and function of vanilloid receptor 1 [J].J Biol Chem, 2005, 280(1): 618-627.
[20] Chen CC, Akopian AN, Sivilotti L, et al.A P2X purinoceptor expressed by a subset of sensory neurons [J].Nature,1995, 377(6548): 428-431.
[21] Shi L, Zhang HH, Hu J, et al.Purinergic P2X receptors and diabetic neuropathic pain [J].Acta Physiol Sin, 2012,64(5): 531-542.
[22] Migita K,Moriyama T,Koguchi M,et al.Modulation of P2X receptors in dorsal root ganglion neurons of streptozotocin-induced diabetic neuropathy [J].Neurosci Lett, 2009, 452(2): 200-203.
[23] Chen Y, Li GW, Wang C, et al.Mechanisms underlying enhanced P2X receptor-mediated responses in the neuropathic pain state [J].Pain, 2005, 119(1-3): 38-48.
[24] Burnstock G.Physiology and pathophysiology of purinergic neurotransmission [J].Physiol Rev, 2007, 87(2): 659-797.
[25] Wang W, Gu J, Li YQ, et al.Are voltage-gated sodium channels on the dorsal root ganglion involved in the development of neuropathic pain? [J]. Mol Pain,2011,7: 16.
[26] Dorn G, Patel S, Wotherspoon G, et al.siRNA relieves chronic neuropathic pain [J].Nucleic Acids Res, 2004, 32(5): 49.
Inhibitory effect of low frequency electroacupuncture on the P2X3 receptor in dorsal root ganglion of rats suffering from type II diabetic neuropathic pain
SHOU Sheng-yun, WEI Jun-jun, HE Xiao-fen, WU Yuan-yuan,FANG Jian-qiao*, JIANG Yong-liang*
(The Third Clinical Medical College, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Objective To investigate the effects of low frequency electroacupuncture on the P2X3 receptor expression in dorsal root ganglion (DRG) of rats with type II diabetic neuropathic pain. Methods Part 1:Fifty normal SD rats were randomly divided into normal group (8 rats) and model group (42 rats). The rat model of type II diabetic neuropathic pain was generated by high fat and high sugar diet with a single intraperitoneal injection of streptozotocin (STZ, 35 mg/kg). 2 Hz electroacupuncture was administered at ipsilateral acupoints Zusanli and Kunlun for consecutive 7 days. Insulin sensitivity index (ISI) was measured at 0 w and 5 w, and fasting plasma glucose (FPG) was measured at 0 w, 5 w, and 7 w. Paw withdrawal threshold (PWT) was measured by mechanical pain threshold, and P2X3 receptor was determined by immunofluorescence. Part 2:Twelve rats with diabetic neuropathic pain (DNP) were divided into EA + vehicle group (6 rats) and EA + αβ-meATP group (6 rats). Rats in the two groups received the same EA treatment as Part 1. Rats in the EA + αβ-meATP group were injected with P2X3 receptor agonist αβ-meATP (0.6 μmol/L, 100 μL) into the ventral surface of each hind paw every time before EA treatment. Rats in the EA + vehicle group received the same dose of vehicle (PBS buffer) as a control. Pain threshold of the rats were measured. Results ① Compared with the normal group, the ISI levels of the rats in DNP group was significantly decreased after 5 weeks of the high-fat high-sugar diet (P< 0.01). Two weeks after STZ injection, the fasting plasma glucose levels in the rats receiving STZ were significantly elevated (P< 0.01). The type 2 diabetes model was established with a successful rate of 69.04%. ② PWTs:The PWTs of rats in DNP group were reduced compared with rats in the normal group (P< 0.01), indicating that the type 2 DNP model was successfully established. Compared with the PWTs of DNP-controlled rats, the 2 Hz electroacupuncture significantly increased bilateral PWT of rats subjected to DNP from day 3 after treatment (P< 0.01). P2X3 receptor agonist αβ-meATP greatly reduced bilateral PWT of EA-treated DNP rats compared with that of the EA + vehicle group (P< 0.01). ③The immunofluorescence essay showed that P2X3 receptor expression in bilateral L5 DRGs in the DNP group was significantly increased as compared with that in the normal group (P< 0.01). The increases were inhibited by 2 Hz EA in L5 DRGs compared with the DNP group (P< 0.01). Conclusions 2Hz electroacupuncture can effectively treat the type II diabetic neuropathic pain by decreasing the expression of L5 DRG P2X3 receptors in rats.
Type II diabetic neuropathic pain; Electroacupuncture; P2X3
JIANG Yong-liang, E-mail: jyl2182@126.com; FANG Jian-qiao, E-mail:fangjianqiao7532@163.com
国家自然科学基金(编号:81303039);教育部高等学校博士学科点专项科研基金(编号:20133322120001);浙江省博士后基金(编号:BSH1302083);国家中医药管理局重点学科(针灸学)建设经费资助(国中医药发[2009]30号)。
寿升芸(1990-),女,硕士研究生,专业:针灸推拿学。E-mail: 502901943@qq.com
蒋永亮(1981-),男,副研究员,研究方向:针灸镇痛与免疫相关性疾病的研究。E-mail: jyl2182@126.com;方剑乔(1961-),男,教授,研究方向:针灸镇痛与免疫相关性疾病的研究。E-mail: fangjianqiao7532@163.com。
Q95-33
A
1005-4847(2017) 01-0054-06
10.3969/j.issn.1005-4847.2017.01.010
2016-05-03