“形神共养”对MCAO大鼠学习记忆能力及BDNF表达的影响
王娟,郝赤子,廖维靖,张璇,万芪
“丰富生存环境”可以增强学习和记忆能力[1],诱导脑结构和功能的改变,对脑损伤修复具有显著促进作用,《黄帝内经》中的养生学十分重视形体与精神的整体调摄,强调动以养形,静以养神,动静结合,形神共养[2],但养生缺乏科学合理的评价方法[3]。本研究将中医养生理论,借助现代医学技术和手段,应用于局灶性脑缺血的研究,在“丰富生存环境”的实践基础上,根据中医养生“动以养形,静以养神”理论的指导,制作“形神共养”的丰富生存环境模型,探讨“形神共养”对局灶性脑缺血再灌注大鼠学习记忆能力的影响及其分子机制。
1 材料与方法
1.1 实验动物及造模 选取健康雄性Sprague-Dawley大鼠共50只(SPF级),体质量(220±20)g,饲养于武汉大学动物实验中心的屏障环境中,饲养环境保持室温22℃,湿度72%,12h昼夜交替。术前禁食12h,不禁水。适应性饲养5d后,采用计算机随机数字法将50只SD大鼠随机分为假手术标准环境组(Sham Standard Environment,SS)10只、缺血丰富环境组(Ischemia Enriched Environment,IE)30只,缺血标准环境组(Ischemia Standard Environment,IS)10只。50只大鼠均参照廖维靖等[4]的线栓改良法制作大脑中动脉阻塞(Middle Cerebral Artery Occlusion,MCAO)及再灌注模型,假手术组的线栓插入颈总动脉的深度为1cm,随即拔出,结扎颈总动脉远端的备用丝线。造模后对已经苏醒的大鼠参照Zea Longa法进行神经功能缺损评分[5],评分在1~3分为造模成功,纳入实验,否则弃之。对于造模失败的大鼠,通过致死量麻醉后颈椎脱臼的方法对其实施安乐死[6]。
1.2 方法 ①“形神共养”的“丰富生存环境”模型的制作。a.“形养”笼尺寸长、宽、高分别为90cm、75cm、50cm,笼内放置木梯、台阶、网格、秋千、绳索等物品供动物攀爬,放置塑料管道、跑轮等供动物自主运动及探索,各种大小和颜色的球、积木供动物玩耍[1,7]。笼内物品每天一换,随机更换物品摆放的位置,保持新鲜感。食物和水可自由获取,偶尔给予葵花籽、馒头、红薯等,每笼可放置8~12只大鼠。b.“神养”笼尺寸同“形养”笼,笼内只放置垫料、食物、水,不放置诱发大鼠主动运动和探索的物品。每笼可放置8~12只大鼠。c.标准笼尺寸长、宽、高分别为44cm、32cm、20cm,每笼3~4只大鼠。笼内放置垫料、食物和水,笼内无其他设施。②大鼠术后休养3d,缺血丰富环境组被随机分为3组:“形养”组(IE1)(n=8)、“神养”组(IE2)(n=8)和“形神共养”组(IE3)(n=8)。IE1组居于“形养”笼中,每天入住4h(8:30~12:30),其余时间居于标准笼;IE2组居于“神养”笼中,每天入住4h(12:30~16:30),其余时间居于标准笼。IE3组大鼠先居于“形养”笼中4h(8:30~12:30),后居于“神养”笼中4h(12:30~16:30),其余时间居于标准笼[8]。SS组(n=9)及IS组(n=8)一直居住于标准笼中。
1.3 评定标准 ①Morris水迷宫实验:干预4周后,进行为期6d的水迷宫实验。水迷宫直径120cm,高60cm,平台直径9cm,高30cm,水面高出平台2cm,水温保持在(22±1)℃,实验时将适量墨汁倒入水池中搅匀,直至看不见水面下的平台[7,9]。定位航行实验,水迷宫随机划分为4个象限,将平台放置于其中一个象限中央。分别选取4个象限之间的交点作为A、B、C、D 4个入水点。a.第1~5天记录逃避潜伏期时,在实验开始时,将大鼠头部面向池壁,轻放入水池,直到大鼠找到平台并在平台上停留3s。记录大鼠寻找平台的时间,即逃避潜伏期。每次寻找平台的时间定为60s,如果大鼠在规定时间内找不到平台,用木棍引导大鼠找到平台,并学习20s后,将大鼠拿走。每只大鼠每天从4个不同象限入水训练各1次,两次训练间隔大于20min,取4次训练时间的平均值作为每天定位航行实验的逃避潜伏期;b.第6天测试空间探索实验,将平台移除,大鼠从原平台所在象限的对角线位置入水,记录30s内大鼠在原平台所在象限的时间。②免疫组织化学染色:水迷宫测试结束后大鼠称重,用10%水合氯醛(350mg/kg)腹腔注射麻醉后,迅速打开胸腔,充分暴露心脏,用50ml注射器针头插入左心室,剪开右心耳,经心脏快速灌注生理盐水100~150ml,再用4%的多聚甲醛溶液100~150ml进行灌注,先快后慢。灌注成功后立即断头取脑组织,冠状切取视交叉前2mm到视交叉后2mm组织块,浸泡于4%多聚甲醛固定液中,24h后进行脱水、浸蜡、石蜡包埋,切成4μm石蜡切片。采用Envision两步法进行免疫组化染色,免疫组化选用一抗为抗大鼠脑源性神经营养因子(Brain Derived Neurotrophic Factor,BDNF)兔多克隆抗体,二抗为辣根过氧化物酶标记的山羊抗兔IgG;染色标记的物质为脑源性神经生长因子发生抗原抗体反应后的阳性产物。染色完成后每个脑组织随机选取5张切片,在显微镜下(×200)分别于梗死灶周边区及海马齿状回(Dentate gyrus,DG)区随机选取3个不重叠视野摄片。采用专业图片分析软件Image-Pro Plus 6.0 系统进行图像分析,分别测定梗死灶周边皮质及海马DG区BDNF阳性反应产物的累积光密度值(Integrated Optical Density,IOD)。
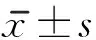

IE1组 IE2组 IE3组 IS组 SS组
图15组大鼠脑梗死灶周围皮质BDNF的表达(×200)

IE1组 IE2组 IE3组 IS组 SS组
图25组大鼠海马DG区BDNF的表达(×200)
2 结果
2.1 Morris水迷宫结果 各组组内5d训练的潜伏期随时间变化差异有统计学意义(F4,36=121.274,P<0.01),每个时间点各组间水迷宫训练的潜伏期差异有统计学意义(F4,36=4.877,P<0.01)。第1天,SS、IE3组大鼠在水迷宫中的逃避潜伏期比IE1、IE2、IS组大鼠短(均P<0.05);第4天,SS和IE3组大鼠的逃避潜伏期均比IS短(P<0.05,0.01);第5天,SS、IE1、IE3组逃避潜伏期均比IS组短(P<0.05,0.01),且IE1、IE3组与SS组之间无显著性差异。见表1。
第6天的水迷宫空间探索实验中,IE1、IE2、IE3、IS及SS组目标象限停留时间分别为9.58±2.96、8.97±1.29、9.70±2.24、5.94±1.70及11.82±2.19s,各组大鼠在对原平台的记忆方面差异有统计学意义(F4,36=5.131,P<0.05);IE1、IE2、IE3组大鼠均比IS组在目标象限停留的时间长(P<0.05,0.01);但是IE1、IE3组和SS组之间差异无显著性意义。

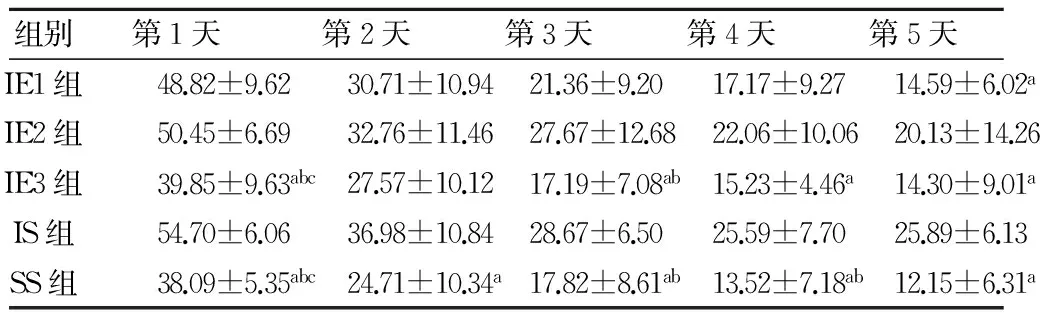
组别第1天第2天第3天第4天第5天IE1组48.82±9.6230.71±10.9421.36±9.2017.17±9.2714.59±6.02aIE2组50.45±6.6932.76±11.4627.67±12.6822.06±10.0620.13±14.26IE3组39.85±9.63abc27.57±10.1217.19±7.08ab15.23±4.46a14.30±9.01aIS组54.70±6.0636.98±10.8428.67±6.5025.59±7.7025.89±6.13SS组38.09±5.35abc24.71±10.34a17.82±8.61ab13.52±7.18ab12.15±6.31a
与同时间点IS组比较,aP<0.05;与同时间点IE2组比较,bP<0.05;与同时间点IE1组比较,cP<0.05
2.2 免疫组织化学检测结果 在光学显微镜下观察,大鼠脑梗死周边皮质及海马DG区均可见BDNF免疫组化阳性细胞,阳性细胞胞体呈圆形或椭圆形,胞核较大,胞浆呈棕黄色或深棕黄色。假手术组皮质及DG区也有表达,但表达相对较少。不同分组间BDNF蛋白的表达在梗死灶周围皮质及缺血侧海马DG部位差异均有统计学意义(F4,36=10.919,P<0.01;F4,36=21.349,P<0.01)。在梗死灶周围皮质部位IE1、IE2、IE3组BDNF蛋白的表达均比SS组高,且IE1、IE3组BDNF蛋白的表达比IS组高,IE3组BDNF蛋白的表达较IE1、IE2组高(均P<0.05)。在缺血侧海马DG部位,IE1、IE2、IE3组BDNF蛋白的表达均比IS、SS组高(均P<0.05),且IE1、IE3组的蛋白表达较IE2高(均P<0.05)。见图1,图2,表2。

组别n梗死周边皮质海马DGIE1组87763.33±803.12ab2745.39±435.224abcIE2组87357.92±642.89a2267.40±414.07abIE3组88724.95±636.53abcd3162.89±409.71abcIS组86597.07±981.491770.86±336.66SS组96306.96±603.971377.66±290.86
与SS组比较,aP<0.05;与IS组比较,bP<0.05;与IE2组比较,cP<0.05;与IE1组比较,dP<0.05
3 讨论
《黄帝内经》中的养生学十分重视形体与精神的整体调摄,“动以养形”是指运动可以促使人体气血充盈、使精气更加流通,能够增强人体生理的气化作用,提高人体抵抗疾病的能力。“静以养神”是指保持心情的宁静、舒畅、专一,能够使脏腑气机协调、通畅[2]。事实上人体完成任何一项动作,都是动与静的有机结合,只不过是从形式上看以哪一种方式为主。养形侧重于动,这里的“动”是指运动形体而言,顺应自然以利其形,调摄饮食养其形,运动锻炼强其形。“静”是相对的概念,不是绝对的静止,是指精神内敛而言。大鼠喜群居生活,有研究发现长期独居容易使动物产生焦虑感[10],独居大鼠与群居大鼠相比,更加容易激惹。也有研究表明,社会孤立产生的压力可能会导致皮质酮水平增加,而皮质酮可能会导致海马区神经元的损伤[11],从而加重缺血性脑损伤。实验中标准环境的特点是活动空间狭小、单调,各种刺激和活动训练很有限,再加上群体成员少,社会交往机会遭到剥夺。相反,丰富生存环境的活动空间较大,里面放置的物体丰富而新奇,群体成员较多,除了能够提供充分的多感官刺激、运动和社交刺激外,还能够为动物提供训练学习机会。
“形神共养”能够提高脑缺血大鼠空间学习能力及记忆能力,从而改善脑缺血大鼠的认知功能。实验中随着水迷宫的不断训练,大鼠可以通过周围环境中的空间线索形成对平台位置的记忆,寻找平台的逃避潜伏期逐渐缩短,这与Birch[12]的报道基本一致。在水迷宫实验的最后IE1组、IE3组与SS组差异不显著,水迷宫成绩几乎恢复到正常大鼠水平,而IS组大鼠学习记忆能力也随着训练的加强,有一定程度的改善,可能是脑缺血后功能自发性恢复的结果。
丰富环境作为影响脑可塑性的外界因素其分子机制在一定程度上归功于神经营养因子BDNF的作用。有研究认为脑缺血缺氧损伤后,BDNF及其受体TrkB基因表达增加,特别是在脑梗死灶周围皮质和海马区域更加突出[13-14]。本研究发现“形神共养”能促进梗死灶周边皮质和海马DG区BDNF的表达,有利于脑缺血大鼠运动功能以及认知功能的恢复。这与Gobbo等[15]的研究基本一致。大鼠脑缺血后缺血灶周围皮质、海马部位BDNF表达存在着一定的规律[16-17],也有研究显示BDNF在脑缺血后3d开始增高,7d后表达持续增强达高峰,30d后表达下降[18-19]。而BDNF在海马不同部位的表达也存在着一定差异:有研究发现脑缺血后BDNF在海马缺血耐受区域CA3、CA4以及DG区反而比缺血敏感区CA1表达高出很多[20]。可能是在脑缺血发生后,海马CA3、CA4以及DG区通过自身代偿作用,调节内源性BDNF的表达,从而促进了受损神经元的修复和再生。
由此可见,“形神共养”的丰富生存环境有利于促进局灶性脑缺血再灌注大鼠学习记忆能力的恢复,促进局灶性脑缺血再灌注大鼠梗死周边皮质和海马齿状回区BDNF的表达,从而促进脑缺血大鼠功能的恢复。其可能机制是“形神共养”的丰富的生存环境中的多样化的刺激和训练促进了大脑可塑性的变化,使神经系统的功能重组和代偿,且“形养”与“神养”相结合的“形神共养”方式在某些方面更优于单纯“形养”与“神养”。
[1] Nithianantharajah J, Hannan AJ. Enriched environments, experience-dependent plasticity and disorders of the nervous system[J]. Nat Rev Neurosci, 2006, 7(9): 697-709.
[2] 徐月英, 王喜涛. 《黄帝内经》中的运动养生思想及方法[J]. 沈阳体育学院学报, 2006, 25(2): 23-25.
[3] 张雪亮. 中医养生理论随想[J]. 中国中医基础医学杂志, 2004, 10(12): 55-56.
[4] 廖维靖, 刘淑红, 范明, 等. 线栓阻断大鼠大脑中动脉制作缺血性脑损伤模型的改良[J]. 中华物理医学与康复杂志, 2002, 24(6): 345-348.
[5] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[6] 刘云波. 实验动物安乐死若干问题[J]. 中国比较医学杂志, 2008, 18(2): 76-78.
[7] 孙慧敏. 丰富环境对慢性脑低灌注大鼠认知功能损害的影响[D]. 武汉: 武汉大学, 2010, 11-12.
[8] 张璇, 蔺俊斌, 王娟, 等. "形神共养"对脑缺血再灌注大鼠功能恢复和突触形态结构参数的影响[J]. 中国康复医学杂志, 2015, 30(11): 1105-1111.
[9] Zhu H, Zhang J, Sun H, et al. An enriched environment reverses the synaptic plasticity deficit induced by chronic cerebral hypoperfusion[J]. Neuroscience Letters, 2011, 50(2): 71-75.
[10] 李阔. 丰富环境对局灶性脑梗死大鼠行为学恢复及NF、GFAP、GAP-43表达的影响[D]. 石家庄: 河北医科大学, 2007, 155-157.
[11] Shih PC, Yang YR, Wang RY. Effects of exercise intensity on spatial memory performance and hippocampal synaptic plasticity in transient brain ischemic rats[J]. PLoS One, 2013, 8(10): 78-83.
[12] Birch AM, McGarry NB, Kelly AM. Short-term environmental enrichment, in the absence of exercise, improves memory, and increases NGF concentration, early neuronal survival, and synaptogenesis in the dentate gyrus in a time-dependent manner[J]. Hippocampus, 2013, 23(6): 437-450.
[13] Lee TH, Yang JT, Kato H, et al. Expression of brain-derived neurotrophic factor immunoreactivity and mRNA in the hippocampal CA1 and cortical areas after chronic ischemia in rats[J]. J Neurosci Res, 2004, 76(5): 705-712.
[14] 白蓉, 梁雪琴, 王魁花, 等. 康复训练对脑缺血大鼠行为学及BDNF、CaBP-D28k表达的影响[J]. 山东医药, 2012, 52(21): 33-35.
[15] Gobbo OL, O'Mara SM. Impact of enriched-environment housing on brain-derived neurotrophic factor and on cognitive performance after a transient global ischemia[J]. Behav Brain Res, 2004, 152(2): 231-241.
[16] Shono Y, Yokota C, Kuge Y, et al. Gene expression associated with an enriched environment after transient focal ischemia[J]. Brain Res, 2011, 137(1): 60-65.
[17] Taliyan R, Ramagiri S. Delayed neuroprotection against cerebral ischemia reperfusion injury: putative role of BDNF and GSK-3β[J]. J Recept Signal Transduct Res, 2015, 10(1): 1-9.
[18] 张三明, 鲁翔. BDNF在局部脑缺血大鼠的表达[J]. 江苏医药, 2008, 34(10): 1032-1033.
[19] Neumann JT, Thompson JW, Raval AP, et al. Increased BDNF protein expression after ischemic or PKC epsilon preconditioning promotes electrophysiologic changes that lead to neuroprotection[J]. J Cereb Blood Flow Metab, 2015, 35(1): 121-130.
[20] 李英平, 郭瑞芳, 李育臣, 等. 局灶性脑缺血大鼠海马区不同部位BDNF的表达及其意义[J]. 中国老年学杂志, 2004, 24(12): 1180-1182.

