猪圆环病毒2型诱导3D4/2细胞氧化应激模型的建立
尹 丹,谭红连,郝祝兵,杨 剑,韦英益,曾 芸,李 亮,廖玲玲*,胡庭俊*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西壮族自治区畜牧研究所,广西南宁 530001;3.广西柯新源原种猪有限责任公司,广西南宁 530001)
猪圆环病毒2型诱导3D4/2细胞氧化应激模型的建立
尹 丹1,谭红连1,郝祝兵1,杨 剑1,韦英益1,曾 芸1,李 亮2,3,廖玲玲2,3*,胡庭俊1*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西壮族自治区畜牧研究所,广西南宁 530001;3.广西柯新源原种猪有限责任公司,广西南宁 530001)
通过研究不同浓度猪圆环病毒2型(PCV2)对体外感染3D4/2细胞产生氧化应激水平的影响,来确定建立PCV2体外诱导3D4/2细胞氧化胁迫模型的条件。以5个不同浓度PCV2感染组(100、10-1、10-2、10-3、10-4)作用于3D4/2细胞2 h,弃去病毒液,加入含100 mL/L胎牛血清1640培养液后继续培养,于4、8、12、24、48 h分别收集细胞上清液或细胞,测定NO、ROS、GSH、GSSG、XOD、MPO和iNOS等指标。10-1PCV2感染3D4/2细胞24 h、48 h后显著升高细胞NO水平,感染4 h~24 h显著升高细胞ROS水平,降低细胞GSH水平和GSH/GSSG比值;10-1PCV2感染3D4/2细胞4 h、8 h显著升高细胞GSSG水平;10-1PCV2感染3D4/2细胞4、8、12、24 h均能显著升高细胞XOD、MPO、iNOS活力,提示10-1PCV2感染3D4/2细胞一定程度上改变了细胞氧化还原状态,诱导了细胞产生氧化应激,而病毒感染后48 h未检测到PCV2核酸。表明PCV2感染后4 h~24 h能诱发3D4/2细胞氧化应激,选择10-1PCV2作为氧化应激模型的感染剂量。
猪圆环病毒2型;猪肺泡巨噬细胞;氧化应激
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是断奶仔猪多系统衰竭综合征(Postwea-ning mutisystenic wasting syndrome,PMWS)的主要致病原,已成为影响全球养猪业的重大疫病,给养猪业带来了巨大的经济损失。PCV2复制的主要场所是机体的单核-巨噬细胞和抗原递呈细胞,PCV2感染后,病猪体内肺、肝、肾、扁桃体、胸腺、外周血单核细胞、支气管淋巴结、腹股沟淋巴结中均能检测到PCV2核酸[1]。PCV2感染主要表现为淋巴细胞缺失和单核细胞浸润等,引起猪的免疫系统的破坏,免疫能力受到抑制。PCV2感染后诱导了B淋巴细胞的凋亡,使细胞减少,进而抗原递呈的树突细胞数量减少,T细胞无法识别抗原,从而引起免疫抑制[2]。氧化应激(oxidative stress)是指细胞内氧化和抗氧化系统失衡,导致活性氧自由基(reactive oxy-gen species,ROS)产生速率大于清除速率,从而引起细胞和组织损伤的一种病理状态。氧化损伤主要包括生物膜脂质过氧化、细胞内蛋白及酶活性、DNA损伤、最后导致细胞死亡或凋亡,并引发疾病[3]。近年来研究发现,病毒感染是引发多种动物疾病的直接原因,并与自由基堆积导致的氧化损伤密切相关。一方面,病毒感染引起细胞活性氧自由基的累积;另一方面,病毒感染后,吞噬细胞活化并释放氧化性细胞因子,如TNF-α和IL-1β等。相关研究结果表明,部分病毒在感染动物机体和在动物机体内复制的过程中,会破坏宿主细胞的氧化还原状态的平衡,而宿主细胞氧化还原状态的改变反过来也能影响病毒的感染和复制。Gray P等[4]研究发现,PCV2感染PK-15细胞能促进ROS的产生,诱导细胞产生氧化应激,而ROS的产生反过来促进了PCV2的复制。
为了探讨PCV2感染是否能引起免疫细胞氧化还原状态的改变,本试验通过PCV2体外感染猪肺泡巨噬细胞系3D4/2细胞,测定感染细胞分泌一氧化氮(NO)的水平、活性氧(ROS)水平、还原型谷胱甘肽(GSH)含量、黄嘌呤氧化酶(XOD)活性、髓过氧化物酶(MPO)活性、诱生型一氧化氮合酶(iNOS)活性,初步探讨PCV2感染量、感染时间与活性氧水平动态变化的相关性,建立3D4/2细胞氧化胁迫体外模型。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞 猪圆环病毒2型(SH株),南京农业大学农业部动物疫病诊断与免疫重点开放实验室分离保存,经PK-15细胞增殖后测得病毒滴度为104TCID50/0.1mL;猪肾传代细胞系PK-15细胞、猪肺泡巨噬细胞系3D4/2细胞,广西大学动物科学技术学院预防兽医学教研室提供。
1.1.2 主要试剂 南美洲胎牛血清、DMEM高糖培养液,美国Gibco公司产品;黄嘌呤氧化酶(XOD)检测试剂盒、髓过氧化物酶(MPO)检测试剂盒、诱生型一氧化氮合酶(iNOS)检测试剂盒,南京建成生物工程研究中心产品;噻唑蓝、邻苯二甲醛(OPT)、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG),北京索莱宝科技有限公司产品;萘乙烯二胺,国药集团化学试剂有限公司产品;对氨基苯磺酸,天津福晨化学试剂。
1.1.3 主要仪器 UV1750型紫外可见光分光光度计,日本岛津公司产品;Multimode Plate Reader多功能酶标仪,瑞士Perkin Elme公司产品;S1000梯度PCR仪,美国Bio-Rad公司产品;C150细胞培养箱,德国BINDER公司产品;TS100-F倒置显微镜,日本尼康公司产品。
1.2 方法
1.2.1 细胞分离培养及分组处理
1.2.1.1 细胞的分离培养 3D4/2细胞复苏后用含100 mL/L胎牛血清1640培养液转入瓶中,于37℃、体积分数为5%的CO2培养箱中培养,并进行传代培养后,调节细胞浓度为1×106cell/mL铺于24孔板,每孔1 mL,37℃、体积分数为5%的CO2培养贴壁,弃上清,分别加入PCV2 200 μL,37℃、体积分数为5%的CO2孵育2 h,PBS洗2遍,加入100 mL/L胎牛血清1640培养液培养4、8、12、24、48 h。细胞处理后弃上清,PBS洗3次,收集细胞,反复冻融4次~5次,按照苯酚-氯仿法提取DNA,通过PCR扩增检测病毒核酸。
1.2.1.2 试验分组及处理 分别设置细胞对照组和5个不同浓度PCV2感染组(100、10-1、10-2、10-3、10-4),调整细胞浓度为5×106个/mL,按1 000 μL/孔加至24孔板内,细胞对照组加入无血清1640培养液200 μL,病毒组加入等量同浓度病毒液,37℃、体积分数为5%的CO2培养箱中吸附2 h,弃去病毒液,PBS清洗3次后,每孔加入1 mL含50 mL/L胎牛血清1640培养液后继续培养,于4、8、12、24、48 h分别收集细胞上清液或细胞,用于NO、ROS、GSH、GSSG、XOD、MPO和iNOS等指标测定。
1.2.2 MTT法检测细胞活性 细胞培养44 h后吸出110 μL上清,加入10 μL 5 g/L MTT继续培养,4 h后弃上清,加入100 μL DMSO,室温避光静置10 min,酶联免疫检测仪检测OD 450 nm值。
1.2.3 Griess法检测上清中NO含量 细胞分别培养4、8、12、24 h后,收集细胞上清100 μL,加入100 μL Griess试剂,室温避光反应10 min,酶联免疫检测仪检测OD 450 nm值,根据NaNO2标准曲线计算NO含量。
1.2.4 DCFH-DA荧光探针检测细胞内ROS水平 细胞分别培养4、8、12、24、48 h,弃上清,每孔加入500 μL 10 μmol/L DCFH-DA荧光探针,孵育30 min后弃上清,PBS洗3次,再加入1 000 μL PBS,收集细胞200 μL于96孔黑板中,于荧光酶标仪测定其荧光值(激发波长488 nm,发射波长525 nm)。
1.2.5 OPT荧光法检测细胞内氧化还原状态 细胞处理后分别于4、8、12、24、48 h后收集细胞,加入0.05 g/mL三氯醋酸400 μL,冰水浴超声破碎1 min,4℃、12 000 r/min离心15 min,取上清分装于-80℃保存。
GSH测定:取200 μL上清加入3.6 mLPBS-EDTA缓冲液(pH8.0)和200 μL OPT,混匀室温孵育40 min,于荧光酶标仪测定激发波长350 nm,发射波长425 nm处荧光值,并根据标准曲线计算含量。
GSSG测定:取100 μL上清加入40 μL NEM(0.04 mol/L)室温孵育30 min,再加入1.9 mL NaOH(0.1 mol/L)和100 μL OPT(1 mg/mL),混匀,室温孵育15 min,于荧光酶标仪测定激发波长337.8 nm,发射波长421.6 nm处荧光值,并根据标准曲线计算含量。
1.2.6 分光光度法检测细胞内XOD、MPO及iNOS活性 细胞处理后,分别于4、8、12、24、48 h后弃上清,分别收集细胞,2 000 r/min离心5 min,弃上清,PBS洗3次,再加入500 μL PBS,超声破碎,10 000 r/min离心10 min,取上清液,用于XOD、MPO及iNOS活性的检测,严格按照XOD、MPO、iNOS测定试剂盒说明进行操作。
1.2.7 数据分析 试验数据采用SSP18.0统计软件进行单因素方差分析(One-Way ANOVA),并用LSD法进行两两比较。肩标*表示与细胞对照组相比差异显著(P<0.05),肩标**表示与细胞对照组相比差异极显著(P<0.01)。
2 结果
2.1 PCV2感染3D4/2细胞的结果
PCV2感染3D4/2细胞8 h、12 h后经PCR扩增,可见特异性片段,感染后24 h、48 h所得特异性片段较弱,而感染后4 h未见特异性片段(图1)。结果表明PCV2能成功感染3D4/2细胞。

M.DNA 标准DL 2 000;1,2.4 h;3,4.8 h;5,6.12 h;7,8.24 h;9,10.48 h;11.阳性对照
M.DNA Marker DL 2 000;1,2.4 h;3,4.8 h;5,6.12 h;7,8.24 h;9,10.48 h;11.Positive control
图1 PCR检测3D4/2细胞中PCV2 DNA结果
Fig.1 The results of PCV2 DNA in 3D4/2 cells detected by PCR
2.2 不同浓度PCV2体外感染对3D4/2细胞活性的影响
PCV2原液(100PCV2)感染3D4/2细胞,可明显降低细胞活性,与细胞对照组相比差异显著(P<0.05);其余各浓度的PCV2感染3D4/2细胞组,细胞活性均有一定程度降低,但与细胞对照组相比差异不显著(P>0.05)(图2)。
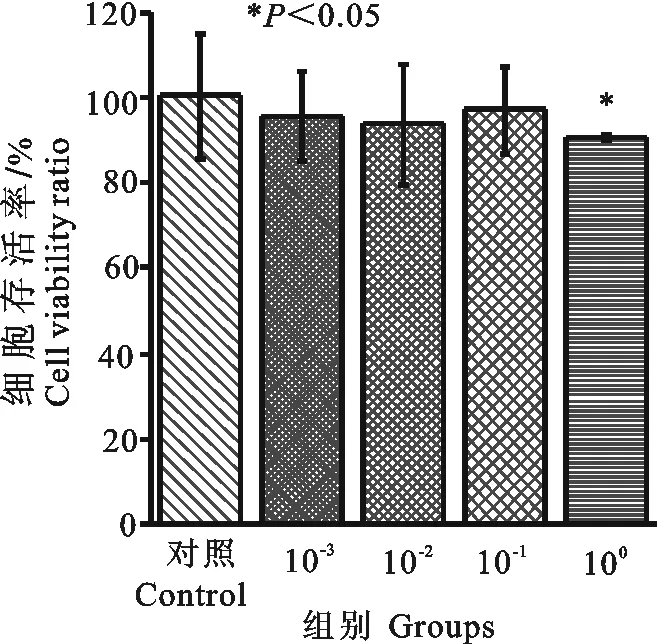
图2 PCV2感染对3D4/2细胞存活率的影响
2.3 不同浓度PCV2体外感染3D4/2细胞对NO分泌的影响
10-1PCV2感染3D4/2细胞12 h,可升高细胞分泌NO水平,与细胞对照组比较差异显著(P<0.05);其余浓度PCV2感染,均能一定程度升高感染细胞分泌NO水平,但与细胞对照组相比差异不显著(P>0.05)(图3)。结果表明,PCV2感染3D4/2细胞,能促进细胞分泌NO。
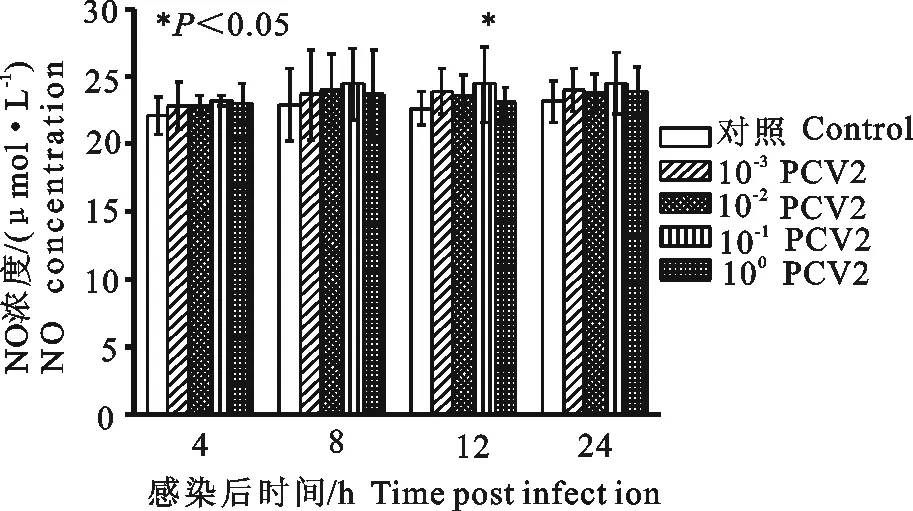
图3 PCV2感染3D4/2细胞对NO分泌的影响
2.4 不同浓度PCV2体外感染3D4/2细胞对ROS产生的影响
PCV2感染3D4/2细胞4、8、12、24 h后,ROS水平随时间逐渐升高。PCV2原液感染细胞8、12、24 h,可升高细胞内ROS水平,与细胞对照组比较差异显著或极显著(P<0.05或P<0.01);10-1PCV2感染3D4/2细胞4、8、12、24 h,均能升高细胞内ROS水平,与细胞对照组比较差异显著或极显著(P<0.05或P<0.01)(图4)。
2.5 PCV2体外感染3D4/2细胞对细胞内氧化还原状态的影响
10-1PCV2感染3D4/2细胞4、8、12、24 h后,可降低细胞内GSH水平,与细胞对照组比较差异极显著(P<0.01);10-2PCV2感染12 h、24 h后,可降低细胞内GSH水平,与细胞对照组比较差异极显著(P<0.01),感染后8 h降低细胞内GSH水平,与细胞对照组比较差异显著(P<0.05);10-3PCV2感染3D4/2细胞12 h、24 h后,可降低细胞内GSH水平,与细胞对照组比较差异极显著(P<0.01)(图5)。
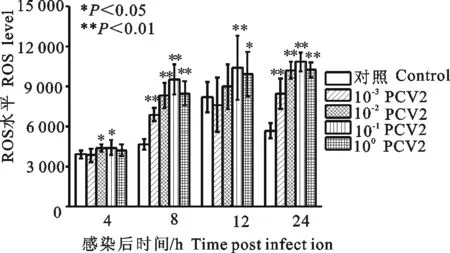
图4 PCV2感染3D4/2细胞对ROS产生的影响
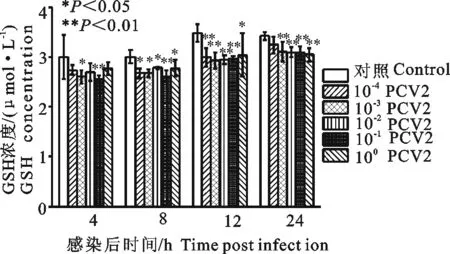
图5 PCV2感染3D4/2细胞对细胞内GSH的影响
10-1PCV2感染3D4/2细胞4、12、24 h,可升高细胞内GSSG水平,感染4 h、12 h的升高水平与细胞对照组比较差异极显著(P<0.01),感染24 h升高水平,与细胞对照组比较差异显著(P<0.05);100PCV2感染3D4/2细胞24 h,可升高细胞内GSSG水平,与细胞对照组比较差异显著(P<0.05);10-2PCV2感染3D4/2细胞4 h,可升高细胞内GSSG水平,与细胞对照组比较差异显著(P<0.05)(图6)。
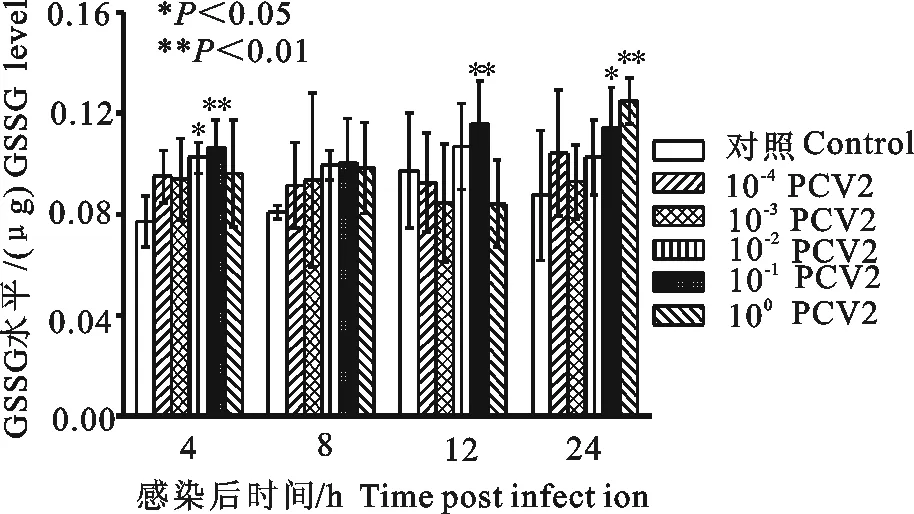
图6 PCV2感染3D4/2细胞对细胞内GSSG的影响
100PCV2感染3D4/2细胞4 h、24 h,可降低感染细胞内GSH/GSSG比值,与细胞对照组比较差异显著或极显著(P<0.05或P<0.01);10-1PCV2感染3D4/2细胞4、8、12、24 h,可降低感染细胞内GSH/GSSG比值,感染4 h、24 h时GSH/GSSG比值与细胞对照组比较差异极显著(P<0.01),感染8 h、12 h GSH/GSSG比值与细胞对照组比较差异显著(P<0.05);10-2PCV2感染3D4/2细胞4、8、24 h后,可降低感染细胞内GSH/GSSG比值,与细胞对照组比较差异极显著(P<0.01)(图7)。
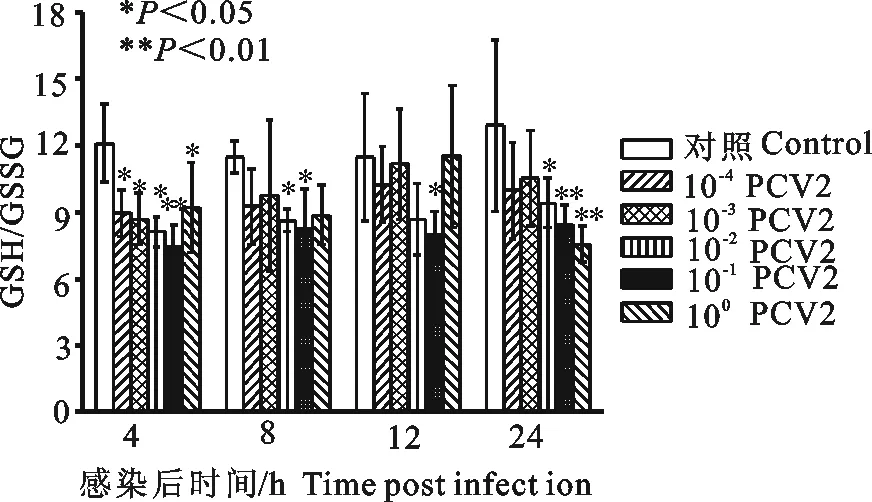
图7 PCV2感染3D4/2细胞对细胞内GSH/GSSG的影响
2.6 不同浓度PCV2感染3D4/2细胞对XOD活性的影响
10-1PCV2感染3D4/2细胞4、8、12 h,可升高感染细胞XOD活力,与细胞对照组比较差异显著或极显著(P<0.05或P<0.01);10-2PCV2感染3D4/2细胞8 h,可升高感染细胞XOD活力,与细胞对照组比较差异显著(P<0.05)(图8)。

图8 PCV2感染3D4/2细胞对细胞XOD活力的影响
2.7 不同浓度PCV2感染3D4/2细胞对MPO活性的影响
100PCV2感染3D4/2细胞4 h、12 h,可升高感染细胞MPO活力,与细胞对照组比较差异显著(P<0.05);10-1PCV2感染3D4/2细胞4、8、12 h,可升高感染细胞XOD活力,与细胞对照组比较差异极显著(P<0.01);10-2PCV2感染3D4/2细胞24 h,可升高感感染细胞XOD活力,与细胞对照组比较差异显著(P<0.05)(图9)。
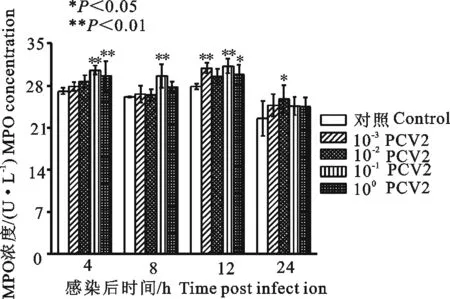
图9 PCV2感染3D4/2细胞对细胞MPO活力的影响
2.8 不同浓度PCV2感染3D4/2细胞对iNOS活性的影响
100PCV2感染3D4/2细胞4、12、24 h,可升高感染细胞iNOS活力,与细胞对照组比较差异显著(P<0.05);10-1PCV2感染3D4/2细胞4、8、12 h,可升高感染细胞iNOS活力,与细胞对照组比较差异显著或极显著(P<0.05或P<0.01);10-2PCV2感染3D4/2细胞12 h、24 h,可升高感染细胞iNOS活力,与细胞对照组比较差异显著(P<0.05)(图10)。
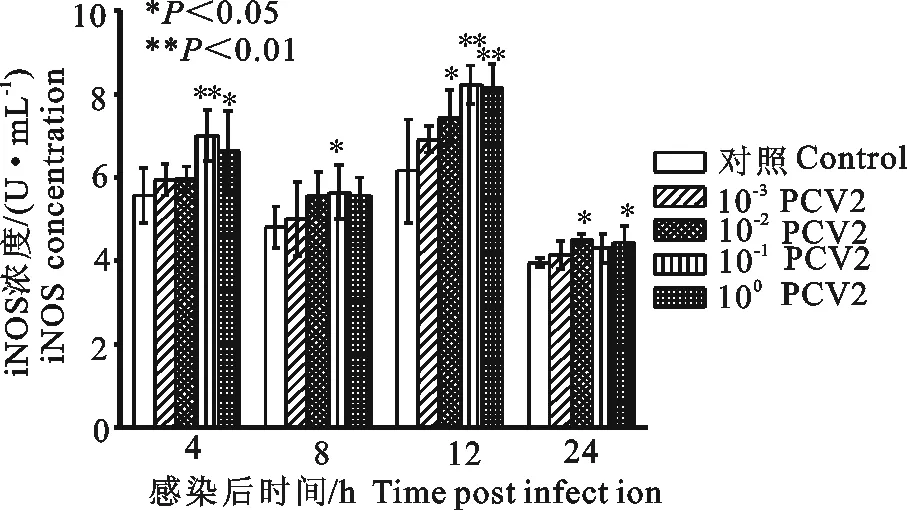
图10 PCV2感染3D4/2细胞对细胞iNOS活力的影响
3 讨论
巨噬细胞的吞噬作用是机体清除外来微生物入侵并参与炎症反应的一个免疫应答过程,猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)和其他单核巨噬细胞能抵抗各种病原体的感染,在先天性免疫和获得性免疫中都起着重要的作用,是肺脏初级防御的重要免疫细胞,又是PCV2感染的重要靶细胞[5-6]。PMWS患猪肺部的损伤程度与猪肺泡巨噬细胞感染PCV2有关[7-8]。3D4/2细胞作为猪肺泡巨噬细胞系,携带SV40大T抗原,经转染PSV3-neo,质粒携带新霉素抗性基因,含有SV40病毒DNA序列,常用于猪病毒学及免疫学研究。相关研究表明,3D4/2细胞对牛腺病毒、猪瘟病毒、人副流感病毒、水疱性口炎病毒、猪腺病毒、单纯疱疹病毒1、非洲猪瘟病毒、伪狂犬病病毒、牛痘病毒、猪水疱病病毒等均易感[9-10]。但PCV2是否能成功感染3D4/2细胞尚未见报道。为了观察PCV2是否能感染猪肺泡巨噬细胞系3D4/2细胞,本研究利用PCV2与3D4/2细胞共同培养2 h后,洗净PCV2,3D4/2细胞进行培养,利用PCR扩增,琼脂糖凝胶电泳观察PCV2特异性扩增条带。结果显示,病毒感染后8 h~48 h均可检测到特异性条带,提示PCV2成功感染3D4/2细胞。为了探讨不同剂量的PCV2感染3D4/2细胞不同时间,对3D4/2细胞内氧化还原状态是否有影响,本文观察了PCV2感染3D4/2细胞后对细胞NO、ROS、GSH、GSSG水平及MPO、XOD、iNOS活力的影响。结果表明,10-1PCV2感染3D4/2细胞12 h后,可显著升高细胞分泌NO水平、感染3D4/2细胞4 h~24 h,可显著升高细胞ROS水平、降低细胞GSH水平和GSH/GSSG比值;10-1PCV2感染3D4/2细胞4、12、24 h,可显著升高细胞GSSG水平;10-1PCV2感染3D4/2细胞4、8、12 h,可显著升高细胞XOD、MPO、iNOS活力,提示10-1PCV2能成功感染3D4/2细胞,且一定程度上改变了细胞氧化还原状态,诱导细胞产生氧化应激。
综上所述,本研究采用PCV2成功诱导3D4/2细胞发生了氧化应激,并且确立10-1PCV2体外感染3D4/2细胞4 h~24 h,是建立3D4/2细胞氧化胁迫模型的最佳条件。该模型能够进一步应用于PCV2感染与3D4/2氧化应激相关的研究,可为PCV2的感染机制和治疗方法研究提供参考。
[1] Yu S,Opriessnig T,Kitikoon P,et al.Porcine circovirus type 2 (PCV2) distribution and replication in tissues and immune cells in early infected pigs[J].Vet Immunol Immunopathol,2007,115(3-4):261-272.
[2] Mandrioli L,Sarli G,Panarese S,et al.Apoptosis and proliferative activity in lymph node reaction in postweaning multisystemic wasting syndrome (PMWS)[J].Vet Immunol Immunopathol,2004,97(1-2):25-37.
[3] Malhotra J D,Kaufman R J.ER and oxidative stress: implications in disease[J].Intercell Signal Develop Dis:Cell Signal Collec,2011,1(2):447.
[4] Gray P,Scott S K.Reactive oxygen species regulate the replication of porcine circovirus type 2 via NF-κB pathway[J].Virology,2012,426(1):66-72.
[5] Rosell C,Segalés J,Plana-Durán J,et al.Pathological,immunohistochemical,and In-situ hybridization studies of natural cases of postweaning multisystemic wasting syndrome (PMWS) in pigs[J].J Compara Pathol,1999,120(1):59-78.
[6] Review P C A.Porcine circoviruses:a review[J].J Vet,2000,12(1):3-14.
[7] Sirinarumitr T,Sorden S D,Morozov I,et al.Double in situ hybridization for simultaneous detection of porcine reproductive and respiratory syndrome virus (PRRSV) and porcine circovirus (PCV)[J].J Vet,2001,13(1): 68-71.
[8] Gilpin D F,Mccullough K,Meehan B M,et al.Invitrostudies on the infection and replication of porcine circovirus type 2 in cells of the porcine immune system[J].Vet Immunol Immunopathol,2003,94(3-4):149-161.
[9] Lim J C,Weisman J.Biosafety procedures in cell culture[J].Meth Cell Sci,1988,11(4):223-227.
[10] Weingartl H M,Sabara M,Pasick J,et al.Continuous porcine cell lines developed from alveolar macrophages:Partial characterization and virus susceptibility[J].J Virol Meth,2002,104(2):203-216.
Establishment of Oxidative Stress Model of 3D4/2 Cells Induced by PCV2 inVitro
YIN Dan1, TAN Hong-lian1, HAO Zhu-bing1, YANG Jian1, WEI Ying-yi1, ZENG Yun1, LI Liang2,3, LIAO Ling-ling2,3, HU Ting-jun1
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530005,China; 2.GuangxiInstituteofAnimalHusbandry,Nanning,Guangxi,530001,China;3.GuangxiKeXinyuanLimitedLiabilityCompanyofOriginalBreeding,Nanning,Guangxi,530001,China)
The study was carried out to establish a oxidative stress model induced by PCV2invitro.The 3D4/2 cells were incubated with different concentrations of PCV2 to investigate the levels of oxidative stress in the cells.3D4/2 cells were incubated with PCV2 at dose of 100,10-1,10-2,10-3or 10-4.The supernatant or cells were collected at different time to observe the levels of NO,ROS,GSH,GSSG,cell viability,and the activities of XOD,MPO,iNOS.The level of NO in 3D4/2 cells infected with 10-1PCV2 was significantly increased after 24 h,48 h,and the levels of ROS,GSSG and the activities of XOD,MPO,iNOS were significantly upregulated post infection.These findings suggested that PCV2 infection changed the redox state of 3D4/2 cells and induced 3D4/2 cells to be in state of oxidative stress.PCV2 infection induced oxidative stress in 3D4/2 cells,and 10-1PCV2 was selected as the infection dose of oxidative stress model,the infection time was determined to be 4 h-24 h.
PCV2;porcine alveolar macrophage;oxidative stress
2016-07-10
国家自然科学基金项目(31260619);高等学校博士学科点专项科研基金博导类资助项目(20134501110004);国家科技支撑计划项目(2014BAD13B0102)
尹 丹(1990-),女,贵州赫章人,硕士研究生,主要从事中药药理学研究。*通讯作者
S852.659.2;S852.33
A
1007-5038(2017)03-0016-06

