羊传染性脓疱病毒CEV112基因的克隆与原核表达
杨小健,李亚颖,庞 峰,李国华,彭冬梅,朱 姝,聂 鑫,曹瑞勇,王凤阳,杜 丽
(海南大学热带农林学院,海南省热带动物繁育与疫病研究重点实验室,海口市动物基因工程重点实验室,海南海口 570228)
羊传染性脓疱病毒CEV112基因的克隆与原核表达
杨小健,李亚颖,庞 峰,李国华,彭冬梅,朱 姝,聂 鑫,曹瑞勇,王凤阳,杜 丽*
(海南大学热带农林学院,海南省热带动物繁育与疫病研究重点实验室,海口市动物基因工程重点实验室,海南海口 570228)
为了克隆羊传染性脓疱病毒CEV112基因并对其进行原核表达,根据GenBank中CEV112基因序列信息设计1对引物,以CEV基因组为模板,采用PCR扩增出1条大小为867 bp的CEV112基因,将其连接到pMD20-T载体上,构建pMD20-T-CEV112重组质粒,转化到大肠埃希菌(E.coli)DH5α感受态细胞中,提取质粒进行酶切鉴定。鉴定正确后构建重组质粒pET28a-CEV112,转化到E.coliBL21(DE3)感受态细胞中。经IPTG诱导表达,表达产物用SDS-PAGE和Western blot进行分析。结果表明,成功构建了pET-28a-CEV112原核表达载体,并在E.coliBL21(DE3)中表达了CEV112基因,表达的融合蛋白大小约36 ku,且主要以包涵体形式存在,为后续开展CEV112基因的功能研究奠定了基础。
羊传染性脓疱病毒;CEV112基因;克隆;原核表达
羊传染性脓疱(Contagious ecthyma,CE)俗称羊口疮,是由羊传染性脓疱病毒(CE virus,CEV)引起的山羊、绵羊的接触性、嗜上皮性人兽共患传染病[1]。临床上主要以感染动物的唇、鼻孔、口腔黏膜、乳房、阴部等部分皮肤形成红斑、水疱、脓疱、丘疹和疣状痂皮为特征[2]。
CEV属于痘病毒科(Poxviridae),副痘病毒属(Parapoxvirus),该病毒基因组大小为130 kb~150 kb,含有16个开放阅读框,编码132个基因,CEV112基因位于病毒基因组反向末端重复序列区[3-5]。CEV112基因编码一种趋化因子结合蛋白(chemokine binding protein,CBP),在病毒复制的早期,该蛋白能够有效地结合趋化因子,阻止趋化因子与相应的受体作用[6]。CEV-CBP拥有结合CC型炎症趋化因子的能力,从而抑制单核-巨噬细胞、T淋巴细胞向炎症部位聚集,而其他痘病毒则不能。此外,CEV-CBP还能与C型趋化因子结合,进而抑制中性粒细胞、T淋巴细胞、B淋巴细胞向炎症部位聚集[7],但是,CEV-CBP的具体作用机制尚不完全清楚。本试验成功克隆表达了CEV112基因,为进一步深入开展CEV-CBP的功能研究夯实了基础。
1 材料与方法
1.1 材料
1.1.1 菌株 CEV基因组提取自CEV HCE弱毒株,由本实验室保存;E.coliDH5α和E.coliBL21(DE3)感受态细胞,由本实验室氯化钙法制备。
1.1.2 载体及主要试剂 质粒提取试剂盒,中科瑞泰(北京)有限公司产品;胶回收试剂盒、T-Verctor、BamHⅠ和Hind Ⅲ限制性内切酶,宝生物工程(大连)有限公司;T4 DNA ligase,Thermo Fisher公司产品;兔抗His多克隆抗体,Merck公司产品;HRP标记的羊抗兔IgG,InvitrogenTM公司产品;ECM of Western blot检测试剂盒,博士德生物公司产品。
1.1.3 主要仪器 超净工作台,苏州安泰空气技术有限公司产品;PCR仪、生物分光光度计、小量高速离心机,德国Eppendorf公司产品;凝胶成像分析系统,美国BIO-RAD公司产品;全自动高压蒸汽灭菌锅,日本SANYO公司产品;电泳仪,北京市六一仪器厂产品;电热恒温培养箱,上海精宏实验设备有限公司产品;超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品。
1.2 方法
1.2.1 引物设计合成 从NCBI网站的GenBank中查到CEV的基因组序列(GenBank登录号:AY386264.1),根据CEV基因组中CEV112基因编码框DNA序列,利用DNAMAN软件设计1对引物,送上海生工生物工程技术服务有限公司合成。
上游引物CEV112-F:5′ -GCGCAAGCTTATGAAGGTGGTGTTGTTGCTAGTG-3′ (下划线部分是添加的Hind Ⅲ酶切位点);下游引物CEV112-R:5′ -CATGGGATCCTCAATGGCCAGGGCTGAGGTTAAG-3′ (下划线部分是添加的BamHⅠ酶切位点)。
1.2.2 CEV112基因的克隆 以提取CEV基因组的DNA为模板,以CEV112-F/CEV112-R为引物配制PCR反应体系,按以下程序进行PCR反应:94℃ 3 min;94℃ 30 s,63℃ 30 s,72℃ 1 min,29个循环;72℃ 5 min,16℃结束反应。待PCR反应结束后,进行琼脂糖凝胶检测并回收目的基因片段。将回收产物连接到pMD20-T载体上,构建重组质粒pMD20-T-CEV112,连接体系及反应条件为:载体pMD20-T 1 μL,目的片段3 μL,ddH2O 1 μL,SolutionⅠ 5 μL,混匀后,4℃过夜连接。将重组质粒转化到E.coliDH5α感受态细胞中,挑取阳性克隆菌落,37℃过夜摇菌,提取质粒进行酶切鉴定。
1.2.3 重组质粒pET-28a-CEV112的构建 参照史巧芸等[8]的方法,构建pET-28a-CEV112重组质粒,首先用Hind Ⅲ和BamHⅠ分别对酶切鉴定正确的pMD20T-CEV112重组质粒与pET-28a(+)空载体进行双酶切,酶切产物用琼脂糖凝胶电泳进行检测,检测正确后用胶回收试剂盒回收酶切片段。将经双酶切回收的CEV112基因与pET-28a(+)用T4 DNA ligase连接,22℃连接1 h以上,把连接产物转化到E.coliBL21(DE3)受体菌,挑取单菌落,37℃过夜摇菌,提取质粒进行酶切鉴定,并将鉴定正确的质粒送上海生工生物工程技术服务有限公司测序。
1.2.4 CEV112基因的原核表达与鉴定 参照赵天靖等[9]的方法进行原核表达及鉴定。将鉴定正确的阳性单菌落和含空载体的pET28a(+)单菌落分别接种于含卡那霉素的3 mL LB液体培养基中,37℃、220 r/min过夜振荡培养。次日,按1∶100的比例将其分别转接至含卡那霉素的20 mL LB液体培养基中扩大培养,待菌液OD 600 nm达到0.5~0.6时,分别吸出1 mL菌液作为诱导前对照,剩余菌液分别加入IPTG至最适浓度1 mmol/L,继续培养5 h后分别取1 mL菌液。将收集的菌液离心收集沉淀,尽量吸除上清,在沉淀中加入20 μL DTT和80 μL 2×SDS上样缓冲液,充分吹打混匀,沸水煮沸10 min,冰上放置5 min,12 000 r/min,高速离心5 min,取上清。以未用IPTG诱导的菌体为对照,对诱导产物进行SDS-PAGE检测。
1.2.5 融合蛋白CEV-CBP的可溶性分析 收集10 mL IPTG诱导表达的重组菌菌液,4℃、4 000 r/min离心10 min,收集湿菌,用5 mL 1×TE悬浮湿菌,加入50 μL溶菌酶至终浓度为0.1 mg/mL,4℃放置30 min。将悬浮细菌置于冰浴中进行超声破碎,直至破碎菌液清亮,低温离心破碎菌液,分别收集上清和沉淀,取样进行SDS-PAGE电泳,以确定重组菌是否为可溶性表达。
1.2.6 融合蛋白CEV-CBP的Western blot鉴定 将诱导产物进行SDS-PAGE后,转移至硝酸纤维素薄膜上,用含50 g/L脱脂牛奶粉的TBS室温静置封闭2 h,之后先用兔抗His多克隆抗体(1∶2 000稀释)在室温下孵育2 h,再用HRP标记的羊抗兔IgG(1∶5 000稀释)在室温下孵育1.5 h,最后用ECM of Western blot检测试剂盒显色检测。
2 结果
2.1 CEV112基因PCR结果
利用所设计的引物,以CEV基因组为模板,对CEV112基因进行PCR扩增,用琼脂糖凝胶电泳分析,在867 bp处出现特异条带(图1),说明CEV112基因成功扩增。
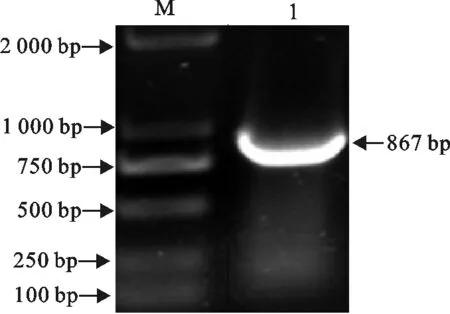
M.DNA 标准DL 2 000;1.CEV112基因的PCR产物
M.DNA Marker DL 2 000;1.PCR production of CEV112 gene
图1 PCR扩增CEV112基因
Fig.1 PCR amplification of CEV112 gene
2.2 重组质粒pET28a-CEV112的酶切鉴定
构建重组质粒pET28a-CEV112,转化到E.coliBL21(DE3)感受态细胞中,提取重组质粒,BamHⅠ和Hind Ⅲ双酶切该重组质粒,得到867 bp片段(图2),与目的基因片段大小一致,经上海生工生物工程技术服务有限公司测序结果显示,目的基因成功连入表达载体。
2.3 重组质粒pET28a-CEV112表达产物的SDS-PAGE分析
含阳性质粒的重组菌株用IPTG诱导表达,表达产物用SDS-PAGE电泳检测目的蛋白。CEV112基因编码289个氨基酸,该目的蛋白分子质量为31.41 ku,加上载体上His-tag,预计大小约为36 ku,SDS-PAGE电泳检测结果证实了这一预测,目的条带约为36 ku(图3)。
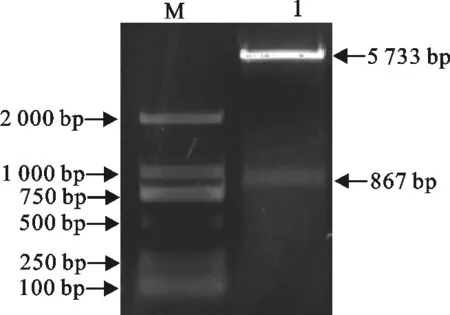
M.DNA 标准DL 2 000;1.重组质粒pET28a-CEV112用Hind Ⅲ和BamHⅠ酶切
M.DNA Marker DL 2 000;1.Recombinant plasmid pET28a-CEV112 digested withHind Ⅲ andBamHⅠ
图2 重组质粒pET28a-CEV112双酶切鉴定
Fig.2 Identification of recombinant plasmid pET28a-CEV112 by double enzyme digestion
2.4 融合蛋白CEV-CBP的可溶性分析
收集IPTG诱导表达的菌体,经超声波破菌处理后对沉淀和上清进行SDS-PAGE分析,结果发现,融合蛋白CEV-CBP存在于沉淀里(图4),以包涵体的形式存在。
2.5 融合蛋白CEV-CBP的Western blot鉴定
将SDS-PAGE分离后的蛋白条带电转印到PVDF膜上,进行Western blot检测。ECM显色后,在分子质量约为36 ku处有一条特异性抗体结合带(图5),说明目的蛋白表达正确。
3 讨论
CE分布广泛,全世界有养羊的国家几乎均有该病发生的报道,近年来随着全国各地肉羊产业的发展,该病呈暴发趋势,给我国养羊业带来了巨大的经济损失[10]。该病主要是通过损伤的皮肤和黏膜感染传播,可以感染羊以外的其他动物,现已有猫和家养驯鹿被感染的报道[11-12]。目前,已对CEV的基因结构和功能、免疫逃避的分子机制、新型疫苗等方面进行了大量研究,取得了显著进展,但是,由于CEV免疫的特殊性,迄今还没有安全、高效的CEV疫苗问世,而当前用于预防CE的疫苗主要是弱毒疫苗。随着研究的深入,发现CEV112基因编码的CBP具有阻止趋化因子与相应受体结合的作用,在CEV免疫逃避机制中发挥着重要的作用。
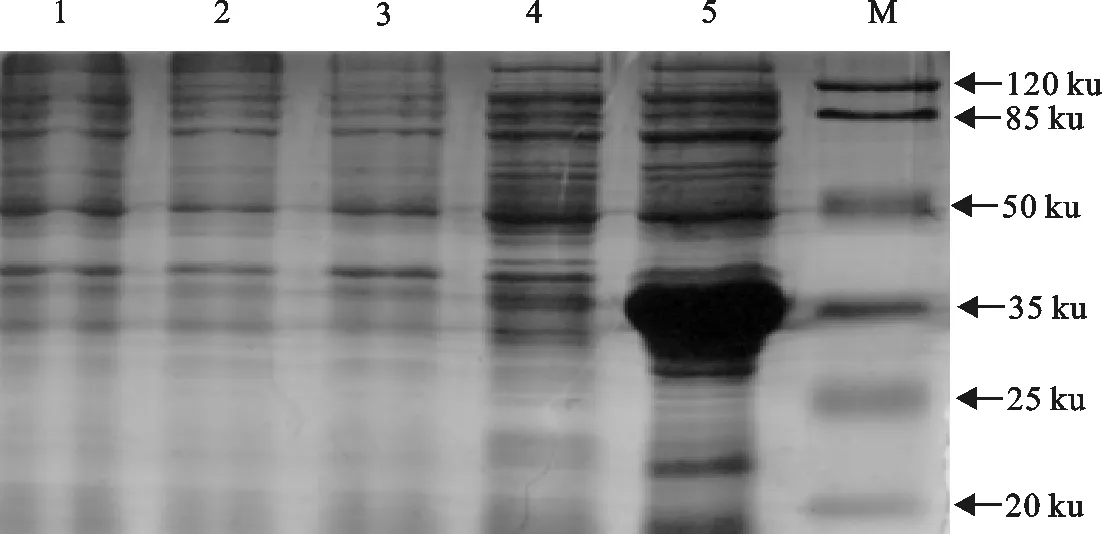
M.蛋白分子质量标准;1.E.coliBL21(DE3)阴性对照;2.转化pET28a(+)空载体的E.coliBL21(DE3)未诱导表达产物;3.转化pET28a(+)空载体的E.coliBL21(DE3)经1 mmol/L IPTG诱导5 h表达产物;4.重组质粒pET-28a-CEV112未诱导表达产物;5.重组质粒pET-28a-CEV112经1 mmol/L IPTG诱导5 h表达产物
M.Protein molecular weight Marker;1.E.coliBL21 (DE3) negative control;2.pET28a (+) expression products without IPTG induction;3.pET28a (+) expression products induced for 5 h by 1 mmol/L IPTG;4.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 without IPTG induction;5.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 induced for 5 h by 1 mmol/L IPTG
图3 融合蛋白CEV-CBP的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of CEV-CBP fusion protein

M.蛋白分子质量标准;1.表达产物超声破碎处理后的上清;2.表达产物超声破碎处理后的沉淀;3.重组质粒pET-28a-CEV112未加IPTG诱导阴性对照;4.重组质粒pET-28a-CEV112经1 mmol/L IPTG诱导5 h表达产物
M.Protein molecular weight Mmarker;1.Supernatant after ultrasonic treatment;2.Precipitate after ultrasonic treatment;3.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 without IPTG induction;4.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 induced for 5 h by 1 mmol/L IPTG
图4 融合蛋白CEV-CBP的可溶性分析
Fig.4 Solublility analysis of CEV-CBP fusion protein
M.蛋白分子质量标准;1.E.coliBL21(DE3)阴性对照;2.转化pET28a(+)空载体的E.coliBL21(DE3)未诱导表达产物;3.转化pET28a(+)空载体的E.coliBL21(DE3)经1 mmol/L IPTG诱导5 h表达产物;4.重组质粒pET-28a-CEV112未诱导表达产物;5.重组质粒pET-28a-CEV112经1 mmol/L IPTG诱导5 h表达产物
M.Protein molecular weight Marker;1.E.coliBL21 (DE3) negative control;2.pET28a (+) expression products without IPTG induction; 3. pET28a (+) expression products induced for 5 h by 1 mmol/L IPTG;4.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 without IPTG induction;5.Expression products ofE.coliBL21 (DE3) transformed with pET-28a-CEV112 induced for 5 h by 1 mmol/L IPTG
图5 融合蛋白CEV-CBP的Western blot分析
Fig.5 Western blot anlysis of CEV-CBP fusion protein
CEV在与机体免疫系统相互作用过程中,形成了一套自身免疫逃避系统,用以抵御机体的清除。其中CEV-CBP是一种与免疫调节作用相关的蛋白,主要参与干扰宿主的免疫防御。CEV-CBP能够激活细胞趋化蛋白-1、巨噬细胞炎症蛋白-1α和RANTES等细胞因子,这些因子主要协助IFN-γ增强免疫应答,所以也被称作Th1细胞因子,这些因子也可以激活巨噬细胞、NK细胞以及CD8+细胞,增强机体Th1免疫应答[13]。然而,CEV-CBP能够与G蛋白竞争结合机体自身产生的CBP,来阻止信号的传导和细胞因子的趋化,抑制宿主的免疫应答,但其具体的控制机制还不清楚[14]。
研究发现CEV112基因与CEV的致病性和毒力有一定的关系,这对于CEV疫苗的研发具有重要意义。本试验对CEV112基因展开研究,通过分子生物学的方法,成功克隆表达了CEV112基因,并通过可溶性分析表明,表达产物存在于包涵体内,这不仅为融合蛋白CEV-CBP的大量表达以及纯化做了良好铺垫,而且也为CEV-CBP蛋白功能的深入研究以及单克隆抗体和疫苗的研制奠定了基础。
[1] 殷 震,刘景华. 动物病毒学[M].2版.北京:科学出版社,1997:977-978.
[2] Hosamani M,Bhanuprakash V,Scagliarini A,et al.Comparative sequence analysis of major envelope protein gene(B2L) of Indian orf viruses islated from sheep and goats[J].Vet Microbiol,2006,116(4):317-324.
[3] 林裕胜,江锦秀,林 甦,等.羊传染性脓疱病毒研究进展J].动物医学进展,2016,37(2):91-96.
[4] 赵文博,李瑞航,贺鹏亮,等.羊口疮病毒B2L基因克隆及表达[J].黑龙江八一农垦大学报,2015,27(2):42-45.
[5] 于永忠,谭 强,赵文博,等.羊口疮病毒黑龙江省分离株的分离鉴定[J].中国预防兽医学报,2013,35(8):678-680.
[6] Jorg R,Frederic E,Michael R K,et al.Orf virus interferes with MHC classⅠsurface expression by targeting vesicular transport and Golgi[J].BMC Vet Res,2012,8:114-125.
[7] Weber O,Mercer A A,Friebe A,et al.Therapeutic immunomodulation using a virus-the potential of inactivated orf virus[J].Eur J Clin Microbiol,2013,32:451-460.
[8] 史巧芸,荣 辉,郭莳雨,等.羊布鲁菌外膜蛋白Bp-26基因的克隆及其原核表达[J]. 动物医学进展,2013,34(9):15-17.
[9] 赵天靖,贾晓晓,焦寒伟,等.布鲁氏菌外膜蛋白P2b基因的克隆、原核表达及蛋白生物信息学分析[J].中国畜牧兽医,2014,41(9):11-14.
[10] 田婷婷.羊口疮疫苗研制及其免疫效果评估[D].陕西杨凌:西北农林科技大学,2013.
[11] Fairley R,Whelan E,Pesavento P,et al.Recurrent localised cutaneous parapoxvirus infection in three cats[J].New Zeal Vet J,2008,56:196-201.
[12] Al-Salam S,Nowotny N,Sohail M R,et al.Ecthyma contagiosum (orf)-report of a human case from the United Arab E-mirates and review of the literature[J]. J Cutan Pathol,2008,35:603-607.
[13] Dorner B G,Scheffold A,Rolph M S,et al. MIP-1α,MIP-1β,RANTES and ATAC/lymphotactin function together with IFN-γ as type 1 cytokines[J].PANS,2002,99(9):6181-6186.
[14] Smith V P,Alcami A.Expression of secreted cytokine and chemokine inhibitors by ectromelia virus[J]. J Virol,2000,74(18):8460-8471.
Cloning and Prokaryotic Expression of CEV112 Gene of Contagious Ecthyma Virus
YANG Xiao-jian,LI Ya-ying,PANG Feng,LI Guo-hua,PENG Dong-mei, ZHU Shu,NIE Xin,CAO Rui-yong,WANG Feng-yang,DU Li
(KeyLaboratoryofAnimalGeneticEngineeringofHaikouCity,KeyLaboratoryofTropicalAnimalReproduction&BreedingandEpidemicDiseaseReseachofHainanProvince,CollegeofTropicalAgricultureandForestry,HainanUniversity,Haikou,Hainan,570228,China)
To clone the CEV112 gene and make prokaryotic expression inEscherichiacoli,one pair of primers were designed according to the CEV112 gene sequence in GenBank, and then a target gene fragment with 867 bp was amplified by PCR.The cloning recomenbinant plasimid pMD20-T-CEV112 was constructed and transformed into theE.coliDH5α.The prokaryotic expression recombinant plasmid pET-28a-CEV112 was constructed after appraising,and transformed into theE.coliBL21(DE3).After induction with IPTG,the protein was detected by SDS-PAGE and Western blot.The results showed that the pET-28a-CEV112 prokaryotic expression vector was successfully constructed and expressed inE.coliBL21(DE3).The expression fusion protein was about 36 ku in molecular weight and it existed in the form of inclusion bodies,which would provide the research basis in the future.
CEV;CEV112 gene;cloning; prokaryotic expression
2016-07-26
海南省重大科技计划项目(ZDKJ2016017-01)
杨小健(1991-),男,山东滨州人,硕士研究生,主要从事动物功能基因组学研究。*通讯作者
S852.659.1;Q789
A
1007-5038(2017)03-0068-05

