H5亚型和N6亚型禽流感病毒二重RT-PCR检测方法的建立
何 莹,谢芝勋,罗思思,李 孟 ,谢志勤,谢丽基,黄 莉,邓显文,黄娇玲,张艳芳,曾婷婷
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
研究论文
H5亚型和N6亚型禽流感病毒二重RT-PCR检测方法的建立
何 莹1,2,谢芝勋2*,罗思思2,李 孟2,谢志勤2,谢丽基2,黄 莉2,邓显文2,黄娇玲2,张艳芳2,曾婷婷2
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
为了建立一种快速、简便的H5亚型、N6亚型禽流感病毒(AIV)的检测方法,根据GenBank中H5亚型、N6亚型AIV的HA和NA基因保守序列,分别设计了2对特异性引物,通过优化条件,建立了H5亚型和N6亚型AIV二重RT-PCR检测方法。特异性试验结果显示,该方法对H5N6亚型AIV特异性扩增出418 bp和251 bp目的片段,对 H5Ny(y≠6)亚型AIV扩增出418 bp目的片段,对 HxN6(x≠5)亚型AIV扩增出251 bp目的片段,对其他亚型和常见的禽病病原体均未扩增出目的片段;敏感性结果显示,该方法对H5亚型和N6亚型最低检测限为1.59×10-5ng/μL。本研究建立的H5亚型和N6亚型AIV检测方法,具有特异性强,灵敏度高的特点,为H5亚型和N6亚型AIV临床检测以及防控提供了有效方法。
禽流感病毒;H5亚型; N6亚型; 二重逆转录-聚合酶链反应
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,根据血凝素(henmagglutinin,HA)和神经氨基酸酶(neuraminidase,NA)抗原性差异可分为不同亚型。目前已发现有18种HA(H1-H18)亚型和11种NA(N1-N11)亚型[1-2],其中H5亚型属于高致病性禽流感病毒(Highly pathogenic avian influenza virus,HPAIV),HPAIV H5N1引起的香港大流行,给养禽业和人类的公共卫生造成巨大的冲击[3]。H5亚型AIV一直在不断进化和重组, 2013年,我国江苏省首次在活禽市场监测中发现H5N6亚型AIV,并对其基因分析发现,H5N6亚型AIV由H5N1和H6N6两种亚型AIV基因重组而来,并且多个基因来源于H5N1 HPAIV,使其具备了高致病的特性[4-5]。2014年,四川省南充市首次从人类中分离了高致病性H5N6亚型AIV[6]。目前,已确诊15例人类感染H5N6亚型AIV病例[7]。H5N6亚型AIV不仅给养禽业带来巨大的经济损失,还可以跨越宿主屏障直接感染人,进而危害人类健康。因此,建立一种能同时快速鉴别H5亚型和N6亚型AIV的检测方法对养禽业及公共卫生事业具有重要意义。
病毒分离及分子生物学技术是诊断H5N6亚型AIV的主要方法。病毒分离一般采用鸡胚分离,血凝试验和血凝抑制试验鉴定,诊断周期长和敏感性低,具有一定的局限性。分子生物学技术中RT-PCR因具有特异性好和敏感性高而得到广泛的临床应用,但目前大部分只能鉴别单一的H5亚型或者N6亚型AIV,并不能同时检测H5和N6亚型AIV[8]。本试验构建H5和N6亚型AIV二重RT-PCR是同一管反应中加入2对引物,同时扩增两条不同核苷酸目的条带的PCR反应,具有经济、快速、同时检测两种不同病原体的特点。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂 Nano Drop2000超微量分光光度计,美国 Thermo Scientific公司产品;PCR 仪,Biometra公司产品;病毒DNA/RNA抽提试剂盒、胶回收试剂盒、2×EasyTaqPCR Super Mix,北京全式金生物技术有限公司产品;MMLV反转录酶、dNTP、DNA Marker DL 1 000、DNA Marker 100 bp,TaKaRa公司产品。
1.1.2 毒株来源 AIV (H1N1、H3N2、H3N6、H4N6、H4N8、H6N6、H9N2、H11)[9-13]、新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、传染性喉气管炎病毒(ILTV),由广西兽医研究所实验室分离鉴定保存;H5N6、H5N2、H5N9、H13N6亚型AIV灭活抗原,由美国宾夕法尼亚州立大学禽病诊断研究室赠送;H2N3、H8N4、H10N3、H12N3亚型AIV,由香港大学赠送;H7N9亚型AIV的阳性cDNA,由广西壮族自治区疫病控制中心赠送。
1.2 方法
1.2.1 引物的设计与合成 根据 GenBank中 H5亚型AIV的HA基因和N6亚型AIV的NA基因的核苷酸序列,用DNA Star软件进行比对筛选出保守区域和Primer 5.0软件设计针对H5亚型、N6亚型2对特异性引物,并通过NCBI Blast验证。引物由北京六合华大基因科技有限公司合成,引物核酸序列见表1。
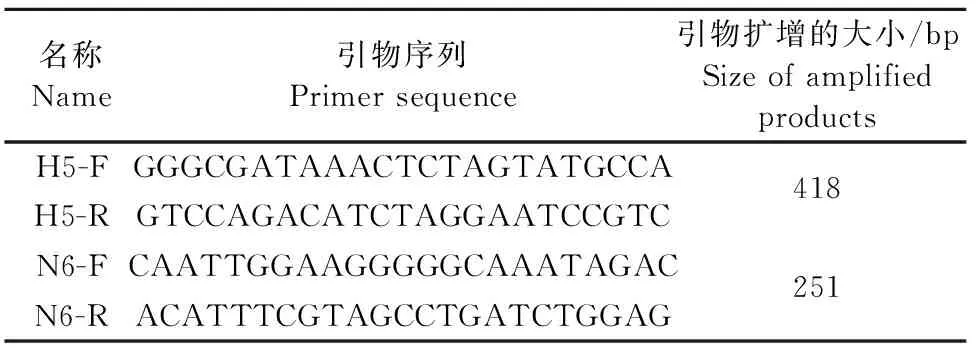
表1 H5和N6引物的核苷酸序列
1.2.2 病毒RNA抽提与RNA反转录 根据病毒DNA/RNA抽提试剂盒使用说明书抽提病毒RNA;抽提后的RNA用30 μL DEPC水溶解,对RNA产物反转录成cDNA;反转录体系(50 μL)如下:5×MMLV buffer 10μL,反转录引物 1.5 μL,10 mmol/L dNTP 2 μL,40 U/μL RRI酶抑制剂 0.6 μL,MMLV反转录酶 1 μL,DEPC水补足50 μL。所得到的cDNA置于-30℃保存备用。
1.2.3 质粒的制备 参照文献[14]的方法,用H5亚型AIV和N6亚型AIV全长引物分别与对应的cDNA进行PCR扩增,用胶回收试剂盒对目的条带回收纯化后,连接到pMD18-T载体,转化DH5α感受态细胞,涂布于LB培养基37℃培养过夜,挑取阳性菌落接种于LB培养基(含100 μg/mL氨苄青霉素)37℃培养过夜,送至上海Invitrogen公司测序验证。以测序结果正确的菌液抽提质粒,根据其浓度和分子质量分别计算质粒的拷贝数。
1.2.4 反应条件的优化 二重RT-PCR反应体系 25 μL;2×EasyTaqPCR 12.5 μL,cDNA 1 μL,上、下游引物在0.1 μmol/L~0.6 μmol/L,退火温度在52℃~58℃之间,进行梯度优化,以超纯水补足25 μL,筛选出二重RT-PCR最佳反应条件。
1.2.5 特异性试验 按照优化好的条件,用该法对H1N1、H2N3、H3N2、H3N6、H4N6、H5N2、H6N6、H7N7、H9N2、H10N3、H11、H12N3、H13N6、NDV、IBV、ILTV进行特异性扩增,检验其特异性。
1.2.6 敏感性试验 将H5基因和N6基因的AIV核酸用超微量分光光度计测量浓度后进行10倍倍比稀释,按照优化好的条件,用该法对其进行扩增,检验其敏感性。
2 结果
2.1 二重RT-PCR条件优化
通过对H5和N6亚型AIV的引物浓度、扩增温度、时间等条件的优化,最终确定二重RT-PCR最佳反应体系(25 μL):H5-F、H5-R引物均为0.2 μmol/L,N6-F、N6-R引物均为0.4 μmol/L,2×EasyTaqPCR 12.5 μL,cDNA模板1 μL,超纯水补足25 μL。二重RT-PCR最佳扩增程序为:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 40 s,共35个循环;72℃ 10 min;4℃结束扩增。用上述程序扩增H5、N6亚型AIV核酸扩增结果与预期目的条带一致(图1)。
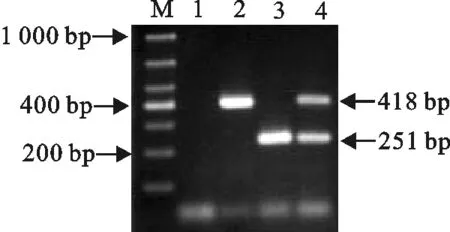
M.DNA标准DL 1 000;1.阴性对照;2.H5亚型;3.N6亚型;4.H5+N6亚型
M.DNA Marker DL 1 000;1.Negative control;2.H5 subtype;3.N6 subtype;4.H5+N6 subtypes
图1 二重RT-PCR扩增结果
Fig.1 Amplification results of duplex RT-PCR
2.2 特异性试验结果
对AIV亚型、NDV、IBV、ILTV核酸扩增结果显示,对H5、N6亚型AIV扩增结果出现2条特异性条带,分别为418 bp和251 bp;对H5N2亚型AIV即H5Ny (y≠6)亚型AIV扩增结果仅出现1条特异性条带,片段大小为418 bp;H3N6、H4N6、H6N6、H13N6亚型AIV即HxN6(x≠5)亚型AIV仅扩增出1条特异性条带,片段大小为251 bp,对其他亚型AIV以及常见的禽病病原体的扩增均未出现条带(图2)。
2.3 敏感性试验结果
对H5、N6亚型AIV核酸浓度1.59×10-1ng/μL~1.59×10-6ng/μL分别扩增出418 bp、251 bp目的条带,H5、N6亚型AIV核酸浓度1.59×10-6ng/μL无扩增的目的条带。敏感性结果表明,二重RT-PCR 最低能检测到1.59×10-5ng/μL(图3)。
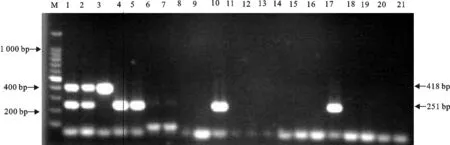
M.DNA 标准DL 1 000;1.H5N2+H13N6;2.H5N9+H13N6;3.H5N2;4.H3N6;5.H4N6;6.H1N1;7.H2N3;8.H3N2;9.H4N8;10.H6N6;11.H7N9;12.H8N4;13.H9N2;14.H10N3;15.H11;16.H12N3;17.H13N6;18.NDV;19.IBV;20.ILTV;21.阴性对照
M.DNA Marker DL 1 000;1.H5N2+H13N6;2.H5N9+H13N6;;3.H5N2; 4.H3N6;5.H4N6;6.H1N1;7.H2N3;8.H3N2;9.H4N8;10.H6N6;11.H7N9;12.H8N4;13.H9N2;14.H10N3;15.H11;16.H12N3;17.H13N6;18.NDV;19.IBV;20.ILTV;21.Negative control
图2 特异性试验结果
Fig.2 Specificity test results

M.DNA 标准DL 1 000;1.1.59×10-1ng/μL;2.1.59×10-2ng/μL;3.1.59×10-3ng/μL;4.1.59×10-4ng/μL;5.1.59×10-5ng/μL;6.1.59×10-6ng/μL;7.阴性对照
M.DNA Marker DL 1 000;1.1.59×10-1ng/μL;2.1.59×10-2ng/μL;3.1.59×10-3ng/μL;4.1.59×10-4ng/μL;5.1.59×10-5ng/μL;6.1.59×10-6ng/μL;7.Negative control
图3 敏感性试验结果
Fig.3 Sensitivity test results
3 讨论
禽流感病毒亚型较多,H5、H7亚型HPAIV引起的禽类发病迅速,具有极高的发病率和病死率,造成养禽业的巨大损失。随着抗原的转变和基因重排, H5亚型AIV由原来的H5N1到H5N5、H5N6、H5N8等亚型的转变[15-17],更为惊讶的是这些亚型多数处于2.3.2和2.3.4分支上[18],具有HPAIV特性。N6亚型基因主要由H6N6亚型基因重排而来,以往H6N6亚型属于LPAIV,对于养禽业的危害较小[6],缺乏对该亚型的研究。H5亚型和N6亚型的重排组合,对禽类乃至人类都是一种极大的危害。据世界动物卫生组织报道,我国哈尔滨、厦门等地区暴发H5N6亚型HPAIV,导致大量家禽死亡,造成巨大的经济损失。自2014年以来,H5N6亚型AIV不仅仅引起禽类感染,跨越物种传播给人类[19],严重危害人类健康。HPAIV传播快,危害大,早发现、早诊断、早控制是预防病毒在家禽和人群中传播的关键。因此,建立一种能同时快速检测H5、N6亚型AIV的方法,具有重要的公共卫生意义。
本研究构建的H5亚型和N6亚型AIV二重RT-PCR是根据其保守序列设计的2对特异性引物,成功构建H5亚型和N6亚型AIV二重TR-PCR检测方法。对H5亚型和N6亚型AIV只需一管反应就可以快速把H5N6亚型AIV及其他H5N1、H5N2、H5N8、H6N6、H13N6等不同HA与NA亚型搭配中的H5和N6亚型AIV鉴别诊断。本研究构建的H5亚型和N6亚型AIV二重RT-PCR特异性试验和敏感性试验扩增条带与预期结果一致,具有特异性强、灵敏度高、快速便捷的特点,可为早期快速检测和临床诊断提供参考依据。
[1] Sun X,Shi Y,Lu x,et al.Bat-derived influenza hemagglutinin H17 does not bind canonical avian or human receptors and most likely uses a unique entry mechanism[J].Ceel Rep,2013,3(3):769-778.
[2] Tong S,Zhu X,Li Y,et al.New world bats harbor diverse influenza A viruses[J/OL].PLoS Pathog,2013,9(10):e1003657.
[3] Yune K Y,Chan P K,Peiris M,et al.Clinical features and rapid viral diagnosis of human disease associated with avian influenza A H5N1 virus[J].Lancet,1998,351(9101):467-471.
[4] Wong F Y,Phommachanh P,Kalpraviddh W,et al.Reassortant highly pathogenic influenza A( H5N6 ) virus in Laos[J].Emerg Infect Dis,2015,21(3):511-516.
[5] Sun H, Bi Y H,Gary W,et al.Characterization of clade 2.3.4.4 highly pathogenic H5 avian influenza viruses in ducks and chickens[J].Vet Microbiol,2016,182:116-122.
[6] Jiao P,Cui J,Song Y,et al.New reassortant H5N6 highly pathogenic avian influenza virusesin Southern China,2014[J].Front Microbiol,2016,19(7):754.
[7] World Health Organization.Upate on highly pathogenic avian influenza in animals[EB/OL].http://www.oie.int/en/animal-health-in-the-world/update-on-avian-influenza/2016.
[8] 彭 宜,谢芝勋,刘加波,等.H5亚型禽流感病毒RT-LAMP可视化检测技术的建立[J].南方农业学报,2013(2):323-327.
[9] 彭 宜,谢芝勋,郭 捷,等.利用RT-LAMP可视化检测技术检测H1亚型禽流感病毒及N1、N2亚型的分型[J].病毒学报,2013(2):154-161.
[10] 刘婷婷,谢芝勋,宋德贵,等.H3亚型禽流感病毒的分离与鉴定[J].中国家禽,2015,37(19):64-67.
[11] 罗思思,谢芝勋,周辰瑜,等.H6亚型禽流感病毒的分离鉴定与生物学特性分析[J].中国家禽,2015,37(2):54-56.
[12] 徐 倩,谢芝勋,谢丽基,等.禽流感病毒H9和N2亚型双重RT-PCR检测方法的建立[J].动物医学进展,2015,36(1):11-15.
[13] 罗思思,谢芝勋,刘加波,等.H11亚型禽流感病毒RT-PCR可视化检测方法的建立[J].中国兽医科学,2014,44(10)1042-1046.
[14] Hoffmann E,Stech J,Guan Y.et al.Universal primer set for the full-length amplification of all influenza A viruses [J].Arch Virol,2001,146:2275-2289.
[15] Zhao G,Gu X,Lu X,et al.Novel reassortant highly pathogenic H5N2 avian influenza viruses, in poultry in China[J].PLoS One,2012,7:e46183.
[16] Zhao K,Gu M,Zhong L,et al.Characterization of three H5N5 and one H5N8 highly pathogenic avian influenza viruses in China[J].Vet Microbiol,2013,163:351-357.
[17] Shen H,Wu B,Chen Y,et al.Influenza A(H5N6) virus reassortant,Southern China,2014[J].Emerg Infect Dis,2015,21(7):1261-1262.
[18] Su S,Bi Y,Wong G,et al.Epidemiology,evolution,and recent outbreaks of avian influenza virus in China[J].J Virol,2015,89(17):8671-8676.
[19] Pan M,Gao R,Lv Q,et al.Human infection with a novel,highly pathogenic avian influenza A (H5N6) virus:Virological and clinical findings[J].J Infect,2016,72(1):52-59
Development of a Duplex RT-PCR for Detecting AIV H5 and N6 Subtypes
HE Ying1,2, XIE Zhi-xun2,LUO Si-si2, LI Meng2, XIE Zhi-qin2, XIE Li-ji2, HUANG Li2,DENG Xian-wen2,HUANG Jiao-ling2, ZHANG Yan-fang2, ZENG Ting-ting2
(1.CollegeofAnimalScienceandTechnology,Guangxiuniversity,Nangning,Guangxi,530001,China;2.GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofAnimalEpidemicEtiologyandDiagnosis,Nangning,Guangxi,530001,China)
In order to establish a rapid,simple H5 and N6 subtypes avian influenza virus (AIV) detection method,according to the sequences of HA and NA genes of H5 and N6 subtypes of AIV,two pairs of specific primers were designed respectively,the conditions were optimized and the duplex RT-PCR assay for detection of AIV H5 and N6 subtypes was established.It was shown that H5N6 AIV could be amplified into two specific bands by this duplex RT-PCR, the lengths of bands were 418 bp(H5 AIV) and 251 bp(N6 AIV),respectively.Samples containing H5 or N6 subtype AIV could be amplified into one specific band,which was 418 bp,251 bp,respectively.No specific band was amplified from other subtypes AIV and avian pathogenic virus.Sensitivity test results showed that as low as 1.59×10-5ng/μL H5N6 AIV could be detected.This duplex RT-PCR assay is a specific,sensitive method for the detection of H5 and N6 subtypes AIV in the same tube,and provided an effective tool to determine the infection of AIV H5 and N6 subtypes.
Avian influenza virus; H5 subtype; N6 subtype; duplex RT-PCR
2016-06-30
广西自然科学基金项目(2015GXNSFBA139070);广西科技项目(桂科AD16380009,14123001-8); 广西水产畜牧局科研项目(桂渔牧科201452001);;南宁市科技项目(20152308)
何 莹(1990-),女,广西北流人,硕士,主要从事兽医生物技术研究。*通讯作者
S852.659.5
A
1007-5038(2017)03-0001-04

