腹部炎性肌纤维母细胞瘤以病理为基础的影像学特征
孙海涛, 刘锴, 王艳秋, 周建军
·腹部影像学·
腹部炎性肌纤维母细胞瘤以病理为基础的影像学特征
孙海涛, 刘锴, 王艳秋, 周建军
目的:探讨腹部炎性肌纤维母细胞瘤(IMT)的病理及影像学特征,以提高该病的诊断水平。方法:回顾性分析9例经手术病理证实的腹部IMT的影像学及临床资料。结果:9例IMT中,4例呈类圆形,2例呈椭圆形,1例呈葫芦形,2例呈不规则形;位于肝脏4例,胃2例,腹膜后2例,肠系膜1例;肿瘤直径为1.8~15cm;8例呈实性肿块,1例呈囊实性。CT/MRI平扫上,9例实性部分均呈低密度或T1WI低信号、T2WI混杂高信号;增强扫描上,9例动脉期均轻中度强化;静脉期及延迟期持续性强化。结论:腹部IMT临床少见,CT和MRI对该病的诊断具有一定的提示作用,但确诊仍需要依赖病理学检查。
腹部肿瘤; 炎性肌纤维母细胞瘤; 体层摄影术,X线计算机; 磁共振成像
炎性肌纤维母细胞瘤(inflammatory myofibrolastic tumor,IMT)是一种临床少见的、间叶组织来源、交界性/中间型的肿瘤性病变,既往被称为炎性假瘤[1]。近年的研究提示IMT是一种真性肿瘤,具有复发和转移可能。IMT属于梭形细胞肿瘤,肿瘤内主要包含分化的肌纤维母细胞性梭形细胞,并伴有大量炎性细胞[2]。腹部IMT可以发生在胃、小肠、肠系膜、腹膜后、胰腺、肝脏等部位,临床特征性征象不多,定性诊断困难。笔者收集经手术病理证实的9例腹部IMT的临床病理及影像学资料,旨在探讨其病理及影像学特点,以提高对本病的诊断水平,为临床诊疗提供帮助。
材料与方法
1.一般资料
搜集我院2009年1月-2016年5月经手术病理证实的9例腹部IMT患者的临床病理及影像学资料。9例患者中,男7例,女2例;年龄21~70岁,平均60岁。临床表现:无症状2例,高热、消瘦、腹部包块各1例,上腹部不适4例(其中1例伴腰背痛,1例伴恶心、呕吐,1例因腹痛被外院误诊为腹膜恶性间皮瘤)。9例均行手术切除及病理确诊。
2.检查方法
4例仅行CT检查,4例仅行MRI检查,1例同时行CT及MRI扫描。
CT检查:采用GE Light speed 64层CT机,Siemens Sensation 16层/128层螺旋CT机,管电压120 kV,管电流300 mA,层厚5 mm。增强扫描对比剂选用优维显或欧乃派克(30 mg I/mL),剂量1.5 mL/kg,经肘静脉注射,注射流率3.0 mL/s。动脉期扫描延迟25~30 s、静脉期扫描延迟75~90 s、延迟期扫描延迟150~300 s。
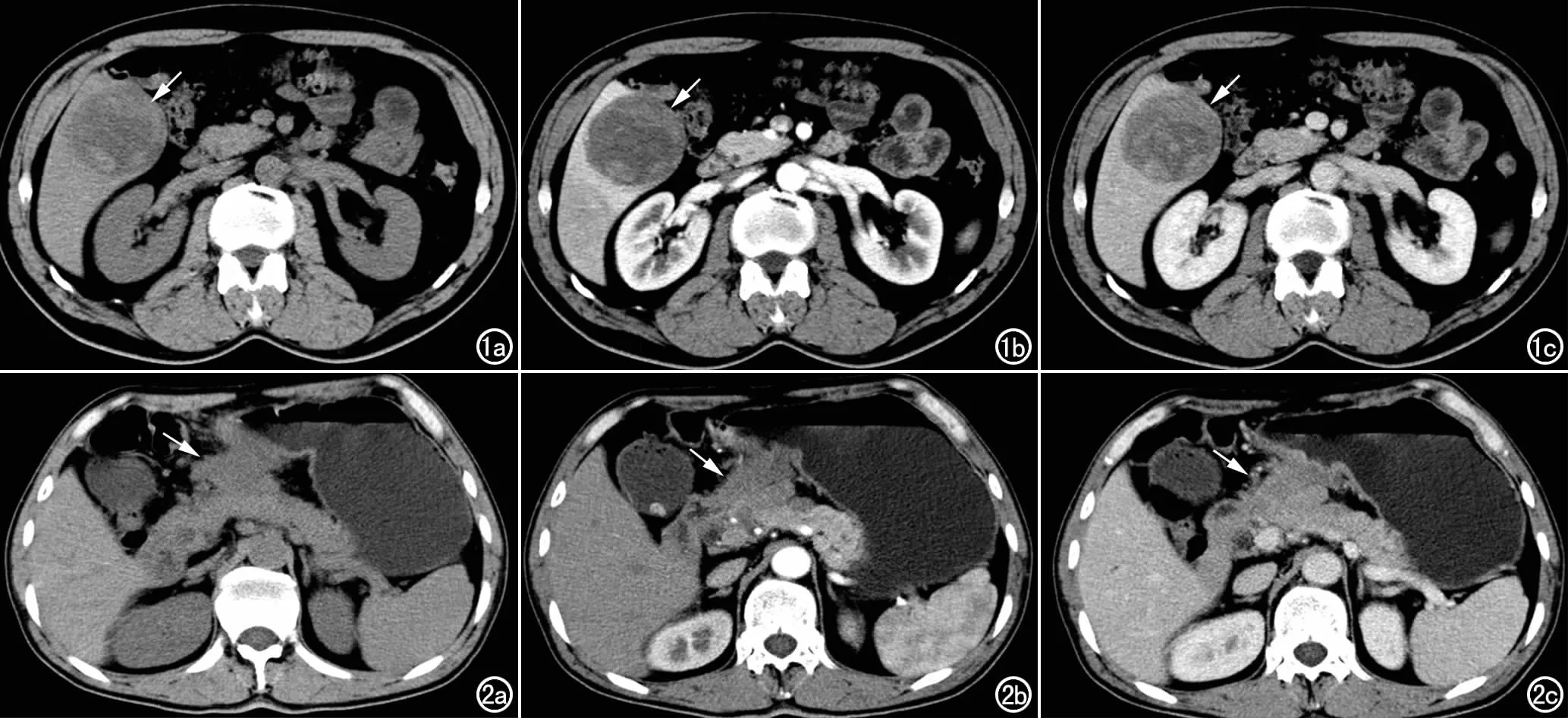
图1 男,54岁,肝右后叶IMT。a) CT平扫示肝右后叶混杂低密度病灶,呈类圆形且边缘稍模糊(箭),病灶内见条片状稍高密度; b) CT增强动脉期示不规则条片状强化区与低密度无强化区混杂分布(箭),周边肝实质见环形强化; c) CT增强门静脉期示病灶呈持续性强化(箭)。 图2 男,62岁,胃窦部IMT。a) CT平扫示胃窦部不规则低密度病灶,边界不清(箭); b) CT增强动脉期示病灶轻度不均匀强化,边缘模糊,与胰腺头部、横结肠系膜根部及小肠系膜根部分界不清(箭); c) CT增强静脉期示病灶持续轻度强化,边界不清(箭)。
MRI检查:采用GE Signal 1.5 T磁共振扫描仪,体表线圈。扫描序列及参数:脂肪抑制SE-T1WI(TR 500 ms,TE 25 ms);脂肪抑制FSE-T2WI(TR 3500 ms,TE 80 ms);DWI采用横轴面单次激发平面回波成像序列(TR 2400 ms,TE 66 ms,层厚4.0 mm,层间距1.0 mm,b值取0、500 s/mm2);GRE-T1WI动态增强扫描(TR 150 ms,TE 5 ms,翻转角90°,层厚4.0 mm,间隔1.0 mm)。对比剂采用Gd-DTPA,于肘前静脉注射,剂量15~20 mL或0.15~0.20 mmol/kg,注射流率1.5~2 mL/s。
3.图像分析
由3名主治医师以上职称医师共同对图像进行观察和分析,主要观察征象:①病灶部位、形态、大小及内部结构特征;②病灶CT/MRI平扫密度/信号特点,强化程度及方式;③肿瘤边界、累及范围及继发改变等。
结 果
1.一般表现
9例均为单发病灶。9例IMT中,4例位于肝脏(肝左叶1例,肝右叶3例);2例位于胃(胃体及胃窦部后壁各1例);2例位于腹膜后;1例位于肠系膜根部。病灶大小不等,直径1.8~15 cm,平均7.0 cm。病灶形态多样,4例呈类圆形;2例呈椭圆形;1例呈葫芦形;2例呈不规则形。7例边界不清晰,2例较清晰,8例为实性肿块,1例为囊实性肿块。
2.CT表现
5例行CT平扫及增强扫描。
2例肝脏IMT的CT表现:均为低密度肿块,平均CT值为31.2 HU;增强后均呈轻中度强化,平均CT值为76.3 HU;1例伴周边肝实质环形强化(图1),另1例呈环形强化(门静脉期强化范围扩大,延迟期强化呈充填趋势,门静脉期平均CT值为94.2 HU)。2例胃部IMT的CT表现:平扫均为低密度,平均CT值为30.8 HU;增强后均呈轻度不均匀强化,平均CT值为54.1 HU,静脉期呈持续进行性强化,平均CT值为71.5 HU(图2)。1例腹膜后IMT的CT表现:呈囊实性肿块,实质部分CT值为27.8 HU;增强后实质部分呈轻中度强化,囊变坏死区未见强化,CT值为58.9 HU,静脉期持续强化,CT值为80.1 HU。
3.MRI表现
5例行MRI平扫及增强扫描,其中1例肝脏IMT同时行CT平扫及增强扫描。
3例肝脏IMT的MRI表现:脂肪抑制T1WI上病灶均为低信号,T2WI上均呈混杂高信号;增强表现与CT大体类似,其中2例肝脏病灶周边伴环形强化带,门静脉期病灶持续性强化,延迟期病灶仍呈高信号(图3):1例肠系膜IMT及1例腹膜后IMT的MRI表现:脂肪抑制T1WI上,病灶均为低信号,T2WI上均呈混杂高信号;动脉期均呈轻中度强化,其中不规则条片状、结节状强化区与低密度区混杂分布,延迟期呈持续性强化。

图3 男,55岁,肝左内叶IMT。a) 抑脂T1WI示肝左内叶肿块呈均匀低信号(箭); b) 抑脂T2WI示肿块呈混杂稍高信号(箭); c) DWI示肿块呈均匀高信号(箭); d) MRI增强动脉期示肿块呈不均匀轻中度强化(箭); e) MRI增强门静脉期示肿块呈轻度不均匀强化(箭); f) MRI增强延迟期示肿块信号仍未减弱(箭); g) 镜下病理示细胞呈梭形、束状或漩涡状排列,灶区见坏死、间质内炎性细胞浸润及间质胶原化(HE,×200)。
4.病灶边界、对周边结构侵犯
4例肝脏IMT中,1例边界较清晰,余3例边界不清;2例胃部IMT中,1例边界不清晰,1例边界清楚;1例肠系膜IMT及2例腹膜后IMT边界均不清。2例腹膜后IMT(直径均>5 cm)中,1例侵及第一肝门、第二肝门、右肾下极、脾门及部分胃壁,向右侧推移下腔静脉;另1例与左侧肾上腺分界不清,侵犯腹腔后壁。1例肠系膜IMT,直径>5 cm,下缘达盆腔,与周围肠管等组织分界不清。1例胃窦部后壁IMT与胰腺头部、横结肠系膜根部及小肠系膜根部分界不清(图2)。其余病灶无明显周围结构侵犯。
5.病理学特征
9例腹部IMT中,行手术全部切除6例,部分切除3例。大体:肿块部分无包膜,边界不清,切面呈灰黄或灰白色,质地坚韧,漩涡状,部分伴黏液样变性、灶性出血和坏死。镜下:肿瘤细胞由增生的梭形纤维母细胞/肌纤维母细胞构成,呈束状或漩涡状排列,核居中呈卵圆形,胞质丰富呈嗜酸性,间质水肿,其内见不同程度的炎性细胞浸润,多为浆细胞、淋巴细胞和嗜酸性粒细胞,少数为中性粒细胞。免疫组化:Vimentin (4/5)、SMA (6/9)、CD34(3/7)为阳性表达;ALK(1/7)、S-100(1/9)及CD68(6/6)为部分阳性表达;其他标记物如Desmin、CD117表达阴性。
6.随访结果
本组9例IMT患者术后随访时间为6个月~3年,其中1例腹膜后IMT患者死于局部复发;1例肠系膜IMT患者,术后6个月随访时病灶完全消失,随访至第3年时仍未见复发征象;其余病例均无复发和转移。
讨 论
IMT是近年来提出的一个新的组织病理学概念,既往称为炎性假瘤、纤维黄色肉芽肿、肌纤维母细胞瘤、纤维组织细胞瘤、黏液样错构瘤等。2002年WHO软组织肿瘤分类将IMT定义为“由分化的肌纤维母细胞性梭形细胞组成的,常伴有大量浆细胞和/或淋巴细胞的一种肿瘤”,并将其归为纤维母细胞/肌纤维母细胞肿瘤;中间型,少数可转移类[3]。IMT的病因尚不明确,可能与感染、免疫抑制、放化疗、局部创伤等因素有关[2,4],此外,一些疾病包括克罗恩病、胃肠间质瘤、先天性中性白细胞减少症等可能与IMT的产生和发展有关[5]。近年的研究认为ALK-1型基因表达可能与IMT局部复发、远处转移和总体预后有关[6]。
1.临床特点
IMT可发生于任何年龄,多见于儿童和青少年,在性别上无明显差异[7]。本组病例年龄为21~70岁,平均60岁,且多为男性(7/9),与文献报道有差异。IMT可发生于任何部位,以肺部多见,偶可见于头颈、泌尿道、盆腔、腹膜后等部位;腹部为肺外IMT的多发区域,肠系膜、腹膜、腹膜后IMT的病灶多较大。IMT的症状和体征亦不典型。本组病例中,无症状者2例(2/9,占22.2%);上腹部不适4例(4/9,占44.4%);高热、消瘦、腹部包块各1例(1/9,各占11.1%),与既往文献报道[8]的19%的IMT患者伴发热、消化道症状、体重减轻等表现相符。IMT属于良性或低度恶性肿瘤,Coffin等[8]随访53例肺外IMT患者发现,24.5%的患者术后1~24个月内复发;9.4%的患者死于局部复发或并发症,但无远处转移。本组病例的随访中,1例腹膜后IMT患者死于局部复发; 1例肠系膜IMT患者,由于病灶广泛,仅切除相对较大的病灶,术后6个月常规随访,病灶完全消失,目前已经随访3年仍然未见复发征象,提示IMT的部分炎性特征,其余病例均无复发和转移。
2.病理特点
IMT由梭形细胞(肌纤维母细胞)、淋巴细胞、浆细胞及巨噬细胞等炎性细胞组成,伴或不伴有细胞异型性改变[9]。Coffin等[8]提出将IMT分成3种组织学类型:①黏液型,以黏液、血管为主;②丰富梭形细胞型,以梭形细胞为主,夹杂炎症细胞;③少细胞纤维型,以致密成片的胶原纤维为主。而实际上,IMT的各种组织成分多混合存在,其组织分型与预后的关系尚需进一步研究。免疫组织化学在IMT的诊断中具有极其重要的作用。文献报道[1]80%~90%的病例SMA阳性,Desmin阳性率60%~70%,ALK阳性率约50%,而本组病例Desmin及ALK多为阴性,可能与样本收集及小肠系膜肿瘤中ALK多呈阴性有关[6]。
3.腹部IMT影像学特点
本组IMT中,1例因黏液变呈囊实性,另8例呈实性(8/9,占88.9%),略高于李小会等[10]报道的实性率,可能与样本收集有关。本组9例IMT均未见钙化,与文献报道[11]的IMT的低钙化率相仿。CT平扫肿瘤实质部分多呈低或略低密度。病理对照显示低密度区为黏液、坏死和慢性炎性细胞浸润;等高密度区为密集排列的梭形细胞和纤维组织增生。MRI能反映病灶内的组织成分,不同的病理阶段可导致各序列的信号不同。本组5例IMT表现为抑脂T1WI上低信号,T2WI上呈混杂高信号,其中等信号和稍高信号对诊断有一定提示性。病理对照显示3例病灶内纤维组织或凝固性坏死成分较多,由于梭形细胞密集排列、纤维成分及凝固性坏死组织缺乏运动质子而造成病变在T1WI上呈稍低信号,T2WI上呈等或稍高信号。
增强扫描可反映病灶血供及病理特征。IMT的CT、MRI增强表现类似。本组9例IMT的实性部分于增强动脉期均呈轻中度强化,于静脉期均呈持续性强化,部分病灶强化范围扩大,见延迟强化充填区,与文献报道大致相仿[10]。强化方式与病灶结构有关,结合手术病理分析,肿瘤强化主要与间质内丰富的薄壁毛细血管增生和大量炎性细胞浸润有关。本组4例肝脏IMT中3例增强动脉期见环形强化带,可能与病灶周围肝实质炎性充血、血供较丰富有关;静脉期持续强化及部分延迟强化,与间质内丰富的纤维间质有关,上述表现均与文献报道相符[10,12,13]。另外本组1例腹膜后IMT及1例肠系膜IMT呈轻中度不均质强化,其中不规则条片状、结节状强化区与低密度区混杂分布,分析可能为肿瘤肌纤维母细胞及其增生形成的胶原纤维和间质血管分布的差异、肿瘤内少许坏死区等因素所致。
尽管文献报道IMT在影像学上无明显的特征性征象,笔者通过复习文献并结合本组资料,总结出如下特点:①发生于实质器官者,多呈圆形、类圆形,肿瘤直径一般小于<5cm,且边界相对清楚,但相对于肝实质和胃壁其他原发或继发肿瘤,其边界依然不清楚。本组发生于肝脏的病例出现环形强化、延迟期向病灶中心渐进性强化的方式、且周围肝实质出现炎性反应带,均与文献报道相符[14],笔者认为病变周围及邻近组织出现炎性改变的征象时,有利于该病诊断。②IMT位于腹腔或腹膜后者,直径多>5cm,形态多不规则。本组1例肠系膜IMT及2例腹膜后IMT直径均>5cm,且边界均不清楚,与周边组织器官粘连。③腹部IMT强化较为显著,尤其持续性强化明显,其程度大于大多数腹部肿瘤,同时T2WI相对低信号区域显著强化对诊断也有一定提示性。
4.鉴别诊断
①肝细胞癌(Hepatocellular carcinoma,HCC):典型病例呈快进快出强化,边界多清楚,有假包膜。②淋巴瘤:密实而坏死少见,多呈轻中度强化,如发现其他部位淋巴结肿大尤其非引流区淋巴结肿大,则更支持淋巴瘤的诊断。③恶性纤维组织细胞瘤:中老年多见,肿瘤较为规则,边界相对清楚,易出血坏死,且坏死范围较大,实性部分多呈中等程度强化,很少出现花环状强化。④胃肠道间质瘤:边界清楚,与胃肠道关系需要仔细辨认,强化程度多样,但强化不及IMT。
[1] Chaudhary P.Mesenteric inflammatory myofibroblastic tumors[J].Ann Gastroenterol,2015,28(1):49-54.
[2] Kovach SJ,Fischer AC,Katzman PJ,et al.Inflammatory myofibroblastic tumors[J].J Surg Oncol,2006,94(5):385-391.
[3] Elpek GO.Inflammatory myofibroblastic tumor of the liver:a diagnostic challenge[J].J Clin Transl Hepatol,2014,2(1):53-57.
[4] Huang YH,Zhong DJ,Tang J,et al.Inflammatory myofibroblastic tumor of the liver following renal transplantation[J].Ren Fail,2012,34(6):789-791.
[5] Chen CB,Chou CT,Hsueh C,et al.Hepatic inflammatory pseudotumor mimicking hepatocellular carcinoma[J].J Chin Med Assoc,2013,76(5):299-301.
[6] Choi AH,Bohn OL,Beddow TD,et al.Inflammatory myofibroblastic tumor of the small bowel mesentery:an unusual cause of abdominal pain and uveitis[J].J Gastrointest Surg,2011,15(4):584-588.
[7] Liu B,Xu J,Wang J,et al.Computed tomography appearance of inflammatory myofibroblastic tumor in the abdomen:CT features and pathologic correlation[J].Int J Clin Exp Med,2015,8(9):16745-16755.
[8] Coffin CM,Watterson J,Priest JR,et al.Extrapulmonary inflammatory myofibroblastic tumor (inflammatory pseudotumor).A clinicopathologic and immunohistochemical study of 84 cases[J].Am J Surg Pathol,1995,19(8):859-872.
[9] Chang SD,Scali EP,Abrahams Z,et al.Inflammatory pseudotumor of the liver:a rare case of recurrence following surgical resection[J].J Radiol Case Rep,2014,8(3):23-30.
[10] 李小会,黄仲奎,龙莉玲,等.腹部炎性肌纤维母细胞瘤的CT表现与病理对照分析[J].临床放射学杂志,2013,32(04):548-551.
[11] Kirchgesner T,Danse E,Sempoux C,et al.Mesenteric inflammatory myofibroblastic tumor:MRI and CT imaging correlated to anatomical pathology[J].JBR-BTR,2014,97(5):301-302.
[12] 唐威,周纯武.肝脏炎性肌纤维母细胞瘤的影像学诊断[J].放射学实践,2009,24(2):217-220.
[13] 钱民,柏瑞,李小荣,等.腹部炎性肌纤维母细胞瘤CT表现[J].放射学实践,2012,27(11):1238-1241.
[14] 徐凡,吴梅,郭媛,等.腹盆部炎性肌纤维母细胞瘤的影像征象及病理分析并文献复习[J].磁共振成像,2015,6(1):40-44.
Image features of abdominal inflammatory myofibroblastic tumor based on pathology
SUN Hai-tao,LIU Kai,WANG Yan-qiu,et al.
Department of Radiology,Zhongshan Hospital,Fudan University,Shanghai 200032,China
Objective:To improve diagnostic level by investigating the image features correlating with pathological changes of abdominal inflammatory myofibroblastic tumor (IMT).Methods:9 patients with pathologically proved IMT were enrolled.Results:Among 9 cases,the tumors showed round in 4 cases,oval 2 cases,gourd shape 1 case,and irregular 1 case.4 cases located in the liver,2 cases in the stomach,2 cases adjacent to retroperitoneum and 1 case adjacent to mesenterium.The tumors measured 1.8 to 15.0cm in diameter.CT or MRI presented solid mass in 8 cases,cystic and solid mass in 1 case.The solid parts of all cases showed hypodense on non-enhanced CT,hypointense on T1WI and mixed hyperintense on T2WI.The enhancement patterns of the 9 cases were various,showing striped,nodular and asymmetrical.All 9 cases showed mild to moderate enhancement in arterial phase and persistent enhancement in venous and delayed phases.The margins of 7 tumors were unclear and 2 cases showed relatively clear.Conclusion:Abdominal inflammatory myofibroblastic tumor is rare.CT and MRI can show valuable characteristics of the tumor and provide some help for the diagnosis,but the confirmed diagnosis still depends on the pathological examination.
Abdominal neoplasms; Inflammatory myofibroblastic tumor; Tomography,X-ray computed; Magnetic resonance imaging
200030 上海,复旦大学附属中山医院放射科(孙海涛 刘锴 周建军),病理科(王艳秋)
孙海涛(1992-),男,安徽蚌埠人,硕士研究生,主要从事腹部、骨肌系统影像学诊断工作。
周建军 E-mail:jianjunrcn@163.com
R738.6; R445.2; R814.42
A
1000-0313(2017)02-0162-05
10.13609/j.cnki.1000-0313.2017.02.014
2016-04-25
2016-07-06)

