钙调激酶Ⅱ抑制剂在异动症发生中的分子机制研究
朱忠方,丁喜晴,杨新新,崔桂云,花放,沈霞
·论著·
钙调激酶Ⅱ抑制剂在异动症发生中的分子机制研究
朱忠方,丁喜晴,杨新新,崔桂云,花放,沈霞
目的 探讨钙调激酶Ⅱ(CaMKⅡ)抑制剂在异动症发生中的分子机制。方法 采用6-羟多巴胺立体定向注射至小鼠右侧内侧前脑束制备偏侧帕金森病(PD)小鼠模型,将造模成功的PD小鼠分为PD组(n=11)、KN-92组(n=11)和KN-93组(n=11),并设假手术组(n=10)(在相同部位注射生理盐水作为对照)。KN-92组和KN-93组给予左旋多巴(15 mg/kg) 和苄丝肼 (12 mg/kg) 腹腔注射,假手术组及PD组注射等量的生理盐水,1次/d,持续14 d。在第11 d、12 d左旋多巴给药前,KN-92组纹状体给予KN-92处理,KN-93组纹状体给予K-93处理(2 μl,浓度0.1 μg/μl),假手术组及PD组给予等量生理盐水处理。在给药的第1 d、3 d、5 d、8 d、10 d、13 d行异常不自主运动(AIM)评分。在给药的第4 d、9 d、14 d行左前肢使用率的评价。采用Western blot法检测损伤侧纹状体区环磷腺苷效应元件结合蛋白(CREB)、多巴胺和环磷腺苷调节的磷酸化蛋白-32(DARPP-32)及其磷酸化水平变化情况。 结果 假手术组治疗前后左前肢使用率差异无统计学意义。PD组给药后左前肢使用率逐渐下降,与治疗前比较差异有统计学意义(P<0.01),KN-92组和KN-93组给药后左前肢使用率逐渐升高,与治疗前比较差异有统计学意义(P<0.01)。PD组、KN-92组和KN-93组给药前左前肢使用率两两比较差异无统计学意义。PD组、KN-92组和KN-93组小鼠治疗前及治疗第4 d、9 d左前肢使用率均显著低于假手术组,差异有统计学意义(P<0.01),PD组、KN-92组治疗第14 d左前肢使用率均低于假手术组,差异有统计学意义(P<0.01),KN-93组治疗第14 d左前肢使用率与假手术组比较差异无统计学意义。与PD组比较,KN-92组治疗第4 d、9 d、14 d及KN-93组治疗第4 d、9 d左前肢使用率显著升高(均P<0.01)。与KN-92组比较,KN-93组第14 d左前肢使用率显著升高(P<0.01)。KN-93组、KN-92组小鼠治疗后第1 d、3 d、5 d、8 d、10 d AIM评分呈现逐渐增高趋势,两两比较差异有统计学意义(均P<0.01)。治疗后第14 d,KN-93组AIM评分明显低于KN-92组(P<0.01),治疗后第1 d、3 d、5 d、8 d、10 d,KN-93组AIM评分与KN-92组差异无统计学意义。与假手术组比较,PD组及KN-93组p-DARPP-32及p-CREB水平显著降低(均P<0.01),KN-92组p-DARPP-32及p-CREB水平显著升高(均P<0.01)。与PD组比较,KN-92组p-DARPP-32及p-CREB水平显著升高(均P<0.01),KN-93组比较差异无统计学意义。KN-93组p-DARPP-32及p-CREB水平明显低于KN-92组(均P<0.01)。结论 左旋多巴诱发的异动症可能与CaMKⅡ有关,其抑制剂KN-93可能是治疗PD引发的运动并发症的一种新的治疗方式。
帕金森病;运动并发症;磷酸化;钙调激酶Ⅱ;KN-93
帕金森病(PD)又名震颤麻痹,是一种常见的中老年人神经系统变性疾病[1]。PD的病因尚未完全明确,可能与年龄老化、环境因素、遗传因素、氧化应激、自由基生成、兴奋性氨基酸毒性、免疫异常、细胞凋亡等因素相关[2]。左旋多巴替代疗法是PD治疗发展史上一重要的里程碑[3]。然而左旋多巴治疗PD的“蜜月期”是短暂的,一般是2~5年,之后会出现左旋多巴诱导的异动症(LID)。新近的研究[4]发现,由钙调激酶Ⅱ(CaMK Ⅱ)引起的磷酸化后的环磷腺苷效应元件结合蛋白(CREB)基因转录的开关,它引发的基因表达可加强长时程记忆的形成。LID的发生与左旋多巴长期治疗诱发的皮质纹状体病理性长时程增强(LTP)形成密切相关[5]。同时一些研究[6]也发现,纹状体环磷酸腺苷(cAMP)依赖性蛋白激酶A(PKA)通路和其下游信号转导蛋白多巴胺和环磷腺苷调节的磷酸化蛋白-32(DARPP-32)的活化参与了LID的发生。KN-93是其特异性抑制剂,KN-92是KN-93的无功能结构类似物。本实验通过检测CaMK Ⅱ抑制剂对LID小鼠模型纹状体中CREB、DARPP-32及其磷酸化表达的变化情况,进一步探讨CaMK Ⅱ在LID发生中的作用机制。
1 材料与方法
1 材料
1.1.1 实验动物 雄性C57BL/6小鼠60只,体质量约25 g,购于上海西普尔-必凯实验动物有限公司。将10只小鼠分为假手术组,其余小鼠进行PD造模。
1.1.2 主要试剂及仪器 6-羟基多巴、左旋多巴、苄丝肼(Sigma公司),维生素C、KN-93、KN-92(Cayman Chemical Company);兔源性单克隆抗体磷酸化多巴胺和环磷腺苷调节的磷酸化蛋白-32(p-DARPP-32)、DARPP-32、磷酸化环磷腺苷效应元件结合蛋白(p-CREB)、CREB(CST公司,美国);抗β-肌动蛋白(β-actin)抗体(Vicmed公司)、山羊抗兔二抗(美国LI-COR公司);SDS-凝胶快速配置试剂盒、BCA蛋白浓度测定试剂盒(碧云天公司);KOPF 脑立体定向仪(徐州医学院神经生物学实验室,购于美国 KOPF 公司);电泳仪与电转膜仪(徐州医学院神经生物学实验室,购于Bio-Rad公司)。
1.2 方法
1.2.1 动物模型制备及分组 10%的水合氯醛(0.004 ml/g)腹腔注射将小鼠麻醉后,严格平颅位固定于小鼠脑立体定向仪上,确定纹状体坐标[7]:(1)前囟前1.0 mm,矢状缝左侧2.1 mm,颅骨骨膜下2.9 mm;(2)前囟前0.3 mm,矢状缝左侧2.3 mm,颅骨骨膜下2.9 mm。注射器针头钻孔,造模小鼠用10 μl的微量注射器抽取6-羟基多巴4 μl(0.2%维生素C配置,浓度3 μg/μl)[8],每点注射2 μl。为减少组织损伤,进针速度为0.5 μl/min,留针10 min后退针缝合创口。假手术组在相同坐标注射等量的无菌生理盐水。注射4周后,行圆柱体实验评分,具体如下:小鼠被放在一个直径10 cm,高14 cm的圆柱体玻璃瓶中观察5 min,记录每只小鼠右爪或左爪及两爪同时碰壁的次数,只有完全碰壁时才可以被计数。最后以损伤侧(即左侧)前爪碰壁次数与总两爪同时碰壁次数的比值作为对损伤功能的测定来筛选PD小鼠。损伤对侧爪贴壁与共同使用两爪贴壁的次数比值小于40%的小鼠即为成功PD模型。将造模成功的PD小鼠随机分为PD组(n=11)、KN-92组(n=11)和KN-93组(n=11)。
1.2.2 给药方法 KN-93组及KN-92组小鼠于每天上午9点将左旋多巴(15 mg/kg)和苄丝肼(12 mg/kg)溶于含0.2%维生素C的消毒生理盐水中进行腹腔注射,每日1次,持续14 d;假手术组及PD组腹腔注射等量生理盐水。于第11 d、12 d给予腹腔注射左旋多巴后,KN-93组小鼠通过立体定向对损伤侧纹状体注射KN-93(溶于生理盐水,浓度0.1 μg/μl,注射2 μl),KN-92组小鼠同时注射同体积KN-92(溶于生理盐水,浓度0.1 μg/μl,注射2 μl),坐标为前囟前0.5 mm,矢状缝左侧2.0 mm,颅骨骨膜下2.5 mm[7]。假手术组及PD组小鼠腹腔及纹状体给予同体积生理盐水。
1.2.3 行为学观察
1.2.3.1 左前肢使用率的评价 采用圆柱体实验,于给药前及给药后第4 d、9 d、14 d时分别评价各组小鼠的左前肢使用率。小鼠被放在一个直径10 cm,高14 cm的圆柱体玻璃瓶中观察5 min,记录每只老鼠右爪或左爪及两爪同时碰壁的次数,只有完全碰壁才可以被计数。最后以损伤侧(即左侧)前爪碰壁次数与总两爪同时碰壁次数的比值作为左前肢使用率的测定。
1.2.3.2 不自主运动的评价 于造模后第1 d、3 d、5 d、8 d、10 d、13 d给药后2 h每隔20 min对小鼠进行1次异常不自主运动(AIM)评分[9],每次观察1 min,AIM评分按观察时间内总积分的平均数进行统计。AIM分成3个部分(上肢AIM、口面部AIM、轴性AIM)进行评定,每部分又根据其有无和严重程度分为5个等级:(1)0级:无;(2)1级:AIM存在不到观察时间的50%;(3)2级:AIM存在大于观察时间的50%;(4)3级:持续存在,刺激使之停止;(5)4级:持续存在,刺激不能使之停止。另外根据肢体和轴向运动障碍的幅度,再分为0~4个等级:(1)轴向的AIM的幅度是由动物的颈部及躯干从小鼠躯体的纵向轴线的横向偏离(或扭转)程度来定:①1级:头颈部扭转在0°~30°;②2级:头颈部扭转在30°~60°;③3级:头颈部、躯干上部扭转在60°~90°;④4级:头颈躯干扭转>90°,失去平衡。(2)肢体的AIM的振幅是基于四肢活动的程度和近端肌肉群的收缩程度:①1级:上肢远端和爪有轻微震颤;②2级:近远侧上肢有明显的移动;③3级:整个上肢有明显移动,并伴有肩部肌肉收缩;④4级:强烈的上肢和肩部大幅度的运动,有偏侧投掷样的特征。
1.2.4 纹状体CREB及DARPP-32磷酸化水平的检测 采用Western blot法检测纹状体部位CREB及DARPP-32磷酸化水平的表达。所有小鼠于第15 d断头处死,快速开颅取脑分离纹状体。加入匀浆液(强裂解液+蛋白酶抑制剂+磷酸酶抑制剂,其中裂解液的量为组织块重量×4 μl,蛋白酶抑制剂和磷酸酶抑制剂量∶裂解液量=1∶100),用电动匀浆器匀浆,每匀浆10 s停顿30 s,重复2~3次。将组织或细胞匀浆物转移到离心管,15 000 r/min,4℃离心30 min,取上清,用BCA法蛋白浓度测定试剂盒检测蛋白浓度,取样本(10 μl)经10%SDS-聚丙烯酰胺凝胶电泳后,通过电转膜仪(Bio-Rad)转印蛋白至NC(硝酸纤维素)膜,用封闭液室温封闭1.5 h,加入CREB或p-CREB、DARPP-32或p-DARPP-32的兔抗溶液及抗β-actin的鼠抗溶液 (滴度均为1∶500),4℃孵育过夜;洗后加山羊抗兔二抗或山羊抗小鼠二抗(1∶10 000),室温孵育1.5 h;洗后再移入Odyssey红外激光扫描成像系统玻璃板上方,按照该机器使用说明设置参数,扫描条带,显示结果并进行图像分析。

2 结 果
2.1 各组左前肢使用率的比较 见表1。假手术组治疗前后左前肢使用率差异无统计学意义。PD组给药后左前肢使用率逐渐下降,与治疗前比较差异有统计学意义(P<0.01),KN-93组给药后左前肢使用率逐渐升高,治疗后第14 d与治疗前比较差异有统计学意义(P<0.01),KN-92组给药前后左前肢使用率差异无统计学意义。PD组、KN-92组和KN-93组给药前左前肢使用率两两比较差异无统计学意义。PD组、KN-92组和KN-93组小鼠治疗前及治疗第4、9 d左前肢使用率均显著低于假手术组,差异有统计学意义(均P<0.01),PD组、KN-92组治疗第14 d左前肢使用率均低于假手术组,差异有统计学意义(P<0.01),KN-93组治疗第14 d左前肢使用率与假手术组比较差异无统计学意义。与PD组比较,KN-92组治疗第4、9、14 d及KN-93组治疗第4、9 d左前肢使用率显著升高(均P<0.01)。与KN-92组比较,KN-93组第14 d左前肢使用率显著升高(P<0.01)。
2.2 各组AIM评分的比较 见表2。各组治疗前均无不自主运动,给药后KN-93组、KN-92组小鼠出现不自主运动。KN-93组、KN-92组小鼠治疗后第1、3、5、8、10 d AIM评分呈现逐渐增高趋势,两两比较差异有统计学意义(均P<0.01)。治疗后第14 d,KN-93组AIM评分明显低于KN-92组(P<0.01),治疗后第1、3、5、8、10 d ,KN-93组AIM评分与KN-92组差异无统计学意义。
2.3 各组纹状体CREB及DARPP-32磷酸化水平的比较 见表3。各组间CREB及DARPP-32水平差异无统计学意义。与假手术组比较,PD组及KN-93组p-DARPP-32及p-CREB水平显著降低(均P<0.01),KN-92组p-DARPP-32及p-CREB水平显著升高(均P<0.01)。与PD组比较,KN-92组p-DARPP-32及p-CREB水平显著升高(均P<0.01),KN-93组比较差异无统计学意义。KN-93组p-DARPP-32及p-CREB水平明显低于KN-92组(均P<0.01)。

表1 各组左前肢使用率的比较(x±s)组别例数治疗前(%)治疗后(%)第4d第9d第14dPD组1120.35±5.21#16.17±3.19*#11.00±4.95*#5.50±2.78*#KN-93组1120.62±3.69#23.56±4.37#△28.72±5.13#△33.18±5.89*#▲KN-92组1120.67±3.12#23.81±6.31#△29.56±5.32#△20.92±4.58△假手术组1033.46±5.4633.21±5.2033.32±4.8133.25±5.31 注:与治疗前比较*P<0.01;与假手术组比较#P<0.05;与PD组比较△P<0.01;与KN-92组比较▲P<0.01
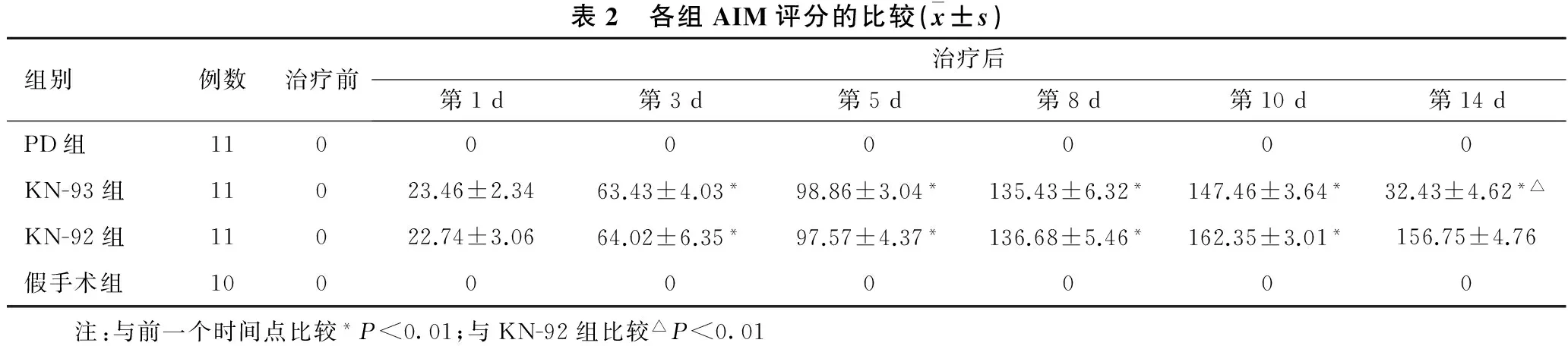
表2 各组AIM评分的比较(x±s)组别例数治疗前治疗后第1d第3d第5d第8d第10d第14dPD组110000000KN-93组11023.46±2.3463.43±4.03*98.86±3.04*135.43±6.32*147.46±3.64*32.43±4.62*△KN-92组11022.74±3.0664.02±6.35*97.57±4.37*136.68±5.46*162.35±3.01*156.75±4.76假手术组100000000 注:与前一个时间点比较*P<0.01;与KN-92组比较△P<0.01
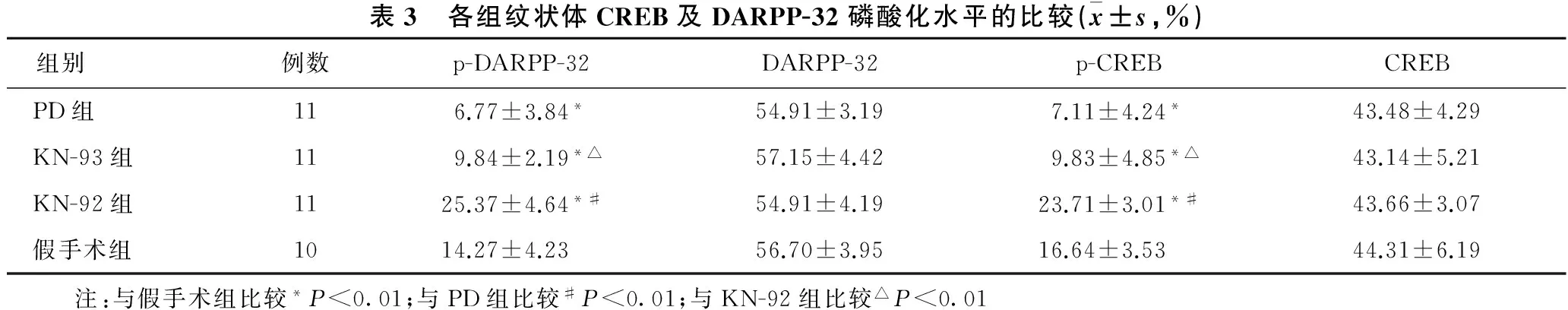
表3 各组纹状体CREB及DARPP-32磷酸化水平的比较(x±s,%)组别例数p-DARPP-32DARPP-32p-CREBCREBPD组116.77±3.84*54.91±3.197.11±4.24*43.48±4.29KN-93组119.84±2.19*△57.15±4.429.83±4.85*△43.14±5.21KN-92组1125.37±4.64*#54.91±4.1923.71±3.01*#43.66±3.07假手术组1014.27±4.2356.70±3.9516.64±3.5344.31±6.19 注:与假手术组比较*P<0.01;与PD组比较#P<0.01;与KN-92组比较△P<0.01
3 讨 论
临床研究[8]结果显示,约有80%的PD患者在接受长期左旋多巴治疗后出现运动并发症,并且随着治疗时间的延长及疾病的加重,其发生率增加且发生的程度加重。本研究结果表明PD小鼠在接受波动性左旋多巴治疗后AIM评分呈现逐渐升高后趋于平稳的趋势,这表明PD小鼠的AIM行为学与人类PD诱发的LID在表现特征上具有相似性,可以作为研究LID的啮齿类模型[9]。
皮质纹状体Glu能投射中系统是脑内最重要的兴奋性氨基酸投射系统之一,广泛介导各种生理过程,在脑内信息加工和处理,传导径路的重塑中占有重要地位。研究[10]表明,皮质纹状体突触活性增强在基底节环路的失衡改变中为一关键环节,与LID的发生密切相关,而突触长时程电位(LIP)的可塑性改变常伴随突触前及突触后蛋白的异常磷酸化,突触的形态结构和功能发生变化。早期的研究[4]表明,CaMK Ⅱ与多种形式的行为学及突触可塑性有关,并指出CaMK Ⅱ信号介导的多种靶蛋白磷酸化在突触反应中发挥重要角色。新近的研究[5]发现,由CaMK Ⅱ引起磷酸化后的CREB是基因转录的开关,它引发的基因表达可加强长时程记忆的形成。而LID的发生与左旋多巴长期治疗诱发的皮质纹状体病理性LTP形成密切相关[6],因此体内CaMK Ⅱ信号激酶介导GluR1的丝氨酸参与了运动并发症的发生[11]。既往研究[12]表明,多巴胺作用于D1受体引起直接通路的过度激活在异动症的发生中起重要作用。多巴胺通过D1受体引起一系列病理性的分子生物学和蛋白改变,其中慢性左旋多巴治疗激活腺苷酸环化酶(AC),生成cAMP,进而激活PKA,PKA导致DARPP-32的Thr34位点磷酸化增加,减少Thr75位点磷酸化,Thr34位点磷酸化增加后通过抑制下游的目的蛋白-蛋白质磷酸酶Ⅰ进一步增强PKA效应。磷酸化DARPP-32可以磷酸化细胞外信号调节激酶1/2(ERK1/2),同时启动相关的级联反应激活下游的两种转录因子:CERB和Elk-1。CREB对多种基因如FosB和强啡肽基因表达有调控作用。这些都表明DARPP-32磷酸化激活后在LID的发生中起重要作用[13]。CaMK Ⅱ可以导致内源性多巴胺的增加,而波动性的多巴胺刺激可导致纹状体中PKA通路的过度活化,促进DARPP-32磷酸化水平异常升高,从而诱发LID的发生。本研究发现,给予左旋多巴腹腔注射的KN-93组、KN-92组的第1 d、3 d、5 d、8 d、10 d AIM评分呈现逐渐增高趋势,两两比较差异有统计学意义(均P<0.01)。治疗后第14 d,即给予KN-93及KN-92干预后,KN-93组AIM评分明显低于KN-92组(P<0.01)。PD组、KN-93组及KN-92组给予6-羟基多巴处理的小鼠左前肢使用率显著下降,予左旋多巴处理后,KN-92组治疗第4 d、9 d、14 d及KN-93组治疗第4 d、9 d左前肢使用率显著高于PD组(均P<0.01)。治疗后第14 d,即给予KN-93或KN-92干预后,KN-93组左前肢使用率显著高于KN-93组(P<0.01)。提示KN-93可以在不影响左旋多巴治疗PD作用的同时减少PD小鼠LID的发生。通过KN-93抑制CaMKⅡ的活性,不仅可以有效逆转了长期左旋多巴所诱导的AIM评分明显下降及左前肢使用率的提高,而且通过Western blot法检测损伤侧纹状体区CREB、DARPP-32及其磷酸化水平变化情况发现,KN-93抑制了CREB及DARPP-32的磷酸化表达,进而改善了LID的症状,推测是由于CaMKⅡ抑制了PKA信号系统进而导致下游信号分子表达变化所致。
综上所述,LID可能与纹状体投射神经元内的CaMK Ⅱ有关,其抑制剂 KN-93可能是治疗PD引发的运动并发症的一种新的治疗方式。对于CaMK Ⅱ抑制剂 KN-93的自身调节机制、作用机制及与其他信号蛋白间的相互作用机制,有待进一步详细研究,才能为临床治疗LID提供一个新的治疗靶点。
[1]Rothwell JC, Edwards MJ. Parkinson’s disease[J]. Handb Clin Neurol, 2013,115:535.
[2]李晓庆,郑国庆.帕金森病的神经保护治疗[J].中国现代实用医学杂志,2004,3:37.
[3]Sulzer D,surmeier DJ.Neuronal vulnerability pathogenesis,and Parkinson’s disease[J]. Mov Disord, 2013,28:41.
[4]Peltier J,O’Neill AV.Schaffer D.PI3K/Akt and CREB regulate adult neural hippocampal progenitor proliferation and differentiation[J]. Devel Neurobio, 2007,67:1348.
[5]张广辉,王超峰.CREB依赖的突触长时程增强[J].中国医学物理学杂志,2011,28:2767, 2780.
[6]宋璐,马雅萍,刘振国,等.左旋多巴诱导帕金森病异动症与纹状体DARPP-32磷酸化的关系[J].中国神经免疫学和神经病学杂志,2011,18:1.
[7]Lundblad M, Picconi B, Lindgren H, et al. A model of L-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function[J]. Neurobiol Dis, 2004, 16: 110.
[8]巴茂文,刘振国.左旋多巴诱发异动症的病理生理机制研究进展[J].中华神经科杂志,2005:403.
[9]Lundblad M, Andersson M, Winkler C, et al. Pharmacological validation of behavioural measures of akinesia and dyskinesia in a rat model of Parkinson’s disease[J]. Eur J Neurosci, 2002, 15: 120.
[10]曹学兵,孙圣刚,王岚,等.左旋多巴诱发异动症大鼠皮质纹状体突触超微结构与功能的变化[J].中华神经科杂志,2004,37:126.[11]巴茂文,孔敏,于国平,等.钙调激酶Ⅱ抑制剂对帕金森病运动并发症大鼠谷氨酸受体GluR1亚基特性的影响[J].中华行为医学与脑科学杂志,2010,19:888.
[12]Stocchi F, Olanow CW. Continuous dopaminergic stimulation in early and advanced Parkinson’s disease[J]. Neurology, 2004, 62: S56.
[13]杨新新,任甜甜,吴娜,等.可控释左旋多巴和苄丝肼微球减少帕金森病大鼠异动症的发生[J].中华神经科杂志,2011,44:820.
Study on the molecular mechanism of calmodulin kinase Ⅱ inhibitor on the occurrence of dyskinesia
ZHUZhong-fang,DINGXi-qing,YANGXin-xin,etal.
DepartmentofNeurology,theAffiliatedHospitalofXuzhouMedicalCollege,Xuzhou221006,China
Objective To investigate the molecular mechanism of calmodulin kinase Ⅱ (CaMK Ⅱ) inhibitor on the occurrence of dyskinesia. Methods 6-hydroxy dopamine was injected into the right medial forebrain bundle to establish the model of Parkinson’s disease (PD) mice.The established PD mice were divided into PD group(n=11), KN-92 group(n=11) and KN-93 group(n=11). Another group of sham-operated mice was involved as control(n=10). KN-92 group and KN-93 group received intraperitoneal injection of L-DOPA (15 mg/kg) and Benserazide (12 mg/ kg), mice in sham-operated group and PD group were injected with the same volume of physiological saline, once daily for 14 d. At 11 d and 12 d, KN-92 or KN-93 (2 μl, concentration 0.1 μg/μl) was intrastriatumly injected into mice before L-doap treatment. Mice in sham -operated group and PD group received normal saline treatment. At 1 d, 3 d, 5 d, 8 d, 10 d and 13 d of treatment, abnormal involuntary movement scale (AIM) was performed in sham -operated group, PD group,KN-92 group and KN-93 group. At 4 d, 9 d and 14 d of treatment,the rate of usage of left fore was evaluated. The levels of cAMP-response element binding protein (CREB), dopamine and cAMP-regulated phosphoprotein of Mr 32 000 (DARPP-32), phosphorylated levels of CREB and DARPP-32 were determined by western blot. Results There was no difference in the rate of usage on left fore after operation when compared with original condition in sham-operated group. Surprisingly the rate of usage on left fore decreased clearly after treatment and there was significantly difference in using rate when compared with it before treatment in PD treatment group (P<0.01). The rate of usage on left fore increased clearly after treatment and there was significantly difference in KN-92 and KN-93 treating group when compared with it before treatment (P<0.01). Before treatment there was no difference in rate of usage on left fore among all groups. At 4 d and 9 d after treatment the rate of usage on left fore in PD, KN-92, and KN-93 group was lower than that in sham-operated group (P<0.01). At 14 d, there was no difference between KN-93 group and sham-operated group but in both PD and KN-92 treating group rate of usage still lower than that in sham-operated group (P<0.01). The rate of usage on left fore at 4 d, 9 d and 14 d in KN-92 group and at 4 d and 9 d in KN-93 group were significantly higher than those in PD group in corresponding days (allP<0.01). Especially at 14 d, the rate of usage on left fore in KN-93 group was significantly higher than that in KN-92 group (P<0.01). The AIM score in mice increased gradually in 1 d, 3 d, 5 d, 8 d and 10 d after treatment with KN-92 and KN-93 when compared with PD treatment (P<0.01). Except at 14 d, the AIM score was higher after KN-92 treatment there was no difference on all other observing days between KN-92 and KN-93 treatment. The phosphorylated levels of CREB and DARPP-32 were both higher in mice of KN-92 group than those in PD group, and the differences were statistically significant (P<0.01). Moreover, the phosphorylated levels of CREB and DARPP-32 in mice of KN-93 group were significantly reduced, and the differences were statistically significant (P<0.01). Conclusion L-DOPA induced dyskinesia may be associated with CaMK Ⅱ and its inhibitor KN-93 may be used in the treatment of PD motor complications as a new option.
Parkinson’s disease;motor complications;phosphorylation;calmodulin kinase Ⅱ;KN-93
国家自然科学基金(81301077);江苏省高校自然科学基金(13KJB320026)
221006徐州医学院附属医院神经内科
杨新新
R742.5
A
1004-1648(2017)01-0040-05
2015-10-09
2016-03-18)

