两种水稻的镉积累能力和生理特性研究
马志强 ,王培培 ,孙溪 ,3,靳涛
由于工业生产废弃物和农业生产中农药化肥等的施放,我国农田土壤普遍存在不同程度的重金属污染。有统计数据显示,我国遭受重金属污染的耕地面积约有25亿hm2[1]。环保部及国土资环部2014年公布的全国6.3亿hm2土地污染状况评估报告指出,重金属污染面积占总调查面积的21.7%,其中以镉(Cd)污染最为突出,约占7%[2]。镉是一种生物毒性很强的重金属元素,可造成农作物生长发育受阻,产量和品质下降[3],并通过食物链的富集作用传递和积累在人体内,危害人类健康。水稻是我国乃至世界的主要粮食作物,世界上有接近一半的人口以稻米为主食。水稻也是人体摄入镉元素的重要来源之一[4]。因此研究水稻作物中重金属镉的代谢机制,对于调控水稻作物对镉的吸收和积累有重要意义。科学选育低积累镉的水稻品种,能够实现在中轻度镉污染的土地上生产镉含量不超标的稻米,保障农业安全生产。前期研究表明,镉在水稻植株中不同部位的积累具有很大差异[5-6],不同水稻品种对镉的吸收积累也存在显著的基因型差异[7-9]。然而,以往研究多以水稻的地方自然品种为材料,针对水稻同一品种的野生型和突变体的镉积累差异研究却鲜见报道。本研究以‘日本晴’的野生型和乙烯信号相关基因突变体为材料,研究二者不同组织的镉积累差异,并对二者的生理特性做比较研究,为深入探索水稻基因型与镉积累能力之间的关系打下基础,也为利用基因型筛选低镉水稻品种提供一定的参考依据。
1 材料与方法
1.1 供试水稻材料与培养
供试水稻品种为粳稻品种‘日本晴’野生型和其基因突变体ET-M,由农业部环境保护科研监测所提供。选取饱满均一的水稻种子,于1%次氯酸钠溶液中浸泡消毒15 min,用去离子水冲洗2遍,放在培养皿中保持湿润状态,置于28℃恒温箱,待胚芽露白后播种于育苗盘中,置于人工智能气候室中培养,在两叶一心时选取长势均一的幼苗,移至盛有Hoagland营养液的育苗箱(附80个插秧孔的盖板),2~3 d更换一次营养液。三叶一心时,向不同育苗箱中添加Cd2+溶液(CdCl2·2.5H2O),使Cd2+终浓度为0.5 mg/L或1 mg/L,以不添加Cd2+为对照(CK),每处理3次重复,5 d后开始取样,分别测定根部和叶片的镉含量。同时,收取部分样品立即用液氮速冻,于-80℃温度下保存或者收取后立即用于各项酶活指标的测定。
1.2 取样与测定方法
将剪下的幼根和幼叶分别于80℃烘箱中烘干,将每组样品准确称取0.25 g,置于消煮管中,加入 10 mLHNO3-HClO4混合液(VHNO3:VHClO4=7:1),过夜,然后置于平板炉上消煮,温度190~200℃,消煮至溶液变为无色并冒白烟,体积蒸发至1 mL左右,为消煮完成。用去离子水定容至25 mL,过滤后用原子吸收仪(AAS ZEEnit 700)测定样品Cd2+浓度。
取0.2 g新鲜的水稻组织在液氮中研磨,加入磷酸盐缓冲液(0.1 mol/L,pH=7.4),制备成酶萃取液。超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光化还原法[10]。反应混合物(3.0 mL)包括2.95 mL 50 mmol/L磷酸缓冲液(pH=7.8)、13 mmol/L甲硫氨酸、75 mmol/L氮蓝四唑、0.1 mmol/L EDTA、2 mmol/L维生素B2,以及0.05 mL酶萃取液。一组避光反应混合物(不发生变色反应)为对照。在560 nm下,将SOD酶对硝基氮蓝四唑的光化学还原产生半数抑制的酶量定义为1个酶活力单位。
过氧化氢酶(CAT)测定:反应混合物(3.0 mL)含2.8 mL的50 mmol/L NaH2PO4缓冲液(pH=7.0)、19 mmol/L H2O2和0.2 mL的酶萃取液。在240 nm下溶液吸光度的减少量,定义为H2O2的分解量。每毫克酶蛋白每分钟所分解的H2O2的毫摩尔数作为一个酶活力单位[11]。
过氧化物酶(POD)的测定:反应混合物(3.0mL)含2.95 mL的100mmol/LNaH2PO4缓冲液(pH=6.0)、2 mmol/L H2O2,9 mmol/L愈创木酚以及0.05 mL的酶萃取液。在H2O2存在下,棕色的愈创木酚在460 nm处吸光度的变化值代表POD酶的活性[11]。
丙二醛(MDA)含量通过硫代巴比土酸(TBA)活性代谢物来测定。取0.2 g新鲜样品溶解于10 mL的10%三氯乙酸和0.25%TBA混合溶液中,95℃加热30 min,然后冰上迅速冷却。10 000 g离心10 min,测定上清液在532 nm下的吸光度值。非特异性吸光度校正是通过减去600 nm的吸光值来完成。脂质过氧化的水平以nmol/g鲜重表示[10]。
还原型谷胱甘肽(GSH)的测定是将新鲜组织放于研钵中,加入2 mL 0.1%三氟乙酸(含6.3 mmol/L DTPA)(pH<1)和少量石英砂,冰浴并充分研磨,离心(4℃,10 000 g,10 min),上清液冷藏,用于分析测定。为避免巯基化合物接触空气氧化,立即进行柱前衍生化反应。用100%乙氰准确配制25 mmol/L mBBr衍生化试剂,震荡混匀后避光4℃保存,现配现用。向250 μL植物组织上清液中加入450µL 200 mmol/L HEPPS(含6.3 mmol/L DTPA,pH=8.2)和 10µL 25 mmol/L mBBr,充分混合45℃反应,30 min后加入300µL 1 mmol/L甲磺酸终止反应,摇匀,转移至棕色顶空瓶内,4℃保存,高效液相色谱仪分析测定[11]。
1.3 数据处理
采用sigmaplot 12.0软件进行显著性分析。
2 结果与分析
2.1 两种水稻体内的镉积累量差异
两种水稻于0.5 mg/L和1 mg/L Cd2+浓度条件下胁迫5 d后,根部的镉积累量大约是叶片的40倍以上,可能是由于根系与外界含镉培养液直接接触,被动扩散和主动运输作用导致镉离子在根部积累较多,而在叶片的积累是依靠根部向上的局部运输。从图1可以看出,在0.5 mg/L浓度下,两种水稻根部的镉积累量没有明显差异,但是叶片中的镉含量差异极显著;而在1 mg/L浓度下,两种水稻根部和叶片中的镉含量,均表现出了显著差异。说明两种水稻在相同镉胁迫条件下,镉积累量存在着显著差异,突变体ET-M的镉积累能力相对较低。ET-M是乙烯信号相关基因的突变体,分析其镉积累较低的原因可能是植物的乙烯信号途径能够影响其对重金属胁迫的耐受性[12-13],突变体由于抗镉胁迫能力降低而不能耐受高浓度的镉,因此积累的镉相对较少;同时,乙烯信号基因突变也可能影响镉由根部向地上部的转运,因为镉积累的差异在两种水稻的地上部分更为明显。
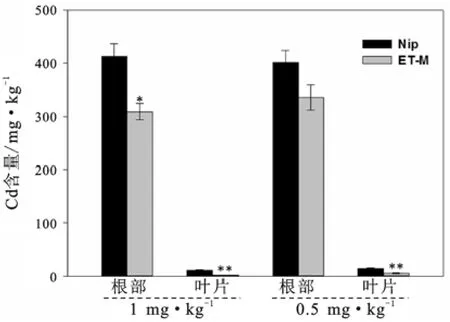
图1 ‘日本晴’野生型Nip和突变体ET-M在不同浓度胁迫下的镉积累量
2.2 两种水稻的抗氧化酶活性差异分析
植物本身具有一系列重要的耐受机制来避免或降低重金属诱导的氧化损伤,这些机制包括抗氧化酶体系,如超氧化物歧化酶SOD、过氧化氢酶CAT、过氧化物酶POD等[14-17]。为研究两种水稻在镉胁迫后的抗氧化能力,分别测定两种水稻在0.5 mg/L和1 mg/L Cd2+条件下胁迫5 d后,3种抗氧化酶活性的变化及差异。结果表明,0.5 mg/L胁迫浓度下,两种水稻的酶活性没有显著性差异,而在1 mg/L胁迫浓度下,两种水稻的酶活性存在差异。说明品种间的酶活差异因处理浓度而异,一般情况下,高浓度处理可能更容易体现这种差异性。
图2~图4显示了在1 mg/L胁迫浓度下两种水稻的3种酶活性。由图2可以看出,两种水稻的叶片酶活性没有显著的差异,结合图1结果,可能由于叶片积累的镉含量较低,尚未对植物的酶活性产生较明显的影响。在镉胁迫前后,野生型Nip根部的SOD酶活性没有发生显著变化,而突变体ET-M的酶活性则发生显著变化。ET-M的SOD酶活性在胁迫前后都显著低于野生型Nip。图3表明,野生型根部的CAT酶活性在镉胁迫后没有发生显著变化,而ET-M则发生显著变化,ET-M的酶活在胁迫后显著低于其胁迫前的对照和野生型组。图4为POD酶的变化情况。由图4可知,两种水稻在胁迫前后相比,以及两种水稻之间进行比较,POD酶活性均无显著差异,说明该酶的胁迫反应可能和镉处理浓度、处理时间以及品种基因型等诸多因素有关。综合以上结果可知,相比高积累的野生型,低积累型ET-M的抗氧化酶活性可能对镉胁迫较为敏感(表现为它在镉胁迫前后发生显著变化),并且ET-M在镉胁迫(前)后的抗氧化能力在一定程度上低于野生型。另外,试验结果也说明在同一种胁迫浓度下,水稻中有些酶活性受到影响,有些酶活性可能没受到影响,不同酶类的胁迫反应阈值不尽相同。
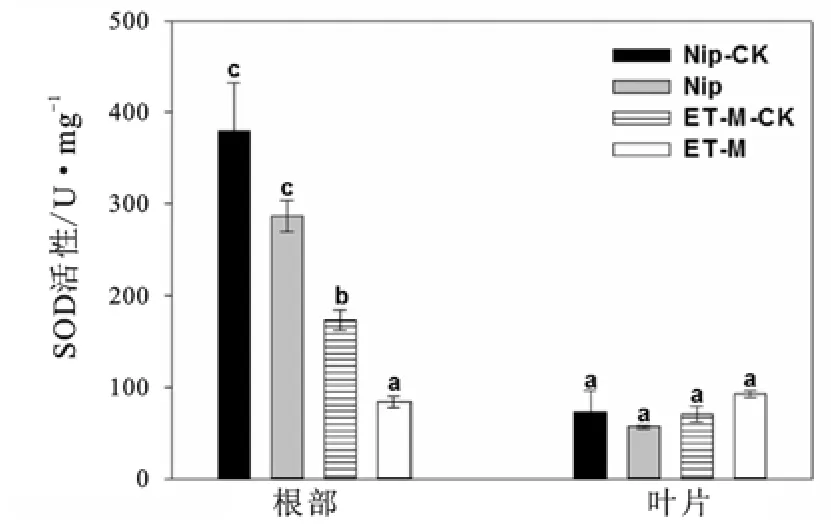
图2 镉胁迫前后两种水稻的SOD酶活性
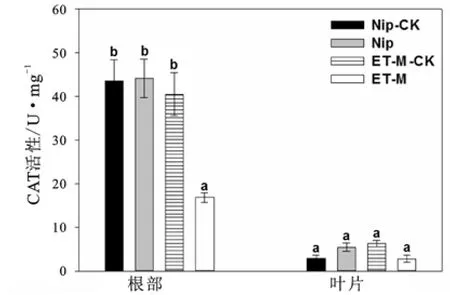
图3 镉胁迫前后两种水稻的CAT酶活性
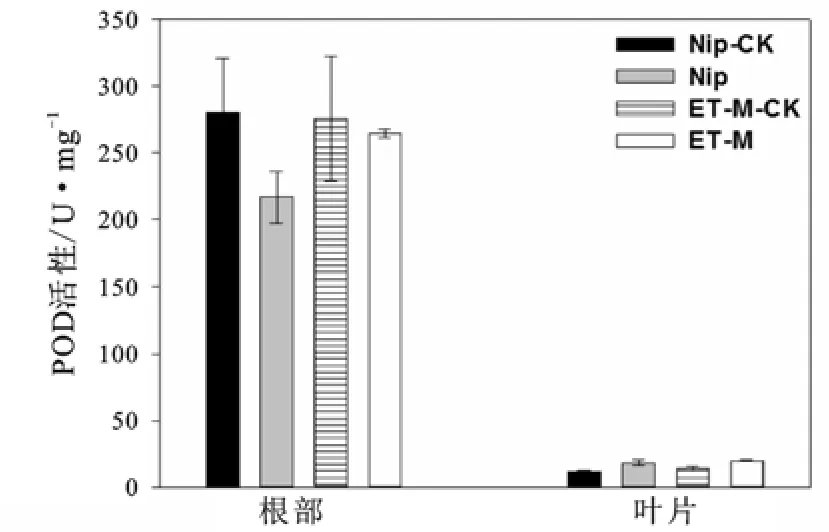
图4 镉胁迫前后两种水稻的POD酶活性
2.3 两种水稻的GSH和MDA含量分析
还原型谷胱甘肽(GSH)是生物细胞内普遍存在的具有抗氧化能力的有机物质,GSH含量对于缓解植物氧化胁迫有重要作用[18-19]。如图5所示,在1 mg/L镉胁迫后,两种水稻叶片的GSH含量没有明显差异,但根部的GSH含量在镉胁迫后显著高于胁迫前含量,可能是镉胁迫促进了根部细胞的GSH生成。ET-M胁迫后,GSH含量也显著高于野生型胁迫后的含量。丙二醛(MDA)是植物组织在逆境下遭受氧化胁迫后发生脂质过氧化的产物,它能反映细胞膜脂过氧化的程度以及植物对逆境条件反应的强弱[20]。在本试验中,两个品种叶片中的MDA含量基本没有差异(图6),而ET-M根部的MDA含量稍高于野生型根部的MDA含量,但差异不显著。
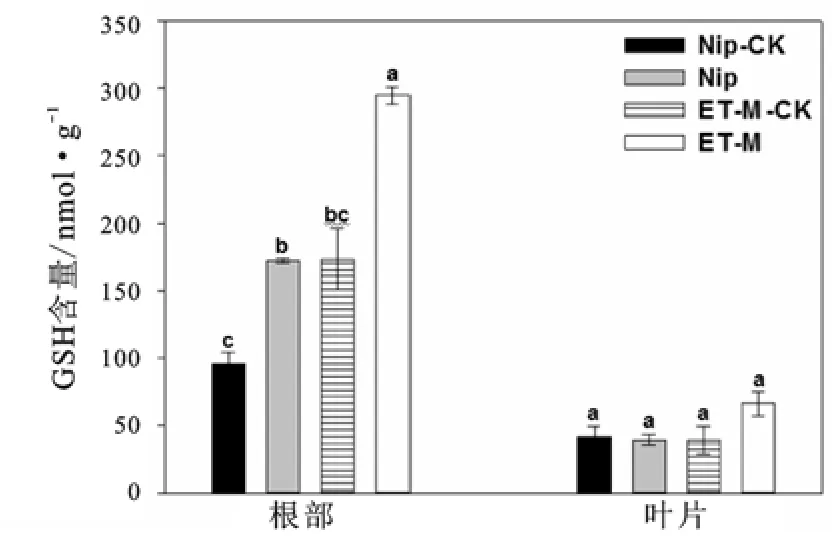
图5 镉胁迫前后两种水稻的GSH含量
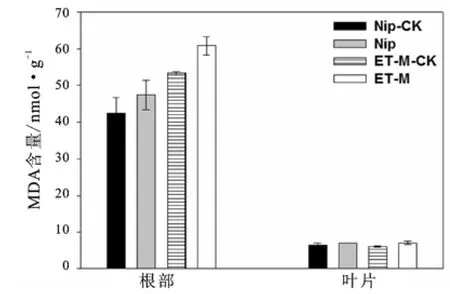
图6 镉胁迫前后两种水稻的MDA含量
3 讨论
目前农业环境中的镉污染非常普遍,直接导致镉超标稻米数量上升,威胁着人类健康。研究不同基因型水稻对镉的吸收积累差异,对于调控污染耕地上水稻安全生产有着重要的指导意义。本研究以粳稻‘日本晴’野生型及其基因突变体为材料,比较镉积累差异,分析其SOD、CAT、POD和GSH等组成的抗氧化系统差异,初步探讨不同基因型水稻的镉积累特性和其镉抗性之间的关系,为下一步基因突变体影响镉代谢的机理研究奠定理论基础。本研究结果初步认为,‘日本晴’的基因突变体ET-M是一种相对低积累镉的品种,其组织内的SOD和CAT酶活性都显著低于高积累镉的野生型,这和以往镉低积累品种的抗氧化酶活结果相似[21-23]。POD酶在两个品种间并无差异,这可能与镉胁迫的浓度、胁迫时间的长短、生育期、组织部位差异以及植物的基因型等因素有关。
镉元素通过根部的皮层细胞进入到植株的根部,其中一部分直接进入液泡,另外一部分则通过木质部运往地上部分,现有许多报道均指出根部镉含量要明显高于地上部[5-6],本试验中,根部的镉含量是地上部的40倍以上。另外,诸多研究结果也证明了不同植物中根部向地上部运输重金属元素的能力不同,该能力越强,重金属对植物的危害越大[7-8]。本试验中,在0.5 mg/L浓度下,两种水稻根部的镉积累量没有明显差异,但是叶片中的镉含量差异极显著,说明突变体水稻向上运输镉的能力与野生型存在差异。找到影响突变体和野生型向上运输镉差异的因素,对稻米的安全生产有重要指导意义。
脂质过氧化可以作为植物遭受Cd氧化损伤的第一指标,通常根据MDA的含量来判断膜脂过氧化损伤的程度。本试验中,‘日本晴’野生型和ET-M在镉胁迫后MDA含量均有所增加,但并不显著,这与以往结果不尽相同[21]。分析原因可能是植物只有在一定的胁迫浓度以上,以及一定的胁迫时间,才会发生膜质过氧化即MDA含量的显著变化。在酶活试验上,‘日本晴’野生型的SOD和CAT酶活性在胁迫前后未发生显著变化,ET-M则对镉胁迫较为敏感,表现为胁迫前后发生了显著变化,并且野生型受胁迫后的酶活性显著高于ET-M胁迫后的酶活性。结合前期文献报道,推测ET-M的乙烯相关基因的突变能够影响其抗重金属氧化损伤的能力,导致ET-M在镉胁迫后酶活变化明显,同时也低于野生型镉胁迫后的酶活性。该试验结果一方面说明镉积累特性和基因型有必然联系[9],另一方面,也暗示了乙烯信号途径、镉胁迫和植物抗氧化能力三者之间可能互相影响[12]。本研究结果为后续深入研究‘日本晴’野生型和突变体的镉代谢差异打下基础,也为低镉水稻品种的基因筛选提供了参考依据。
[1]崔斌,王凌,张国印,等.土壤重金属污染现状与危害及修复技术研究进展[J].安徽农业科学,2012,40(1):373-375,447.
[2]环境保护部,国土资源部.全国土壤污染状况调查公报[R].2014.
[3]刘海亮,崔世民,李强,等.镉对作物种子萌发、幼苗生长及氧化同工酶的影响[J].环境科学,1992,13(5):31-35.
[4]张潮海,华村章,邓汉龙,等.水稻对污染土壤中镉、铝、铜、锌的富集规律的探讨[J].福建农业学报,2003,18(3):147-150.
[5]文志琦,赵艳玲,崔冠男,等.水稻营养器官镉积累特性对稻米镉含量的影响[J].植物生理学报,2015,51(8):1280-1286.
[6]居学海,张长波,宋正国,等.水稻籽粒发育过程中各器官镉积累量的变化及其与基因型和土壤镉水平的关系[J].植物生理学报,2014,50(5):634-640.
[7]李坤权,刘建国,陆小龙,等.水稻不同品种对镉吸收及分配的差异[J].农业环境科学学报,2003,22(5):529-532.
[8]吴启堂,陈卢,王广寿.水稻不同品种对Cd吸收累积的差异和机理研究[J].生态学报,1999,19(1):104-107.
[9]杨春刚,廖西元,章秀福,等.不同基因型水稻籽粒对镉积累的差异[J].中国水稻科学,2006,20(6):660-662.
[10]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002.
[11]Guo B,Liang Y C,Zhu Y G,et al.Role of salicylic acid in alleviating oxidative damage in rice roots(Oryza sativa)subjected to cadmium stress[J].Environmental Pollution,2007,147(3):743-749.
[12]Thao N P,Khan M I R,Thu N B A,et al.Role of ethylene and its cross talk with other signaling molecules in plant responses to heavy metal stress[J].Plant Physiology,2015,169:73-84.
[13]Schellingen K,Straeten D V D,Remans T,et al.Ethylene signalling ismediating the early cadmium-induced oxidative challenge inArabidopsis thaliana[J].Plant Science,2015,239:137-146.
[14]王贝贝,李汶骏,鞠林江,等.两种地被植物生长、生理及光合特性对干旱胁迫的响应[J].天津农学院学报,2016,23(4):1-4.
[15]汪洪,赵士诚,夏文建,等.不同浓度镉胁迫对玉米幼苗光合作用、脂质过氧化和抗氧化酶活性的影响[J].植物营养与肥料学报,2008,14(1):36-42.
[16]严重玲,付舜珍,方重华,等.Hg、Cd及其共同作用对烟草叶绿素含量及抗氧化酶系统的影响[J].植物生态学报,1997,21(5):468-473.
[17]杨舒贻,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统响应研究进展[J].福建农林大学学报,2016,45(5):481-489.
[18]丁继军,潘远智,李丽,等.外源谷胱甘肽对石竹幼苗镉毒害的缓解效应[J].植物生态学报,2013,37(10):950-960.
[19]杜琳,张荃.植物谷胱甘肽与抗氧化胁迫[J].山东科学,2008,21(2):27-32.
[20]章秀福,王丹英,储开富,等.镉胁迫下水稻SOD活性和MDA含量的变化及其基因型差异[J].中国水稻科学,2006,20(2):194-198.
[21]邵国胜,Hassan M J,章秀福,等.镉胁迫对不同水稻基因型植株生长和抗氧化酶系统的影响[J].中国水稻科学,2004,18(3):239-244.
[22]Klair A,Poljakoff-Mayber A.Changes in activity of malate dehydrogenase,catalase,peroxidaseandsuperoxidedismutase in leaves ofHalimione portulacoides(L.)Aellen exposed to high sodium choloride concentration[J].Annals of Botany,1984,47:75-85.
[23]Zhang J,Kirkham M B.Drought-induced changes in activitiesof superoxide dismutase,catalase and peroxidase in wheat species[J].Plant and Cell Physiology,1994,35:489-495.

