藏药十八味党参丸抑制CIA大鼠滑膜组织炎性因子表达和细胞凋亡诱导※
朱艳媚,祁 岗,杨春燕,杨本扎西,曹成珠,严云飞
(1.青海大学医学院生理教研室,810001;2.青海省人民医院核医学科,810007;3.青海省藏医院药浴科,810007)
类风湿关节炎(rheumatoid arthritis,RA)的发病机制尚未完全明了。藏药十八味党参丸(tibetan eighteen flavor dangshenpills,TEP)治疗RA疗效确切、毒副作用小[1,2]。本研究通过观察TEP对胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠滑膜组织炎症反应及细胞凋亡的影响,探讨TEP改善CIA大鼠关节炎的分子机制。
1 材料与方法
1.1 材料
1.1.1 动物及分组
清洁级雌性SD大鼠60只,质量180±20 g,由兰州大学实验动物中心提供,许可证号:SCXK(甘)20160003。随机分为空白对照组(Control)、模型组(CIA)、雷公藤多苷组(TP)、TEP低剂量组(TEPⅠ)、TEP中剂量组(TEPⅡ)、TEP高剂量组(TEP Ⅲ),每组10只。
1.1.2 试剂及药物
TEP(国药准字Z63020215,青海柴达木高科技药业有限公司);雷公藤多苷片(tripterygium,TP。浙江得恩德制药有限公司)。大鼠白细胞介素17(interleukin,IL-17)ELISA、兔抗Bcl-2相关X蛋白多克隆抗体(Bcl-2 Associated X Protein,BAX)、兔抗B细胞淋巴瘤-2多克隆抗体(B cell lymphoma 2,BCL-2)、兔抗核转录因子kappa B多克隆抗体(nuclear factor-kappa B,NF-κB)、兔抗半胱天冬酶-3多克隆抗体(caspase 3)、兔抗肿瘤坏死因子α多克隆抗体(tumor necrosis factor-α,TNF-α)、兔抗β-actin多克隆抗体(CST)试剂盒。
1.2 实验方法
1.2.1 CIA模型建立
本研究所有大鼠实验符合实验动物伦理要求并获得兰州大学实验动物伦理委员会的审查,大鼠适应性饲养1周后,根据文献[3]建立CIA大鼠模型,将大鼠仰卧位固定,大鼠膝关节腔内注射与牛Ⅱ型胶原蛋白等体积混合的卡介苗溶液(Bacillus Calmette-Guérin,BCG,4mg/mL),每次每个关节腔注射0.2 mL,1周重复一次,共2周。正常对照组大鼠等量同部位注射生理盐水。
1.2.2 模型评价
每周用游标卡尺测定大鼠膝关节直径,测定3次,取其平均值;观察大鼠的一般状态、足爪厚度。
一般状态:初次免疫后,第1天观察对照组大鼠活动正常,膝关节无红肿,毛色发亮柔顺,对外界刺激敏感,而模型组大鼠膝关节红肿明显,出现急性炎症反应,双后肢僵直,行走困难,瘸拐和拖后腿现象明显,活动受限,精神萎靡,对外界刺激不敏感,抓取时无挣扎,同时触摸膝关节时出现强烈的保护性回缩现象。第3天模型组大鼠红肿有所缓解,但后肢依然僵硬,行走困难,精神萎靡,毛色暗淡,无光泽。到第5天时,模型组大鼠肿涨未见明显减退,但活动度与空白组相同,皮毛已变得柔顺,有光泽,行走略微显得僵硬,精神状态较之前恢复很多,对外界刺激敏感度和空白几乎一样,但触摸膝关节时出现膝关节的回缩现象。第7天进行二次加强免疫后,大鼠膝关节反应状态同第一次几乎一致,第8天毛显枯槁,急性炎症性红肿较前明显,大鼠几乎没有活动,偶尔有活动的大鼠,双后肢也是僵硬拖行,对外界刺激很不敏感,触碰后肢,会明显地保护性回缩,甚至出现尖叫。第14天,大鼠膝关节依然肿胀,但无红色,对外界刺激敏感,略有跛行,但不影响正常活动,毛色较光亮。
关节厚度:第一次免疫及第二次免疫后第1、3、5天,与对照组大鼠相比,模型组大鼠关节厚度显著增加,表明模型建立成功。
1.2.3 给药
造模成功后,给予药物灌胃干预,TEP低剂量组剂量为9 g/kg/d,TEP中剂量组为45 g/kg/d,TEP高剂量组为90 g/kg/d,TP组为12 mg/kg/d,连续给药6周。
1.2.4 滑膜样品制备
采用颈椎脱臼方法处死大鼠,在超净工作台,仰位固定,常规碘伏、酒精消毒。沿膝关节正中纵行切开皮肤直至暴露出以膝关节为中心约3 cm×3 cm的区域,用有齿镊提起髌骨,沿髌骨上缘处向下切割直至股骨,再分别沿髌骨两侧向下分离至胫骨,此时即打开了膝关节腔,可见由髌骨下缘向上延缓有一层平滑光亮呈淡黄色的滑膜组织。完整剥离滑膜组织,用眼科镊轻轻夹住其游离端,用刀片完整切下,一部分转移至离心管后置-80 ℃冰箱备用。另一部分浸泡在4%多聚甲醛溶液中固定。
1.2.5 HE染色
取新鲜的关节腔滑膜组织,切成 3 mm×5 mm×2 mm大小的小块;将取材组织放在无菌培养皿中用4%多聚甲醛固定24小时;行梯度酒精脱水,依次进行二甲苯透明、浸蜡、包埋、切片(5μm)、常规脱蜡、苏木素浸染、盐酸乙醇分色、伊红浸染、脱水、透明及封片,用光镜观察并拍照。显微镜下观察大鼠膝关节滑膜组织形态的改变,并按照滑膜病理5级评分法对炎性细胞浸润、滑膜细胞增生及滑膜纤维组织增生三项指标进行评分。炎性细胞浸润:每高倍视野(×200)下无炎性细胞浸润为0分;有1~5个炎性细胞为1分;有6~10个炎性细胞为2分;>11个炎性细胞为3分,每个组织切片选取5个视野。
1.2.6 ELISA实验
取适量滑膜组织,加入适量磷酸盐缓冲液(phosphate buffered saline,PBS)研磨,离心后取上清液。按照大鼠IL-17 ELISA试剂盒说明书进行检测。检测450 nm OD值,绘制标准曲线,计算待测样品IL-17浓度。
1.2.7 免疫组化实验
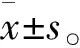
1.2.8 Western Blot实验
1.2.9 统计学处理
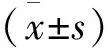
2 结果
2.1 HE染色及各组大鼠关节滑膜IL-17水平比较
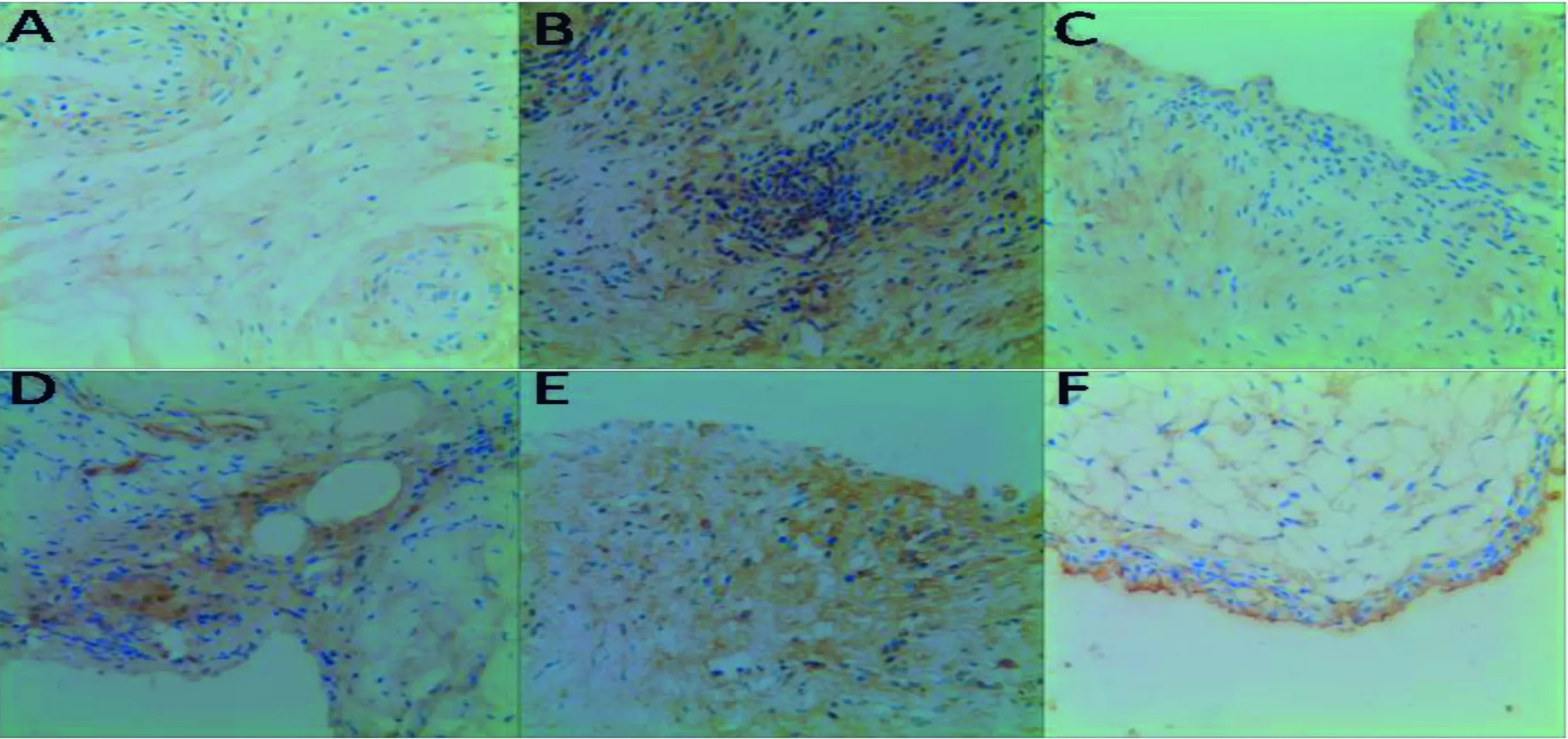
与对照组相比,CIA大鼠关节滑膜有大量炎症细胞浸润,细胞排列紊乱,细胞增生,部分滑膜组织纤维化,HE染色评分有统计学意义(P<0.05)。见图1。
与CIA大鼠相比,TP组及TEP高剂量组炎症细胞明显减少,炎症评分有统计学意义(P<0.05);而关节滑膜中IL-17的表达CIA组较对照组高表达(P<0.05),并且TP及各不同剂量组的表达较CIA组显著降低,差异有统计学意义(P<0.05)。结果见表1。

A为Control组,B为CIA模型组,C为TP组,D为TEPⅠ组,E为TEPⅡ组,F为TEPⅢ组(×100)
图1滑膜组织HE染色图
Figure1TheHEstainingofsynovialtissue(×100)
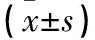

Table 1 Inflammatory cell infiltration score of HE staining and the concentration changes of IL-17(±s)
*:与对照组比较,P<0.05;#:与模型组相比,P<0.05.
2.2 各组大鼠关节滑膜TNF-α的表达
与对照组大鼠相比,CIA模型组TNF-α表达显著增加(P<0.05)。与模型组大鼠相比,TP及高剂量TEP治疗组大鼠TNF-α表达显著降低,差异有统计学意义(P<0.05)。见图2、表2。
A为Control组,B为CIA模型组,C为TP组,D为TEPⅠ组,E为TEPⅡ组,F为TEPⅢ组(×200)
图2各组大鼠滑膜细胞TNF-α的表达图
Figure2TheexpressionofTNF-αinsynovialcellsofrats(×200)
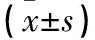

Table 2The average optical density value of TNF-α in synovial tissue of rats(±s)
*:与对照组比较,P<0.05;#:与模型组相比,P<0.05.
2.3 各组大鼠关节滑膜caspase-3、NF-κB、BCL-2及BAX表达比较
CIA组NF-κB表达较对照组高表达、Caspase 3低表达、BCL-2与BAX比值显著升高(P<0.05);与模型组相比,TP及不同剂量TEP组大鼠NF-κB表达、BCL-2与BAX比值降低,差异有统计学意义(P<0.05);而Caspase 3表达,TP及中、低剂量TEP组表达增加,差异有统计学意义(P<0.05),但高剂量组未见差异(P>0.05)。见图3、表3。
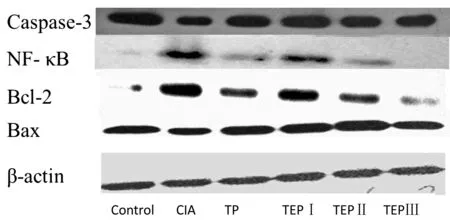
图3各组大鼠Westernblot印迹图
Figure3TheresultsofWesternblotindifferentgroupsofrats
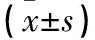

Table 3 The relative expression levels of related factors in rats’ synovial tissue(±s)
*:与对照组比较,P<0.05;#:与模型组相比,P<0.05.
3 讨论
目前,大部分治疗类风湿性关节炎的药物都是基于抑制炎症反应,改善滑膜炎性环境,靶向于身体的免疫细胞和免疫因子。滑膜由免疫耐受向免疫过敏转变是慢性炎症的基础,这种转变跟环境遗传以及感染等相关。在炎性环境中,滑膜组织不断接受炎性因子的刺激导致滑膜细胞凋亡抑制、增生异常,而异常增生的滑膜又不断破坏软骨等组织导致关节炎症加重,形成恶性循环。因此,阻止滑膜组织的异常增生对缓解关节炎具有重要意义。
TEP在临床上具有治疗风湿、类风湿及痛风性关节炎的作用[1,2]。但是其治疗机制尚不明确,本研究通过观察TEP对CIA大鼠滑膜组织炎症反应及细胞凋亡的影响,探讨TEP改善CIA大鼠RA的分子机制。
由CD4+T细胞分泌的IL-17,能够诱导上皮细胞、内皮细胞、成纤维细胞合成分泌白细胞介素6(interleukin,IL-6)、白细胞介素8(interleukin,IL-8)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、前列腺素E2(prostaglandin E2,PGE2),促进细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达,它在关节炎发病中起到起始促进作用,诱导滑膜细胞和炎症细胞产生多种炎症因子,激活增强相关信号通路[4,5]。研究表明,RA患者外周血单核细胞中Th17细胞对凋亡信号更敏感[6]。而RA患者IL-17可导致线粒体功能障碍从而增加滑膜细胞抗凋亡作用[7]。此外,NF-κB在CIA大鼠滑膜组织主要定位于细胞核,且表达升高,NF-κB的调控与活化在RA的病理变化中占有重要地位[8]。IL-17与受体结合后,可通过NF-kB途径发挥其生物学作用。当滑膜细胞受到IL-17的刺激时,NF-κB抑制蛋白(inhibitor of NF-κB,IκB)被降解,NF-κB异二聚体移位到胞核内,与DNA上的κB基序列相结合从而调控各种TNF-α与白细胞介素-1β(interleukin-1β,IL-1β)等炎症介质基因的表达,反过来所产生的炎症因子又可进一步激活NF-κB通路,形成正向调控循环,使关节炎得以维持发展。NF-κB对维持细胞存活和抗凋亡具有重要作用[9-12]。本实验通过ELISA、Western blot和免疫组化法发现与空白组相比较,CIA模型大鼠的滑膜细胞中IL-17、NF-κB和TNF-α表达量明显升高(P<0.05),经过TEP治疗后,中高剂量组滑膜细胞中IL-17、NF-κB和TNF-α的含量明显降低(P<0.05),表明TEP可明显改善关节炎炎症环境。
研究发现,Bcl-2基因上有κB识别位点,而Bax、BCL-2/BCL-XL相关死亡促进因子(BCL-xL/BCL-2-associated death promoter,Bad)则无κB位点。滑膜细胞中NF-κB大量激活可引起Bcl-2家族中抗细胞凋亡基因的表达增加,进而发挥此类因子降低线粒体膜的通透性、抑制线粒体去极化及细胞色素C释放的抗凋亡作用[13-15],这是滑膜细胞大量增生的主要原因之一。超表达的Bcl- 2蛋白一方面可与bax形成异源二聚体,抑制bax的转位及二聚体化,关闭PT孔道,通过阻断细胞色素C(cytochrome C,cyt-c)的释放,抑制下游caspase-3的激活,而有效地抑制细胞凋亡的发生[16]。另一方面,Bcl-2还能与凋亡蛋白酶激活因子(apoptotic protease activating factor 1,Apaf-1)结合并抑制其功能,阻止半胱天冬酶-9前酶(procaspase-9)活化实现抗凋亡的效应[17]。增加BAX且降低Bcl-2表达的药物可以缓解RA患者症状,如有研究表明复方丹参注射液、牛蒡子苷元可以通过增加RA患者BAX及降低Bcl-2表达从而促进滑膜细胞的凋亡,缓解RA患者症状[18,19]。此外,抗炎药物甲氨蝶呤可以提高RA患者滑膜细胞Caspase-3 mRNA水平从而改善炎症情况[20]。本实验通过Western blot发现在CIA模型组大鼠滑膜中Bcl-2/Bax的比值明显高于空白组(P<0.05),Caspase-3的含量明显低于空白组,经过TEP治疗后,CIA大鼠滑膜中Bcl-2/Bax的比值较模型组明显降低(P<0.05),而Caspase-3的含量明显提高,表明TEP通过提高滑膜组织中Caspase-3的含量,降低Bcl-2/Bax的比值促进滑膜细胞凋亡,从而抑制滑膜异常增生。由于NF-κB可诱导表达Bcl-2,提示TEP可能通过抑制滑膜细胞NF-κB的表达,从而抑制Bcl-2的表达、促进滑膜细胞凋亡。
综上所述,TEP可通过抑制CIA大鼠滑膜细胞中IL-17、NF-κB和TNF-α的表达,改善关节炎症情况。此外,TEP可提高滑膜组织中Caspase-3的含量,并降低Bcl-2/Bax的比值,以此促进滑膜细胞的凋亡,从而抑制滑膜的异常增生。提示,TEP通过抑制CIA大鼠滑膜组织的炎症反应并促进滑膜细胞的凋亡,改善CIA大鼠关节的炎症。
[1]龙巴.藏医藏药治疗风湿病88例临床观察[J].微创医学,2001,20(1):64-5.
[2]杨本扎西,彭毛东主,辛措吉,等.藏医治疗类风湿性关节炎的临床疗效评价研究 [J].中国民族医药杂志,2013,19(5):18-19.
[3]Postigo J,Iglesias M,Cerezo-wallis D,et al.Mice deficient in CD38 develop an attenuated form of collagen type II-induced arthritis[J].PloS one,2012,7(3):e33534.
[4]Lubberts E,Koenders M I,Van den berg W B.The role of T-cell interleukin-17 in conducting destructive arthritis:lessons from animal models[J].Arthritis research & therapy,2005,7(1):29-37.
[5]Roeleveld D M,Koenders M I.The role of the Th17 cytokines IL-17 and IL-22 in Rheumatoid Arthritis pathogenesis and developments in cytokine immunotherapy[J].Cytokine,2015,74(1):101-7.
[6]Ji L,Geng Y,Zhou W,et al.A study on relationship among apoptosis rates,number of peripheral T cell subtypes and disease activity in rheumatoid arthritis[J].Int J Rheum Dis,2016,19(2):167-171.
[7]Kim E K,Kwon J E,Lee S Y,et al.IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy[J].Cell Death Dis,2017,8(1):e2565.
[8]Mu N,Gu J,Huang T,et al.A novel NF-kappaB/YY1/microRNA-10a regulatory circuit in fibroblast-like synoviocytes regulates inflammation in rheumatoid arthritis[J].Sci Rep,2016,6(200):59.
[9]Van loo G,Beyaert R.Negative regulation of NF-kappaB and its involvement in rheumatoid arthritis[J].Arthritis research & therapy,2011,13(3):221.
[10]Okamoto T.NF-kappaB and rheumatic diseases[J].Endocrine,metabolic & immune disorders drug targets,2006,6(4):359-372.
[11]Wang S,Liang S,Zhao X,et al.Propofol inhibits cell proliferation and invasion in rheumatoid arthritis fibroblast-like synoviocytes via the nuclear factor-kappaB pathway[J].Am J Transl Res,2017,9(5):2429-2436.
[12]Wen H L,Yang G,Dong Q R.Ellipticine inhibits the proliferation and induces apoptosis in rheumatoid arthritis fibroblast-like synoviocytes via the STAT3 pathway[J].Immunopharmacol Immunotoxicol,2017,39(4):34.
[13]Adams J M,Cory S.The Bcl-2 protein family:arbiters of cell survival [J].Science(New York,NY),1998,281(5381):1322-1326.
[14]Kodama T,Hikita H,Kawaguchi T,et al.The Bcl-2 homology domain 3(BH3)-only proteins Bim and bid are functionally active and restrained by anti-apoptotic Bcl-2 family proteins in healthy liver[J].The Journal of biological chemistry,2013,288(42):30009-30018.
[15]Li H,Zhu H,Xu C J,et al.Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis[J].Cell,1998,94(4):491-501.
[16]Guo J,Zhang K,Ji Y,et al.Effects of ethyl pyruvate on myocardial apoptosis and expression of Bcl-2 and Bax proteins after ischemia-reperfusion in rats[J].Journal of Huazhong University of Science and Technology Medical sciences=Hua zhong ke ji da xue xue bao Yi xue Ying De wen ban=Huazhong keji daxue xuebao Yixue Yingdewen ban,2008,28(3):281-283.
[17]Kawatani M,Imoto M.Deletion of the BH1 domain of Bcl-2 accelerates apoptosis by acting in a dominant negative fashion[J].The Journal of biological chemistry,2003,278(22):19732-19742.
[18]Liu Q S,Luo X Y,Jiang H,et al.Salvia miltiorrhiza injection restores apoptosis of fibroblast-like synoviocytes cultured with serum from patients with rheumatoid arthritis[J].Mol Med Rep,2015,11(2):1476-1482.
[19]Liu H,Yang Y,Cai X,et al.The effects of arctigenin on human rheumatoid arthritis fibroblast-like synoviocytes[J].Pharm Biol,2015,53(8):1118-1123.
[20]Malysheva I E,Topchieva L V,Barysheva O Y,et al.The level of cytokines and expression of caspase genes in rheumatoid arthritis[J].Dokl Biochem Biophys,2016,468(1):226-228.

