CK-MB特异性单抗的制备方法及其应用
陈自敏,周国梁,徐伟玲,郑小红,童勋章,柯起沈,宋浏伟,葛胜祥
1 厦门大学 生命科学学院 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
2 厦门万泰凯瑞生物技术有限公司,福建 厦门 361026
CK-MB特异性单抗的制备方法及其应用
陈自敏1,周国梁1,徐伟玲2,郑小红2,童勋章2,柯起沈2,宋浏伟1,葛胜祥1
1 厦门大学 生命科学学院 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
2 厦门万泰凯瑞生物技术有限公司,福建 厦门 361026
本研究拟建立肌酸激酶同工酶MB (CK-MB) 特异性单克隆抗体 (mAb) 的研制方法,对抗CK-MB单抗进行评价分类及性质鉴定,并初步建立CK-MB定量检测试剂。以CK-MB抗原免疫BALB/c小鼠,利用常规单抗制备技术,使用间接和捕获ELISA差异筛选法筛选单抗。利用肌酸激酶同工酶 (CK-MM/BB/MB) 抗原对所制备单抗的抗原识别表位进行鉴定,另通过免疫印迹法及合成CK-MM、CK-BB差异性的线性表位肽鉴定对所制备的单抗进行评价分类。使用双抗体夹心ELISA方法筛选检测CK-MB抗原的配对mAb,并初步建立CK-MB定量检测试剂。使用74例临床标本初步评价该试剂与罗氏试剂的检测一致性。最终,我们成功筛选到22株稳定分泌抗CK-MB抗体的杂交瘤细胞株,这些单抗可以分为线性、偏构象的CK-MB和CK-MM或者CK-BB交叉的单抗以及与CK-MB特异反应的偏构象型单抗,并使用偏构象型单抗研制出CK-MB定量检测试剂,该试剂与罗氏试剂相关系数r达到0.930 9。综上所述,本研究建立了研制CK-MB偏构象型特异性单抗的筛选方法,通过对所筛选的单抗进行分析鉴定并建立了CK-MB定量检测试剂,与罗氏试剂检测结果符合率高。
肌酸激酶同工酶MB (CK-MB),急性心肌梗死 (AMI),单克隆抗体,构象型单抗,捕获法
急性心肌梗死 (AMI) 已经成为威胁人类生命的主要疾病之一,目前全球每年有1 700万人死于心血管疾病,其中有一半以上死于急性心肌梗死[1],AMI过程中心肌细胞中的酶,如肌酸激酶 (CK)、门冬氨酸转氨酶 (AST) 和乳酸脱氢酶 (LDH) 在血清中活性增高,广泛应用于AMI的诊断。心肌是唯一一个含有肌酸激酶同工酶MB (CK-MB) 较多的器官,CK-MB是心肌类疾病早期诊断的重要指标。健康人血清中肌酸激酶同工酶MM (CK-MM) 占94%–96%,CK-MB仅占5%以下,若血清中CK-MB显著增高,说明心肌受损,一般认为血清中CK-MB大于总活性的6%以上为心肌损伤的特异性指标[2-3]。
CK是由脑型亚单位B和肌型亚单位M组成的二聚体,每个亚单位的分子量都约为43 kDa,M亚基与B亚基在一级结构上的同源性达80%,在高级结构上会形成3种二聚体,有CK-MM、CK-BB、CK-MB三种同工酶。目前传统的区分 3种同工酶的方法主要是基于 3种蛋白带电荷的不同采用非变性电泳鉴定[4]。CK-M与CK-B亚基在形成异源二聚体的时候各自都发生了变构形成新的构象型表位[5]。人体很多组织中都含有肌酸激酶,但是每一种同工酶的分布都不一样,骨骼肌中富含有 CK-MM型同工酶,脑、胃、小肠、膀胱以及肺主要含有CK-BB同工酶,而CK-MB仅存在于心肌组织中。CK-MB诊断透壁型心肌梗死的敏感性及特异性均极高,在发病后4 h其含量增高,在16–24 h达到高峰,3–4 d恢复正常。若CK-MB在急性心肌梗死 (AMI) 后仍保持高水平,表明心肌坏死还在进行;若恢复正常后再次升高,说明原梗死部位扩展或者新的梗死部位出现[6]。目前CK-MB的诊断原料以及试剂大多都是依赖于国外进口,昂贵的成本导致医院检测价格居高不下。因此,本研究通过建立CK-MB单抗的筛选方法,对CK-MB单抗进行筛选和分类评价,初步建立 CK-MB定量的双抗体夹心法定量检测试剂,为CK-MB试剂和原料的国产化奠定重要的基础。
1 材料与方法
1.1 材料
1.1.1 试剂
CK-MB、CK-MM、CK-BB抗原均购于Meridian公司 (分别的批号是VTI820、VTI830、VT810)。利用购买的抗原进行变性胶以及非变性胶鉴定,结果显示与文献描述一致。小鼠骨髓瘤细胞株 SP2/0购自中国典型培养物保藏中心 (CCTCC)。BALB/c小鼠为上海斯莱克实验动物中心提供。PEG1500、次黄嘌呤、胸腺嘧啶、氨基喋呤、DMSO和辣根过氧化物酶 (HRP)等购自Sigma公司。RPMI 1640基础培养基购自Gibco公司。胎牛血清购自PAA公司。
1.1.2 样本
选取2014年10月至2015年10月厦门大学附属中山医院收集的临床样本,来源于门诊住院病人,其中确诊AMI的76例 (AMI的诊断标准参照全国中西医结合防治冠心病、心绞痛、心律失常研究座谈会修订的诊断标准和WHO缺血性心脏病诊断标准)。
1.2 方法
1.2.1 单抗制备
选择6只雌性BALB/c 小鼠以CK-MB抗原乳化完全弗氏佐剂 (CFA) (Sigma,St. Louis,MO) 皮下免疫,两周后使用同样的抗原乳化不完全弗氏佐剂 (IFA) (Sigma,St. Louis,MO) 进行免疫,间隔2周继续免疫2针。最后使用相同的抗原PBS稀释脾脏免疫最后加强,采集血清3 d后开展细胞融合。细胞融合、克隆化、腹水制备以及纯化均按照常规方法[7]。
1.2.2 单抗的筛选方法
1) 间接法筛选:3种CK-MM/BB/MB抗原用碳酸缓冲液 (20 mmol/L CB,pH 9.6) 稀释后包被于聚氯乙烯板上,然后加入待检样品,最后加入HRP标记的羊抗鼠二抗 (保存于20 mmol/L PBS (pH 7.4) 中,含有酪蛋白与明胶)。2) 捕获法筛选:羊抗鼠多抗 (GAM) 用20 mmol/L PBS缓冲液 (pH 7.4) 稀释后包被于聚苯乙烯板上,然后加入待检样品 (保存于 20 mmol/L PBS,pH 7.4) 即捕获所有的鼠源单抗,最后加入HRP标记的3种抗原 (CK-MM/BB/MB) 进行差异性筛选。
1.2.3 单抗性质鉴定分析
1) mAb间接法滴度测定:采用3种抗原包被检测抗体的活性滴度即利用 CK-MM/BB/MB抗原用碳酸缓冲液 (20 mmol/L CB,pH 9.6) 稀释后包被于聚氯乙烯板上,然后加入待检样品,最后加入HRP标记的羊抗鼠二抗。2) mAb捕获法滴度测定:采用GAM包被捕获不同单抗后用3种标记 HRP的抗原检测抗体的活性滴度。3)免疫印迹法评价单抗性质:3种抗原(CK-MM/ BB/MB)包被于硝酸纤维素膜上,用 5%脱脂奶进行封闭 (Blocking) 1 h后,进行1–22株不同单抗的分别孵育 (即Primary antibody incubation,使用比例:5 μg/mL) 1 h,然后用洗液 (20 mmol/L PBS (pH 7.4)+0.05% Tween20) 洗涤,加入碱性磷酸酶标记的羊抗鼠 IgG (GAM-AP) 孵育 (即Secondary antibody incubation) 反应1 h,最后用洗液洗涤,显色液 (购自北京万泰生物技术有限公司) 显色15 min后,终止观察反应情况。4) 单抗的线性差异性表位验证:通过比对CK-MM与CK-BB的序列发现在258–272 aa (CK-MM 是QKIEEIFKKAGHPFM;CK-BB是TQIETLFKSK DYEFM) 之间存在较明显的连续差异,合成两个15 aa的短肽包被验证其22株单抗的活性和特异性。
1.2.4 酶联免疫吸附试验建立
采用方阵滴定法筛选配对单抗,选择抗原浓度为 1 ng/mL检测值进行正交配对筛选,后续继续优化以灵敏度高、本底低、线性范围广为选择标准。
1.2.5 磁微粒包被单克隆抗体
取 4 mg磁微粒用 EDC 溶液 (10 mg EDC·HCl溶于1 mL去离子水) 活化,然后加入80 μg单克隆抗体并置于旋转混匀仪上孵育偶联,孵育后用1 mL 1%甘氨酸溶液 (pH 7.4) 进行封闭,完成封闭后保存在含酪蛋白的PBS缓冲液中。
1.2.6 吖啶酯标记单克隆抗体
取单克隆抗体稀释到合适浓度后加入吖啶酯 (溶于甲基甲酰胺中),混匀,室温避光反应;加入赖氨酸溶液 (pH 8.0) 封闭;最后用PBS缓冲液 (20 mmol/L PBS,pH 7.4) 透析,用含酪蛋白的PBS缓冲液稀释后使用。
1.2.7 统计学处理
单抗6种活性评价方法采用GPS统计软件处理;试剂与同类产品的比较采用 GraphPad Prism统计软件进行处理。
2 结果与分析
2.1 CK-MB单克隆抗体的制备与鉴定
利用间接ELISA法以及捕获ELISA常规单抗制备筛选技术,获得了22株CK-MB单抗。
2.2 单抗活性评价
将所筛选的单抗分别用间接ELISA以及捕获 ELISA法进行抗体的活性评价及鉴定 (检测的抗体量是1 μg/mL),不同单抗与3种抗原两种不同检测方法 (间接法、捕获法) 的反应性结果见图 1。根据反应性图谱,22株单抗可以分为6大类,分别是:Ⅰ类单抗是CK-MM/BB/MB三种抗原间接、捕获法均反应;Ⅱ类、Ⅲ类单抗分别是CK-MM/MB、CK-BB/MB两种抗原间接、捕获法均反应;Ⅳ类、Ⅵ类单抗分别是CK-MM/MB、CK-BB/MB 2种抗原捕获法反应;以及Ⅴ类单抗是只与CK-MB捕获法反应。
2.3 免疫印迹法评价单抗性质
免疫印迹法评价单抗的性质结果见图2。从评价结果可知,Ⅰ/Ⅱ/Ⅲ类单抗均可与硝酸纤维素膜上的抗原反应,交叉反应模式与ELISA检测基本一致,而Ⅳ/Ⅴ/Ⅵ类抗体在对硝酸纤维素膜上的抗原基本不反应或者是对 CK-MB有很微弱的反应。初步认为是抗原在固相上展示的表位与液相上的差异。
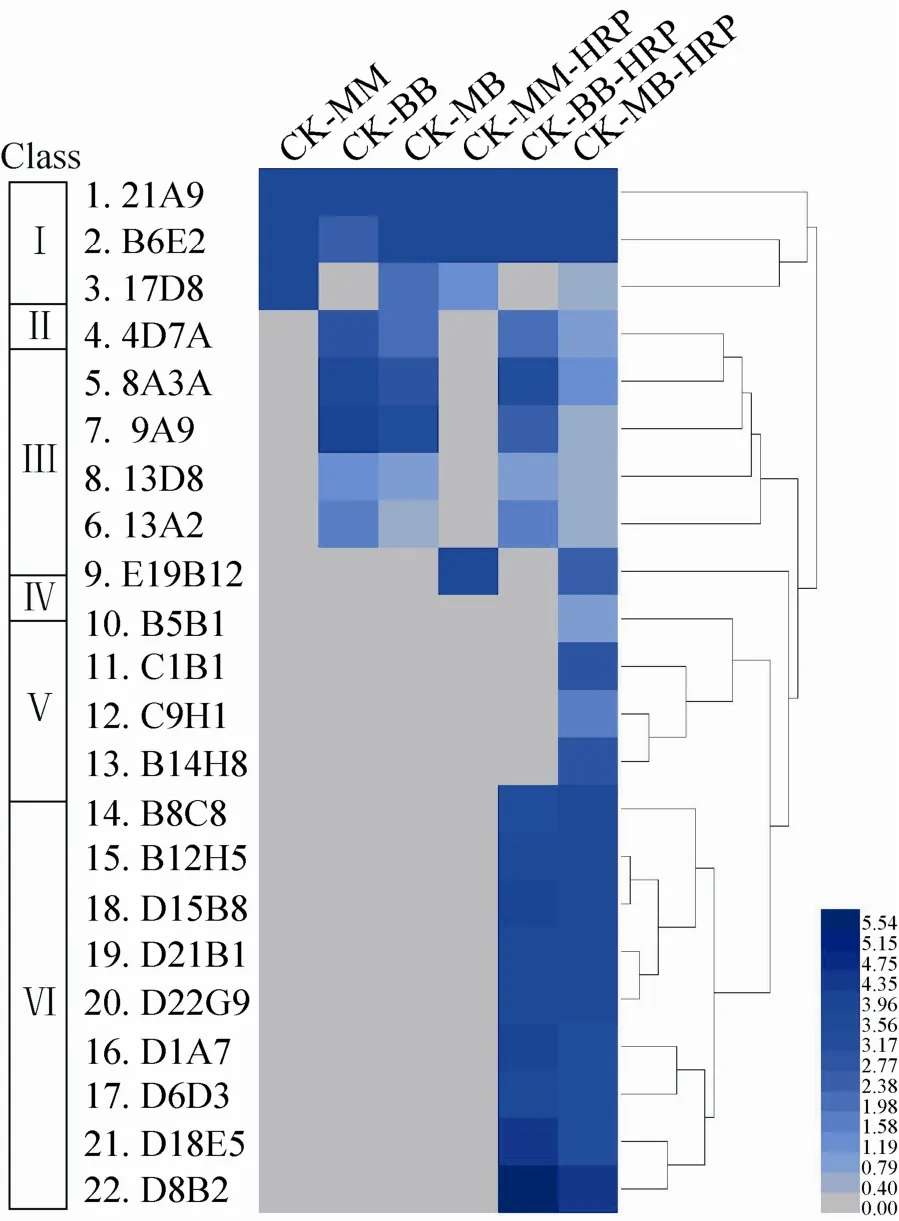
图1 单抗6种活性评价方法图谱Fig. 1 Mapping of evaluation for the activity of monoclonal antibodies using 6 methods.

图2 免疫印迹法评价单抗性质图谱Fig. 2 Evaluation of monoclonal antibodies with immune blotting method.
2.4 线性表位验证单抗性质
线性表位验证单抗性质结果见图 3 (检测的抗体量是10 μg/mL)。从结果可知,Ⅰ/Ⅱ/Ⅲ类单抗对CK-MM与CK-BB的两个在258–272 aa的线性表位有反应,而后也存在差异性反应的单抗,而Ⅳ/Ⅴ/Ⅵ类单抗对这两个线性表位都不反应。初步推测Ⅰ/Ⅱ/Ⅲ类单抗是偏线性表位的单抗。
2.5 单抗配对筛选

图3 线性表位评价单抗性质图谱Fig. 3 Mapping of linear epitope evaluation of monoclonal antibody properties.

图4 抗体正交配对评价Fig. 4 Evaluation of the cross reaction with antibodies.
将获得的22株单抗分别标记HRP,使用3种抗原进行正交配对检测结果见图 4,其中CK-MM/CK-BB使用浓度是500 ng/mL,CK-MB使用浓度是100 ng/mL。从结果可知,Ⅰ/Ⅱ/Ⅲ单抗与现有所有类单抗正交配对显示部分单抗无法交叉配对,部分单抗交叉配对后存在CK-MM/BB的交叉反应,故这3类间接方法筛选的单抗都无法应用在 CK-MB检测试剂中。Ⅳ/Ⅴ/Ⅵ三类单抗相互之间正交配对结果显示存在特异性检测 CK-MB的配对,也存在Ⅵ类单抗相互之间配对存在的CK-BB的交叉,目前认为红色标记的方框中是相互之间配对可以特异性检测出 CK-MB的配对。根据图 4的结果选择了几个较优的配对进行抗原的线性测定以及两份 Roche背景高值、低值样本以及小牛血清和正常人样本的评价,配对分别是:Ⅳ类(E19B12)-Ⅵ类(D22G9)、Ⅴ类 (B14H8)-Ⅵ类(D22G9)、Ⅴ类 (B14H8)-Ⅳ类 (E19B12)、Ⅵ类(D22G9)-Ⅳ类 (E19B12)和Ⅵ类 (D22G9)-Ⅴ类(B14H8),结果见图 5。从结果中可知,Ⅵ类(D22G9)-Ⅳ类 (E19B12) 配对对抗原的线性检测以及对血清的评价都比其他配对优越。后续将该配对应用到管式发光化学平台。2.6 单抗在管式化学发光平台原料的应用
利用该配对初步建立定量的检测 CK-MB特异性检测试剂,用Roche公司生产的CK-MB电化学发光试剂平行检测74份血清样本检测结果经线性回归分析 (r2=0.930 9,P<0.000 1),显示两者检测结果无显著差异,具有很好的相关性,结果见图6。
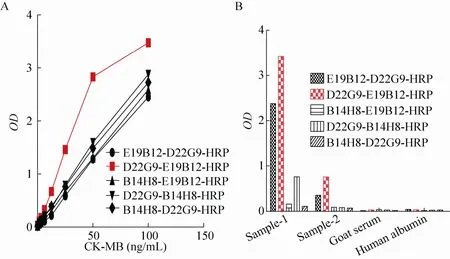
图5 比较不同抗体配对评价 (A) CK-MB抗原和 (B) 样本Fig. 5 Comparison of different pairs of antibodies in detection of CK-MB antigen (A) and samples (B).

图6 与同类试剂比较Fig. 6 Comparison with similar assay.
3 讨论
CK及其同工酶 CK-MB是心肌梗死在血清中出现较早的两种酶,它们在心肌中的含量相对较高,特别是 CK-MB,约占心肌酶的20%[8]。随着试验技术的快速发展,联合检测cTnI、肌红蛋白、CK-MB对早期诊断AMI具有重要的临床意义,目前已经在多个检测平台广泛推广[9-19]。
本研究利用外购的CK-MB抗原免疫、并通过购买的CK-MM/BB/MB抗原建立固相包被间接法和液相标记捕获法的单抗筛选方法,总共筛选出22株单抗,并利用6种方法对单抗进行分类以及鉴定,大体上可以分为 5类单抗分别为Ⅰ类单抗是CK-MM/BB/MB三种抗原固相包被、液相标记均反应;Ⅱ类、Ⅲ类单抗分别是CK-MM/MB、CK-BB/MB两种抗原固相包被、液相标记均反应;Ⅳ类、Ⅵ类单抗分别是CK-MM/MB、CK-BB/MB两种抗原液相标记反应;以及Ⅴ类单抗是只与CK-MB抗原液相标记反应。还利用了免疫印迹法以及 CK-MM 和CK-BB差异性的线性表位肽鉴定,发现Ⅰ/Ⅱ/Ⅲ类单抗存在免疫印迹以及差异表位肽的反应,而后Ⅳ/Ⅴ/Ⅵ类单抗都不反应。通过单抗的性质鉴定等分析,我们进一步推测间接法与捕获法都反应的单抗大多都是偏向线性单抗,或者说固相包被检测筛选获得的单抗都是偏向线性的抗体。我们将这些不同类单抗进行正交配对,结果显示与抗原固相包被在板的 3种反应模式的单抗与其他类单抗之间配对存在交叉反应或者是不反应,而液相方式反应的 3类单抗相互之间配对存在对 CK-MB特异性反应的配对。挑选这些不同类别之间配对进一步评价发现D22G9与E19B12配对对抗原以及样本的检测都较优,利用该配对初步建立了特异性检测CK-MB的定量试剂。与同类的产品进行比较r2=0.930 9,P<0.000 1,表明二者具有良好的的相关性。
本研究结果显示固相包被抗原有反应的抗体都无法特异性检测CK-MB,都会存在交叉反应,预测可能固相包被检测有反应的单抗识别的是偏线性的表位,即可能检测的是CK-MB与CK-BB或者CK-MM有交叉的线性表位;而后液相标记捕获筛选到的单抗存在可以特异性检测CK-MB的抗体,预测可能液相标记检测反应的单抗识别的是偏构象的表位,及M和B亚型形成的异源二聚体的构象表位。而这种构象型表位比较脆弱,如果采用间接法固相吸附包被容易破坏该表位,而利用捕获法筛选可以使抗原一直保存在液相状态,保证构象表位稳定从而有利于获得构象型表位单抗。
肌酸激酶 MB同工酶目前多数用免疫抑制法测定 CK-MB酶活性,特异性差而且干扰严重,目前国内有多家公司研制出CK-MB双抗夹心检测试剂[20-22],包括荧光免疫层析以及胶体金免疫层析法,因此对CK-MB的抗体原料需求很大,但目前国内的试剂大多都是依托进口原料,大大提高了试剂的成本。而本研究生产的抗体原料初步试剂评价与进口原料相当,从而极大地提高了本土原料的竞争力。
总之,本研究建立一套利用捕获法来保证抗原处于液相状态的筛选模式,该筛选模式能够更好地获得针对偏构象表位的单抗,并可以建立特异性检测CK-MB的定量检测试剂。同时也初步阐明脑型亚单位B和肌型亚单位M形成的同源二聚体CK-MM、CK-BB,与异源二聚体CK-MB所形成的构象不同,也进一步阐明想通过基因重组技术获得类似 CK-MB天然抗原是有一定难度的[23-25],以及获得特异性识别CK-MB的单抗必须筛选识别偏构象型表位的单抗,这也为后续CK-MB结构的研究提供帮助。此外,对于其他抗原构象型表位比较脆弱,也可以借鉴该筛选方法制备单抗。
REFERENCES
[1] Wang LL. Classification and clinical application of myocardial markers. Int J Lab Med, 2004, 25(5):385–387 (in Chinese).王兰兰. 心肌标志物的分类和临床应用. 国际检验医学杂志, 2004, 25(5): 385–387.
[2] Tucker JF, Collins RA, Anderson AJ, et al. Value of serial myoglobin levels in the early diagnosis of patients admitted for acute myocardial infarction. Ann Emerg Med, 1994, 24(4): 704–708.
[3] Lin XJ, Gong XD. Application of chemiluminescence detection of cTnI/Myo/CK-MB in coronary heart disease. Chin J Healthy Birth Child Care, 2014, 20(4): 247–249 (in Chinese).林小娟, 巩晓东. 化学发光联合检测 cTnI/Myo/ CK-MB在冠心病中的应用. 中国优生优育, 2014, 20(4): 247–249.
[4] Zhao X, Han B, Yang ZH. Electrophoretic separation and fluorescence scanning of creatine kinase isoforms. J Clin Lab Sci, 1999, 17(3): 145–147 (in Chinese).赵昕, 韩冰, 杨振华. 肌酸激酶亚型的电泳分离和荧光扫描法. 临床检验杂志, 1999, 17(3): 145–147.
[5] Tai DF, Ho YF, Wu CH, et al. Artificial-epitope mapping for CK-MB assay. Analyst, 2011, 136(11): 2230–2233.
[6] Sachdeva A, Paul B. Newer cardiac biomarkers in myocardial necrosis. J Assoc Physicians India, 2014, 62(10): 83–84.
[7] Harlow E, Lane D. Antibodies//Harlow E, Lane D, Eds. Antibodies: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press, 1998: 139–312. [8] Wang F, Li J, Lin Y, et al. To discuss the values of CK,CK-MB in early diagnosis of acute myocardial infarction. Chin J Mod Med, 2010, 12(8): 20–23 (in Chinese).王芾, 李佳, 林艺, 等. CK和CK-MB在急性心肌梗死诊断中的价值探讨. 中国现代医药杂志, 2010, 12(8): 20–23.
[9] Zhang H, Dong M, Zhong HQ. Clinical value of joint detection of Mb, CK-Mb and cTnI inearly diagnosis of acute myocardial infarction. Chin J Lab Med, 2010, 20(6): 1448–1449 (in Chinese).张辉, 董敏, 周厚清. Mb、CK-MB及cTnI三项联合检测在 AMI早期诊断中的临床意义. 中国卫生检验杂志, 2010, 20(6): 1448–1449.
[10] Wang HM. The application value of the detection of myocardial markers in the rapid diagnosis of acute myocardial infarction. The Medical Forum, 2015, 19(23): 3197–3198 (in Chinese).王会明. 心肌标志物检测在急性心肌梗死快速诊断中的应用价值. 基层医学论坛, 2015, 19(23): 3197–3198.
[11] Hu ZJ, Zhou YQ, Zhang HB, et al. Clinical value of monitoring serum cardiac biomarkers in pulmonary thromboembolism-induced myocardial injury. J First Mil Med Univ, 2008, 28(10): 1853–1855 (in Chinese).胡灼君, 周宇麒, 张海波, 等. 心肌生物标记物在肺血栓栓塞症继发心肌损害中的临床意义.南方医科大学学报, 2008, 28(10): 1853–1855.
[12] Wang GH. Diagnostic value of troponin T, troponin I and creatine kinase isoenzyme in acute myocaridal infarction. Clin Pharm, 2015, 8(12): 69–70 (in Chinese).王国辉. 肌钙蛋白 T、肌钙蛋白Ⅰ与肌酸激酶同工酶对急性心肌梗死的诊断价值. 临床合理用药杂志, 2015, 8(12): 69–70.
[13] Dohi T, Maehara A, Brener SJ, et al. Utility of peak creatine kinase-MB measurements in predicting myocardial infarct size, left ventricular dysfunction, and outcome after first anterior wall acute myocardial infarction (from the INFUSE-AMI trial). Am J Cardiol, 2015, 115(5): 563–570.
[14] Wang QH, Clinical significance of hs-CRP, cTnI, Myo and CK-MB detection in serum of patients with acute myocardial infarction. Lab Med, 2012, 9(25): 111–112 (in Chinese).王全河. 急性心肌梗死患者血清中hs-CRP、cTnI、Myo及CK-MB的表达及其临床意义. 医学检验, 2012, 9(25): 111–112.
[15] Brandt DR, Gates RC, Eng KK, et al. Quantifying the MB isoenzyme of creatine kinase with the Abbott "IMx" immunoassay analyzer. Clin Chem, 1990, 36(2): 375–378.
[16] Panteghini M, Bonora R, Pagani F. A two-tube immunochemical method for determination ofCK-MB isoenzyme in serum evaluated. Clin Chem, 1990, 36(3): 550–553.
[17] Plran U, Kohn DW, Uretsky LS, et al. Immunochemiluminometric assay of creatine kinase MB with a monoclonal antibody to the MB isoenzyme. Clin Chem, 1987, 33(9): 1517–1520.
[18] Christenson RH, Vaidya H, Landt Y, et al. Standardization of creatine kinase-MB (CK-MB) mass assays: the use of recombinant CK-MB as a reference material. Clin Chem, 1999, 45: 1414–1423.
[19] Brener SJ, Lytle BW, Schneider JP, et al. Association between CK-MB elevation after percutaneous or surgical revascularization and three-year mortality. J Amer Coll Cardiol, 2002, 40(11): 1961–1967.
[20] Sadoh WE, Eregie CO, Nwaneri DU, et al. The diagnostic value of both troponin T and creatinine kinase isoenzyme (CK-MB) in detecting combined renal and myocardial injuries in asphyxiated infants. PLoS ONE, 2014, 9(3): e91338.
[21] Venta R, Cecchini BG, Geijo SA, et al. Serum creatinine kinase MB after acute myocardial infarction in a patient with IgA-CK-BB complex. Clin Chem,1994, 40(1): 160–1.
[22] Zeng LL, Jiang CX, Zhao YH, et al. Clinical application and diagnostic cutoff value analysis of cardiac markers in the diagnosis of acute myocaridial infarction. Lab Med Clin, 2013, 18: 2365–2367.曾令恒, 姜朝新, 赵艳华, 等. 心肌标志物在诊断急性心肌梗死中的临床应用及诊断. 检验医学与临床, 2013, 18: 2365–2367.
[23] Friedman DL, Kesterson R, Puleo P, et al. Recombinant creatine kinase proteins and proposed standards for creatine kinase isoenzyme and subform assays. Clin Chem, 1993, 39(8): 1598–1601.
[24] Gao YS, Zhao TJ, Chen Z, et al. Isoenzyme-specific thermostability of human cytosolic creatine kinase. Int J Biol Macromol, 2010, 47(1): 27–32.
[25] Sunahara Y, Uchida K, Tanaka T, et al. Production of recombinant human creatine kinase (r-hCK) isozymes by tandem repeat expression of M and B genes and characterization of r-hCK-MB. Clin Chem, 2001, 47(3): 471–476.
(本文责编 郝丽芳)
Development and application of CK-MB specific monoclonal antibodies
Zimin Chen1, Guoliang Zhou1, Weiling Xu2, Xiaohong Zheng2, Xunzhang Tong2, Qishen Ke2, Liuwei Song1, and Shengxiang Ge1
1 National Institute of Diagnostics and Vaccine Development in Infectious Diseases, School of Life Sciences, Xiamen University, Xiamen 361102, Fujian, China
2 Xiamen Innodx Biotech Co., Ltd., Xiamen 361026, Fujian, China
The aim of this study is to develop creatine kinase isoenzyme MB (CK-MB) specific monoclonal antibodies (mAb), and characterize the monoclonal antibody and further development of quantitative detection assay for CK-MB. The BALB/c mice were immunized with purchased CK-MB antigen, then monoclonal antibodies were prepared according to conventional hybridoma technique and screened by indirect and capture ELISA method. To identify the epitopes and evaluate the classification, purchased creatine kinase isoenzyme MB (CK-MM/BB/MB) antigen was used to identify the epitopes, with immunoblotting and synthetic CK-MM and CK-BB in different linear epitope. A double antibody sandwich ELISA was applied to screen the mAb pairs for CK-MB detection, and the quantitative detection assay for CK-MB was developed. We used 74 cases of clinical specimens for comparison of our assay with Roche’s CK-MB assay. We successfully developed 22 strains of hybridoms against CK-MB, these mAbs can be divided into linear, partial conformational CK-MB, CK-MM or CK-BB cross monoclonal antibody and CK-MB specific reaction with partial conformational monoclonal antibody, and CK-MB quantitative detection assay was developed by using partial conformational monoclonal antibody. The correlation coefficient factor r of our reagent and Roche’s was 0.930 9. This study established a screening method for CK-MB partial conformational specific monoclonal antibody, and these monoclonal antibodies were analyzed and an established quantitative detection assay was developed. The new assay had a high concordance with Roche’s.
creatine kinase isoenzyme MB, acute myocardial infarction (AMI), monoclonal antibodies, conformational monoclonal antibodies, capture method
Shengxiang Ge. Tel/Fax: +86-592-6536555; E-mail: sxge@xmu.edu.cn
10.13345/j.cjb.160216
Received: May 31, 2016; Accepted: November 24, 2016
Supported by: Xiamen Science and Technology Program (No. 3502Z20126007).
厦门市科技计划 (No. 3502Z20126007) 资助。
时间:2016-12-09
http://www.cnki.net/kcms/detail/11.1998.Q.20161209.1525.001.html
陈自敏, 周国梁, 徐伟玲, 等. CK-MB特异性单抗的制备方法及其应用. 生物工程学报, 2017, 33(1): 141–150.
Chen ZM, Zhou GL,Xu WL, et al. Development and application of CK-MB specific monoclonal antibodies. Chin J Biotech, 2017, 33(1): 141–150.

