多孔储氢材料研究现状评述
任 娟,刘其军,张 红
(1.西安工业大学,理学院,陕西 西安 710021; 2.西南交通大学,物理科学与技术学院,四川 成都 610031;3.四川大学,物理科学与技术学院,四川 成都 610065)
多孔储氢材料研究现状评述
任 娟1,3,刘其军2,张 红3
(1.西安工业大学,理学院,陕西 西安 710021; 2.西南交通大学,物理科学与技术学院,四川 成都 610031;3.四川大学,物理科学与技术学院,四川 成都 610065)
本文综述了几种多孔储氢材料,如碳基储氢材料、非碳基储氢材料、沸石、金属有机框架材料、共价有机框架材料目前的研究现状和其发展趋势。
多孔储氢材料; 碳基储氢; 非碳基储氢; 沸石; 金属有机框架材料; 共价有机框架材料
1 引 言
随着社会和经济的持续发展,能源问题成为全世界关注的焦点。传统的化石能源属于不可再生资源,加之其有限性,正在逐渐走向枯竭。并且由于使用化石能源造成的环境污染也日趋严峻,已经影响到人类的正常生活和工作。近两年来,我国部分地区连续爆发雾霾天气,据调查分析,在机动车尾气排放、燃煤产生的CO2、SO2等废气、沙尘等诸多因素中,其中燃煤产生的气体排放,是加剧雾霾天气的重要原因。2014年,在我国召开的“全国人民代表大会”和“中国人民政治协商会议”上,对环境污染治理的探讨作为议政的专题,强调指出雾霾天气主要还是发展方式粗放、产业结构和能源结构不尽合理造成的,产生的根源还是化石能源使用,排放了大量的污染物。只有发展新能源,能源结构才能得到改善。因此,寻找并开发可再生的绿色能源迫在眉睫,关系到人类的生存和发展。
氢作为一种理想的新能源,具有以下的优势:第一,重量最轻:标准状态下,密度为0.0899g/L。第二,高热值:氢的发热值为142.35kJ/g,是汽油发热值的3倍。第三,无毒无污染:燃烧后生成产物是水,不会产生二氧化碳、一氧化碳、二氧化硫等污染物质,可以最大限度地减少对环境的污染。第四,多种形态存在:可以以气态、液态或固态形式存在,能够在不同的环境下储存。第五,损耗小:可以避免高压远距离输电造成的能量损失,并且可以反复循环使用。 氢能作为绿色的清洁能源,有如此多的优势,因此成为未来最具有发展潜力的能源之一,已引起了国内外的广泛关注。然而迄今为止,氢能仍然未能实现工业化应用。随着科技的发展,目前制备氢已不再是难题。然而由于氢气特殊的物理性质和化学性质,现在氢能使用最主要瓶颈是氢的存储,氢气的存储是氢能使用的关键环节。
近年来,由于吸附储氢具有安全可靠、储存效率高、能够在温和条件下吸附/解吸附氢气等特点而迅速发展。目前吸附储氢材料研究的热点是多孔的纳米材料,如沸石、分子筛、碳纳米管、富勒烯、硅纳米管、活性炭、碳气凝胶、金属有机骨架材料(MOFs)、共价有机材料(COFs)等。有机化合物储氢,其优点是储氢量高、安全和储运方便,不足之处是化学反应难以控制,距离商业化应用还有很远距离。传统的压缩储氢和液化储氢方式都需要在极端条件下进行,耗能严重,安全性差。因此,必须寻找新的高性能固态储氢材料来满足车载系统的要求。
2 多孔储氢材料
多孔固体储氢材料,由于其具有低密度、高比表面积、优异的吸附性能等优点,成为当前储氢材料开发和研究的热点。多孔材料储氢主要是靠孔表面和氢气分子发生相互作用,通过Van der Waals(VDW)相互作用吸附氢气。根据国际理论与应用化学联合会(International Union of Pure and Applied Chemistry, IUPAC)的分类,按照孔径的大小多孔材料可以分为三类,微孔材料:孔径小于2nm;介孔材料:孔径介于2~50nm之间;大孔材料:孔径大于50nm。下面我们介绍几种主要的多孔储氢材料。
2.1 碳基多孔材料
在吸附储氢材料中,碳基材料主要包括活性炭、碳纳米管、碳纳米线、富勒烯、石墨烯、碳气凝胶等。
2.1.1 活性炭 活性炭(active carbon)是由微晶碳不规则排列,在交叉之间形成细孔的多孔碳材料[1-2]。活性炭含有大量微孔、具有巨大的比表面积,这些都是吸附氢所具备的特点。Yürüm等人[3]报道在T=77K时,储氢质量密度可以达到5.5wt%。天津大学周理等人[4]报道比表面积为3000m2/g,孔体积为115mL/g的超级活性炭,在液氮温度(77K),3MPa的压强下,储氢质量密度为5wt%;但是在常温,6MPa的压强下,质量储氢量只有0.14wt%。活性炭的结构与合成使用的材料以及合成的初始条件有关,因此对于已有的活性炭储氢量的报道不尽相同,这与活性炭的结构有关。由于活性炭属于无定型碳,内部结构复杂,实验上很难精确表征其结构,所以理论上不容易得到活性炭的模型结构。
2.2.2 碳纳米管 1991年,日本NEC公司的Iihima从电弧放电法生产的碳纤维中首次发现了碳纳米管,由于其具有独特的结构特征,而引起广泛关注[5-8]。碳纳米管自身重量轻,具有中空的结构,被认为是极具潜力的储氢材料。美国国立可再生能源实验室Dillon等人第一次研究了单壁碳纳米管(SWNT)的储氢情况,实验结果得到单壁碳纳米管在室温下储氢质量分数可以达到5~10wt%[9]。1999年,加州理工大学的Ye等人[10]研究了不同条件下,碳纳米管表面积与储氢量的关系,结果表明,在温度为T=80K,压强为P=1.2×107Pa时,储氢质量分数可以达到8%。同年7月,新加坡国立大学的Chen等人[11]研究了碱金属掺杂的多壁碳纳米管(MWNT),Li掺杂的多壁碳纳米管(MWNT)在653K时储氢量最高可达20%,K掺杂的MWNT在室温吸附量为14%。2000年,清华大学毛宗强等人[12]在室温下,P=1.0×107Pa时,经过预处理碳纳米管表面后,储氢量为9.99%。这一系列的研究报道在国际上引起了广泛关注。后来有研究报道[13]指出,由于这些实验的不可重复性和不一致性,可能是由于实验测量的错误造成的,这些结果中包含了吸附和凝聚的水蒸气。2003年,国外的Kajiura等人[14]从实验上研究了单壁碳纳米管(SWNTs)、多壁碳纳米管(MWNTs)、碳纳米纤维(CNFs)的储氢量,在常温下,压强增加到8MPa时,储氢量也超不过0.43wt%。Ritschel等人[15]采用和Kajiura实验中相同的方法,结果测得纯的单壁碳纳米管在室温下,压强为45bar时,储氢量为0.63wt%。近期,国内的臧小亚[16]小组测得在T=273.6K,P=16.5MPa时,SWNTs氢气的吸附量只有0.75wt%。对于这些相互冲突的报道结果,主要还是由于目前对于碳纳米管储氢机理研究尚不成熟缺少理论指导而致。从理论模拟可知,碳纳米管可以储存氢气,但是只能是在低温下才有理想的储氢量。
2.2.3 碳气凝胶 多孔的碳气凝胶,具有丰富的纳米级孔洞(1~100nm)、高的孔隙率(>80%)、超高的比表面积(400~3200m2/g)、结构可控、且孔洞又与外界相通等优良特性,是一种很有潜力的多孔吸附储氢材料。由于碳气凝胶具备多孔储氢材料性质,该材料被推测可能有很高的储氢量而引起了广泛关注。美国能源部曾于2005年设立了专门机构,并且给予资金支持去研究碳气凝胶储氢。我国也在碳基纳米储氢材料研究上给予了大力支持。Kabbour等人[17]首次研究了碳气凝胶的储氢性质,CO2在高温下950℃活化制备的碳气凝胶,比表面积为3200m2/g,储氢结果显示在77 K时的储氢量为5.3wt%。国内的袁秋月等人[18]研究了不同CO2活化温度对碳气凝胶储氢性能的影响。结果表明活化温度可以改变碳气凝胶的孔结构,提高碳气凝胶的比表面积,从而增加氢吸附量。杨曦等人[19]制备了超低密度(20 mg/cm3)的碳气凝胶,氢吸附测试得到此碳气凝胶在常压、液氮温度时吸氢量为4.4 wt%。但是由于碳气凝胶的结构复杂,对于其理论模型研究少之又少,所以缺少理论指导。
2.2.4 富勒烯 富勒烯(Fullerene)是一种碳的同素异形体,在富勒烯的结构中存在六元环和五元环,是一种球型的笼状结构。自从1985年发现C60之后,不断有新结构的富勒烯被预言或者发现。富勒烯储氢,早期的研究主要是氢化富勒烯方面,氢原子和碳原子之间形成C-H键。这种方法的优点是氢可以稳定地化学吸附在富勒烯的表面,结合能比较大,但是这种储存方式吸氢和脱氢条件比较苛刻。需要在573~623K的温度,500~850bar 氢压下实现,循环利用不好,不利于实际的应用[20]。随后,研究者们尝试用物理方法吸附氢气。Ye等人[21]通过实验方法测得,纯的C60和C70的储氢量仅仅只有0.7wt%和0.33wt%。为了提高富勒烯的储氢量,研究者们采用改性富勒烯的方法,给富勒烯的外部掺杂一些金属原子,或替换掺杂一些非金属原子,来提高富勒烯的储氢量。Sun等人[22]使用密度泛函方法研究了12个Li原子掺杂的C60,结果发现有120个氢气分子可以稳定地吸附在Li12C60周围,平均吸附能为0.075eV/H2。Chandrakumar等人[23]报道了用碱金属(Li、Na、K)掺杂C60吸附氢的研究,Na原子掺杂的C60吸附氢气分子最多,储氢质量密度高达9.5wt%。Wang等人[24]采用理论计算研究了碱土金属Ca修饰富勒烯C60,32个Ca原子可以分别稳定吸附在C60结构的20个六元环和12个五元环上,而且Ca原子之间不会形成团簇。62个氢气分子分两层吸附在C60Ca32的周围,氢气分子平均的结合能为0.11eV/H2, 储氢质量分数可以达到6.2wt%。Shin等人[25]研究了过渡金属Ni分散吸附的C60储氢情况,结果表明储氢量为6.8wt%。Saha等人[26]实验合成了Pd和Ru掺杂的C60,测试了其吸附氢气的性能,发现Pd-C60和Ru-C60在298K,300bar的条件下储氢量分别为0.85wt%和0.69wt%,要高于相同外界条件下纯C60的储氢量。对于富勒烯掺杂的研究,目前绝大部分是基于理论模拟,还需要实验验证。
2.2 非碳质储氢材料
纳米管是一类极具潜力的储氢材料,除碳纳米管外,BN、AlN、TiS2、Si、MoS2纳米管作为储氢材料也有研究。Ma等人[27]研究了在室温下,10MPa的压力,多壁的BN纳米管的储氢量为1.8wt%,而BN粉末的储氢量仅仅为0.2wt%。Chen等人[28]研究了TiS2纳米管,其储氢量在室温,4MPa的条件下可以达到2.5wt%。Lan等人[29]采用巨正则蒙特卡洛方法模拟了Si纳米管的吸氢等温线,(9,9)SiNT在T=298K,P=2MPa、6MPa、10MPa的条件下,储氢量分别为1.30wt%、2.33wt%、2.88wt%,比同一条件下碳纳米管的储氢量分别提高了106%、65%、52%。因此,非碳质纳米管有望成为一种高性能的储氢材料。
2.3 沸 石
沸石分子筛是由硅铝酸盐构成的一种水合结晶。有整齐的孔道结构,分子大小的孔径尺寸、高的比表面积和微孔体积。由于这些特殊的性质,沸石现已被广泛用作吸附剂、离子交换剂和催化剂、以及气体的净化污水的处理等诸多方面。沸石按照孔道特征可以分为一维、二维、三维体系。虽然沸石有高的孔隙率、比表面积,但是至今为止文献中所报道的吸附氢气量很低。Nijkamp等人[30]得出结论,和多孔碳相比,沸石不可能成为高效的储氢材料,由于受其孔体积的限制。Vitillo等人[31]列出了实验上测得的沸石储氢量,结果表明,在77 K时,储氢量最高值为1.81wt%,Langmi等人[32]也给出了同样的结果。近期,Anderson等人报道在低温77K,压强为40bar时,沸石Na-X的最高储氢量为2.55wt%。由于人们在对沸石储氢的实验研究中出现了不同的争论,因此也从理论上对于沸石吸附等温线的模拟以及理论解释进行了大量的研究。研究者们采用了巨正则蒙特卡洛(GCMC)、分子动力学(MD)、分子力学(MM)等方法模拟氢气分子在沸石中的吸附或者扩散行为。Vitillo等人[31]从理论上预测了沸石的储氢性能,他们采用分子动力学模拟得到在77K时,储氢量介于2.65~2.86wt%之间。vandenBerg等人[33]从理论上得到SOD结构的沸石储氢量可以达到4.8±0.5wt%之间,然而Vitillo等人模拟的SOD结构沸石的储氢量为1.92wt%。在后续的工作中,van den Berg等人[34]利用巨正则蒙特卡洛模拟得到Mg-X沸石在77K时的储氢量为4.45wt%。目前报道的储氢量不尽相同,对于储氢机理的研究不够清晰,因此沸石到底能否做为有价值的储氢材料还有待进一步研究。
2.4 金属有机框架材料(MOFs)
金属有机框架(Metal-Organic Frameworks, MOFs),又称为金属有机配位聚合物(Metal Organic Coordination Polymer, MOCP),是一类有机-无机杂化材料,由有机配体和无机金属单元构成的一维、二维或者三维结构的聚合物。金属-有机框架材料一般具有多变的拓扑结构以及物理化学性质。MOFs孔穴的大小、形状以及构成等可以通过选择不同的配体和金属离子,或者改变合成策略加以调节。MOFs材料在气体的储存、分离、催化、磁性、非线性、发光,特别是在低温储氢方面的应用受到广泛关注。MOFs 作为新兴储氢材料是最近十几年来才被报道的,用作储氢材料的 MOFs 和一般的 MOFs 相比较有更高的比表面积。美国密歇根大学Yaghi 教授组[35]于1995年合成了MOF-5材料,发表在Nature杂志上。MOF-5是由无机基团[Zn4O]6+与1,4-苯二甲酸二甲酯以八面体形式连接成的三维框架结构。2003年,Yaghi等人首次报道了MOF-5的储氢性能,研究结果表明在77K,0.7bar时,MOF-5的储氢质量密度为4.5wt%。随后他们的研究表明,MOF-5在77K时的储氢量从1.3wt%到5.2wt%不同,与合成MOF-5的合成初始准备和合成条件有关。近期,Rowsell等人[36]也报道了非常相近的研究结果,MOF-5在低温77K,压强为1bar条件下的储氢量只有1.3wt%;在298K、20bar条件下的储氢量不到0.2wt%。MOF-5在常温下如此低的储氢量很明显不具备实用价值。自从MOF-5报道后,越来越多的金属有机框架材料被合成出来,并且有较高的储氢量[37-44]。到目前为止,据报道MOFs材料中储氢量最高的是MOF-210,在77K,80bar条件下的储氢量达到17.6wt%[36]。表1列出了部分MOFs材料的性质以及储氢性能。从中可以看出,MOFs材料作为储氢材料,依然同其他的多孔材料一样,只有在低温77K时才有高的储氢量,不能满足美国能源部(DOE)在常温下的储氢量的要求。MOFs材料的储氢机理、结构与储氢性能之间的关系,以及如何提高在常温下的储氢量等还有待进一步探究。

表1 部分MOFs材料的吸氢性能
2.5 共价有机框架材料(COFs)
2007年,Yaghi及其合作者[45]首次报道合成了三维共价有机骨架材料(covalent organic framework, COFs)。这些材料中只含有轻元素,H、B、C、O、Si等,原子之间由强的共价键搭建而成的三维网络结构。新合成的COFs材料具有MOFs的所有优点,而且密度比MOFs更小。后来,研究者们又合成出了不同结构的二维和三维COFs材料,比如二维的COF-1和COF-5,三维的COF-102、COF-105以及COF-108等。到目前为止已经制备出的COFs中,比表面积最高的是COF-103,可达到4210m2/g[46],与MOFs比表面积最高的MOF-177(4526m2/g)接近[47]。而COFs材料的最低密度为0.17g/m3(COF-108),要远低于MOFs材料的0.42g/m3(MOF-177),是到目前为止已知密度最低的晶体。
目前,关于COFs储氢性能的报道并不多。表2总结出了部分COFs的储氢量。如表2所示,Tilford等人[48]研究了由不同烷基长度构成的二维COFs,比如COF-18Å,比表面积为1263m2/g,在T=77K,P=1bar的条件下储氢量为1.22wt%;而比表面积为105m2/g的COF-11Å在相同的条件下储氢量只有0.05wt%。可见随着比表面积的增大储氢量也随之增大。Furukawa等人[49]详细测量了氢气在二维COFs(COF-1、COF-5、COF-6、COF-8、COF-10)以及三维COF-102、COF-103的储氢性能。从表中可以看出,三维的COFs材料储氢量要远远高于二维的COFs材料。Garberogilo等人[50]使用巨正则蒙特卡洛方法(GCMC)模拟了H2在三维COFs材料(COF-102、COF-103、COF-105、COF-108)中的吸附等温线,吸附结果表明,在77K,50bar的条件下,COF-102的吸附量达到11wt%;然而在室温(298K),90bar时,COF-108的储氢量只有1.0wt%。大量的研究结果表明,COFs材料和其它的多孔材料一样在室温下,吸氢量远低于储氢载体实际应用的要求。
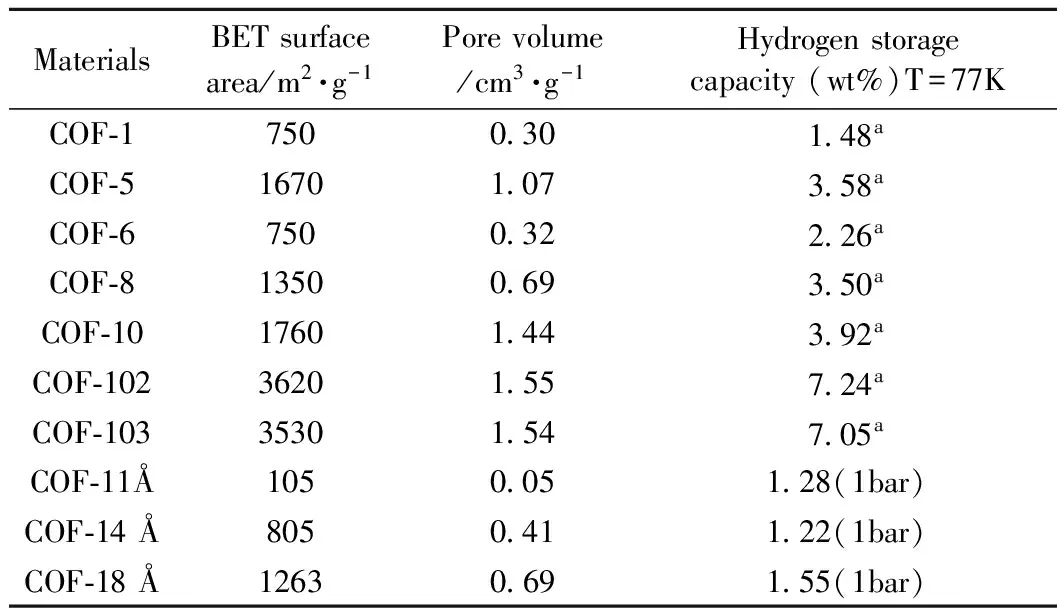
表2 部分COFs材料的吸氢性能
a氢气的饱和吸附量
3 复合型纳米多孔材料
除了以上我们所介绍的各种储氢材料之外,研究者们设计的各种复合型纳米材料或者金属掺杂的多孔纳米材料也有不少的报道。这类材料主要是避免材料本身的缺点,发挥各自的优势,提高复合型纳米多孔材料的储氢密度和储氢性能。Han S S小组[51]用Li+(THF)4和Li+(DHF)4连接层状石墨烯得到三维柱状的多孔结构,用GCMC模拟了其储氢量,模拟结果表明在温度为300 K,压强为100 bar 时,储氢量可以达到4.0wt%,41.9kg/m3。该小组还研究了金属原子Li、Na、K掺杂共价有机框架(COF-102、COF-103以及COF-202),金属有机框架(MOF-77、MOF-80、MOF-200、MOF-205、MOF-210)的储氢情况,金属的掺杂可以很大程度上提高这些材料在常温下的储氢量[52]。美国西北大学的Snurr Q[53]小组在这方面也做了大量的研究。使用金属醇盐(M-O-R, M=Li、Mg、 Mn、Ni、Cu)修饰 IRMOF-1、IRMOF-10、IRMOF-16、UiO-68 以及UMCM-150结构,第一性原理计算表明锂镁醇盐物理吸附氢气分子,锰镍铜醇盐化学吸附氢气分子。GCMC模拟结果表明修饰后的结构在常温下有比较高的储氢量。希腊克里特大学,Froudakis小组[54]理论设计了新型的三维碳纳米管多孔结构,利用多尺度的从头算和GCMC方法得到在77K时,该材料的储氢质量超过20%,在室温下,Li掺杂的三维碳纳米管多孔结构的储氢量达到8%。此外,他们还设计了Li掺杂的柱状氧化石墨烯(GO)。模拟结果得到在低温(77K),低压时的储氢量能够达到美国能源部(DOE)的要求[55]。
4 结 论
到目前为止,多孔储氢材料的总体性能仍需进一步提高,商业化的进程仍需继续推进。当前存在的问题主要是多孔储氢材料在低温高压下有比较理想的储氢量,但是在常温下的储氢量不是很理想,所以要想使其商业化应用,还需各位科研工作者努力探索,不断改进。
[1] M. Rzepka, P. Lamp, M. A. de la Casa-Lillo. Physisorption of hydrogen on microporous carbon and carbon nanotubes [J]. J. Phys. Chem. B., 1998, 102:10894~10898.
[2] 詹亮,李开喜,朱星明,宋燕,吕春祥,凌立成. 超级活性炭储氢性能研究[J].材料科学与工程学报, 2002, 20(1):31~34.
[3] Y. Yürüm, T. Aaralp, T. N. Vezirroglu. Storage of hydrogen in nanostructured carbon materials[J].Int. J. Hydrogen Energy, 2009, 34:3784~3798.
[4] 周理,周亚平. 关于氢在活性炭上高压吸附特性的实验研究 [J].中国科学(B辑), 1996, 26(5): 473~479.
[5] S. Lijima. Helical microtubules of graphitic carbon [J]. Nature, 1991, 354: 56~58.
[6] M. Meyyappan. Carbon nanotubes: science and applications [M]. Beijing: Science Press, 2005.
[7] R. Pekoz, S. Erkoc. Structural and electronic properties of lithium endohedral doped carbon nanocapsules[J]. Physica E., 2007, 36: 211~216.
[8] M. Simeoni, C. D. Luca, et al. Interaction between zigzag single-wall carbon nanotubes and polymers: a density- functional study [J]. J. Chem. Phys., 3005, 122:214710~214718.
[9] A. C. Dillon, K. M. Jones, et al. Storage of hydrogen in single- walled carbon nanotubes [J]. Nature, 1997, 386:377~379.
[10] Y. Ye, C. C. Ahn, C. Witham. Hydrogen adsorption and cohesive energy of single-walled carbon nanotubes [J]. Appl. Phys. Lett., 1999, 74: 2307~2309.
[11] P. Chen, X. Wu, J. Lin. High H2uptake by alkali-doped carbon nanotubes under ambient pressure and moderate temperature [J].Science, 1999, 285:91~93.
[12] H. W. Zhu, A. Chen, et al. The effect of surface treatments on hydrogen storage of carbon nanotubes[J]. J. Mat. Sci. Lett., 2000, 19:1237~1239.
[13] R. T.Yang. Hydrogen storage by alkali-doped carbon nanotubes- revisited [J]. Carbon, 2000, 38:623~626.
[14] H. Kajiura, S. Tsutsui, et al. Hydrogen storage capacity of commercially available carbon materials at room temperature[J]. Appl. Phys. Lett., 2003, 82:1105~1107.
[15] M. Ritschel, M. Uhlemann, et al. Hydrogen storage in different carbon nanostructures[J].Appl. Phys. Lett., 2002, 80: 2985~2987.
[16] 臧小亚,梁德青,吴能友. 碳纳米管和碳纳米管-四氢呋喃水合物的储氢特性[J]. 高等学校化学学报, 2012, 33:580~585.
[17] H. Kabbour, T. F. Baumann, et al. Toward new candidates for hydrogen storage: high surface area carbon aerogels[J]. Chem. Mater, 2006, 18:6085~6087.
[18] 袁秋月,王朝阳,付志兵,唐永建,涂海燕. CO2活化温度对碳气凝胶结构及氢吸附性能影响[J].强激光与粒子束, 2011, 23(7):1853~1856.
[19] 杨曦,付志兵,焦兴利,袁磊,张厚琼,王朝阳,唐永建. 超低密度碳气凝胶的制备与研究[J].原子能科学技术, 2012, 46(8): 996~1000.
[20] J. Changming,H. Robert, et al. Direct solid-phase hydrogenation of fullerenes[J].J. Phys. Chem., 1994, 98:4215~4217.
[21] Y. Ye, C. C. Ahn, et al. Hydrogen adsorption and phase trans-itions in fullerite[J].App. Phys. Lett., 2000, 77:2171~2173.
[22] Q. Sun, P. Jena, et al. First-principles study of hydrogen storage on Li12C60[J].J. Am. Chem. Soc., 2006, 128:9741~9745.
[23] K. R. S. Chandrakumar, S. K. Ghosh. Alkali-metal-induced enhancement of hydrogen adsorption in C60fullerene: an ab initio study[J].Nano Lett., 2008, 8:13~19.
[24] Q. Wang, Q. Sun, et al. Theoretical study of hydrogen storage in Ca-coated fullerenes[J].J. Chem. Theory Comput, 2009, 5:374~379.
[25] W. H. Shin, S. H. Yang, et al., Ni-dispersed fullerenes: hydrogen storage and desorption properties[J].App. Phys. Lett., 2006, 88:053111~053113.
[26] D. Saha, S. G. Deng. Hydrogen adsorption on Pd- and Ru-doped C60fullerene at an ambient temperature[J].Langmuir, 2011, 27:6780~6786.
[27] R. Ma, Y. Bando, H. W. Zhu. Hydrogen uptake in boron nitride nanotubes at room temperature[J].J. Am. Chem. Soc., 2002, 124(26):7672~7673.
[28] J. Chen, S. L. Li, Z. L. Tao. Titanium disulfide nanotubes as hydrogen-storage materials[J].J. Am. Chem. Soc., 2003, 125(18) 5284~5285.
[29] J. H. Lan, D. J. Cheng, et al. Silicon nanotube as a promising candidate for hydrogen storage: From the first principle calculations to grand canonical monte carlo simulations[J]. J. Phys. Chem. C, 2008, 112:5598~5604.
[30] M. G. Nijkamp, J. E. M. J. Raaymakers, et al. Hydrogen storage using physisorption -materials demands[J]. Appl. Phys. A, 2001, 72: 619~623.
[31] J. G. Vitillo, G. Ricchiardi, et al. Theoretical maximal storage of hydrogen in zeolitic frameworks[J].Phys. Chem. Chem. Phys., 2005, 7:3948~3954.
[32] H. W. Langmi, A. Walton, et al. Hydrogen adsorption in zeolites A, X, Y and RHO[J]. J. Alloy Compd., 2003, 356~357:710~715.
[33] A. W. C. van den Berg, S. T. Bromley, J. C. Jansen. Thermodynamic limits on hydrogen storage in sodalite framework materials: a molecular mechanics investigation[J].Microporous Mesoporous Mater, 2005, 78: 63~71.
[34] A. W. C. an den Berg, S. T. Bromley, et al. Adsorption isotherms of H2in microporous materials with the SOD structure: A grand canonical Monte Carlo study[J]. Microporous Mesoporous Mater, 2006, 87: 235~242.
[35] H. L. Li, M. Eddaoudi, et al. Design and synthesis of an exceptionally stable and highly porous metal-organic frameworks [J]. Nature, 1999, 402: 276~279.
[36] J. L. C. Rowsell, O. M. Yaghi. Effect of functionalization, catenation, and variation of the metal oxide and organic linking units on the low-pressure hydrogen adsorption properties of metal-organic frameworks[J]. J. Am. Chem. Soc., 2006, 128:1304~1315.
[37] J. Sculley, D. Yuan, H. C. Zhou. The current status of hydrogen storage in metal-organic frameworks-updated[J]. Energy Environ. Sci., 2011, 4: 2721~2735.
[38] X. Lin, N. R. Champness, M. Schröder. Hydrogen, methane and carbon dioxide adsorption in metal-organic frameworks materials [J]. M. Top. Curr. Chem., 2010, 293: 35~76.
[39] Y. H. Hu, L. Zhang. Hydrogen storage in metal-organic frameworks[J]. Adv. Mater, 2010, 22: E117~E130.
[40] S. Ma, H. C. Zhou. Gas storage in porous metal-organic frameworks for clean energy applications[J]. Chem. Commun, 2010, 46: 44~53.
[41] S. S. Han, J. L. Mendoza-Cortés, W. A. Goddard. Recent advances on simulation and theory of hydrogen storage in metal-organic frameworks and covalent organic frameworks[J]. Chem. Soc. Rev., 2009, 38:1460~1476.
[42] L. J. Murray, M. Dincä, J. R. Long. Hydrogen storage in metal-organic frameworks[J]. Chem. Soc. Rev., 2009, 38: 1294~1314.
[43] M. Dincä, J. R. Long. Hydrogen storage in microporous metal-organic frameworks with exposed metal sites[J]. Angew. Chem., Int. Ed., 2008, 47:6766~6779.
[44] 周素芹,程晓春,居学海,朱小红. 储氢材料研究进展[J]. 材料科学与工程学报, 2010,28(5):783~790.
[45] D. Yuan, D.Zhao, et al. An isoreticular series of metal-organic frameworks with dendritic hexacarboxylate ligands and exceptionally high gas-uptake capacity[J]. Angew. Chem., Int. Ed., 2010, 49: 5357~5361.
[46] E. L. Spitler, J. W. Colson, et al. Lattice expansion of highly oriented 2D phthalocyanine covalent organic framework films[J]. Angew. Chem. Int. Ed., 2012, 51:2623~2627.
[47] J. L. C. Rowsell, A. R. Millward, et al. Hydrogen sorption in functionalized metal-organic frameworks[J].J. Am. Chem. Soc., 2004, 126:5666~5667.
[48] R. W. Tilford, S. J. Mugavero III, P. Pellechia, Tailoring microporosity in covalent organic frameworks[J].Adv. Mater., 2008, 20:2741~2746.
[49] H. Furukawa, O. M. Yaghi. Crystalline covalent organic frameworks with hydrazone linkages[J]. J. Am. Chem. Soc., 2009, 131:8875~8879.
[50] G. Garberoglio. Adsorption and diffusion of hydrogen and methane in 2D covalent organic-frameworks[J]. Langmuir, 2007, 23:12154~12158.
[51] S. S. Han, S. S. Jang. A hydrogen storage nanotank: lithium- organic pillared graphite[J]. Chem. Commun, 2009, 5427~5429.
[52] J. L. Mendoza-Cortés, S.S Han. High H2uptake in Li-, Na-, K-metalated covalent organic frameworks and metal organic[J]. J. Phys. Chem. A, 2012, 116:1621~1631.
[53] R.B.Getman,J. H. Miller, et al. Metal alkoxide functionalization in metal-organic frameworks for enhanced ambient-temperature hydrogen storage[J].J. Phys. Chem., 2011, 115: 2066~2075.
[54] E. Tylianakis, G. K. Dimitrakakis, et al. Porous nanotube network: a novel 3D nanostructured material with enhanced hydrogen storage capacity [J]. Chem. Commun, 2011, 47: 2303~2305.
[55] E. Tylianakis, G. M. Psofogiannakis, et al. Li-doped pillared graphene oxide: a graphene-based nanostructured material for hydrogen storage[J]. J. Phys. Chem. Lett., 2010, 1: 2459~2464.
Overviews on Porous Materials for Hydrogen Physical Adsorption
REN Juan1,3, LIU Qijun2, ZHANG Hong3
(1.School of Science, Xi’an Technological University, Xi’an 710032, China; 2.College of Physical Science and Technology, Southwest Jiaotong University, Chengdu 610031, China; 3.College of Physical Science and Technology, Sichuan University, Chengdu 610065, China)
In this article, we reviewed kinds of hydrogen storage materials such as carbon-based material, non carbon-based material, zeolite, metal-organic frameworks (MOFs), and covalent organic framework (COFs). The present research situation and its development trend are analyzed.
porous hydrogen storage materials; carbon-based material; non carbon-based material; zeolite; MOFs; COFs
1673-2812(2017)01-0160-07
2015-07-14;
2016-02-02
2015年国家自然科学基金应急资助项目(NSFC:11547152)和西安工业大学博士科研启动金资助项目(204-000317)
任 娟(1986-),女,博士。研究方向:低维纳米材料及储氢材料计算模拟。E-mail:renjuan@xatu.edu.cn。
张 红,教授,博士生导师,E-mail: hongzhang@scu.edu.cn。
TB34
A
10.14136/j.cnki.issn 1673-2812.2017.01.032

