液相制备α-Fe2O3粉末的结构及其光催化性能
邓赛夫,王双保,李学青,陈 希
(华中科技大学光学与电子信息学院,湖北 武汉 430074)
液相制备α-Fe2O3粉末的结构及其光催化性能
邓赛夫,王双保,李学青,陈 希
(华中科技大学光学与电子信息学院,湖北 武汉 430074)
运用了液相均匀沉淀法较为经济地制备纳米α-Fe2O3粉末。通过在合成时是否添加或者不添加硬脂酸(C8H36O2)或十二烷基苯磺酸钠(SDBS,C18H29NaO3S)等分散剂,研究了纳米α-Fe2O3晶粒形核和长大的特征。借助XRD和SEM表征,可以发现:不添加分散剂的条件下制备的α-Fe2O3粉末生成了较为粗大的晶粒,添加了SDBS的反应物则得到了均匀分布的、有着规则多面体外形、晶粒粒径约40nm的α-Fe2O3粉末;而添加硬脂酸(C8H36O2)分散剂则制备得到了无定型、粒径约10nm的α-Fe2O3粉末。光催化测试结果表明不仅尺寸效应会影响光催化能力,晶化完整性也是十分重要的影响因素。适当添加分散剂有助于抑制α-Fe2O3粉末成核以及结晶过程中的团聚,从而使得生成的晶粒更细小。而加入不同分散剂的条件下,其影响水平也是十分不一样的,这可能是由于分散剂中的阴离子与Fe3+发生了配位反应的结果。最后,光催化实验结果表明添加了SDBS分散剂的例子要明显好于不添加分散剂和添加了硬脂酸得到的纳米α-Fe2O3粉末。
纳米粉末; α-Fe2O3; 形貌; 粒径; 分散剂
1 引 言
纳米α-Fe2O3粉末在科学研究和生产生活的各个领域(建筑、医疗、环保、电子等)都能发现它的踪迹,具体应用有:涂料、陶瓷、药品、环保材料、磁记录、微波器件、传感器等技术[1-4]。目前已经有很多有关纳米α-Fe2O3合成方法的报道,其中最为普遍的就是液相法(包括强迫水解法[5],微波法[3],溶胶-凝胶法[2],水热法,化学沉淀法[6]):反应中颗粒尺寸和形态的控制主要通过调节粉末合成过程的工艺参数,如试剂浓度、温度、搅拌速度、pH值、反应时间等[7]来实现。
考虑到当前国内纳米氧化物材料产业升级及其在环境保护上的应用的现实需要,更加高效的纳米α-Fe2O3制备工艺仍在研发之中。在本次研究中,我们采用的是液相化学沉淀法。该方法比较简单和实用,比较适合于工业化生产[8-11],因而有着较大的现实意义。为了获得较为理想的α-Fe2O3粉末,研究其晶粒生长的机制,我们在此采用了在均匀沉淀制备过程中添加少许分散剂的方法。在分散剂的选择上,我们尝试按照其基本特点选择相对较为简单的活性剂来控制Fe2+或Fe3+在成核过程的相变和结构。
文献[2]报道了Fe3+与分散剂羧基(COO-z)基团之间可存在配位作用,所制备的α-Fe2O3粉末的晶相、尺寸和相貌可通过改变分散剂结构来调制。为了进一步研究分散剂对制备纳米α-Fe2O3粉末相貌的影响,我们分别对不添加、添加常规表面活性剂SDBS和添加有着羧基基团的硬脂酸分散剂进行实验对比,通过表征所得到的α-Fe2O3粉末来进一步地解析分散剂对合成α-Fe2O3的影响;本文是为了探寻一种经济高效的纳米α-Fe2O3粉末的制备方法而进行的实验和表征研究。
从两种添加剂分子结构中可以做出初步的分析:由于硬脂酸分子具有羧基(COO-)基团,容易与Fe2+离子产生配位作用,从而能够得到超细颗粒α-Fe2O3。而SDBS则是一般常用到的分散剂,也经常用于纳米α-Fe2O3粉末的合成。
2 实 验
2.1 实验原料
实验主要原料:FeCl3·6H2O(分析纯)、NH3·H2O(分析纯)、十二烷基苯磺酸钠(SDBS)(分析纯)、硬脂酸(分析纯)、稀盐酸(30%)等。
2.2 实验过程
主要用到的实验仪器有:PHS-3C型酸度计、78-1磁力加热搅拌器、离心机、电热恒温干燥箱、低温电阻炉、高温炉、JM-B2003电子天平等。
通过液相均匀沉淀法来制备α-Fe2O3粉末的实验步骤如下:用电子天平称取结晶三氯化铁(FeCl3·6H2O)13.525g,配制成500mL(0.1mol/L)的溶液;在500mL量筒中加入100mL浓氨水,再加去离子水至500mL配制稀氨水,搅拌均匀;将上述溶液均分3等份。
在500mL烧杯中加入约100mL去离子水作为底液,按表1方案配制3份,分散剂0.068g或者无分散剂,再滴加稀盐酸将底液的pH值调至3;在室温下,将底液置于磁力搅拌器上搅拌。

表1 底液配置方案
用酸式和碱式滴定管将FeCl3溶液和稀氨水同时以一定的速率比缓慢滴入底液中。当FeCl3溶液滴完后,停止滴加稀氨水,在pH值恒定的条件下,继续对溶液进行搅拌,反应1h得到悬浊液。
陈化1天,将悬浊液离心分离,将离心后得到的沉淀物放入烘箱干燥,反复清洗5次,350℃烧结2h,再经玛瑙乳钵研磨成粉末。
2.3 性能表征
为了研究分析制备粉末的晶相、尺寸及形貌,采用XRD(日本理学公司生产D/MAX-RB)与FE-SEM(JEM-2100F STEM/EDS)对粉末进行了表征。为了研究分析粉末的表面吸收特性及晶体合成机理,使用FT-IR(Nexus)红外光谱仪对α-Fe2O3粉末的吸收特征进行了表征。
此外,为了对2种添加剂制备的α-Fe2O3的光催化性能进行分析比较,我们用自建的光催化实验台对样品进行光催化研究。光催化的对象是我们自己配置的甲基橙溶液,放在250瓦的高压汞灯下进行辐照(光源与试剂液面的距离为10cm)。每当光催化进行2h后,我们取出一个样品,最后在PerkinElmer Lambda35紫外-可见-近红外分光光度计上进行甲基橙吸收光谱的测试[12],最后再运用朗伯-比尔定律换算出甲基橙的浓度。朗伯-比尔定律如下式所示:
A=lg(1/T)=KbC
(1)
其中A 为甲基橙吸光度;T为透射光强度与入射光强度之比;C为甲基橙的浓度,单位mol/L;b 为甲基橙吸收层厚度,单位cm。
3 结果与讨论
3.1 XRD表征
所制备的粉末的XRD表征结果如图1所示。
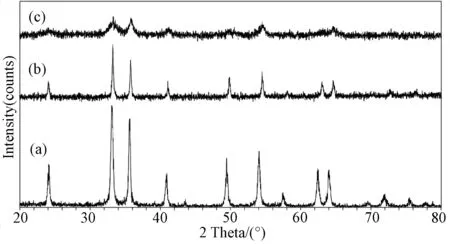
图1 α-Fe2O3纳米粒子的XRD衍射谱 (a)无分散剂; (b) 添加SDBS; (c) 添加硬脂酸Fig.1 XRD spectra of α-Fe2O3 nanoparticles: (a) bare dispersing agent; (b) add SDBS; (c) add stearic acid
从图中可以观察到三个样品得到的都是α-Fe2O3相,但是可以很明显看出(a)中为完全结晶的α-Fe2O3相,晶粒质量好;(b)结晶较完全,结晶质量较好;(c)中结晶不完全,衍射峰呈现弥散的宽包络峰,对应有较多的非晶体相。
这样的结果可归因于:(a)是没有加任何的分散剂的条件下,所以形核和生长进行得很自由,晶体化进行得很迅速,晶粒生长得比较粗大;由于(b)中添加了SDBS后,晶体结晶完整,晶粒较大,因而衍射线强、尖锐且对称;但是SDBS的阴离子还是会与Fe3+之间发生配位作用,从而抑制了晶相的形成(相对于不加分散剂(a)的情况)。而在(c)中硬脂酸会抑制非晶的
b-FeOOH相向α-Fe2O3相的转变[2],另外由于纳米粒子的表面覆盖有有机溶剂,可以防止晶粒的生长[13,15],得到的颗粒较小(如表2所示),而且比较分散的无定型颗粒;且这些颗粒可以稳定地分散于常见的有机溶剂中,经过低于传统温度的烧结处理,就可以得到所需的结晶纳米粒子[14];如表2所列出的,加了分散剂的由于其抑制形核和生长的作用,使得它们的晶粒都比没有加分散剂的要小。而从使用的两种分散剂的分散效果来看,羧基密度高的分子结构所起的分散效果更好。
晶粒的平均尺寸可以根据Scherr公式从XRD的主强峰值结果获得:
CrystalliteSize=K*l/FW(S)*Cos(q)
(2)
3.2 不同分散剂对形貌的影响
图2是添加不同分散剂制备得到的α-Fe2O3粒子的FE-SEM照片。

图2 α-Fe2O3纳米粉末的FE-SEM表征图 (a) 没有添加分散剂; (b) 添加SDBS; (c) 添加硬脂酸Fig.2 FE-SEM characterization of α-Fe2O3 nanometer powder(a) Without the addition of dispersant; (b) Add SDBS; (c) The addition of stearic acid
晶粒的生长一般可划分成两个阶段:成核阶段和晶体生长阶段。在成核阶段,成核数目越多,最终晶粒的粒径越小,而在晶体生长阶段沿各个晶面方向生长速度的不同决定了最终的颗粒的外形。例如在不添加任何分散剂的条件下,α-Fe2O3成核过程不受分散剂的限制,进行得比较充分,成核和生长进行得较迅速,结果造成晶粒粒径较大。扫描电镜观察粉末颗粒的外形尺寸大约有十几个微米,而实际上根据谢尔公式推算出的α-Fe2O3粉末晶粒尺寸要比从SEM观察到的小得多。产生差别的主要原因是用XRD表征的是粉末颗粒内部的晶体结构,即晶粒大小(XRD分析的晶粒尺寸大小约为10~80nm),而SEM观察到的是粉末的颗粒大小,颗粒通常是由多个晶粒生长而成。
当添加SDBS分散剂时,SEM观察的视场内看得到的粉末颗粒外观上呈现规则多面体结构,颗粒尺寸在1微米左右,但是颗粒尺寸分布并不是十分均匀,在视场内也能看到很细小的颗粒;当添加硬脂酸分散剂时,得到的α-Fe2O3粉末呈无定型状态,粉末颗粒多聚集在一起,形成较疏松的菜花结构的大团聚物,团聚物上的小颗粒外观尺寸约50nm。可是从XRD衍射和Scherrer公式推导可得,添加SDBS获得的α-Fe2O3晶粒的粒径大约40nm,而添加硬脂酸后得到的晶粒粒径大约10nm。从以上结果分析可得,硬脂酸分散剂比SDBS分散剂的分散能力要好,但是从SEM反映的情况来看,添加硬脂酸的α-Fe2O3粉末比添加SDBS的团聚要严重。
Kamiya et al[10]曾报道了一种使用添加剂来控制晶粒的液相制备方法,该方法是在常规的sol-gel法制备BaTiO3粉末的过程中添加一种特殊顺式结构的低分子、高密度亲水性基团的有机物作为分散剂,最后得到了超细,粒径大约20nm的BaTiO3粒子。实验以四异丙醇钛和Ba(OH)2溶液作为原料,不添加表面活性剂时,粒径几十微米的团聚颗粒会快速形成;当添加表面活性剂时,颗粒粒径减小至几十纳米左右。用FT-IR分析溶液,发现表面活性剂表面的羧基(COO-)基团与Ba2+离子有配位作用,活性剂表面的吸附作用进一步促进了颗粒的生长。Motoyuki Iijima[2]等研究发现如果表面活性剂与目标合成物(α-Fe2O3)的正二价或三价铁离子复合,也有类似的情况发生。他在实验中沿用了Kamiya et al[10]使用的分散剂,而此类分散剂有着明显的结构特点:即有比较多羧基、具有顺式的分子结构,然而,在实际工业制备中此类分散剂结构略显复杂且难以获得。
因此,从控制粒子形貌的角度来说,添加的分散剂不同则对晶粒的生长起了不同的引导作用,从而最终得到不同形态的晶粒[7]。添加硬脂酸的试剂中的COO-与Fe3+的螯合作用有效地抑制了α-Fe2O3晶粒成核、生长以及晶粒生长,使得合成的α-Fe2O3粉末更细小。而添加了SDBS分散剂的条件下,SDBS中的有机分子虽也起了阻碍α-Fe2O3形核和生长的作用,但是SDBS中却没有COO-与Fe3+的螯合作用,α-Fe2O3成核和生长虽受到抑制但却还是可以发展,最后得到相对较大的晶粒尺寸。
3.3 FT-IR表征
图3分别为没有添加分散剂和添加了分散剂条件下制备得到的纳米α-Fe2O3粉末进行FT-IR表征的测试结果。

图3 α-Fe2O3粉末的FT-IR谱图(a) 添加硬脂酸; (b) 无添加; (c) 添加SDBSFig.3 FT-IR spectra of (a) Add stearic acid; (b) without dispersion regent; (c)Add SDBS
从图3没有添加分散剂样品的FTIR谱上可以明显观察到545cm-1、460cm-1处2个α-Fe2O3的特征吸收峰(对应着Fe-O的伸缩振动),此外还有1622cm-1处对应于H-O弯曲振动的共振吸收峰,以及1130cm-1处的对应酸根离子的共振吸收峰。所以,没有添加分散剂的样品里残留物质相对比较简单。
而添加了分散剂样品的FT-IR谱图也都可以明显观察到545cm-1、460cm-1处2个α-Fe2O3的特征吸收峰,说明添加或不添加各类分散剂得到的物质主要都是α-Fe2O3粉末,这与XRD分析结果一致。另外除了可以观察到3386cm-1、1622cm-1处对应于H-O伸缩、弯曲振动的共振吸收峰,添加硬脂酸的图3(a)还可以观察到1401cm-1、927cm-1等处的吸收峰,这些是对应着羧基的吸收峰。而添加了SDBS的图3(b)可以观察到1133cm-1、1079cm-1、1041cm-1、991cm-1等处的几个强吸收峰,这些大体上对应着磺酸根离子的吸收峰位,这些说明在纳米α-Fe2O3的制备过程中,硬脂酸、SDBS起到分散剂的作用,而且在反应得到的粉末颗粒中,硬脂酸的羧基和SDBS的磺酸根阴离子在反应完全后仍然被保留在材料中。也正是由于这些基团与三价铁离子的獒合,导致晶粒的生长受到抑制,减少了颗粒团聚和凝结到一起的机会。但是这两种基团的影响有稍许差别,相对而言,羧基的分散作用要强一些。
3.4 光催化性能
向0.02g/L 的甲基橙溶液放入经过350℃烧结后的α-Fe2O3粉末后在250W 高压汞灯下进行辐照。每2h后从辐照光下取出一个试剂样品,然后通过分光光度计测量甲基橙的浓度来推导α-Fe2O3粉末的降解率。
表3为推导出来的降解率数据,显示出添加了SDBS样品具有最好的降解效果:当光辐照了5个小时后降解率达到了53.6%,从1h 到5h 降解率提高了2倍。可以看出,当时间延长,甲基橙的吸收呈下降趋势。这意味着降解率随时间的延长而提高。然而,13h的辐照后,降解率随时间变化很小,这说明降解率已经趋于平缓。
这里,我们用一个概念——脱色率来衡量光催化降解效果。脱色率的计算公式如下:
(3)
式中D为脱色率,A0为甲基橙光催化降解之前的吸收度值,A为光催化降解之后的吸收度值。随着甲基橙的降解溶液的吸收度降低,而脱色率增加。因此,脱色率与甲基橙的降解是呈正比例的关系,可以更直观地反映出光催化降解的效果。
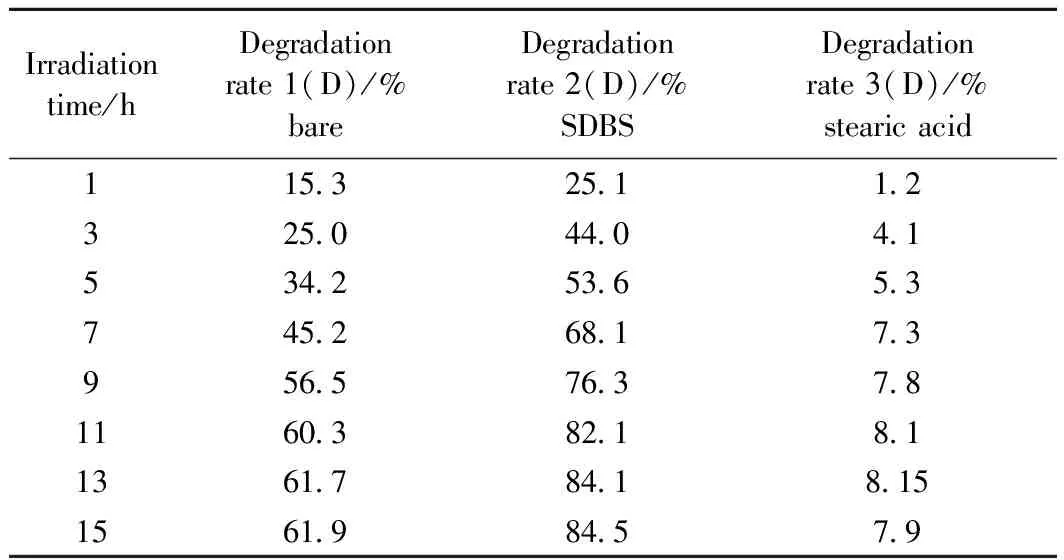
表3 各个样品的甲基橙降解速率
图4反映出添加了SDBS得到的α-Fe2O3作为光催化剂具有较为明显的脱色率,这也说明这类实验得到的α-Fe2O3粉末具有较大的光催化能力,在降解开始,甲基橙降解率提高得很迅速,在后期速度降低了,这意味着α-Fe2O3对甲基橙的光催化作用开始进行得较快,一定时间后速度变慢。可能的解释是:在开始时甲基橙的浓度较高因而OH-能够被很容易地吸附到α-Fe2O3颗粒的表面,在后来的时间里,因为甲基橙浓度已经降低了很多,在α-Fe2O3颗粒表面俘获OH-的机会开始变少,使得其光催化的速度逐渐变慢。
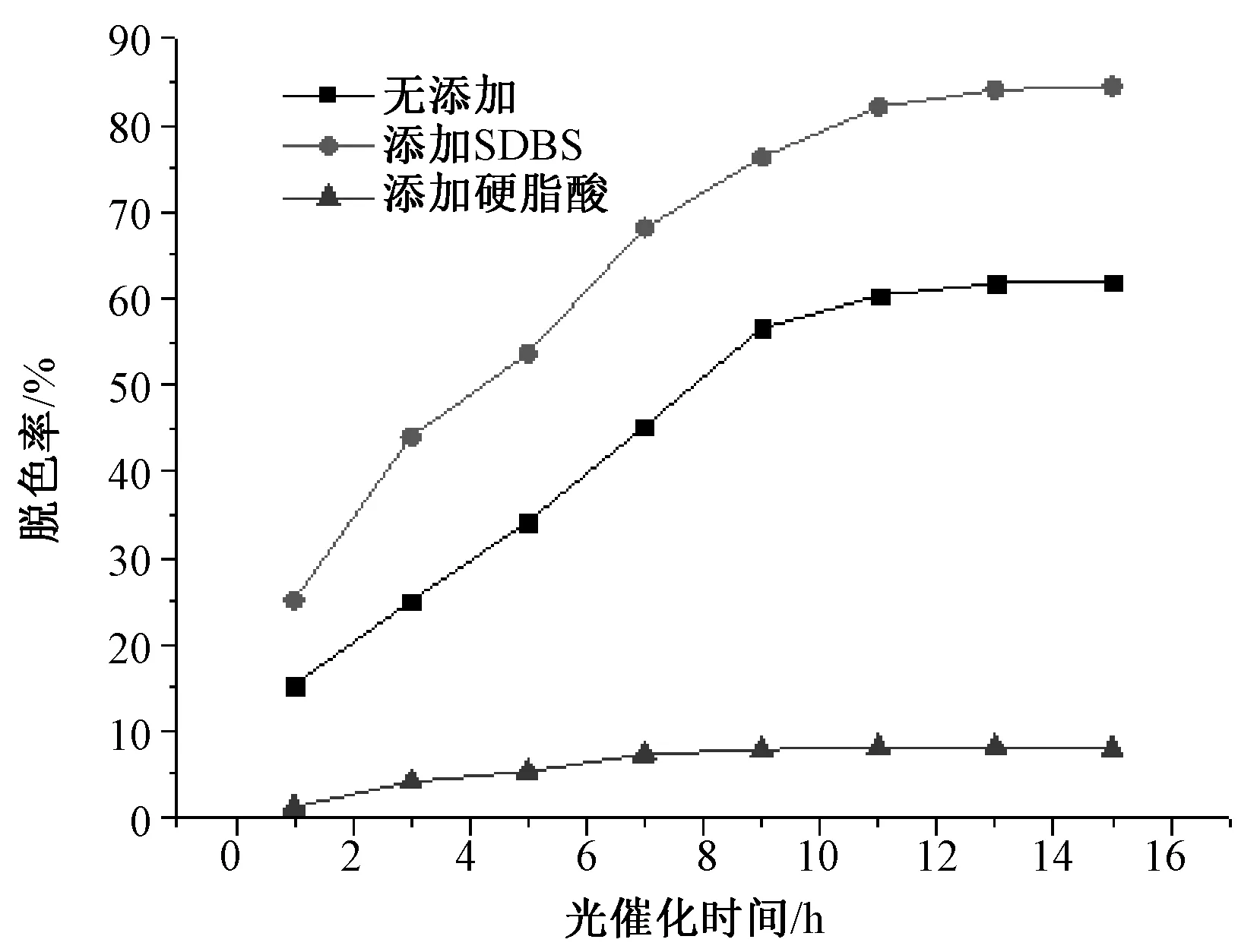
图4 随着辐照时间的延长降解率的变化Fig.4 With the extension of irradiation time curve of degradation rate
另外,添加了SDBS得到的α-Fe2O3粉末对甲基橙的降解率好于不添加分散剂和添加了硬脂酸的。这个应该归结于三者具有非常不同的α-Fe2O3晶化质量和界面条件。添加了SDBS的晶体尺寸要优于没添加分散剂的情况,而其晶粒结晶的质量明显优于添加了硬脂酸的情况下。虽然添加了硬脂酸的条件下得到了颗粒尺寸较小的粉末,但硬脂酸同时也抑制了物相的形成,并造成较严重的团聚,减少了颗粒的表面积,使得烧结处理后α-Fe2O3的晶体质量不是很好,因而获得的α-Fe2O3粉末颗粒的光催化能力也是最差的。
4 结 论
在液相均匀沉淀法制备纳米α-Fe2O3的过程中,研究了不添加、添加硬脂酸和SDBS分散剂制备的不同粒径、形貌的纳米α-Fe2O3;在没有添加分散剂时得到的是颗粒较大的α-Fe2O3粉末,添加SDBS时得到的是规则的多面体颗粒,而添加硬脂酸得到的是粒径较小的无定型颗粒;在合成α-Fe2O3的过程中,分散剂有效抑制了晶粒的生长,硬脂酸的羧基抑制晶粒生长的效果明显好于SDBS,得到的颗粒尺寸也较小;但硬脂酸同时也抑制了物相的转变,并且硬脂酸的存在造成了严重的颗粒团聚,使得烧结处理后α-Fe2O3的晶体质量较差,而添加SDBS的α-Fe2O3晶化进行得较彻底,结晶完整度较高。此外,光催化性能的表征也从侧面说明几种产物的结晶水平是有差别的。
几种分散剂对晶粒团聚的抑制效果目前还不是太理想,在扫描电子显微镜下观察制备得到的粉末,常可以看到很多团聚成大颗粒的情况,这或多或少与均匀沉淀的工艺以及这些分散剂的选择有关[16]。
最后,我们测试了这几种α-Fe2O3粉末的光催化效果,实验结果表明用SDBS做分散剂得到的纳米α-Fe2O3具有最为理想的光催化效果。
[1] Jun Chen, Lina Xu, Weiyang Li, Xinglong Gou. α-Fe2O3nanotubes in gas sensor and lithium-ion battery applications [J]. Advanced Materials, 2005, 17(5): 582~586.
[2] Motoyuki Iijima, Yuichi Yonemochi, Mayumi Tsukada, Hidehiro Kamiya. Microstructure control of iron hydroxide nanoparticles using surfactants with different molecular structures [J]. Journal of Colloid and Interface Science, 2006, 298(1): 202~208.
[3] Wenmin Zhang, Qiang Liu, Yongzheng Tang. Influence of additives on formation and size of uniform hematite particles prepared by microwave irradiation [J]. Materialsence & Engineering, 1999, 17(2): 29~32.
[4] 李莉莉.纳米氧化铁的形貌控制合成及性能[D]. 湖南大学,物理化学,蔡炳新;詹拥共,湖南, 2010.
[5] T.P. Raming, A.J.A. Winnubst, C.M. van Kats, A.P. Philipse. The synthesis and magnetic properties of nanosized hematite (α-Fe2O3) particles [J]. Journal of Colloid and Interface Science, 2002, 249(2): 346~350.
[6] Honglei Fan, Baozhen Song, Juhua Liu, Zhenqiu Yang, Qiaoxia Li. Thermal formation mechanism and size control of spherical hematite nanoparticles [J]. Materials Chemistry and Physics, 2005, 89(2): 321~325.
[7] DOU Qi-Sheng, ZHANG Hui, WU Jian-Bo, YANG De-Ren. Synthesis and characterization of Fe2O3and FeOOH nanostructures prepared by ethylene glycol assisted hydrothermal process [J]. Journal of Inorganic Materials, 2007, 22(2):213~218.
[8] Sugimoto Tadao, Wang Yinsheng, Hiroyuki Itoh, Atsushi Muramatsu. Systematic control of size, shape and internal structure of monodisperse α-Fe2O3particles [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1997, 134(3): 265~279.
[9] Sugimoto Tadao, Wang Yinsheng. Mechanism of the Shape and Structure Control of Monodispersed α-Fe2O3Particles by Sulfate Ions [J]. Journal of Colloid and Interface Science, 1998, 207(1): 137~149.
[10] Hidehiro Kamiya, Kenjiro Gomi, Yuichi Iida, et al. Preparation of highly dispersed ultrafine barium titanate powder by using microbial-derived surfactant [J]. Journal of the American Ceramic Society, 2003, 86(12): 2011~2018.
[11] LIU Haifeng, PENG Tongjiang, SHU Hongjuan. Preparation and characterization of nano-crystallization Fe2O3powder [J]. Journal of Instrumental Analysis, 2009, 28(4):419~423.
[12] 张劭锦,李巍,崔祥水,陈文哲.低温液相法制备掺铁氧化锌及其光催化活性[J]. 材料科学与工程学报, 2014, 4(32):522~526.
[13] 于翔鹏,傅佳佳,王鸿博. 碱沉淀法制备Ce掺杂ZnO及其光催化性能[J]. 材料科学与工程学报, 2015, 4(33):591~594.
[14] DONG Rui, JIANG Ji-Sen, YANG Xie-Long. Preparation of iron oxide nanoparticles in non-aqueoue solution [J]. Journal of Inorganic Materials, 2002,12(5): 967~972.
[15] 刘金生,刘少友,赵钟兴.铁、镉复合掺杂氧化锌纳米粉体的制备及其光降解性能[J]. 材料科学与工程学报, 2013, 31(5):752~757.
[16] Liu Hui, Yu wei, Li Ping, Yanfeng Zhang, Yuhan Sun. Catalytic synthesis of nanosized hematite particles in solution [J]. Materials Chemisry and Physics, 2007, 102(1):1~6.
Structure and Optical-catalysis of α-Fe2O3Nanopowders Obtained by Homogeneous Liquid Phase Sediment
DENG Saifu, WANG Shuangbao, LI Xueqing, CHEN Xi
(School of Optical and Electronic Information, Huazhong University of Science & Technology, Wuhan 430074, China)
In order to find an economic and effective synthesis method for industry production ofα-Fe2O3nanopowders, here we did experimental study of the liquid-phase sediment for nanopowders. Through adding dispersion organic matters such as stearic acid (C8H36O2) or twelve benzene sulfonate (SDBS, C18H29NaO3S), we obtained α-Fe2O3powders with regular polyhedron shape and grain size ranging from 10~80nm. The photon-catalyst measurements show that the α-Fe2O3nanopowders own better degeneration capacity of organic matters. The particles nucleated and agglomerated during growth up process are controlled by those dispersion matters. These powders filling with dispersion matters make the grain loose and smaller in size. It is attributed to the coordination reaction of anion with Fe3+.
nanometer powder; α-Fe2O3; morphology; grain size; dispersion regents
1673-2812(2017)01-0057-06
2015-06-18;
2016-01-04
中央高校基本科研业务费资助项目(HUST:编号2015TS049),国家高技术研究发展计划(863计划)资助项目(2011AA03A106)
邓赛夫(1992-),女,硕士研究生,研究方向为光电材料与探测技术,E-mail: M201471996@hust.edu.cn。
王双保(1972-),博士,副教授,研究方向为光电材料与探测技术,E-mail: sb_wang@126.com。
TF123.7+1
A
10.14136/j.cnki.issn 1673-2812.2017.01.012

