胃癌患者组织p-mTOR的阳性表达与临床病理参数及预后的相关性
王静,王亚明,霍双,吴士茜,孙颖,袁艳龙,王杰,田云霄,张桂东,刘博
(邯郸市中心医院病理科1、普外科2、科教科3、泌尿外科4、急诊外科5,河北 邯郸056001)
胃癌患者组织p-mTOR的阳性表达与临床病理参数及预后的相关性
王静1,王亚明2,霍双3,吴士茜1,孙颖1,袁艳龙1,王杰4,田云霄1,张桂东2,刘博5
(邯郸市中心医院病理科1、普外科2、科教科3、泌尿外科4、急诊外科5,河北 邯郸056001)
目的 探讨胃癌患者组织磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)的阳性表达与临床病理参数及预后的相关性。方法 于2013年1月至12月对邯郸市中心医院收治的89例胃癌患者采用免疫组化法检测胃组织标本中p-mTOR的表达,分析其与淋巴结转移、浸润深度、组织分化程度和病理分期的相关性,并按p-mTOR的不同表达情况比较患者的预后。结果p-mTOR阳性率为77.53%(69/89),其中有淋巴结转移的患者p-mTOR阳性率为90.20%,高于无淋巴结转移者的60.53%,差异有统计学意义(P<0.05);Spearman等级相关分析显示,p-mTOR的阳性表达与浸润深度、组织分化及肿瘤分期均呈正相关(P<0.01),相关系数分别为0.65、0.69和0.64。p-mTOR低表达组的疾病无进展中位生存期为23.5个月,显著长于高表达组的12.8个月,差异有显著统计学意义(P<0.01)。结论p-mTOR在胃癌患者体内高表达,检测p-mTOR的表达有利于患者的预后评估。
胃癌;磷酸化哺乳动物雷帕霉素靶蛋白;免疫组化;预后;相关性
胃癌(gastric cancer,GC)是起源于胃黏膜上皮的恶性肿瘤,作为全球常见的恶性肿瘤之一,其发病率仅次于肺癌、乳腺癌与肠癌之后,且在恶性肿瘤死因顺位中列第二位。我国是胃癌高发地区,每年新发和死亡病例分别约为40万和35万,严重威胁生命健康[1]。研究发现,细胞信号传导机制对肿瘤细胞的侵袭、转移、逃避凋亡起着重要的调控作用[2]。磷酸化雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)相关信号通路的异常与肿瘤的发生发展关系密切,调控血管内皮细胞增殖及蛋白质合成是其主要的生物学功能。p-mTOR在促进肿瘤细胞生长、新生血管的生成、浸润、侵袭、转移等方面发挥重要影响[3],在多种肿瘤细胞中高表达,并且与肿瘤分级呈现明显相关性[4-5]。目前,p-mTOR与胃癌的关系报道很少,本研究采用免疫组化方法分析p-mTOR在胃癌患者胃癌组织中的表达,探讨其表达水平与胃癌临床病理参数及预后的相关性,为今后胃病患者的个体化治疗和预后评价提供科学依据。
1 资料与方法
1.1 一般资料 选择2013年1月至2013年12月在本院经胃镜病理证实为胃部恶性肿瘤、拟行胃癌根治切除术的胃癌患者89例,其中男性54例,女性35例;年龄38~72岁,平均(58.52±12.32)岁。参照1997年UICC临床TNM分期标准:Ⅰ期12例,Ⅱ期24例,Ⅲ期26例,Ⅳ期27例;无淋巴结转移38例,有淋巴结转移51例;组织学类型:高分化腺癌25例、中分化腺癌28例、低分化腺癌36例;浸润黏膜及黏膜下层28例,浸润肌层30例,浸染浆膜层及浆膜层以上31例。另随机抽取25例胃癌切缘黏膜作为正常对照组(均经病理组织学证实)。
1.2 纳入与排除标准 纳入的所有胃癌病例均为初治患者,入选前均没有接受放疗、化疗或者激素及非甾体类药物治疗;病理学诊断明确;均在本院接受规范化根治性胃癌切除治疗,有完整的病历资料。排除术后病理提示为胃肉瘤、胃淋巴瘤等其他组织来源恶性肿瘤、有出血/血栓性疾病或恶性肿瘤已出现骨髓转移、近3个月内使用肾上腺皮质激素、雌激素、阿司匹林等影响凝血功能药物者、一般情况差、合并严重心脑血管疾病或有严重肝、肾脏器功能障碍者、近3个月内曾接受手术治疗者。
1.3 主要试剂 兔抗人p-mTOR多克隆抗体购自美国Bioworld生物公司,免疫组织化学SP试剂盒、DAB显色试剂均购自北京中杉金桥生物技术公司。
1.4 研究方法 取手术切除胃癌标本,用10%福尔马林固定,石蜡包埋组织标本,切成厚度为4 μm的切片,60℃过夜,经过二甲苯、乙醇脱蜡,使用蒸馏水及磷酸盐缓冲液(PBS)各冲洗3次,采用3%甲醇双氧水灭活内源性过氧化物酶,微波抗原修复和血清封闭后,添加一抗、二抗,滴加辣根酶标记链霉卵白素工作液,DAB显色,苏木素复染后封片。用PBS代替一抗作为阴性对照,并用已知的p-mTOR蛋白阳性的胃癌切片为阳性对照。
1.5 结果判断p-mTOR蛋白在细胞质中表达,阳性染色为呈黄色颗粒沉着者。计算每高倍视野中阳性染色细胞的百分率,0分为无阳性细胞者,1分为阳性细胞<10%者;2分为阳性细胞在11%~50%者;3分为阳性细胞在51%~80%者;4分为阳性细胞>80%者。并按照染色深度分为:0分为细胞不显色;1分为浅棕黄色;2分为棕黄色;3分为棕褐色。以两者乘积为最后得分:(-)为0分;(+)为1~4分;(++)为5~8分;(+++)为9~12分。
1.6 术后随访 患者术后均顺利出院。出院后采用电话或门诊复查等方式进行随访,随访间隔为3个月,随访起始时间为术后病理确诊日期,随访截止时间为2015年12月。总生存期是指从确诊时间至疾病进展或随访截止的时间。
1.7 统计学方法 应用SPSS18.0统计软件进行数据分析。计数资料采用Pearson χ2检验或Fisher's精确概率检验,相关分析采用Spearman等级相关分析,使用Log-rank检验比较组间的无进展生存情况。检验水准α取值为0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者的p-mTOR的阳性等级比较89例胃癌患者中,共69例患者p-mTOR表达阳性,阳性率为77.53%,而25例正常胃黏膜中,p-mTOR阳性4例,阳性率为16%,两组受检者的p-mTOR表达阳性率比较差异有统计学意义(χ2=34.15,P<0.05),见表1。

表1 两组受检者的p-mTOR阳性等级比较[例(%)]
2.2 p-mTOR的阳性表达与淋巴结转移的关系 胃癌组有淋巴结转移的51例患者中,p-mTOR阳性有46例,阳性率为90.20%;而无淋巴结转移的38例患者中,p-mTOR阳性有23例,阳性率为60.53%。两组p-mTOR的表达等级情况见表2,两组p-mTOR不同等级构成比的差异有统计学意义(χ2=26.22,P<0.05)。
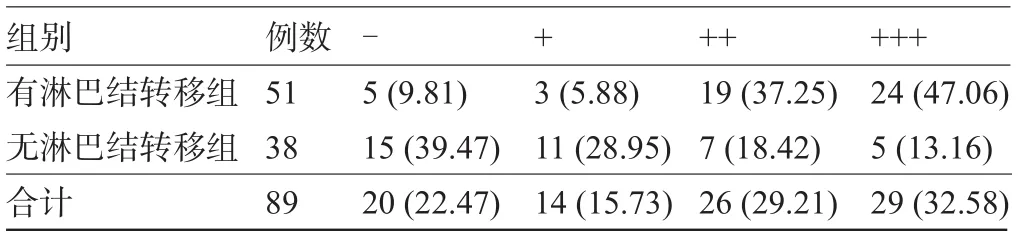
表2 有无淋巴结转移分组的p-mTOR阳性等级情况[例(%)]
2.3 p-mTOR的阳性表达与浸润深度的关系 癌组织浸润在黏膜及黏膜下层p-mTOR阳性有13例,阳性率为46.42%;癌组织浸润肌层者p-mTOR阳性26例,阳性率为86.67%;癌组织浸润浆膜层及浆膜层以上p-mTOR阳性30例,阳性率为96.77%。Spearman等级相关分析显示,p-mTOR的阳性表达与浸润深度呈较强的正相关(r=0.65,P<0.01),见表3。

表3 p-mTOR的阳性表达与浸润深度的相关性(例)
2.4 p-mTOR的阳性表达与组织类型分化的关系 高分化组p-mTOR阳性有12例,阳性率为48.00%;中分化组p-mTOR阳性23例,阳性率为82.14%;低分化组p-mTOR阳性34例,阳性率为94.44%。Spearman等级相关分析显示p-mTOR的阳性表达与组织分化程度呈较强的正相关(r=0.69,P<0.01),见表4。

表4 p-mTOR的阳性表达与组织分化程度的相关性(例)
2.5 p-mTOR的阳性表达与肿瘤病理分期的关系 Ⅰ期组p-mTOR阳性有5例,阳性率为41.67%;Ⅱ期组p-mTOR阳性18例,阳性率为75.00%;Ⅲ期组p-mTOR阳性21例,阳性率为80.77%;Ⅳ期组p-mTOR阳性25例,阳性率为92.59%。Spearman等级相关分析显示p-mTOR的阳性表达与肿瘤病理分期呈较强正相关(r=0.64,P<0.01),见表5。

表5 p-mTOR的阳性表达与肿瘤分期的相关性(例)
2.6 p-mTOR的表达与胃癌预后的关系 将p-mTOR按评分划为低表达组(评分为4分及以下)34例和高表达组(5分以上)55例,低表达组与高表达组的疾病无进展中位生存期分别为23.5个月和12.8个月,两组生存率比较差异有统计学意义(Log-rank χ2= 28.72,P<0.01)。
3 讨论
胃癌细胞自身具有的下调细胞间相互粘附性、促进微血管增生、降解周围基质等功能是促进癌细胞增生、侵袭和转移的生物学基础,也是影响胃癌临床疗效和预后的主要原因[6]。p-mTOR是苏氨酸激酶/丝氨酸的一种,它位于磷脂酰肌醇3-激酶(PI3K)/鼠类胸腺瘤病毒致癌基因同源物(Akt)/mTOR信号通路的下游,它一方面可以接受细胞外生长因子、细胞外营养素的等来自上游的信息刺激;另一方面,mTOR将信息进一步传递给下游,从而对细胞周期的进展发挥影响,导致细胞出现分化。PI3K/Akt途径在肿瘤中被激活后可引起细胞周期调节失控,从而引发细胞转化和肿瘤进展。这种编码mTOR信号通路相关蛋白的基因突变存在于多种肿瘤中,蛋白的异常表达能够使mTOR通路激活过度。PI3K/Akt/mTOR信号通路失调与乳腺癌、卵巢癌、结直肠癌等多种恶性肿瘤的发生有密切的关系,mTOR是肿瘤发生过程中的一个决定性因子,通过PI3K/Akt细胞信号转导通路激活并磷酸化后形成p-mTOR。p-mTOR可以降低细胞凋亡、加速细胞周期、促进肿瘤细胞的转移。对p-mTOR的相关分子作用机制研究显示,p-mTOR可以通过对其下游分子4EBP1的激活,抑制不依赖p53的细胞凋亡[7-8],促进血管内皮生长因子的表达,使肿瘤细胞与新生血管生成加速[9-10],并增强对抗肿瘤药物的抵抗[11],从而促进肿瘤的浸润与转移[12-14]。陈业刚等[5]通过对p-mTOR与膀胱癌的关系进行研究,发现p-mTOR能促使膀胱上皮增生活跃,且p-mTOR是膀胱癌复发的独立危险因素。可见,p-mTOR在人体许多癌症细胞中表达水平高,对肿瘤细胞的生长、浸润、侵袭、转移等具有重要影响。通过对p-mTOR的检测能够反映mTOR通路的激活状态,并成为肿瘤治疗中的一个重要靶点。
p-mTOR与胃癌的关系的研究较少。有研究表明,p-mTOR在胃癌的发展中呈现过度表达。本研究显示p-mTOR在胃癌中的阳性率为77.53%,高于徐大志等[15]的研究,而与Lang等[16]的研究比较接近。本研究显示,p-mTOR在胃癌淋巴结转移患者中的阳性率明显高于无淋巴结转移者,与同类研究结果一致[15]。并且p-mTOR阳性表达情况与癌组织浸润程度、组织分化程度及病理分期呈显著正相关关系,说明癌组织浸润程度越深、组织分化程度越差、病理分期越高,p-mTOR阳性表达率越高,许星宇等[17]的研究也证明了类似的结论。推测p-mTOR的阳性表达可能从上述几方面影响胃癌患者的预后。本研究还发现,p-mTOR低表达组的疾病无进展中位生存期显著高于p-mTOR高表达组,两组生存率的差异有统计学意义。因此,p-mTOR的激活在肿瘤的发生发展过程中起了重要的作用,p-mTOR的测定对于胃癌的治疗和预后判断可以提供积极的指导作用。
综上所述,p-mTOR在胃癌患者体内高表达,对于胃癌的发生、侵袭、进展起着较重要的作用。检测p-mTOR可为患者的预后评估提供参考意义,p-mTOR可能成为预测胃癌进展的新型分子标志物,并且有望成为胃癌靶向治疗的有效靶点。
[1]Ferlay J,Shin H,Bray F,et al.GLOBOCAN 2008,cancer incidence and mortalityworldwide:IARC CancerBase No.10[R].Lyon, France:International Agency for Research on Cancer,2010,2010: 29.
[2]李鹏,张庆九,李旭蕊,等.p-mTOR、eIF4E、p-4EBP1在侵袭性垂体瘤中的表达及相关性研究[J].河北医科大学学报,2016,37(2): 147-150.
[3]宴淼,朱正秋.Akt/mTOR信号通路与恶性肿瘤[J].白求恩军医学院学报,2010,8(6):434-436.
[4]王茜,时延龙,毕经旺.p-mTOR与HIF-1α在结直肠癌组织中的表达及其临床意义[J].中国肿瘤生物治疗杂志,2015,22(6):779-784.
[5]陈业刚,杨拓,刘鹏,等.p-mTOR、p-p70S6K蛋白在膀胱尿路上皮癌中的表达[J].中国中西医结合外科杂志,2013,99(6):639-642.
[6]史忠新,贺颖,王彩芹,等.胃癌组织β-连接素和p53的表达与临床病理参数的关系[J].中国老年学杂志,2007,27(8):1499-1500.
[7]陈云杨,王维杰,王化恺,等.mTOR信号通路活化促进门静脉高压大鼠肠系膜血管新生的实验研究[J].外科理论与实践,2015,20 (3):221-225.
[8]Li N,Zhong M,Song M.Expression of phosphorylated mTOR and its regulatory protein is related to biological behaviors of ameloblastoma[J].Int J Clin Exp Pathol,2012,5(7):660-667.
[9]Chen J,Zhou SJ,Zhang Y,et al.Clinicopathological and prognostic significance of galectin-1 and vascular endothelial growth factor ex-pression in gastric cancer[J].World J Gastroenterol,2013,19(13): 2073-2079.
[10]张禹,伞勇智,朱雨岚.mTOR信号通路在中枢神经系统疾病中的作用机制研究进展[J].卒中与神经疾病,2013,20(6):381-384.
[11]Nakamura J,Kitajima Y,Kai K,et al.HIF-1alpha is an unfavorable determinant of relapse in gastric cancer patients who underwent curative surgery followed by adjuvant 5-FU chemotherapy[J].Int J Cancer,2010,127(5):1158-1171.
[12]Jirouskova M,Zbodakova O,Gregor M,et al.Hepatoprotective effect of MMP-19 deficiency in a mouse model of chronic liver fibrosis[J].PLoS One,2012,7(10):e46271.
[13]Kato Y,Yashiro M,Noda S,et al.Establishment and characterization of a new hypoxia-resistant cancer cell line,OCUM-12/Hypo,derived from a scirrhous gastric carcinoma[J].Br J Cancer,2010,102 (5):898-907.
[14]Rohwer N,Lobitz S,Daskalow K,et al.HIF-1α determines the metastatic potential of gastric cancer cells[J].Br J Cancer,2009,100(5): 772-781.
[15]徐大志,夏良平,林桐榆,等.磷酸化的哺乳动物雷帕霉素靶蛋白在胃癌组织中的表达[J].中山大学学报(医学科学版),2009,30(3): 304-307.
[16]Lang SA,Gaumann A,Koehl GE,et al.Mammalian target of rapamycin is activated in human gastric cancer and serves as a target for therapy in an experimental model[J].Int J Cancer,2007,120(8): 1803-1810.
[17]许星宇,陈博,熊茂明,等.p-mTOR在胃癌组织中的表达与临床病理及预后的关系[J].中华普通外科杂志,2016,31(2):145-148.
Correlation of positive expression of p-mTOR with clinicopathological factors and prognosis in gastric cancerpatients.
WANG Jing1,WANG Ya-ming2,HUO Shuang3,WU Shi-xi1,SUN Ying1,YUAN Yan-long1,WANG Jie4,TIAN Yun-xiao1,ZHANG Gui-dong2,LIU Bo5.Department of Pathology1,Department of General Surgery2,Department of Science and Education3,Department of Urinary Surgery4,Department of Emergency Surgery5,Handan Municipal Central Hospital,Handan 056001,Hebei,CHINA
ObjectiveTo analyze the correlation of positive expression of phosphorylated mammalian target of raphmycin(p-mTOR)with clinicopathological factors and prognosis in gastric cancer patients.MethodsThe expression of p-mTOR of stomach tissue specimens from 89 gastric cancer patients in Handan Municipal Central Hospital from Jan.2013 to Dec.2013 were detected by immunohistochemistry method,and its correlation with lymphatic metastasis, depth of invasion,degree of differentiation and pathological stage were analyzed.The relationship of p-mTOR with prognosis of patients was assessed according to the expression level of p-mTOR.ResultsThe positive rate of p-mTOR was 77.53%(69/89).The positive rate of p-mTOR in patients with lymphatic metastasis was 90.20%,higher than that of patients without lymphatic metastasis(60.53%),and difference was statistically significant(P<0.05).The Spearman rank correlation showed that positive expression of p-mTOR had positive correlation with depth of invasion,degree of differentiation and pathological stage(all P<0.01),with correlation coefficient of 0.65,0.69,and 0.64 respectively.The median progression free survival in group of low p-mTOR expressing was 23.5 months,longer than that of group of high p-mTOR expressing which was 12.8 months,and the difference was statistically significant(P<0.01).ConclusionThere is high expression of p-mTOR in gastric cancer patients,and the detection of p-mTOR is in favor of assessment of prognosis.
Gastric cancer;p-mTOR;Immunohistochemistry;Prognosis;Correlation
R735.2
A
1003—6350(2017)02—0188—04
10.3969/j.issn.1003-6350.2017.02.006
2016-06-08)
王亚明。E-mail:wangjing1133wj@sina.com

