密闭舱室烟雾吸入对大鼠重要脏器损伤的病理观察
孙磊 蔡颖 敖琳 安辉 陈晟 陶成玉 刘晋祎 曹佳
目前国内外关于火灾烟雾损害效应的研究,主要集中于森林火灾、建筑火灾及工作环境中单一非金属材料(如松木[1]、棉花[2]、白杨木屑[3]、泡沫材料[4]等)燃烧烟雾的组成及其对人体的影响[1]。由于保密的原因,有关军用密闭舱室等特殊环境中非金属材料燃烧释放烟雾对机体的毒性效应,尤其是对机体主要器官和系统在不同暴露时相点的病理变化,国内外鲜有报道[5-6]。军用密闭舱室内非金属材料燃烧释放烟雾的组成非常复杂[7-8],其损伤效应涉及的病理过程也具有全身性、多系统性等特点。因此,本研究在建立军用密闭舱室大鼠烟雾吸入损伤模型的基础上,观察大鼠染毒后5个时相点(1、6、24、72 h和 7 d)心、肺、肝及肾组织的病理改变,为开展针对性的基础研究和探究有效的救治措施提供理论依据。
材料与方法
一、实验动物与材料
1.实验动物:健康清洁级雄性SD大鼠36只,7~9周龄,体质量(200±20)g,由陆军军医大学大坪医院实验动物中心提供[动物使用许可证号:SCXK(渝)2010-0005],常规饲养于陆军军医大学军事预防医学院毒理学研究所动物房,以普通基础饲料适应性喂养1周后,按随机数字表法分为6组,每组6只,进行随机对照实验。本实验经陆军军医大学伦理委员会批准,动物处置方法符合动物伦理学标准。
2.主要试剂:二甲苯(重庆川东化工集团有限公司化学试剂厂,批号20090911)、多聚甲醛(成都市科龙化工试剂厂,批号20100501)、无水乙醇(重庆茂业化学试剂有限公司,批号20100509)。
3.主要实验仪器:密闭舱室烟雾吸入染毒装置(陆军第三军医大学毒理学研究所研制,由燃烧箱、染毒箱和循环管道3部分组成[7]):燃烧材料为坦克舱室内使用的9种主要的非金属材料[7,9],主要包括地板胶(主要组分橡胶)、内棉线胶管(主要组分橡胶)、导线(主要组分聚乙丙烯)、蓄电池垫板(硬聚氯乙烯垫板)、座椅表层(主要组分聚氯乙烯)、座椅里层(主要组分海绵和棕垫)、装饰材料一(主要组分软质聚乙烯泡沫塑料)、装饰材料二(主要组分软质聚氨酯泡沫塑料)、油漆类(磷酸盐富锌涂料、白醇酸磁漆、非晶态合金镀液),有某军工生产单位提供,BX60荧光显微镜(日本Olympus公司)。
二、实验动物建模与分组
1.染毒建模:各组大鼠于实验前禁食12 h。将上述主要的9种非金属材料按照该型坦克内部实际的用量比例混合,并按照模拟装置与坦克实际的体积比选择定量的上述混合材料,将所有材料剪成10×10 mm的小块均匀分布铺放于燃烧箱内,用液化气炉点燃非金属材料发烟稳定3 min后,将大鼠置于染毒箱内吸入染毒10 min后取出,使其重新呼吸新鲜空气[7,9],并开始计时。
2.分组:实验组分别于染毒后 1、6、24、72 h和7 d处死大鼠;对照组不予染毒处理,始终呼吸新鲜空气。
三、苏木精-伊红(hematoxylin eosin,HE)染色
大鼠颈动脉放血处死后,分别留取心、肺、气管、肝、肾组织。将各组大鼠的肺组织置于4%多聚甲醛溶液中室温固定24 h,其他脏器置于10%甲醛溶液中室温固定24 h;经梯度乙醇脱水,二甲苯透明,石蜡包埋,常规切片(厚度4μm)和HE染色后,封片,200倍镜检,观察脏器组织间质出血、水肿、炎症细胞浸润及烟雾颗粒物沉积等病理学改变。
结 果
一、烟雾吸入对大鼠心脏组织的病理形态学影响
对照组大鼠心室部位的心肌细胞形态正常,心肌细胞排列整齐,细胞核大小一致,染色均一,未见心肌细胞充血、水肿及空炮形成(图1a)。染毒后1 h:大鼠心肌细胞间可观察到少量的烟雾颗粒物沉积;心肌细胞肿胀;部分心肌细胞排列紊乱呈波浪样(图1b)。染毒后6 h:大鼠心室部位的心肌细胞周围小血管及心肌细胞间烟雾颗粒物沉积明显,颗粒较大、数量较多;部分心肌细胞完整性破坏、空泡化;心肌细胞排列松散、混乱(图1c)。染毒后24 h:大鼠心室部位的心肌细胞周围小血管及心肌细胞间烟雾颗粒物沉积数量比1 h和6 h多,呈弥漫性分布;心肌细胞肿胀明显,有局灶性溶解;;心肌细胞排列松散、混乱(图1d)。染毒后72 h:大鼠心室部位的心肌细胞周围小血管及心肌细胞中烟雾颗粒物沉积减少;心肌细胞有局灶性溶解和坏死;心肌细胞间有出血;部分心肌细胞呈松散排列(图1e)。染毒后7 d:大鼠心室部位的心肌细胞周围小血管内有烟雾颗粒物沉积,心肌细胞间烟雾颗粒物沉积减少;心肌细胞溶解,细胞间有出血;部分心肌细胞呈松散排列(图1f)。

图1 光镜下观察密闭舱室烟雾吸入10 min后各时相点的大鼠心脏组织病理形态学改变。注:a为未吸入烟雾的正常对照组,b为烟雾吸入后1 h组,c为烟雾吸入后6 h组,d为烟雾吸入后24 h组,e为烟雾吸入后72 h组,f为烟雾吸入后7 d组;黑色箭头所指为沉积的烟雾颗粒物
二、烟雾吸入对大鼠肺组织的病理形态学影响
对照组大鼠右肺上叶的肺泡细胞结构正常(图2a)。烟雾吸入后各时相点动物肺表面均可观察到不同程度的出血。各损伤组均可观察到黑色颗粒物的沉积,1、6和24 h组大鼠的肺部颗粒物主要沉积在小支气管内,72 h和7 d组大鼠肺组织切片内颗粒物在小支气管和肺泡腔内呈弥漫性分布。烟雾吸入后1 h组大鼠的肺组织损伤,主要表现为肺泡间隔与肺泡腔内广泛出血和炎细胞浸润(图2b)。6 h组大鼠肺组织损伤加重,可观察到肺泡间隔增宽、充血,炎性细胞浸润,部分肺泡腔内有粉红色的渗出液,局部肺泡壁断裂形成肺大泡,肺泡壁增生变厚,肺实变明显(图2c)。24 h组动物肺组织损伤进一步加重,肺泡腔内广泛炎性细胞的渗出,肺泡腔内有透明膜形成,部分支气管内柱状上皮细胞脱落(图2d)。72 h组可观察到一些组织自我修复的变化,小气管壁增生、炎性渗出相对减少(肺泡腔内的炎性渗出液已被部分吸收),在增宽的肺泡间隔内及小支气管周围可见梭形的成纤维细胞增生明显;肺泡腔增大,形成肺大泡,有肉芽肿的形成(图2e)。7 d组与72 h组大鼠的肺组织损伤类型差异不大,但肺泡壁的增厚程度及气道周围纤维组织增生比72 h组更为明显(图2f)。
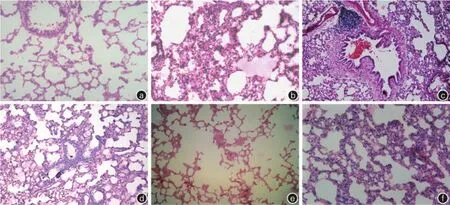
图2 光镜下观察密闭舱室烟雾吸入10 min后各时相点的大鼠肺组织病理形态学改变。注:a为对照组(HE×200),b为1 h组(HE×200),c为6 h组(HE×100),d为24 h组(HE×100),e为72 h组(HE×100),f为7 d组(HE×200)
三、烟雾吸入对大鼠气管组织的病理形态学影响
对照组大鼠主支气管部位的气管结构正常(图3a)。1 h组大鼠的气管结构,管腔内有颗粒的沉积(图3b)。6 h组大鼠的支气管腔内有出血和颗粒物沉积,上皮细胞和软骨分离(图3c)。24 h组大鼠气管的局部上皮细胞与环状软骨分离,疏松结缔组织内有炎细胞浸润,血管充血明显(图3d)。72 h组大鼠的气管切片可见纤毛下结缔组织疏松,有炎细胞的浸润及颗粒物的沉积,局部纤毛脱落,环状软骨下肌层也可见颗粒物沉积(图3e)。7 d组大鼠气管的主要病变为上皮细胞的脱落及颗粒物的沉积(图3f)。

图3 光镜下观察密闭舱室烟雾吸入10min后各时相点的大鼠气管组织病理形态学改变。注:a为对照组(HE×200),b为1 h组(HE×200),c为6 h组(HE×100),d为24 h组(HE×100),e为72 h组(HE×400),f为7 d组(HE×400)
四、烟雾吸入对大鼠肝脏组织的病理形态学影响
对照组肝小叶部位的肝细胞结构正常(图4a)。各烟雾吸入损伤组大鼠的肝脏内均可见颗粒物沉积。1 h组大鼠的部分肝细胞排列紊乱,肝索结构不清晰,中央静脉充血,胞浆疏松,有不同程度的水肿和空泡变性,肝脏内血管及肝细胞都可见大量颗粒物沉积(图4b)。6 h组大鼠肝组织切片可见肝细胞局灶性坏死和空洞形成,颗粒物呈弥漫性沉积,双核细胞增多(图4c)。24 h组大鼠肝细胞呈广泛性溶解、空泡变性,血管和肝细胞内均有颗粒物沉积,但颗粒物数量较6 h组减少(图4d)。72 h组大鼠的肝细胞排列紊乱,细胞溶解程度减轻,同一观察视野中可见肝细胞坏死、增生和修复(图4e)。7 d组大鼠肝组织切片可见肝细胞溶解性坏死,局部肝细胞增生明显,肝小叶结构较完整(图4f)。
五、烟雾吸入对大鼠肾组织的病理形态学影响
对照组大鼠肾叶结构正常(图5a)。1 h组大鼠的肾小管上皮细胞肿胀;肾小球充血严重(图5b)。6 h组大鼠肾脏皮质及髓质区出血明显;皮质区肾小管上皮细胞肿胀;肾小球充血严重;内皮细胞高度肿胀;鲍曼氏囊腔狭窄(图5c)。24 h组大鼠的肾组织主要病变为髓质和皮质区肾小管上皮细胞明显肿胀,有较多的颗粒沉积在细胞内;肾间质出血明显,以髓质更为严重,肾小球充血严重;细胞肿胀;鲍曼氏囊腔几乎消失,也可观察到少量颗粒物沉积(图5d)。72 h组大鼠肾组织病变表现为区域性改变,部分区域肾小管上皮细胞明显肿胀,胞核溶解,胞浆疏松,肾间质出血情况减轻。肾小球和肾小管均可观察到颗粒物沉积,但数量明显减少(图5e)。7 d组大鼠肾小管上皮细胞明显肿胀,肾间质出血明显较少;肾小球病变以增生为主,间隙几乎消失;肾小球与肾小管间隙消失,难以分开,但均可观察到颗粒物沉积,颗粒数量较少(图5f)。

图5 光镜下观察密闭舱室烟雾吸入10min后各时相点大鼠肾脏组织的病理形态学改变。注:a为对照组(HE×100),b为1h组 (HE×200),c为6h组 (HE×200),d为24h组 (HE×200),e为72h组 (HE×200),f为7d组 (HE×200)
讨 论
组织病理学检查在毒性试验中是不可缺少的,他可确定化合物对机体的毒性作用靶器官与部位、损害性质与程度,从病理学角度寻找化合物与病理改变的剂量效应关系,为了解化合物的中毒效应和机制提供依据。由于目前国内外研究主要集中于工作环境和建筑物火灾释放烟雾的组成及对人体的影响,且以单一材料燃烧释放烟雾相关研究为主,而对于坦克舱室这种密闭环境中,多种非金属材料燃烧释放的混合有毒烟雾对人体影响的报道较为少见。因此,在本试验通过大体肉眼观察和常规组织病理学检查来探讨密闭舱室内混合烟雾的生物毒性效应。
对心脏的损害。在发生急性中毒(烟雾吸入损伤)时,多数毒物可直接作用于心肌,造成心脏损害;亦可通过毒性作用引起组织缺血缺氧、外周阻力增高、血容量减少以及电解质紊乱等,间接损害心肌,导致心脏功能障碍、心律失常甚至死亡。本研究结果显示,大鼠吸入烟雾后,光镜下心肌的病理形态学改变表现主要为:颗粒物沉积、心肌细胞肿胀、局部溶解和坏死。结合血清心肌酶在烟雾吸入后短时间内升高的前期研究结果[10],提示烟雾中的有害成分可损伤心肌组织结构、影响心肌正常功能。其原因可能与缺氧、一氧化碳中毒及烧伤有关[11]。
对肺的损害。烟雾吸入后不同时相点,大鼠肺组织病理学的改变是一个渐进的过程。早期(烟雾吸入后的24 h以内)的损伤为肺间质弥漫性充血、炎细胞的浸润和肺泡腔内红细胞渗出,在此阶段采取有效的治疗措施,可使损伤基本恢复[12-13]。当炎症持续存在时,损伤因素继续进行作用,慢性炎症反应可表现为肉芽肿形成或肺组织的纤维化,引起肺通气不足、通气/血流比例失调和静动脉血分流增加,导致低氧血症或伴发代谢性酸中毒。72 h和7 d时,可观察到组织的修复和损伤过程几乎同时进行。损伤早期,由于肺泡孔的存在,大部分颗粒物只能沉积在终末支气管内,而肺泡腔内的颗粒物少见;损伤后期,随着肺泡腔内的透明膜形成,肺泡壁增厚,通气与换气功能受阻,肺泡腔内气体积聚,从而使肺泡壁断裂、形成肺大泡,大量颗粒物可通过断裂的肺泡壁进入肺泡腔内,在小支气管和肺泡腔内弥散性沉积。因此,肺是密闭舱室烟雾吸入损伤的主要靶器官。
对气管的损害。烟雾吸入后不同时相点,大鼠气道内均可观察到颗粒物的沉积,随伤后时间的延长,纤毛下结缔组织及环状软骨下肌层也可见颗粒物沉积。主要病理改变为:上皮细胞水肿、局部纤毛脱落、局部上皮细胞与软骨分离。其致伤原因可能为烟雾中含有大量颗粒物,易沉积黏粘膜表面,造成呼吸道粘膜充血、水肿,分泌物增多;烟雾中大量有害物质可造成呼吸道直接损伤及化学性损伤。此外,烟雾吸入后,在损伤部位从气道进展到肺实质的过程中,支气管循环也起着极其重要的作用,它是导致肺水肿形成、进而引起急性肺损伤的重要因素[14]。
对肝脏的损害。在烟雾吸入后不同时相点均可观察到颗粒物沉积、肝细胞胞浆疏松以及有不同程度的水肿和空泡变性。烟雾吸入后24 h时病变较严重,肝细胞呈广泛性溶解和坏死;72 h时,可见肝组织的增生和修复。前期实验结果也证实,烟雾吸入后大鼠血清中谷丙转氨酶(adanine aminotransferase,ALT)显著升高[10]。提示了密闭舱室内烟雾吸入可损伤肝脏组织并影响肝功能。由于肝脏的自我修复能力极强,在受到损伤后,细胞可通过促进有丝分裂以抵抗外界作用因素的损伤效应[15]。本研究中可观察到肝小叶内的双核细胞增多,也提示肝脏在烟雾吸入后具有较强的代偿增殖活性和自我修复能力。
对肾脏的损害:烟雾吸入后,各组大鼠的肾小管上皮细胞及肾小球血管内皮细胞损伤较为严重。肾小管的重吸收和分泌是尿生成与浓缩过程中的重要环节;肾小球血管内皮细胞受损可使基膜(主要的机械和电屏障结构)异常,引起肾小球滤过功能的异常。烟雾吸入后各时相点均可观察到肾小管间隙及管腔内有烟雾颗粒物的沉积,随着病程时间的延长,沉积的颗粒物体积越大、数量越多,这也提示肾组织的屏障结构受到了损伤。由于肾脏血流丰富(占心脏搏出量的20%~25%)、对缺氧敏感且耐受性差,因此,在烟雾吸入造成的缺氧或循环血量不足的情况下,肾脏较其它脏器更易受到损害[16]。前期研究证实尿素氮(blood urea nitrogen,BUN)、在烟雾吸入后有增高[10]也提示可能是由于肾小球内皮细胞、肾小管上皮细胞受到损伤及颗粒物的沉积而导致滤过功能的异常所引起的。
综上所述,密闭舱室主要非金属材料燃烧释放的有毒烟雾吸入后可通过血液循环在机体多处组织器官沉积,对雄性大鼠心、肺、肝、肾等重要脏器的病理学形态产生影响,继而造成一定程度的功能损害。
1 Bhattacharyya SN,Manna1 B,Smiley R,et al.Smoke-induced inhalation injury:effects of retinoic acid and antisense oligodeoxynuceotide on stability and differentiated state of the mucociliary epithelium[J].Inflammation,1998,22:203-214.
2 Bidani A,Hawkins HK,Wang CZ,et al.Dose dependence and time course of smoke inhalation injury in a rabbitmodel[J].Lung,1999,177(2):111-122.
3 Lee HM,Greeley GH,David N,et al.A rat model of smoke inhalation injury:influence of combustion smoke on gene expression in the brain[J].Toxicol Appl Pharmacol,2005,208(3):255-265.
4 Kaplan HL,Switzer WG,Hinderer RK,et al.Acute and long-term effects of polyvinylchloride(PVC)smoke on the respiratory system of the baboon and a comparison with the effects of hydrogen chloride(HCl)[J].JFire Sci,1993,11(6):485-511.
5 闫金海,韩卫敏,考希宾,等.某特种车辆闭舱行驶舱室内有害气体测试分析[J].职业与健康,2014,30(6):726-728.
6 张世超,欧敏.潜艇舱室环境中有害气体对肺组织的慢性损伤[J].环境与职业医学,2013,30(11):886-888.
7 孙磊,安辉,郑有科,等.模拟密闭战斗舱室烟气吸入染毒装置的研制[J].第三军医大学学报,2009,31(4):290-293
8 Sun L,Zhao X,Li D,et al.A dynamic smoke generation and noseonly inhalation exposure system for rats:preliminary results from studies of selected transportation materials[J].Inhalation Toxicology.2014,26(14):897-907.
9 安辉,孙磊,周燕虹,等.密闭舱室内非金属材料燃烧释放有毒气体对大鼠肺组织通透性的影响[J].第三军医大学学报,2009,31(4):294-296.
10 孙磊,陈晟,蔡颖,等.军用密闭舱室烟雾吸入致雄性大鼠心、肺、肝、肾损伤的观察[J].第三军医大学学报,2017,39(6):499-503.
11 Westphal M,Morita N,Enkhbaatar P.Acute effects of combined burn and smoke inhalation injury on carboxyhemoglobin formation,tissue oxygenation,and cardiac performance[J].Biochemical and Biophysical Research Communications,2004,317:945-949.
12 孙磊,陈晟,蔡颖,等.密闭舱室烟雾吸入性肺损伤救治方案效果评价[J/CD].中华卫生应急电子杂志,2016,2(6):350-357.
13 孙磊,陈晟,蔡颖,等.军用密闭舱室有毒烟雾致急性肺损伤的组合救治方案的评价[J/CD].中华卫生应急电子杂志,2017,3(2):79-87.
14 Sakurai H,Traber LD,Traber DL.Altered systemic organ blood flow after combined injury with burn and smoke inhalation[J].Shock,1998,9(5):369-374.
15 Palmes D,Spiegel HU.Animal models of liver regeneration[J].Biomaterials,2004,25(9):1601-1611.
16 Nagai J,Takano M.Molecular aspects of renal handling of aminoglycosides and strategies for preventing the nephrotoxicity[J].Drug Metab Pharmacokinet,2004,19(3):159-170.

