黑灵芝多糖对丙烯酰胺诱导小肠上皮细胞氧化损伤的保护作用
张路路,石 婷,朱梦婷,陈 奕⋆
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
黑灵芝多糖对丙烯酰胺诱导小肠上皮细胞氧化损伤的保护作用
张路路,石 婷,朱梦婷,陈 奕⋆
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:研究黑灵芝多糖对丙烯酰胺(acrylamide,AA)所致的小肠上皮细胞氧化损伤的保护作用。方法:构建AA诱导小肠上皮细胞(intestinal epithelial cells,IEC)-6氧化损伤型,采用噻唑蓝比色法检测黑灵芝多糖对IEC-6氧化损伤的保护作用;同时测定细胞培养液中乳酸脱氢酶(lactate dehydrogenase,LDH)的漏出量,以及测定细胞中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及丙二醛(malondialdelyde,MDA)水平。结果:与正常对照组相比,不同质量浓度的黑灵芝多糖对细胞增殖影响无显著性差异。与模型(AA)组相比,不同质量浓度的黑灵芝多糖溶液能够明显减轻AA对细胞的毒害作用,提高细胞生存率,降低细胞培养液中LDH的释放;降低MDA含量,提高细胞SOD和GSH-Px活性。结论:黑灵芝多糖可以通过提高细胞内抗氧化酶系的活性和抗氧化物质GSH-Px活性从而有效地减弱AA诱导的小肠上皮细胞氧化损伤。
黑灵芝多糖;丙烯酰胺;IEC-6;氧化损伤
丙烯酰胺(acrylamide,AA)是人们广泛接触的一种重要工业化合物,最初作为合成聚AA的化学单体,广泛应用于污水处理、造纸工业、医药、农药和染料等多种行业[1],是环境中潜在的有毒污染物。在2002年 4月,由瑞典国家食品管理局与斯德哥尔摩大学的研究人员首次在多种油炸、高温烘烤食品中发现了AA,引起世界卫生组织、世界粮农组织、科学界和大众的广泛关注[2]。同时研究结果表明AA具有多种毒性,其中包括神经毒性、遗传毒性、发育毒性、雄性生殖毒性等[3]。由于AA属于一种水溶性的神经毒性物质,渗透性较强,人体可通过消化道、呼吸道、皮肤黏膜等多种途径接触并吸收AA。AA在经口途径随食物进入人体后,在消化过程中可以快速到达肠道[4],肠上皮是实现肠道消化、免疫、内分泌等功能的主要组织细胞,也是构筑肠道黏膜屏障的主要成分,由此可见肠上皮是AA毒性的主要靶目标[5]。然而目前AA对小肠细胞毒性的研究报道很少,且研究并不深入。已有的体内体外研究已证实AA可快速进入小肠细胞,可导致细胞内还原型谷胱甘肽(reduced glutathione,GSH)浓度显著下降,促进活性氧(reactive oxygen species,ROS)自由基的大量生成,使细胞内的氧化压力急剧上升,从而抑制细胞的正常功能,导致细胞死亡或凋亡[5]。同时AA还能够导致小鼠小肠细胞凋亡、肌层损伤、小肠壁和黏膜结构改变、消化吸收面积减少、吸收能力下降[6]。由此可知,AA可通过氧化应激产生大量ROS自由基并且能够抑制机体内抗氧化酶的活性[7],造成组织损伤[8],引起细胞死亡[9-10]。
因此,探求能够有效地抑制ROS自由基大量生成的天然产物,作为一种改善氧化应激的干预措施,有望成为预防和抑制AA导致的肠道氧化损伤的一种切实可行的方法。黑灵芝是我国重要的药食兼用真菌资源,也是江西省的特色资源,具有较好的营养、保健、医疗价值。本实验以黑灵芝为研究对象,分离纯化得到黑灵芝多糖组分。通过体内体外研究表明黑灵芝多糖具有抗氧化防御能力[11-12],能够改善过氧化氢所诱导的氧化应激,具有增强免疫抗肿瘤的作用[13]。本实验利用AA诱导小肠上皮细胞(intestinal epithelial cells,IEC)-6细胞氧化应激损伤模型,探讨黑灵芝多糖对IEC-6的保护作用,以期为黑灵芝多糖的充分应用与深度开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
黑灵芝采自江西赣州赣南灵芝基地;黑灵芝多糖(Ganoderma atrum polysaccharides,GAP)由南昌大学食品科学与技术国家重点实验室制备:采用水提醇沉提取粗多糖,然后采用不同浓度的NaCl溶液进行洗脱得到5 个级份,分别为GAP-FW、GAP-F0.1、GAP-F0.2、GAP-F0.5、GAP-F2,经高效液相色谱(high performance liquid chromatography,HPLC)法检测,其中GAP-F2纯度>98%[14],用于后续实验;大鼠IEC-6 上海酶研生物科技有限公司(来源于美国ATCC细胞库)。
杜尔伯科改良伊格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM) 美国HyClone公司;胎牛血清 美国BI公司;噻唑蓝(methyl thiazol tetrazolium bromide,MTT)细胞增殖及细胞毒性检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdelyde,MDA)及BCA(bicinchonininc acid)蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
二氧化碳培养箱 日本Toshiba公司;倒置显微镜日本Olympus公司;超净工作台 苏州净化设备厂;TGL216G高速台式离心机 上海安亭科学仪器厂;全波长扫描式多功能读数仪 美国Thermo公司。
1.3 方法
1.3.1 细胞培养
细胞培养在含体积分数10%胎牛血清的DMEM高糖培养液,于37 ℃、体积分数5% CO2、饱和湿度条件下静置培养,细胞铺满瓶底80%以上,取对数生长期增殖活跃的细胞进行分组。
1.3.2 IEC-6氧化损伤模型的构建
[15],采用MTT比色法检测存活率。取对数生长期的IEC-6,以1×104个/mL的细胞密度接种于96 孔板中,每孔100 μL,置于37 ℃培养箱中培养24 h。倒掉培养基,加入不含血清的完全培养基。每孔按浓度梯度(终浓度分别为1.0、2.5、5.0、10.0、20.0 mmol/ L)加入AA。同时设置空白对照组(0.0 mmol/L),置于37 ℃培养箱中培养24 h。离心(室温条件下1 500 r/ min)5 min,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗一次,每孔加入100 μL完全培养基,使MTT终质量浓度为0.5 mg/mL,置于培养箱中孵育4 h,3 000 r/min离心5 min。弃上清液,每孔加入150 μL的二甲基亚砜(dimethyl sulfoxide,DMSO)溶液。迅速用平板摇床振荡10 min,待孔内蓝紫色结晶完全溶解后,使用酶标仪检测490 nm波长处的光密度(OD)值。计算公式如式(1)所示。

1.3.3 MTT法检测黑灵芝多糖对IEC-6增殖的影响
参考文献[16],将对数生长期的IEC-6,用胰蛋白酶消化成单层细胞,用新鲜DMEM培养基配制成单个细胞悬液,以1×104个/mL的细胞密度接种于96 孔板中,每孔100 μL。置于37 ℃培养箱中培养24 h。倒掉培养基,加入不含血清的完全培养基。每孔按质量浓度梯度(1.0、2.5、5.0、10.0、20.0、40.0、80.0、160.0 μg/mL)加入GAP-F2,同时设置空白对照组。置于37 ℃培养箱中培养20 h。离心(室温条件下,1 500 r/min)5 min,PBS清洗一次,每孔加入100 μL完全培养基,使MTT终质量浓度为0.5 mg/mL,置于培养箱中孵育4 h,3 000 r/min离心5 min。弃上清液,每孔加入150 μL的DMSO溶液。迅速用平板摇床振荡10 min,待孔内蓝紫色结晶完全溶解后,使用酶标仪检测490 nm波长处的OD值。实验重复3 次。另设空白孔,排除干扰。计算公式与式(1)相同。
1.3.4 黑灵芝多糖对氧化损伤IEC-6存活率的影响
取对数生长期的IEC-6,置于37 ℃培养箱中培养24 h。倒掉培养基,加入不含血清的完全培养基。将细胞分为7 个处理组,分别为空白对照组、 AA组、阳性对照组(N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)终浓度为10 mmol/L)、多糖氧化抑制组(使GAP-F2终质量浓度为20、40、80、160 μg/mL),每组10 个复孔;置于37 ℃培养箱中培养20 h后,1 500 r/min离心5 min,吸去培养基,更换不含血清的AA终浓度为5 mmol/L的完全培养基,其中空白对照组AA终浓度为0 mmol/L。置于37 ℃培养箱中培养4、8、16、24 h。离心(37 ℃、1 500 r/min)5 min,PBS清洗一次,每孔加入100 μL完全培养基,使MTT终质量浓度为0.5 mg/mL,置于培养箱中孵育4 h,3 000 r/min离心5 min。弃上清,每孔加入150 μL的DMSO溶液。迅速用平板摇床振荡10 min,待孔内蓝紫色结晶完全溶解后,使用酶标仪检测490 nm波长处的OD值。计算公式与式(1)相同。
1.3.5 氧化损伤细胞培养液中LDH漏出量的测定
取对数生长期的IEC-6按1.3.4节方法分组,用AA损伤细胞16 h。1 500 r/min离心5 min,收集上清液,按试剂盒说明书步骤测定上清液中LDH的漏出量。
1.3.6 氧化损伤细胞内SOD、GSH-Px活性、MDA水平的测定
参考文献[17]细胞处理在6 孔板内进行,取对数生长期的IEC-6按1.3.4节方法分组,用AA损伤细胞16 h后,用2.5 g/L胰蛋白酶消化,1 500 r/min离心5 min,收集细胞用冷PBS清洗,然后1 500 r/min离心5 min,收集细胞,加入细胞裂解液150 μL,混匀4 ℃孵育5 min。离心取上清液,按试剂盒说明书步骤测定细胞内SOD、GSH-Px活性以及过氧化物产物MDA水平
1.4 数据统计分析
2 结果与分析
2.1 不同浓度AA对IEC-6存活率的影响
采用浓度为0.0(空白对照组)、1.0、2.5、5.0、10.0、20.0 mmol/L AA处理IEC-6 24 h,构建氧化损伤模型,结果如图1所示。
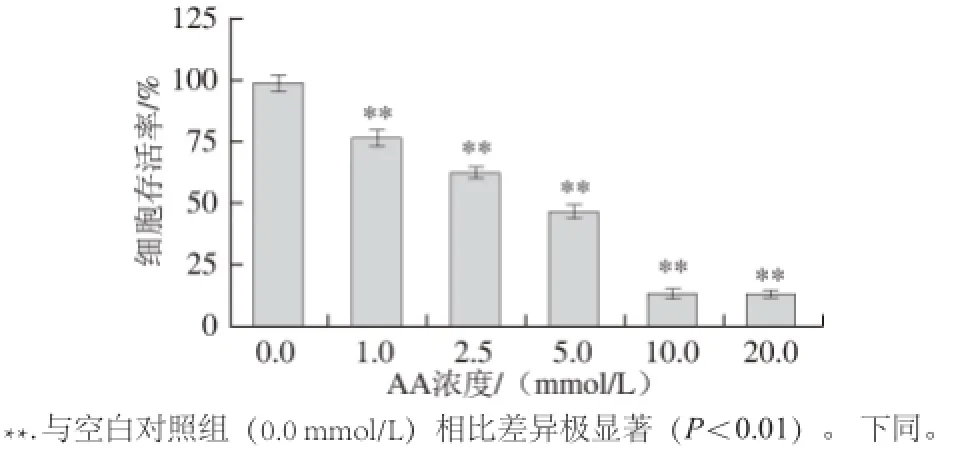
图1 AA对IEC-6的氧化损伤Fig.1 Oxidative damage induced by AA of IEC-6
由图1可知,采用1~20 mmol/L AA处理24 h,均能对IEC-6造成显著损伤,考虑到AA造成的细胞存活率的半数致死量,以及损伤程度过于严重可能导致无法进行修复作用研究,因此本实验选取5 mmol/L AA作为最佳诱导浓度,构建IEC-6氧化损伤模型,此时细胞存活率为46%。
2.2 不同质量浓度黑灵芝多糖对IEC-6增殖的影响
MTT实验是检测活细胞数量的常用方法。采用不同质量浓度(1.0、2.5、5.0、10.0、20.0、40.0、80.0、160.0 μg/mL)GAP-F2处理IEC-6 20 h,测定不同质量浓度GAP-F2处理IEC-6的毒性,筛选安全剂量范围,结果如图2所示。
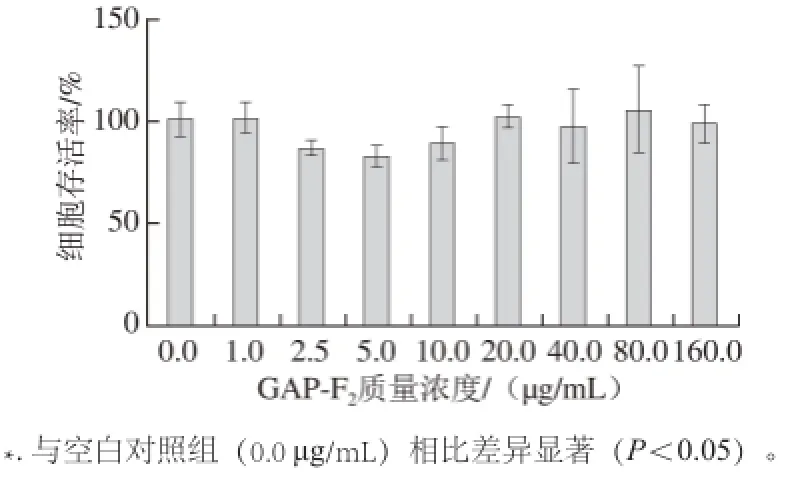
图2 黑灵芝多糖对IEC-6生长的影响Fig.2 Effect of Ganoderma atrum polysaccharides on the growth of IEC-6
由图2可知,在1~160 μg/mL剂量范围内,GAP-F2均未对IEC-6造成显著毒性,属于安全范围内。说明GAP-F2对IEC-6增殖没有影响,不具有细胞毒性,因此在后续研究中,选择不同质量浓度(20.0、40.0、80.0、160.0 μg/mL)GAP-F2研究其对IEC-6氧化损伤的保护作用。
2.3 不同质量浓度黑灵芝多糖对氧化损伤IEC-6存活率的影响
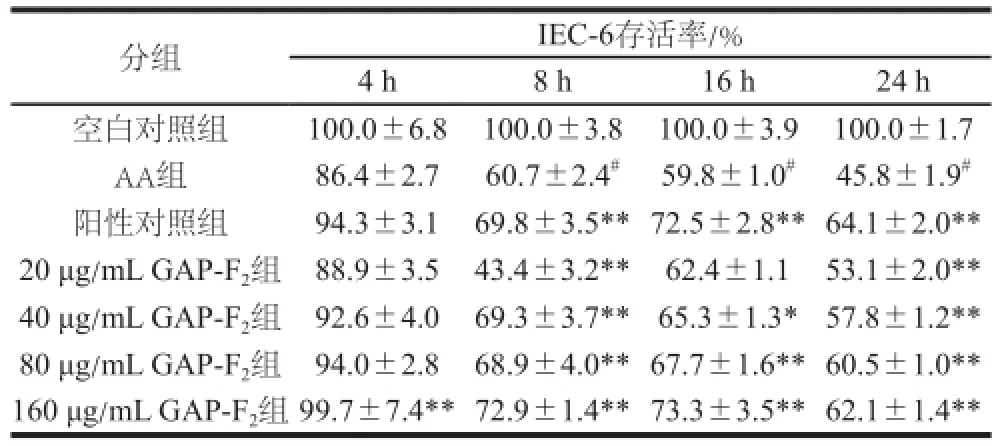
表1 黑灵芝多糖对AA诱导的IEC-6氧化损伤的预防作用Table1 Preventive effect ofGanoderma attrruumm polysaccharides against AA-induced oxidative damage in IEC-6
由表1可知,AA处理不同时间后,与空白对照组相比,IEC-6存活率明显下降(P<0.01)。相反,不同质量浓度GAP-F2预处理20 h后,细胞存活率相对于AA组明显增加,且黑灵芝多糖的保护效果一定程度上随着质量浓度的增加而增强,呈现出一定的剂量-效应关系。由表1中结果可以发现80、160 μg/mL GAP-F2均能显著地缓解AA造成的细胞存活率的降低(P<0.01),与阳性对照组相比细胞存活率无显著性差异。而20 μg/mL GAP-F2组在AA处理4、8、16 h后,黑灵芝多糖无显著保护作用。由此可知40、80、160 μg/mL GAP-F2预处理可有效地抑制AA造成的IEC-6死亡。
2.4 不同质量浓度黑灵芝多糖对氧化损伤IEC-6释放LDH的影响

图3 黑灵芝多糖对氧化损伤IEC-6释放LDH的影响Fig.3 Effect of Ganoderma atrum polysaccharides on the release of LDH in IEC-6 with AA-induced oxidative damage
细胞在凋亡或者坏死过程中细胞膜的结构会遭到破坏,致使细胞浆内的酶释放到培养液中。LDH水平在一定程度上能反映出细胞受损程度,因而常常作为判断细胞氧化损伤程度的重要参数。通过检测培养上清中LDH水平可以实现对细胞毒性的定量分析,从而反映出细胞的损伤程度。
不同处理组检测出LDH漏出量如图3所示,结果发现,与空白对照组相比,AA组中的LDH漏出量极显著上升,表明AA可导致上皮细胞氧化损伤。与AA组相比,黑灵芝多糖组中LDH漏出量极显著降低,而且160 μg/mL GAP-F2组与阳性对照组相比,细胞中LDH漏出量相当,这表明高剂量GAP-F2能显著降低LDH漏出量。这些结果表明黑灵芝多糖可有效降低AA对IEC-6造成的氧化损伤,具有很强的保护作用,且呈剂量-效应关系。
2.5 不同质量浓度黑灵芝多糖对氧化损伤IEC-6中SOD活力、GSH-Px活力、MDA含量的影响
在正常生理条件下,机体内ROS的生成和清除处于一种动态平衡,在内源性或外源性的有害刺激下,这种平衡将会遭到破坏,导致细胞内ROS的大量生成,超过机体抗氧化防御体系的清除能力,从而造成机体氧化应激损伤[18]。在机体受到氧化损伤的情况下,细胞中常见的内源性抗氧化物质主要包括:SOD、GSH-Px[19]。同时细胞在发生氧化应激时,细胞会发生脂质氧化。而MDA则是脂质过氧化的产物之一,可用作与检测细胞中脂质氧化的水平[20-21]。
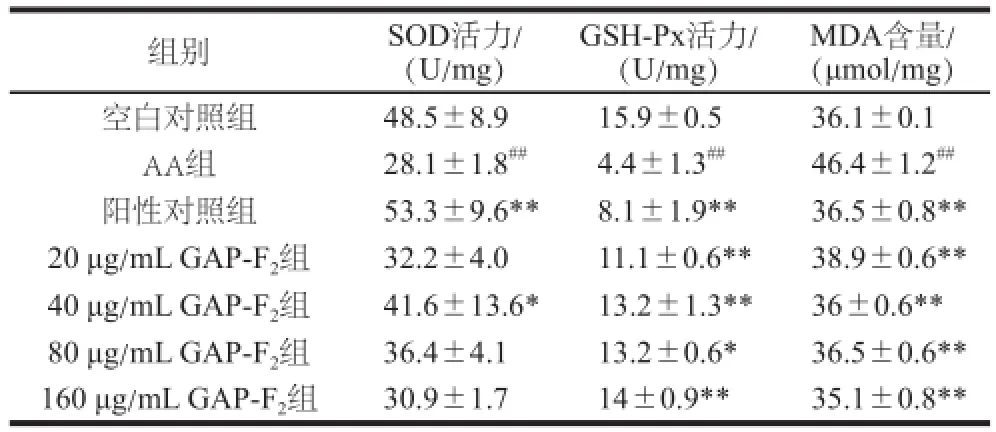
表2 黑灵芝多糖对氧化损伤IEC-6 SOD、GSH-Px活力、MDA水平的影响Table2 Effect off Ganoderma attrruumm polysaccharides on SOD and GSH activities and MDA content in IEC-6 with AA-induced oxidative damage
由表2可知,与空白对照组相比,AA组中的SOD活力显著降低,而不同质量浓度的多糖均能有效缓解细胞中抗氧化酶含量的降低。GSH-Px在保护细胞免受自由基损伤的过程中起着关键作用,是细胞内主要的抗氧化酶,能够反映出细胞内的抗氧化水平。与AA组相比,细胞内GSH-Px活性呈剂量依赖性显著增加,结果表明黑灵芝多糖能够抑制AA造成的细胞氧化损伤,提高细胞内抗氧化酶的活性。与空白对照组相比,AA组中MDA含量显著增加;与AA组相比,黑灵芝多糖组中MDA含量显著降低,且与阳性对照组相比效果相当,表明黑灵芝多糖可减轻AA引起的氧化应激。
3 讨 论
氧化应激作为AA诱导细胞损伤的关键机制之一[22]。可刺激细胞产生过量的ROS自由基,破坏细胞膜的完整性,影响细胞的正常的功能,并降低细胞内抗氧化酶的活性,造成细胞内氧化压力的上升,最终可导致细胞损伤,甚至细胞凋亡或死亡。而大鼠小肠隐窝IEC-6是肠道内外环境的界面,是实现肠道消化、吸收、免疫、内分泌等功能的主要组织细胞,也是构筑肠道黏膜屏障的主要成分。AA可通过多种途径迅速到达肠道,由此可见,肠上皮是AA诱导细胞毒性的主要靶器官。有研究表明[23],在肠道细胞氧化应激状态下,小肠细胞会产生过量的有毒ROS代谢物,与此同时氧化应激还可抑制细胞内抗氧化酶活性,破坏细胞内抗氧化防御体系,造成小肠黏膜损伤。AA作为一种高温食品加工过程中产生的一种潜在致癌物,许多研究者都致力于寻找可用于拮抗膳食中AA对机体损伤的天然活性成分,期望通过多种天然活性成分构建AA体内防护的第二道障,以膳食补充剂的形式缓解AA对人体的潜在危害,并从细胞信号转导通路层面着手,阐明其具体保护机制。研究结果已表明,大量天然活性成分应用于AA对机体毒性的保护上,如葡萄果渣提取物[24]、蓝莓及其提取物[25]、矢车菊素-3-葡萄糖苷[26]、橄榄油提取物[27]等均表明能够在一定程度上缓解AA对机体造成的损伤。近年来研究发现,很多植物、真菌来源的多糖对生物来源的ROS具有显著的清除和抑制作用,如黄芪多糖可清除过多的自由基,抑制炎症因子释放,发挥其肠道免疫保护作用[24,28];枸杞多糖可提高机体抗氧化酶活力及清除过多自由基,对大鼠小肠缺血再灌注氧化损伤有明显的保护作用[29]。而黑灵芝多糖则被证实在清除自由基功能方面尤其突出[30]。本研究就以黑灵芝多糖为研究对象,来确定其是否能够提高机体的内源性抗氧酶活性,抑制脂质过氧化的发生,从而减缓或预防AA诱导的应激性氧化损伤发生,以期为后续研究提供理论基础。
本实验采用AA诱导IEC-6氧化损伤,构建氧化应激损伤模型。实验中选用了5 mmol/L浓度的AA诱导IEC-6损伤24 h能够显著造成细胞氧化损伤,证实了实验的可行性。实验研究结果表明,AA组与空白对照组相比,细胞存活率以及LDH漏出量均显著增加,说明肠上皮细胞受到显著损伤,因此氧化应激损伤模型建立成功。与此同时,细胞在经过AA处理后,细胞中的抗氧化酶活性SOD、GSH-Px的活性显著降低,用于评价细胞的脂质过氧化水平的指标MDA含量与空白对照组相比,AA组显著增高。而不同质量浓度黑灵芝多糖的氧化抑制组能够显著提高细胞存活率、减少细胞培养液中LDH的释放、降低细胞的MDA的水平、提高细胞中SOD和GSH-Px活性。
综上所述,黑灵芝多糖对AA诱导的细胞氧化损伤具有保护作用,此作用可能与提高细胞内抗氧化酶活性有关。此研究能为缓解或抑制AA诱导的细胞氧化应激损失提供一定的理论依据,但本实验结果仅限于细胞水平的体外实验,对黑灵芝多糖在氧化应激损伤下对细胞保护的具体分子生物学机制及其在体内的抗氧化保护机制还有待进一步的深入研究。
参考文献:
[1] DOERGE D R, GAMBOA D C G, MCDANIEL L P, et al. DNA adducts derived from administration of acrylamide and glycidamide to mice and rats[J]. Mutation Research Genetic Toxicology and Environmental Mutagenesis, 2005, 580(1): 131-141. DOI:10.1016/ j.mrgentox.2004.10.013.
[2] TAREKE E, RYDBERG P, KARLSSON P, et al. Analysis of acrylamide, a carcinogen formed in heated foodstuffs[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4998-5006. DOI:10.1021/jf020302f.
[3] BELANDF A, MELLICK P W, OLSON G R, et al. Carcinogenicity of acrylamide in B6C3F 1 mice and F344/N rats from a 2-year drinking water exposure[J]. Food and Chemical Toxicology, 2013, 51: 149-159. DOI:10.1016/j.fct.2012.09.017.
[4] ZÖDL B, SCHMID D, WASSLER G, et al. Intestinal transport and metabolism of acrylamide[J]. Toxicology, 2007, 232(1): 99-108. DOI:10.1016/j.tox.2006.12.014.
[5] PERNICE R, HAUDER J, KOEHLER P, et al. Effect of sulforaphane on glutathione-adduct formation and on glutathione-S-transferase dependent detoxification of acrylamide in Caco-2 cells[J]. Molecular Nutrition & Food Research, 2009, 53(12): 1540-1550. DOI:10.1002/ mnfr.200900447.
[6] DOBOWOLSKI P, HUET P, KARLSSON P, et al. Potato fiber protects the small intestinal wall against the toxic influence of acrylamide[J]. Nutrition, 2012, 28(4): 428-435. DOI:10.1016/j.nut.2011.10.002.
[7] ALTURFAN A A, TOZAN-BECEREN A, ŞCHIRLI A Ö, et al. Resveratrol ameliorates oxidative DNA damage and protects against acrylamide-induced oxidative stress in rats[J]. Molecular Biology Reports, 2012, 39(4): 4589-4596. DOI:10.1007/s11033-011-1249-5.
[8] ZHAO M Y, WANG P P, ZHU Y C, et al. Blueberry anthocyanins extract inhibits acrylamide-induced diverse toxicity in mice by preventing oxidative stress and cytochrome P4502E1 activation[J]. Journal of Functional Foods, 2015, 14: 95-101. DOI:10.1016/j.jff.2015.01.035.
[9] PARK H R, KIM M S, KIM S J, et al. Acrylamide induces cell death in neural progenitor cells and impairs hippocampal neurogenesis[J]. Toxicology Letters, 2010, 193(1): 86-93. DOI:10.1016/ j.toxlet.2009.12.015.
[10] LIU Z G, SONG G, ZOU C, et al. Acrylamide induces mitochondrial dysfunction and apoptosis in BV-2 microglial cells[J]. Free Radical Biology and Medicine, 2015, 84: 42-53. DOI:10.1016/ j.freeradbiomed.2015.03.013.
[11] CHEN Y, XIE M Y, NIE S P, et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241. DOI:10.1016/j.foodchem.2007.08.021.
[12] LI W J, NIE S P, PENG X P, et al. Ganoderma atrum polysaccharide improves age-related oxidative stress and immune impairment in mice[J]. Journal of Agricultural and Food Chemistry, 2012, 60(6):1413-1418. DOI:10.1021/jf204748a.
[13] LI W J, CHEN Y, NIE S P, et al. Ganoderma atrum polysaccharide induces anti-tumor activity via the mitochondrial apoptotic pathwayrelated to activation of host immune response[J]. Journal of Cellular Biochemistry, 2011, 112(3): 860-871. DOI:10.1002/jcb.22993.
[14] ZHANG H, CUI S W, NIE S P, et al. Identification of pivotal components on the antioxidant activity of polysaccharide extract from Ganoderma atrum[J]. BioactiveCarbohydrates and Dietary Fibre, 2016, 7(2): 9-18. DOI:10.1016/j.bcdf.2016.04.002.
[15] RODRÍGUEZ-RAMIRO I, RAMOS S, BRAVO L, et al. Procyanidin B2 and a cocoa polyphenolic extract inhibit acrylamide-induced apoptosis in human Caco-2 cells by preventing oxidative stress and activation of JNK pathway[J]. The Journal of Nutritional Biochemistry, 2011, 22(12): 1186-1194. DOI:10.1016/j.jnutbio.2010.10.005.
[16] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1/2): 55-63. DOI:10.1016/0022-1759(83)90303-4.
[17] CHENG F F, YANG Y J, ZHANG L, et al. A natural triterpene derivative from Euphorbia kansui inhibits cell proliferation and induces apoptosis against rat intestinal epithelioid cell line in vitro[J]. International Journal of Molecular Sciences, 2015, 16(8): 18956-18975. DOI:10.3390/ijms160818956.
[18] FARRUGIA G, BALZAN R. Oxidative stress and programmed cell death in yeast[J]. Frontiers in Oncology, 2012, 2: 64. DOI:10.3389/ fonc.2012.00064.
[19] REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inf l ammation, and cancer: how are they linked?[J]. Free Radical Biology and Medicine, 2010, 49(11): 1603-1616. DOI:10.1016/ j.freeradbiomed.2010.09.006.
[20] 尹小萍, 林冠宇, 宝丽, 等. 正膏坊龟苓膏对氧化应激状态的改善作用[J].食品科学, 2009, 30(5): 235-239. DOI:1002-6630(2009)05-0239-05.
[21] HSU Y W, TSAI C F, CHEN W K, et al. Protective effects of seabuckthorn (Hippophae rhamnoides L.) seed oil against carbon tetrachloride-induced hepatotoxicity in mice[J]. Food and Chemical Toxicology, 2009, 47(9): 2281-2288. DOI:10.1016/j.fct.2009.06.015.
[22] YOUSEF M I, El-DEMERDASH F M. Acrylamide-induced oxidative stress and biochemical perturbations in rats[J]. Toxicology, 2006, 219(1): 133-141. DOI:10.1016/j.tox.2005.11.008.
[23] TAHA R, SEIDMAN E, MAILHOT G, et al. Oxidative stress and mitochondrial functions in the intestinal Caco-2/15 cell line[J]. PLoS ONE, 2010, 5(7): e11817. DOI:10.1371/journal.pone.0011817.
[24] XU C, YAGIZ Y, MARSHALL S, et al. Application of muscadine grape (Vitis routundifolia Michx.) pomaceextract to reduce carcinogenic acrylamide[J]. Food Chemistry, 2015, 182: 200-208.
[25] ZHAO M Y, LIU X, LIU Y H, et al. Evaluation of protective effect of freeze-dried strawberry, grape and blueberry powder on acrylamide toxicity in mice[J]. Journal of Food Science, 2015, 80: H869-H874.
[26] SONG J, ZHAO M Y, LIU X, et al. Protection of cyanidin-3-glucoside against oxidative stress induced by acrylamide inhuman MDAMB-231 cells[J]. Food and Chemical Toxicology, 2013, 58: 306-310.
[27] GHORBEL I, ELWEJ A, JAMOUSSI K, et al. Potential protective effects of extra virgin olive oil on the hepatotoxicity induced by coexposure of adult rats to acrylamide and aluminum[J]. Food Function, 2015, 6: 1126-1135.
[28] 袁媛, 孙梅. 黄芪多糖对LPS损伤小肠上皮细胞的保护作用[J]. 世界华人消化杂志, 2008, 16(1): 15-19.
[29] 周爱国, 李小兰. 枸杞多糖对大鼠小肠缺血再灌注氧化应激的抑制作用[J]. 中国实验方剂学杂志, 2011, 17(22): 221-222. DOI:10.3969/ j.issn.1005-9903.2011.22.062.
[30] 李文娟, 聂少平, 余强, 等. 黑灵芝多糖对氧化应激所致心肌细胞损伤的影响[J]. 食品科学, 2009, 30(11): 221-225.
Protective Effect of Ganoderma atrum Polysaccharides on Oxidative Damage Induced by Acrylamide in IEC-6 Cells
ZHANG Lulu, SHI Ting, ZHU Mengting, CHEN Yi⋆
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective: To investigate the protective effect of Ganoderma atrum polysaccharides (GAP) against oxidative injury induced by acrylamide (AA) in intestinal epithelial cells (IEC)-6. Methods: The MTT assay was used to evaluate the proliferation of IEC-6. After cultivation, the cells and culture medium were collected for determining the activities of lactate dehydrogenase (LDH), malondialdelyde (MDA), superoxide dismutase (SOD) and reduced glutathione peroxidase (GSH-Px). Results: GAP had no toxic effect on the cultured IEC-6 at the tested concentrations. Compared with the AA-treated group, GAP significantly attenuated AA-induced oxidative damage and increased cell viability by decreasing LDH activity and MDA content, and increasing SOD and GSH-Px activities in IEC-6 line. Conclusion: These results suggested that GAP showed a protective effect against AA-induced oxidative damage in IEC-6 through inhibiting lipid peroxidation, and increasing antioxidant system activity.
Ganoderma atrum polysaccharides; acrylamide; IEC-6; oxidative damage
10.7506/spkx1002-6630-201703028
TS201.4
A
1002-6630(2017)03-0170-06
张路路, 石婷, 朱梦婷, 等. 黑灵芝多糖对丙烯酰胺诱导小肠上皮细胞氧化损伤的保护作用[J]. 食品科学, 2017, 38(3):170-175. DOI:10.7506/spkx1002-6630-201703028. http://www.spkx.net.cn
ZHANG Lulu, SHI Ting, ZHU Mengting, et al. Protective effect of Ganoderma atrum polysaccharides on oxidative damage induced by acrylamide in IEC-6 cells[J]. Food Science, 2017, 38(3): 170-175. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703028. http://www.spkx.net.cn
2016-06-25
国家自然科学基金地区科学基金项目(21467016);全国优秀博士学位论文作者专项资金项目(201357);江西省青年科学家培养对象计划项目(20142BCB23005)
张路路(1992—),男,硕士研究生,研究方向为食品营养与安全。E-mail:1126304817@qq.com
⋆通信作者:陈奕(1982—),女,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品质量与安全。E-mail:chenyi-417@163.com

