垂体黄体生成素大腺瘤致闭经患者成功妊娠一例报告及分析
郑备红,徐慧灵,邱淑敏,陈晓菁,孙艳,朱素芹,廖秀花,姜雯雯
(福建省妇幼保健院辅助生殖技术研究室,福州 350001)
垂体黄体生成素大腺瘤致闭经患者成功妊娠一例报告及分析
郑备红*,徐慧灵,邱淑敏,陈晓菁,孙艳,朱素芹,廖秀花,姜雯雯
(福建省妇幼保健院辅助生殖技术研究室,福州 350001)
功能性垂体促性腺激素腺瘤在生育年龄女性中发生率极低,其中黄体生成素腺瘤更是极为罕见。本文报道一例由垂体促黄体生成素大腺瘤引起原发不孕及闭经的29岁患者。该患者激素检查提示异常增高的LH水平和轻度降低的FSH水平,MRI和CT均提示左侧鞍旁占位性病变,遂行经蝶鞍肿瘤切除术。术后患者经治疗后成功妊娠并分娩。因此,育龄妇女出现继发闭经、不孕及异常的LH升高时,需考虑垂体LH腺瘤,并与分泌LH的异位肿瘤等致LH异常升高的疾病相鉴别,仔细诊断,避免误诊、错误治疗甚至不必要的手术。
垂体促性腺激素腺瘤; 促黄体生成素腺瘤; 闭经
功能性垂体促性腺激素腺瘤在生育年龄女性中发生率极低,且其中大部分是单纯性卵泡刺激素腺瘤,黄体生成素腺瘤极为罕见。患者临床表现多样化,故容易误诊和漏诊,部分患者在反复误诊和错误的治疗甚至进行了不必要且具有损伤性的手术操作后最终确诊,以致延误病情。本文报道本院辅助生殖技术研究室接诊1例垂体黄体生成素(LH)大腺瘤患者的处理经验并使其成功妊娠分娩,同时回顾分析相关文献。
患者29岁,原发不孕。因“闭经3年,婚后未避孕2年未孕”于2014年10月17日就诊。月经史:13岁初潮,既往月经周期尚规律,周期30~37 d,2011年始体重增加8 kg,出现闭经,予人工周期后可行经,末次月经2012年5月。患者无头痛、视物模糊、嗅觉异常等不适。2013年4月8日曾于外院查激素提示LH水平异常升高,卵泡刺激素(FSH)水平轻度降低(表1,术前19月),染色体示46,XX。查体:身高 158 cm,体重 60 kg,体重指数(BMI) 24.03 kg/m2。神清,查体合作,双眼活动无明显受限,眼球无震颤。乳房发育正常,溢乳(-),脐下至耻骨联合见数根粗毛。妇科检查:外阴:已婚式,阴毛布及肛周;阴道:通畅;宫颈:尚光滑,偏小;宫体:前位,略小,质中,活动,无压痛;双附件:(-)。遂查尿妊娠试验(-),激素水平与前次大致相同(表1,术前1月),空腹血糖6.03 mmol/L,胰岛素(INS)0.50 mg/L,甲状腺功能、血皮质醇均正常。B超示弓形子宫待排除,宫体4.0 cm×2.5 cm×3.4 cm,内膜厚度0.17 cm,左侧卵巢(LOV) 2.8 cm×2.5 cm×2.6 cm,窦卵泡数约为12个,右侧卵巢(ROV)2.9 cm×2.5 cm×2.9 cm,窦卵泡数约为14个,肝胆胰脾肾超声未见异常,嘱其综合医院就诊,行视野检查示左眼鼻侧视野部分缺损,右眼颞侧视野部分缺损;颅脑电子计算机断层扫描(CT)示左侧鞍旁占位,病灶呈大部分包绕并轻度向后上方推移左侧大脑中动脉水平段及左侧大脑前动脉A1段(图1 C);头颅核磁共振成像(MRI)示左侧鞍旁异常信号灶(2.9 cm×2.1 cm×2.6 cm),考虑淋巴瘤,需与垂体瘤或脑膜瘤鉴别(图1 A、B)。2014年11月行“左额颞开颅翼点入路鞍区及鞍旁占位切除术+脑脊液漏修补+颅内压监测探头置入+颅骨修补术”,术后病理:垂体腺瘤;免疫组织化学染色LH阳性(图1D),促甲状腺激素(TSH)小灶阳性,FSH、泌乳素(PRL)、生长激素(GH)、促肾上腺皮质激素(ACTH)均阴性。2014年12月外院复查头颅MRI未示异常,激素示LH较前明显下降,FSH正常水平(表1,术后1月)。患者至2015年1月28日仍无月经来潮,遂再次就诊我院,复查激素较前无明显改变(表1,术后2月),B超示子宫4.2 cm×2.2 cm×2.0 cm,内膜0.14 cm,LOV窦卵泡数约为14个,ROV窦卵泡数约为14个,予补佳乐2 mg Bid×14 d,2015年2月12日复查B超示子宫4.4 cm×2.6 cm×3.5 cm,内膜厚度0.93 cm,予补佳乐2 mg bid×14 d+地屈孕酮 10 mg bid×14 d,2015年3月2日月经来潮,复查激素示LH较前无明显改变,FSH轻度抑制(表1,术后3月),B超示子宫4.1 cm×2.6 cm×3.3 cm,予克龄蒙2个周期,2015年4月28日月经来潮,B超示子宫4.1 cm×2.7 cm×3.8 cm,LOV窦卵泡数约为14个,ROV窦卵泡数约为14个,再予克龄蒙2个周期,期间出现点滴出血,2015年6月19日月经来潮,复查激素较前无明显改变(表1,术后7月),B超示子宫4.3 cm×3.0 cm×3.9 cm,改予补佳乐2 mg bid ×21 d,后10 d加用地屈孕酮 10 mg bid×10 d,用药2个周期,期间行子宫输卵管造影术(HSG)检查示宫腔正常,双输卵管通畅。男方精液检查大致正常。2015年8月7日月经来潮,复查激素较前无明显改变(表1,术后9月),B超示子宫4.0 cm×3.4 cm×4.0 cm,LOV窦卵泡数约为14个,ROV窦卵泡数约为13个,D4始予丽申宝促排卵,75 IU im qod×10 d+75 IU im qd×9 d,D24 B超提示右卵巢卵泡1.9 cm×1.7 cm,予HCG 10 000 IU im,排卵后予地屈孕酮 10 mg bid,14 d后查血HCG 270.13 U/L,继续予地屈孕酮口服,18 d后B超示宫内单胎妊娠,获得临床妊娠,于孕39+周剖宫产一子,出生体重3.4 kg,Apgar评分10分,随访至今体健。
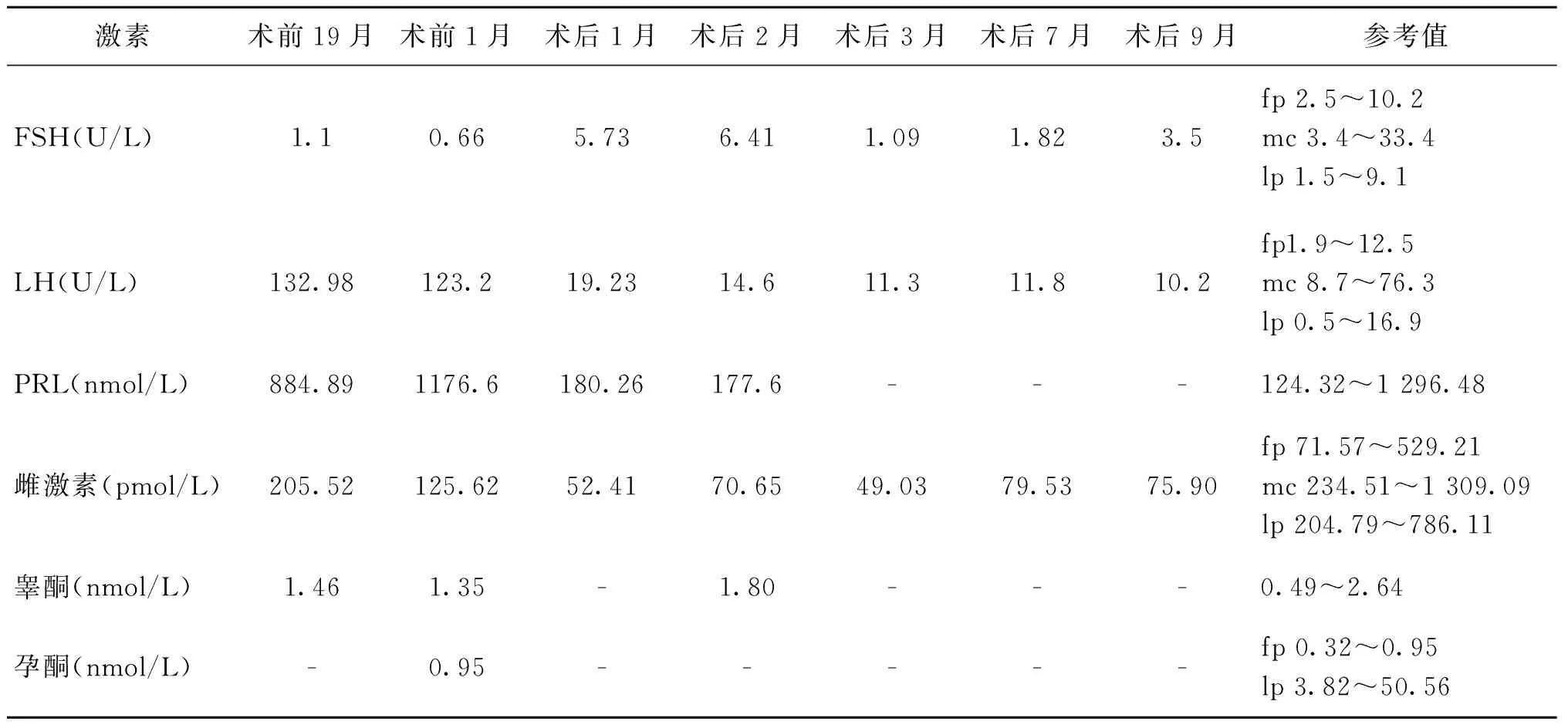
表1 患者垂体瘤手术前后的激素水平
注:fp 卵泡期;mc 月经中期;lp 黄体期(未绝经妇女)
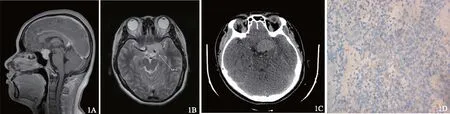
图1 垂体LH腺瘤影像学及病理学检查。1A:头颅MRI成像图的矢状位;1B:头颅MRI成像图的T2W1轴位;1C:头颅CT的增强轴位;1D:术后垂体腺瘤细胞LH阳性 免疫组织化学染色 ×200
讨论 垂体促性腺激素腺瘤常见于中青年患者,男性多见,占垂体腺瘤的15%~20%[1],垂体大腺瘤的40%~50%,无功能腺瘤的80%~90%[2],是最常见的无功能腺瘤[3],极少引起激素相关临床症状,起病多隐匿,多数患者因出现肿瘤占位压迫症状才被发现。功能性垂体促性腺激素腺瘤极其罕见,英国曾对81 149名居民进行垂体腺瘤的大规模流行病学横断面调查,未发现一例该类病例[4]。由于该类病例较少见,临床医生缺乏诊疗经验,部分患者在反复误诊或漏诊和错误的治疗甚至进行了例如腹腔镜下卵巢活检或部分切除术等不必要的手术操作后才最终确诊[5-7]。
功能性垂体促性腺激素腺瘤多为大腺瘤,能表达和分泌具有生物学活性的促性腺激素,其中大部分是单纯性卵泡刺激素腺瘤,黄体生成素腺瘤极为罕见。功能性垂体促性腺激素腺瘤能引起男性睾丸增大及儿童的同性性早熟等临床症状,在育龄妇女中主要表现为月经紊乱、不孕症、溢乳,部分患者表现为卵巢过度刺激综合征[8-9]。激素检测:(1)雌激素升高是最普遍的生化改变,某些卵巢过度刺激综合征患者甚至雌激素仅轻度升高;(2)血清FSH在正常范围或轻度升高,男性比女性更容易出现血清FSH水平的升高;(3)即使在LH腺瘤,尤其女性,血清LH常较正常降低,少部分患者LH在正常范围[8]。研究认为大部分患者出现此免疫组织化学与血液生化结果不一致的原因可能为:(1)肿瘤细胞所产生的激素仅为激素的部分亚单位,或缺乏某些关键结构,无生物活性;(2)肿瘤细胞合成激素后由于分泌机制的障碍使激素滞留于细胞内致血清中激素水平不高[10]。而本例患者激素特点明显不同于既往报道病例,可能与本例患者垂体腺瘤细胞分泌的为有活性的LH有关。患者LH持续异常升高,负反馈抑制下丘脑分泌促性腺激素释放激素(GnRH),从而导致FSH水平轻度降低,无卵泡发育,雌激素处于基础水平,患者出现闭经、不孕。
本例患者原发不孕,继发闭经,多次不同检测方法提示血LH异常升高,>100 U/L,影像学检查、术后病理组织及免疫组织化学检查确诊为垂体黄体生成素大腺瘤,为罕见的病例;不同于文献中报道功能性垂体促性腺激素腺瘤患者LH常低于正常水平或在正常水平。因此本病例需与引起LH升高的生理及其他病理状况鉴别。(1)生理性LH升高:生理性LH升高通常见于排卵前的LH峰,但很少超过100 U/L以上,且此时伴血FSH轻度升高及E2升高,B超应提示卵巢可见卵泡,不伴有月经紊乱等,本例患者继发闭经,多次复查均示LH异常升高,FSH、E2低下,双卵巢未见发育中卵泡,故可排除。(2)卵巢早衰(POF):患者继发闭经,LH升高,E2下降,B超示子宫偏小,内膜薄,需与POF鉴别。但POF患者伴FSH升高,B超示双卵巢萎缩变小,卵泡数目减少或无卵泡,与本例患者不符,故可排除。(3)PCOS:患者继发闭经,有高雄激素体征,肥胖,LH升高,双卵巢多囊样改变,故需与之鉴别。PCOS患者多数FSH处于正常水平,LH水平升高,但多轻度升高或升高2~3倍,极少见LH水平高达100 U/L的患者,故可能性小。(4)LH受体基因的失活突变致LH过度分泌:在女性,LH受体缺陷表现为正常的青春期和乳腺发育,但往往是原发性闭经,实验室检查显示LH和FSH增高及E2、孕烯醇酮、睾酮、雄烯二酮低下。与该病例不符,可排除。(5)分泌LH的异位肿瘤:文献报道肾上腺肿瘤可引起血LH水平异常升高[11-12]。Hirshberg等[13]报道了一例胰腺肿瘤患者不排卵伴LH水平异常增高及体重逐渐增加,与本例患者极为类似,需予以鉴别。本例患者肝胆胰脾肾超声未见异常,术后LH快速下降,可结合胸、腹及盆腔CT、MRI等检查协助诊断。
目前垂体促性腺激素腺瘤首选的治疗是经蝶骨肿瘤切除术,放射治疗可用于术后复发患者,药物治疗通常收效甚微,可用于手术失败、有手术禁忌证或拒绝行手术治疗的患者,但也有报道称药物治疗有效[14-15]。本例患者就诊我院后及时进行了视野检查及头颅MRI检查,发现了垂体腺瘤并进行手术,术后病理提示垂体腺瘤;免疫组织化学LH阳性,TSH小灶阳性,FSH、PRL、GH、ACTH均阴性,术后积极进行助孕治疗并得以顺利妊娠。因此该病例是一例罕见的垂体功能性LH大腺瘤引起LH异常升高病例。
综上所述,育龄妇女出现继发闭经、不孕及异常的LH升高时,需考虑垂体LH腺瘤,并与分泌LH的异位肿瘤等致LH异常升高的疾病相鉴别,仔细诊断,避免误诊、错误治疗甚至不必要的手术。
[1] Chanson P.[Gonadotroph pituitary adenomas][J].Ann Endocrinol(Paris),2000,61:258-268.
[2] Chaidarun SS, Klibanski A.Gonadotropinomas[J].Semin Reprod Med,2002,20:339-348.
[3] Mayson SE, Snyder PJ.Silent(clinically nonfunctioning) pituitary adenomas[J].J Neurooncol,2014,117:429-436.
[4] Fernandez A, Karavitaki N.Wass JA.Prevalence of pituitary adenomas: a community-based,cross-sectional study in Banbury(Oxfordshire,UK) [J].Clin Endocrinol(Oxf),2010, 72:377-382.
[5] Castelo-Branco C, del Pino M, Valladares E.Ovarian hyperstimulation,hyperprolactinaemia and LH gonadotroph adenoma[J/OL].Reprod Biomed Online,2009,19: 153-155.
[6] 蔡婕,郑志群,林雪焕.垂体促性腺激素腺瘤引发卵巢过度刺激综合征1例报告[J].中国实用妇科与产科杂志,2012,28:800.
[7] Halupczok J,Bidzinska-Speichert B,Lenarcik-Kabza A,et al.Gonadotroph adenoma causing ovarian hyperstimulation syndrome in a premenopausal woman[J].Gynecol Endocrinol,2014,30:774-777.
[8] Ntali G, Capatina C, Grossman A,et al.Clinical review: Functioning gonadotroph adenomas[J].J Clin Endocrinol Metab,2014,99:4423-4433.
[9] Halupczok J,Kluba-Szyszka A,Bidzinska-Speichert B,et al.Ovarian Hyperstimulation Caused by Gonadotroph Pituitary Adenoma-Review[J].Adv Clin Exp Med,2015,24:695-703.
[10] Arafah BM,Nasrallah MP.Pituitary tumors: pathophysiology,clinical manifestations and management[J].Endocr Relat Cancer,2001,8:287-305.
[11] Knoepfelmacher M,Danilovic DL, Rosa Nasser RH,et al.Effectiveness of treating ovarian hyperstimulation syndrome with cabergoline in two patients with gonadotropin-producing pituitary adenomas[J].Fertil Steril,2006,86:719.e15-18.
[12] Murata Y,Ando H,Nagasaka T,et al.Successful pregnancy after bromocriptine therapy in an anovulatory woman complicated with ovarian hyperstimulation caused by follicle-stimulating hormone-producing plurihormonal pituitary microadenoma[J].J Clin Endocrinol Metab,2003,88:1988-1993.
[13] Hirshberg B,Conn PM,Uwaifo GI,et al.Ectopic luteinizing hormone secretion and anovulation[J].N Engl J Med,2003,348:312-317.
[14] Gadner H, Weber B, Riehm H.Adrenocortical carcinoma with ectopic LH production[J].Z Kinderheilkd,1974,118:63-70.
[15] Romer TE,Sachnowska K,Savage MO,et al.Luteinizing hormone secreting adrenal tumour as a cause of precocious puberty[J].Clin Endocrinol(Oxf),1998,48:367-372.
[编辑:谷炤]
10.3969/j.issn.1004-3845.2017.02.014 ·病例报告·
2016-10-07;
2016-11-01
福建省临床重点专科建设项目(闽卫科教【2012】149号)
郑备红,女,福建莆田人,主任医师,生殖医学专业.(*
)

