杀菌剂对沙打旺种子萌发和幼苗生长的短期影响
俞斌华,王文建,殷建鹏,王燕超,于丝雨,祁璐璐
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.草地农业生态系统国家重点实验室, 兰州大学草地农业科技学院,甘肃 兰州 730020 )
植物生产层
杀菌剂对沙打旺种子萌发和幼苗生长的短期影响
俞斌华1,2,王文建2,殷建鹏2,王燕超2,于丝雨2,祁璐璐2
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.草地农业生态系统国家重点实验室, 兰州大学草地农业科技学院,甘肃 兰州 730020 )
病害是导致沙打旺(Astragalusadsurgens)草地产量下降的主要原因之一。本研究用杀菌剂对沙打旺种子进行预处理,在培养皿和盆栽两种培养条件下模拟沙打旺种子在自然环境中受到不同病原真菌侵染后的萌发和生长状况,探讨杀菌剂预处理的作用和效果。结果表明,人工接种病原菌后,经杀菌剂处理的种子,其发芽率,植株的株高、根长和干重较无菌水处理种子显著提高(P<0.05),而发病率、死亡率和平均病情指数则相应地显著降低(P<0.05)。不同杀菌剂的防治效果有所不同,在多菌灵、代森锰锌和甲基托布津3种杀菌剂中,代森锰锌预处理防治效果最好。
病原真菌;多菌灵;代森锰锌;甲基托布津;种子预处理
沙打旺(Astragalusadsurgens)为豆科黄芪属,又名直立黄芪、麻豆秧等,起源于欧亚大陆[1],广泛分布于中国、俄罗斯、蒙古、日本和韩国等东北亚地区以及美国、加拿大等北美国家[2-3]。在我国,沙打旺原产于河北、河南、山东和江苏等地的黄河故道,人工栽培已有上百年历史,俗称为薄地强、苦草和麻豆秧[4]。沙打旺适应性非常强,耐寒、抗旱、耐贫瘠、抗风蚀沙埋,在保护环境中发挥着重要作用[5-7]。沙打旺与紫花苜蓿(Medicagosativa)、草木樨(Clematisflorida)等豆科牧草相比,产量较高,尤其是在贫瘠干旱条件下表现更为突出,可作为优质牧草[8-9]。
持久性差是限制沙打旺生产和利用的重要因素,而病害是草地早衰的原因之一,三龄沙打旺草地植被因病害而导致盖度大幅度降低、生产力明显下降,且病害的种数随着草地年龄的增加而增加,二者呈正相关关系[10-14]。截至2008年,世界范围内,在沙打旺上共发现27属37种真菌,共引致22类真菌病害,其中茎叶入侵真菌共25属34种,引起了20类病害;根部入侵真菌共3属7种,引起了3类病害;茎叶和根部共有真菌1属1种,引起了1种系统性真菌病害——沙打旺黄萎病(Verticilliumdahltae)[15-23]。为了减少损失,可以用物理防治,化学防治和生物防治,其中最常用的还是利用杀菌剂进行病害的防除[16,24]。
目前使用杀菌剂仍然是防治植物病害的一种经济有效的方法。随着生物技术的发展,转基因作物种植面积将不断扩大,杀虫剂和除草剂的用量迅速减少,但是对杀菌剂的使用影响较小[25-26]。杀菌剂是用于防治由真菌、细菌类病原微生物引起的植物病害的一类化学制剂。杀菌剂的作用机理主要有两种:一是干扰病菌的呼吸过程,抑制能量的产生;二是干扰菌体生命物质如蛋白质、核酸、甾醇等的生物合成。根据其作用方式杀菌剂可分为两类:一类是保护性杀菌剂,另一类是内吸性杀菌剂。保护性杀菌剂在植物体外或体表直接与病原菌接触,杀死或抑制病原菌,使之无法进入植物,从而保护植物免受病原菌的危害。本研究所用代森锰锌就属于保护性杀菌剂。内吸性杀菌剂施用于作物的某一部位后能被作物吸收,并在体内运输到作物的其它部位发生作用。内吸性杀菌剂有两种传导方式,一种是向顶性传导,即药剂被吸收到植物体内以后随蒸腾流向植物顶部传导至顶叶、顶芽及叶类、叶缘,目前的内吸性杀菌剂多属此类;另一种是向基性传导,即药剂被植物体吸收后于韧皮部内沿光合作用产物的运输向下传导。内吸性杀菌剂中属于此类的较少,本研究所用的多菌灵就属于此类杀菌剂[25,27]。
本研究采用不同的杀菌剂预处理,模拟沙打旺种子在多种病原菌存在的条件下萌发和生长,分析杀菌剂对种子萌发和幼苗生长过程的影响,比较不同杀菌剂的处理效果,寻求沙打旺种植过程中较为适用的杀菌剂种类,以期为生产实践提供理论依据和具体指导,从而提高牧草产量,减少因病害造成的经济损失。
1 材料与方法
1.1 沙打旺种子
本研究所用种子为地方品种辽宁阜新沙打旺,种子保存在兰州大学草地农业科技学院种子库中(4 ℃,黑暗)。
1.2 病原微生物
本研究所用病原真菌分离自辽宁阜新沙打旺种子。种带真菌检验参照文献[16]的方法。将种子放在纱网内用自来水冲洗3遍,再用70%的酒精消毒30 s,然后用1%的次氯酸钠溶液消毒3 min,用无菌蒸馏水冲洗3遍,用灭菌滤纸吸干种子表面水分,均匀摆放在马铃薯葡萄糖琼脂(PDA)平板上,每皿50粒,4个重复,在25 ℃黑暗下培养,分别在第4天和第7天统计每粒种子上生长出的真菌菌落数量和种类,并及时纯化、鉴定。
孢子悬浮液的制备。将沙打旺种子上分离率最高的3种病原菌——镰刀菌(Fusariumspp.)、埃里砖格孢(Embellisiaastragali)、链格孢(Alternariasp.)置于25 ℃恒温培养箱(Sanyo Incubator,Japan)中PDA培养基上密封培养使病原菌产孢。每皿加入无菌水5 mL,用灭菌的载玻片轻轻刮下孢子,经双层纱布过滤后,用血球计数板将孢子悬浮液浓度调节为5×105个·mL-1,备用。
1.3 土壤灭菌及最大持水量测定
盆栽用土为黄壤土,取自兰州大学草地农业科技学院榆中实验田(104.1° E、35.9° N)。按照土壤养分系统研究法(ASI法)[28]测定土壤基本指标。结果显示,土壤pH 7.8,土壤速效氮、速效磷和速效钾含量分别为92.6、30.2和110.9 mg·kg-1。先过筛(2 mm孔径)剔除杂物,平铺在瓷盘上约3 cm厚,将瓷盘放置在烘箱(DHG-9420A,上海一恒科技有限公司)中,169 ℃下灭菌5 h[29],降温后装在塑料大桶中,盖上桶盖备用。每次称取灭菌土壤1 000 g,装在塑料花盆(底部开孔,盆底直径120 mm,盆口直径150 mm,盆高140 mm)中用以种植沙打旺。
土壤灭菌效果检验:用以上方法灭菌的土壤,在超净工作台上,铺在PDA培养基表面,25℃黑暗条件下培养2周,无任何菌物长出[18]。
土壤最大持水量(W)检测[30]:将装有灭菌土壤的花盆放置于略大于花盆底部的塑料盆中,反复向花盆中浇水,直至花盆底部流出的水与塑料盆口同高。然后将花盆口用塑料薄膜封住,共设置5个重复。放置24 h后,将花盆从塑料盆中取出,擦去花盆表面的水分再称重,得到总重(W1)。再将花盆放置于80 ℃烘箱中烘干24 h,反复至重量再无变化时记录干重(W2)。根据公式W=W1-W2计算土壤最大持水量,本研究中每盆土壤平均最大持水量为280 g。
1.4 杀菌剂及配制
本研究中3种杀菌剂都购自兰州市安宁区农药市场,均为可湿性粉剂(四川国光农化公司)。用无菌水配制杀菌剂溶液,分别为0.1%多菌灵溶液、0.1%代森锰锌溶液和0.1%甲基托布津溶液。
1.5 种子预处理
将健康、饱满的沙打旺种子用蒸馏水冲洗干净,先后浸于75%酒精溶液(1 min)和1%次氯酸钠溶液(10 min)进行表面消毒,再用无菌水冲洗5遍,用灭菌滤纸吸干种子表面水分。待种子干燥后,再分别浸于无菌水(CK1和CK2)、0.1%多菌灵溶液、0.1%代森锰锌溶液和0.1%甲基托布津溶液中,10 min后取出晾干。
1.6 接种方法
1.6.1 培养皿试验 在无菌条件下将预处理好的种子放置于铺有双层灭菌滤纸的培养皿中,每皿50粒,每个处理10个重复。CK1(无杀菌剂处理,无人工接种)每皿倒入无菌水10 mL;将3种病原菌的孢子悬浮液按1∶1∶1的比例混合均匀倒入CK2(无杀菌剂处理,有人工接种)和其它处理(有杀菌剂处理,有人工接种)的培养皿中,每皿10 mL。按照国家种子检验规程,将培养皿置于培养箱中20 ℃条件下黑暗培养。
1.6.2 盆栽试验 将预处理种子摆放在装有1 000 g灭菌土壤的花盆中,每盆10粒均匀排列,表面覆土约5 mm,每个处理10盆。将所有花盆放在温度为20 ℃/-25 ℃(夜晚/白天),相对湿度80%,12 h光照、12 h黑暗,光照强度为12 000 lx的温室中培养。第1-14天,CK1每天每盆浇入无菌水10 mL作为对照,CK2和其它处理每天每盆浇入混合孢子悬浮液10 mL。之后所有盆每3 d浇水一次,每次浇水120 mL,约达到土壤最大持水量的70%。试验周期为12周。
1.7 测定项目
发芽率:从种子摆放在培养皿内,每天统计一次发芽数,计算发芽率,共统计14 d[31]。
出苗率:播种后每天统计一次出苗数,计算出苗率,共统计14 d。
株高、发病率、死亡率:每周测量一次所有接种植株和对照植株的株高(卷尺测量),同时统计发病率和死亡率。
根长、干重:第12周收获时,将所有植株用自来水轻轻冲洗干净,测量根长、苗长。之后将植株置于80 ℃烘箱中烘干36 h,称干重。
病情指数:观察地上部分及根部症状,根据以下病情严重等级分级标准,确定病情指数。
地上部分病情严重指数分级标准[32]:0级,无症状;1级,矮化,但无叶斑;2级,有叶斑,但无病侧枝;3级,茎秆基部变色;4级,茎秆基部或颈部有病枝;5级,植株死亡。
根据病情严重等级[33],计算病情指数(disease severity index,DSI):

病原菌再分离:第12周收获后,将病株上的叶片、茎秆和根部经过表面消毒后切成5 mm小段放置在PDA培养基上进行接种病原菌的再分离。
1.8 数据分析
所有数据用Microsoft Excel 2010作图,并用SPSS 19.0分析,对发芽率、出苗率、根苗长、单株干重、发病率、死亡率以及病情指数几个指标采用单因素方差分析方法,对各指标进行不同处理间差异显著性分析。
2 结果
2.1 种带真菌种类与带菌率
在沙打旺种子上共分离出真菌13种(表1)。分离率较高并且普遍存在的真菌有埃里砖格孢(Embellisiaastragali)、链格孢(Alternariasp.)和镰刀菌(Fusariumspp.)。
2.2 培养皿内种子发芽率
1-3 d对照与处理的种子发芽率均较低,为4%~18%。4-7 d,CK1和3个杀菌剂处理的发芽率均上升较快,在54%~62%,而CK2发芽率上升缓慢,仅为14%。8-14 d,CK1和3个处理的发芽率上升速度放缓,14 d时发芽率为67%~89%。CK2发芽率始终较低,14 d发芽种子仅有27%。统计结束时,CK1的发芽率是CK2发芽率的234%,多菌灵处理的发芽率是CK2的179%,代森锰锌处理的发芽率是CK2的185%,甲基托布津处理的发芽率是CK2的151%(图1)。

表1 沙打旺种子上分离出的真菌及其分离率Table 1 Percent frequency of fungi isolated from the seeds of standing milkvetch

图1 杀菌剂对培养皿中沙打旺种子发芽率的影响Fig.1 Effects of fungicide on germination percentage of standing milkvetch seeds inoculation in petri dishes
注:不同小写字母表示14 d时不同处理间差异显著(P<0.05)。图2、表3同。
Note: Different lower case letters indicate significant difference among different fungicide treatments at 14 d at 0.05 level. The same in Fig.2 and Table 3.
CK1的最终发芽率显著(P<0.05)高于其它处理的,CK2的最终发芽发芽率显著(P<0.05)低于其它处理的,代森锰锌处理的最终发芽发芽率显著(P<0.05)高于甲基托布津处理的(图1)。
2.3 盆栽种子出苗率
1-4 d对照与处理的种子出苗率均较低,为7%~10%。5-9 d,CK1和3个杀菌剂处理的出苗率均上升较快,达到48%~61%,而CK2出苗率上升缓慢,仅为16%。7-14 d,CK1和3个处理的出苗率上升速度放缓,14 d时出苗率为59%~83%。CK2出苗率始终较低,14 d出苗种子仅有22%。CK1最终出苗率是CK2的284%,多菌灵处理最终出苗率是CK2的209%,代森锰锌处理最终出苗率是CK2的214%,甲基托布津处理最终出苗率是CK2的172%(图2)。
CK1的最终出苗率显著(P<0.05)高于其它处理的,CK2的最终出苗率显著(P<0.05)低于其它处理的,多菌灵和代森锰锌处理的最终出苗显著(P<0.05)高于甲基托布津处理的(图2)。
2.4 株高与根长
所有盆栽试验中种子出苗2周后,植株地上部分开始明显增长。与发芽率相似,CK1和杀菌剂处理种子的株高持续高于CK2的。12周观察结束时,CK1植株的株高显著(P<0.05)高于多菌灵处理、代森锰锌处理和甲基托布津处理的。与CK1、多菌灵、代森锰锌和甲基托布津处理相比,CK2植株的株高分别显著降低了62%、42%、46%和41%(P<0.05)(图3)。
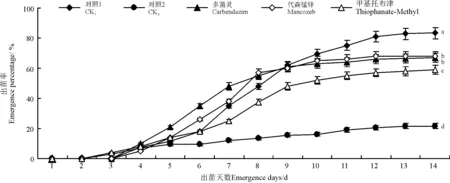
图2 杀菌剂对盆栽沙打旺种子出苗率的影响Fig.2 Effects of fungicide on emergence percentage of standing milkvetch seeds plants in pots
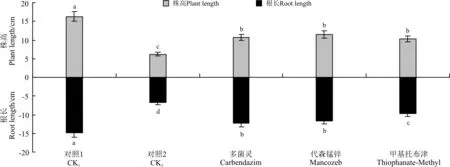
图3 杀菌剂处理对沙打旺植株平均株高和根长的影响Fig.3 Effects of fungicide on plant height and root length of standing milkvetch 12 weeks after planting in pots
12周观察结束时,各处理根长与株高表现出相似趋势。CK1的平均根长显著(P<0.05)大于CK2、多菌灵处理、代森锰锌处理和甲基托布津处理的。多菌灵、代森锰锌与甲基托布津处理间均差异不显著(P>0.05)。CK2处理的根长显著(P<0.05)低于其它处理的,分别为CK1、多菌灵、代森锰锌和甲基托布津处理根长的54%、45%、41%和31%(图3)。
2.5 干重、发病率、死亡率与病情指数
在盆栽试验中,CK1的单株干重为1.42 g,显著(P<0.05)高于其它处理的;CK2单株干重为0.46 g,显著(P<0.05)低于其它处理;多菌灵、代森锰锌和甲基托布津3个处理之间的单株干重无显著差异(P>0.05)(表2)。
盆栽试验中,CK1并未人工接种病原真菌,发病率仅为6%,显著(P<0.05)低于其它各处理。CK2进行了人工接种病原菌,但没有杀菌剂预处理,发病率为87%,显著(P<0.05)高于其它各处理。3个杀菌剂处理中,代森锰锌处理的发病率为47%,显著(P<0.05)低于甲基托布津处理的(表2)。
各组植株死亡率表现出与发病率相似趋势。CK1的死亡率仅为3%,显著(P<0.05)低于其它各处理的。CK2的死亡率为61%,显著(P<0.05)高于其它各处理的。3个杀菌剂处理中,代森锰锌处理的死亡率为26%,显著(P<0.05)低于多菌灵和甲基托布津处理的(表2)。
病情指数为3种病原真菌导致病害病情指数的平均值,可以综合衡量植株的发病率和严重程度。本研究中,CK1的病情指数为2.4,显著(P<0.05)低于其它各处理的。CK2的病情指数为75.6,显著(P<0.05)高于其它各处理的,有相当一部分植株死亡,存活植株的病情也较严重。3个杀菌剂处理的病情指数为36.60~43.20,差异不显著(P>0.05)(表2)。

表2 杀菌剂处理对沙打旺单株干重、发病率死亡率和病情指数的影响Table 2 Effect of fungicide on dry weight of single plant, incidence, mortality and DSI of standing milkvetchin pots experiment
3 讨论与结论
镰刀菌和埃里砖格孢等病原菌能够引起沙打旺植株系统性病害,病原菌长期存活在土壤病残体上,在种子萌发、苗期定植时,从幼苗和根部侵入,导致严重病害最终使植株死亡。生产上由于缺乏抗性品种,化学药剂防治仍是目前控制病害的重要措施,但某种药剂长期单一使用、用药次数和剂量不断增加,导致药剂抗药性出现的问题,已在很多病害防治中有所显露而影响了病害防控效果[34]。关于杀菌剂的研究多数集中在室内毒力测定方面,针对种子预处理后,幼苗的生长研究也主要集中在药效评价方面,而具体关于种子萌发、幼苗生长和干物质累积的研究并不多见。有研究表明,杀菌剂拌种后草坪草出苗率和田间生物量得到不同程度的提高[35]。因此,本研究通过培养皿和盆栽试验研究了不同杀菌剂对沙打旺种子萌发和幼苗生长的影响。通过分析用杀菌剂溶液处理过种子的发芽率,幼苗株高、根长、干重,植株发病率、死亡率以及病情指数等指标,得出防治效果较好的为代森锰锌,其次为多菌灵,而甲基托布津对于3种主要真菌引起的病害防效不佳,这与李兴龙和李彦忠[26]的研究结果相似。
代森锰锌属二硫代氨基甲酸盐类广谱保护性杀菌剂,其作用机理是抑制菌体内丙酮酸的氧化,使病原菌的能量供应受阻,对孢子萌发的抑制作用较强,有“接触性杀菌作用”,能明显降低病原菌的侵入率,使种子能够正常萌发[26,36-37]。因此,在病原菌侵染寄主植物之前,施用代森锰锌等保护性药剂,可阻止真菌孢子的萌发,或干扰病菌与寄主的互作,从而阻止病菌的侵染,保护植物免遭病害。而作为内吸性杀菌剂的多菌灵和甲基托布津,其作用机理主要是干扰真菌的有丝分裂中纺锤体的形成,影响细胞分裂,孢子萌发长出畸形的芽管,起到杀菌作用[36],并且内吸性杀菌剂专性强[35],可能在幼苗生长时期抗病效果较明显,可用于植株发病后抑制体内菌丝的进一步扩展[26,34,36]。由于同一杀菌剂对病原菌菌丝生长和孢子萌发的抑制作用存在差异,比如代森锰锌对孢子萌发抑制作用较强,对菌丝生长抑制作用较弱,故可作为种子预处理药剂,或在发病前喷施,预防病菌孢子的初侵染,并可在发病期喷施,防止孢子再侵染[34-36]。多菌灵是苯并咪唑类杀菌剂,若长期使用,易产生抗药性,应对多菌灵的抗药性给予高度的重视,及早采取相应措施,例如轮换使用不同作用机制的杀菌剂,合理适量用药[34]。
本研究仅使用培养皿和短期盆栽简单模拟了杀菌剂处理对种子受到病原菌侵染影响的抵御作用,还需要在田间条件下,以及更长的时间尺度下研究杀菌剂的作用效果,这将是今后研究的一个重要方向。此外,长期使用一种或几种相同作用靶标的药剂,会导致当地病原菌产生严重的抗药性[34,36]。为避免同一杀菌剂长期使用带来的抗药性而采用不同作用机制杀菌剂复配,研究其复配增效作用,进而提高防治效率,是另一重要研究方向。
References:
[1] Wojciechowski M F.Astragalus(Fabaceae):A molecular phylogenetic perspective.Brittonia,2005,57:382-396.
[2] 刘媖心.中国沙漠植物志(第二卷).北京:科学出版社,1987:168.
[3] 傅坤俊,何业棋,丁陈森.中国植物志第42卷第1分册被子植物门双子叶植物纲.北京:科学出版社,1993:383.
[4] 苏盛发.沙打旺.北京:农业出版社,1985:1-32.
[5] 邹厚远,鲁子瑜,关秀琦,古晓林,张信.黄土高原草地生产持续发展研究Ⅱ.补种沙打旺对退化草地演替的影响.水土保持学报,1994,1(3):61-68. Zou H Y,Lu Z Y,Guan X Q,Gu X L,Zhang X.Study on the sustainable development of the grassland production in loess plateau Ⅱ.Influence of the declined grassland evolution by reseedingAstragalusadsurgens.Research of Soil and Water Conservation,1994,1(3):61-68.(in Chinese)
[6] 关秀琦,邹厚远,鲁子瑜,刘克俭,古晓林.黄土高原草地生产持续发展研究Ⅰ.沙打旺人工草地衰退后的草种更替.水土保持研究,1994,1(3):56-60. Guan X Q,Zou H Y,Lu Z Y,Liu K J,Gu X L.Study on the sustainable development of the grassland production in loess plateauⅠ.Grass varieties alternation in the declined artificial grassland ofAstragalusadsurgens.Research of Soil and Water Conservation,1994,1(3):56-60.(in Chinese)
[7] 芦满济,杜福成,杨志爱.冷温半干旱黄土丘陵区荒坡地沙打旺系统生态效能的调查研究.草业科学,1994,11(2):48-51. Lu M J,Du F C,Yang Z A.Investigation of ecological efficiency in the system plantedAstragalusadsurgenson uncultivated land of loess hill area in the cool semi-arid region.Pratacultural Science,1994,11(2):48-51.(in Chinese)
[8] 贾玉山,张秀芬,葛根图,姜洪喜,刘凤玲,金享一,曹良晓,张俊宝,张永明,张伟.不同刈割技术对沙打旺草粉质量的影响.内蒙古草业,1998,2(3):33-35.
[9] 张慧茹,王丽娟,郑蕊,曹元平.宁夏五种抗旱性牧草的脯氨酸含量的相关性研究.宁夏农学院学报,2001,22(4):12. Zhang H R,Wang L J,Zheng R,Cao Y P.Studies on relationship between five species of herbage with drought resistance and amount of proline’s accumulation.Journal of Ningxia Agricultural College,2001,22(4):12.(in Chinese)
[10] 南志标,刘若.我国五省(区/市)的沙打旺病害及其分布特征.草业科学,1997,14(6):30-34. Nan Z B,Liu R.Diseases ofAstragalusadsurgensgrowing at five provinces of China and characteristics of their occurrence.Pratacultural Science,1997,14(6):30-34.(in Chinese)
[11] 刘爱萍,孙启忠,胡俊,聂素梅,闫志坚,王慧.沙打旺根腐病病原生物学的研究.中国草地,2003,25(2):72-74.
[12] 聂素梅,孙启忠,闫志坚,刘爱萍.影响沙打旺生长衰退因素试验研究.内蒙古草业,2002(3):36-38.
[13] 孙启忠,桂荣,那日苏,那达木德,翟志宏.赤峰地区不同生长年限沙打旺生产力的研究.中国草地,1999(5):29-34.
[14] 孙启忠,桂荣.科尔沁沙地沙打旺草地衰退规律与恢复技术研究.草地学报,2000,8(4):253-261. Sun Q Z,Gui R.Research on decline law and recovery technique ofAstragalusadsurgensmeadow on Kerqin sand land.Acta Agrestia Sinica,2000,8(4):253-261.(in Chinese)
[15] 南志标,刘若.沙打旺种带真菌检测.草业学报,1997,6(4):11-16. Nan Z B,Liu R.Detection of seed-born fungi ofAstragalusadsurgens.Acta Prataculturae Sinica,1997,6(4):11-16.(in Chinese)
[16] 南志标.沙打旺种带真菌——环境、致病力及防治.草业学报,1998,7(1):12-18. Nan Z B.Seed-born fingi ofAstragalusadsurgens——Environment,pathogenicity and control.Acta Prataculturae Sinica,1998,7(1):12-18.(in Chinese)
[17] 尹亚丽,南志标,李春杰,侯扶江,常生华.沙打旺根部入侵真菌的研究.草原与草坪,2006(1):45-48,53. Yin Y L,Nan Z B,Li C J,Hou F J,Chang S H.Study on the root-invading fungi ofAstragalusadsurgens.Grassland and Turf,2006(1):45-48,53.(in Chinese)
[18] 李彦忠.沙打旺(AstragalusadsurgensPall.)黄矮根腐病(Embellisiaastragalisp. nov. Li & Nan)的研究.兰州:兰州大学博士学位论文,2007. Li Y Z.Studies of yellow stunt and root rot ofAstragalusadsurgens(Embellisiaastragalisp. nov. Li & Nan).PhD Thesis.Lanzhou:Lanzhou University,2007.(in Chinese)
[19] Li Y Z,Nan Z B,Hou F J.The roles of anEmbellisiasp. causing yellow stunt and root rot ofAstragalusadsurgensand other fungi in the decline of legume pastures in northern China.Australasian Plant Pathology,2007,36:397-402.
[20] Li Y Z,Nan Z B.A new species ofEmbellisiacausing a disease of standing milk-vetch in China.Mycologia,2007,99(3):406-411.
[21] Li Y Z,Nan Z B.Nutritional study onEmbellisiaastragali,a fungal pathogen of milk vetch (Astragalusadsurgens).Antonie van Leeuwenhoek,2009,95:275-284.
[22] Li Y Z,Nan Z B.First report of yellow stunt and root rot of standing milk vetch caused byEmbellisiasp. from China.Plant Pathology,2008,57:780.
[23] Li Y Z,Nan Z B.Symptoms and etiology of new disease,yellow stunt and root rot of standing milk-vetch in Northern China.Mycopathologia,2007,163:327-334.
[24] Yu B H,Nan Z B,Li Y Z,Lin H L.Resistance of standing milk vetch (Astragalusadsurgens) varieties toEmbellisiaastragali.Crop & Pasture Science,2012,63,351-359.
[25] 宋宝安.新杂环农药(杀菌剂卷).北京:化学工业出版社,2009:78-81. Song B A.New Heterocyclic Pesticide (Fungicide).Beijing:Chemical Industry Press,2009:78-81.(in Chinese)
[26] 李兴龙,李彦忠.5种杀菌剂对沙打旺黄矮根腐病菌的室内毒力测定.草业科学,2013,30(10):1523-1530. Li X L,Li Y Z.Efficacy testing of five fungicides against the pathogen of yellow stunt and root rot ofAstragalusadsurgensin laboratory.Pratacultural Science,2013,30(10):1523-1530.(in Chinese)
[27] 陈仪本,谢小保,欧阳友生.金柚肉果贮藏病原病害及防腐保鲜技术的研究.生态科学,2001(3):100-103. Chen Y B,Xie X B,Ouyang Y S.The flesh storage disease ofCitrusgrandisand the technique of fresh keeping of the fruit.Ecologic Science,2001(3):100-103.(in Chinese)
[28] Wu W,Fan Y,Wang Z Y,Liu H B.Assessing effects of digital elevation model resolutions on soil-landscape correlations in a hilly area.Agriculture,Ecosystems & Environment,2008,126:209-216.
[29] 方中达.植物病原物的接种.见:方中达.植病研究方法.北京:中国农业出版社,1998:62-74.
[30] 刘慧霞,郭正刚,郭兴华,周雪荣,惠文森,王康英.不同土壤水分条件下硅对紫花苜蓿水分利用效率及产量构成要素的影响.生态学报,2009,29(6):3075-3080. Liu H X,Guo Z G,Guo X H,Zhou X R,Hui W S,Wang K Y.Effect of addition of silicon on water ues efficiency and yield components of alfalfa under the different soil moisture.Acta Ecologica Sinica,2009,29(6):3075-3080.(in Chinese)
[31] 王彦荣,余玲,孙建华,郭莉珍,李宏,曾彦军.GB/T2930.4-2001 牧草种子检验规程:发芽试验.北京:中国标准出版社,2001. Wang Y R,Yu L,Sun J H,Guo L Z,Li H,Zeng Y J.GB/T2930.4-2001 Rules for Forage Seed Testing:Germination.Beijing:China Standard Press,2001.(in Chinese)
[32] 南志标.牧草病害的调查与评定.见:任继周.草业科学研究方法.北京:中国农业出版社,1998:214-236.
[33] Graham J H,Devine T E,Hanson C H.Occurrence and interaction of three species ofColletotrichumon alfalfa in the mid-Atlantic United States.Phytopathology,1976,66:538-541.
[34] 唐爽爽,刘志恒,余朝阁,赵廷昌.9种杀菌剂对西瓜炭疽病菌的室内毒力测定及配比试验.植物保护,2014,40(6):171-175. Tang S S,Liu Z H,Yu C G,Zhao T C.Toxicity determination and proportioning tests of nine fungicides toColletotrichumorbiculare.Plant Protection,2014,40(6):171-175.
[35] 李银萍,袁庆华,王瑜.7种杀菌剂对草坪草腐霉枯萎病菌的毒力测定与药效试验.草业科学,2013,20(3):341-345. Li Y P,Yuan Q H,Wang Y.The toxicities and effecs text of seven fingicide onPythiumaphanidermatum.Pratacultural Science,2013,20(3):341-345.(in Chinese)
[36] 徐汉虹.植物化学保护学.第4版.北京:中国农业出版社,2007:117-167.
[37] 姚祥,李秀璋,朱小晓,李春杰.两种杀菌剂对中华羊茅种传内生真菌的影响.草业科学,2013,30(10):1517-1522. Yao X,Li X Z,Zhu X X,Li C J.Effects of two fungicidesonNeotyphodiumseed-borne fungal endophyteofFestucasinensis.Pratacultural Science,2013,30(10):1517-1522.(in Chinese)
(责任编辑 武艳培)
Short-term effect of fungicide on seed germination and seedling growth of standing milk vetch(Astragalusadsurgens)
YuBin-hua1,2,WangWen-jian2,YinJian-peng2,WangYan-chao2,YuSi-yu2,QiLu-lu2
(1.InstituteofGrasslandResearchofCAAS,Hohhot010010,China;2.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China)
Fungal disease is the main factor reducing perennial forage’s biomass of standing milk vetch (Astragalusadsurgens). In this study, the seeds of standing milkvetch were pretreated with three kinds of fungicide: carbendazim, mancozeb and thiophanate-methyl, with the purpose of evaluating the fungicide effects, seed germination and seedling growth after inoculation through resembling the natural environment. The results suggested that three kinds of fungicide treatments significantly(P<0.05) improved the seed germination in petri dishes and pots compared with sterile water controls, and the plant height, root length as well as dry weight revealed a uniform trend. Significant reductions of incidence, mortality and average disease severity index (DSI) were caused by the fungicides. Based on the results, the fungicides have different roles on seed germination and seedling growth under the pathogen conditions, of which mancozeb was the best choice in this study.
pathogen; carbendazim; mancozeb; thiophanate-methyl; seed pretreatment
Yu Bin-hua E-mail:yubh@lzu.edu.cn
10.11829/j.issn.1001-0629.2016-0009
2016-01-11 接受日期:2016-04-05
中国农业科学院科技创新工程(CAAS-ASTIP-IGR-2015-03);中央高校基本科研业务费专项资金项目(lzujbky-2014-77);公益性行业(农业) 科研专项经费项目(201303057);国家牧草产业技术体系(CARS-035)
俞斌华(1983-),男,甘肃兰州人,讲师,博士, 研究方向为植物病理学。E-mail:yubh@lzu.edu.cn
S482.2;S543+.904.3;Q945.34
A
1001-0629(2017)1-0059-08*
俞斌华,王文建,殷建鹏,王燕超,于丝雨,祁璐璐.杀菌剂对沙打旺种子萌发和幼苗生长的短期影响.草业科学,2017,34(1):59-66.
Yu B H,Wang W J,Yin J P,Wang Y C,Yu S Y,Qi L L.Short-term effect of fungicide on seed germination and seedling growth of standing milk vetch(Astragalusadsurgens).Pratacultural Science,2017,34(1):59-66.

