不同Ca2+养殖条件下三角帆蚌外套膜和内脏团组织细胞的钙含量及其对碳酸酐酶的影响
周子睿,施志仪,李文娟,尚 朝,尚 攀
(上海海洋大学水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
不同Ca2+养殖条件下三角帆蚌外套膜和内脏团组织细胞的钙含量及其对碳酸酐酶的影响
周子睿,施志仪,李文娟,尚 朝,尚 攀
(上海海洋大学水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
为了探讨三角帆蚌(Hyriopsis cumingii)在不同钙离子浓度养殖时,内脏团和外套膜细胞对环境中钙离子的吸收,以及细胞内钙离子浓度对碳酸酐酶的影响,本实验设定了5种钙离子的环境浓度(0 mM、0.5 mM、1.25 mM、2 mM、3 mM),采用流式细胞仪测定内脏团和外套膜组织细胞内钙离子含量,用荧光定量PCR检测α-碳酸酐酶基因(HcCA)表达,并用乙酸对硝基苯酯的水解间接测定碳酸酐酶活性,以期能阐明环境中钙浓度对组织细胞钙含量的影响,和组织细胞内不同钙含量与碳酸酐酶基因表达和酶活性之间的关系。研究结果表明,在相同环境的钙离子浓度下,活体三角帆蚌的内脏团细胞中钙含量显著高于外套膜细胞(P<0.05),并且表明从0 mM到2 mM浓度,内脏团和外套膜细胞内的钙含量显著上升(P<0.05),在3 mM浓度时出现下降(P<0.05)。同时,细胞内Ca2+含量较低时,HcCA在内脏团和外套膜中的表达量均显著低于细胞内Ca2+含量较高组(P<0.05),但细胞内Ca2+荧光强度为8×104时达到饱和且开始下降,而HcCA的表达在细胞内Ca2+荧光强度为6×104已经最高,并开始下降。环境钙离子浓度在0mM、0.5mM时碳酸酐酶活性显著高于1.25 mM、2 mM、3 mM浓度组(P<0.05),而且1.25 mM、2 mM、3 mM浓度组间无显著差异(P>0.05),由此发现碳酸酐酶在0.5 mM钙离子浓度中活性较高但表达量却较低,而在1.25 mM和2 mM浓度中表达量高但活性较低,并且碳酸酐酶外套膜细胞酶活性在各浓度均显著高于内脏团细胞(P<0.05)。本研究为三角帆蚌水体最适养殖钙浓度提供了重要依据。
三角帆蚌;外套膜;内脏团;钙离子;碳酸酐酶
三角帆蚌(Hyriopsis cumingii)是我国最主要的淡水珍珠培育品种之一[1]。珍珠和贝壳主要成分均为CaCO3(占95%以上),Ca2+在维持正常生理功能的同时也承担着珍珠和贝壳相关的生物矿化的重要作用。因此,研究育珠贝钙离子相关的代谢特点对珍珠养殖产业具有非常重要的意义。目前对于贝类生物矿化及钙离子的代谢仍是贝类育珠的研究热点。
碳酸酐酶在贝类中广泛存在[2],在生物矿化中发挥着重要的作用[3-5]。碳酸酐酶主要通过催化CO2水解为HCO-3来参与矿化过程中CaCO3结晶的形成,参与了贝壳珍珠层和棱柱层的形成。另有一些研究表明,碳酸酐酶能够调节贝类外套膜中Ca2+的运输[6]。这些研究表明碳酸酐酶既参与了调控CaCO3结晶过程中的HCO-3产生,又参与了为结晶提供钙源的运输。在对合浦珠母贝(Pinctada fucata)的矿化研究中发现碳酸酐酶在外套膜组织中的活性与贝壳的形成有密切关系[7]。显然,碳酸酐酶研究对三角帆蚌珍珠形成有重大意义。
近年来,随着大型流式细胞仪以及相应流式细胞术的兴起,为在细胞层面研究钙离子的流动提供了比激光共聚焦显微镜法更加快速、简便、灵敏、成本低廉的方法[8]。通过荧光染料结合钙离子,在紫外光或可见光激发下使指示剂发出荧光,从而通过流式细胞仪快速检测荧光强度代表的钙离子浓度。钙离子荧光探针Fluo-4/AM是一种可以穿透细胞膜的染料,Fluo-4/AM穿透细胞膜进入细胞后被细胞内的酯酶剪切形成Fluo-4,从而被滞留在细胞内,Fluo-4若以游离配体形式存在时几乎是非荧光性的,但是当它与细胞内钙离子结合后可以产生较强的荧光,具有很强的专一性。该技术将更准确地分析细胞内钙离子的吸收和含量。该技术手段在其它高等生物中的应用已经成熟[9],但是对于贝类,特别是淡水珍珠贝,目前仍未见报道。本研究采用流式细胞术结合钙离子探针荧光标记细胞内钙离子,测定三角帆蚌内脏团和外套膜组织细胞钙离子含量,用RT-PCR定量法测定了α-碳酸酐酶(HcCA)的基因表达量和Western-Blot免疫印迹法测定蛋白含量,最后用乙酸对硝基苯酯在碳酸酐酶作用下的水解间接测定碳酸酐酶的活性,以期能阐明环境中钙浓度对组织细胞钙含量的影响,和组织细胞内不同钙含量与碳酸酐酶基因表达和酶活性之间的关系。
1 材料与方法
1.1 实验用蚌前处理
实验用三角帆蚌取自上海海洋大学浦东滨海养殖基地。200 ind蚌取回后进行内脏团与外套膜插核手术,插核手术使用的珠核经贝壳打磨而成。手术之前将珠核进行高压灭菌干燥。清洗实验蚌外壳泥土和藻类,插核前将其离水放置30~60 min。在每ind实验蚌的外套膜和内脏团靠近性腺前端部位分别插入直径为2.5 mm的珠核,并将制作好的外套膜小片贴在珠核上。取下U型架,插核手术完成。根据文献中的记载,以及本实验室对校园周围河道钙离子检测得到大致水体中钙离子浓度在0.7~1.1 mM范围内,因此将实验蚌平均分为五组养殖在钙离子浓度为0、0.5、1.25、2、3 mM的水体中,水温控制在24℃,每15 d换水一次,每5 d喂食黄豆浆10 mL·10 L-1,培养4个月。取样时取出珍珠,切下珍珠附近5 mm×5 mm×3 mm组织进行实验。
1.2 试剂与仪器
胰蛋白酶、抗生素、DMEM培养基均购置于上海生工公司;胎牛血清来自Gibco公司;Fluo-4/AM采用甲醇溶解后蒸馏水定容(上海翊圣公司);BAC试剂盒来自上海生工用于测定蛋白标曲以及样品蛋白含量;钙离子标准品用CaCl2· 2H2O配置成150 mM的母液加入水体中;用异丙醇溶解PMSF后加入RIP弱裂解液中裂解剪碎后的组织细胞,试剂购买自上海生工;RT-PCR定量试验中Trizol购自Invitrogen;使用M-MLV Reverse Transcriptase(Promega,北京)反转试剂盒反转录cDNA;定量体系中的SYBR Green Supermix为美国Bio-Rad公司生产;Western-Blot蛋白免疫印迹中的碳酸酐酶一抗(Anti-CAI兔抗)、二抗(HRP羊抗兔),GAPDH(兔抗)一抗、二抗(HRP羊抗兔)均购买自上海生工公司。实验主要使用的仪器有C6流式细胞仪(BD Biosciences)、分光光度计(Thermo)、恒温培养箱(上海博讯)、台式高速冷冻离心机5810R(Eppendorf)、酶标仪(Thermo)、蛋白电泳仪(Bio-Rad)、天能成像系统(天能科技上海公司)、iMageQuant Las 4000成像系统(通用电气)、PCR扩增仪(Bio-Rad)、半干转膜仪(Bio-Rad)等。
1.3 三角帆蚌细胞FLuo-4/AM钙离子探针孵育
从不同浓度体系蚌中取出外套膜内脏团组织各5份,清水冲洗后放入含PBS培养皿中,放入含75%的酒精中消毒30 s,依次放入抗生素浓度为2%、5%、10%,5%、2%的PBS中抑菌除菌,每个浓度10 min。在5 mL离心管中剪碎加入胰酶37℃水浴消化25min,15min后开始取酶液放入切片中观察消化情况,消化完成后震荡静置5 min取2 mL上清分装于2个1.5 mL离心管中(共10管,5管试验组,5管对照组)。加入含血清培养基终止消化后1 200 rpm离心3 min去上清,再用PBS洗涤3次。加入Fluo-4/AM溶液,覆盖细胞为准,震荡后37℃孵育30 min,加入PBS洗涤细胞3次,以充分除去染液。重悬细胞后在37℃培养箱孵育约30 min,以确保AM体在细胞内的完全去酯化作用。PBS溶液、胰酶消化液、孵育液均使用CaCl2调节溶液钙离子浓度与培养时水体一致。
1.4 流式细胞仪上样检测
上样前用DDH2O、1%84消毒液快速上样2 min以清洗流式细胞仪液态系统,在流式细胞仪中用488 mm激发,FLI-H荧光通道收集荧光信号,慢速收集104个细胞,每个样品上样前用枪吹打数次重悬细胞。
1.5 荧光定量PCR
将不同Ca2+浓度的外套膜和内脏团组织取1/2剪碎加入Trizol中匀浆(另外1/2用于免疫印迹实验和酶活力测定),进行总RNA提取。提取完毕后,用Nanodrop 2000C(Thermo Fisher Scientific,美国)分光光度仪检测其纯度和浓度,用1%琼脂糖凝胶电泳检测其完整性。按照MMLV Reverse Transcriptase的操作要求进行反转录实验,反转录成cDNA。
根据NCBI上公布的合浦珠母贝GAPDH基因(KM816643.1)和三角帆蚌HcCA基因(KF206121.1)序列设计定量引物[10](表1)。荧光定量采用CFX96 TouchTM Real-Time PCR Detection System平台进行实验。首先进行目的基因(HcCA)和内参基因(GAPDH)的标准曲线实验,然后进行目的基因的定量实验。反应体系为20μL,包括10μL的2×iQ TM SYBR Green Supermix(Bio-Rad,美国)、1.0μL cDNA、上下游引物各0.5μL和8.0μL dH2O。反应条件为95℃预变性1 min;95℃10 s,60℃15 s和72℃20 s,采集荧光40次,72℃7 min,反应终止,添加溶解曲线生成程序:95℃到60℃每降0.5℃(5 s)采集一次荧光。实验结束后,用溶解曲线分析产物专一性,结果用2-ΔΔCt法进行初步数据统计分析。实验结果中R值均大于0.9,相应的扩增效(E)均在95%~100%之间。
1.6 Western-Blot免疫印迹
1.6.1 组织中蛋白上清液的制备和浓度测定
将1.5中剩下1/2组织加入RIPA中匀浆,直至裂解液中组织块消失充分裂解后,12 000 rpm离心5 min,取上清。取部分上清蛋白用BCA蛋白浓度测定试剂盒测定蛋白浓度。将蛋白标准品稀释后到0.5 mg·mL-1,然后按照下表(表2)分装于96孔酶标板,用PBS缓冲液补齐至每孔20μL。再分别取待测蛋白质1μL和PBS缓冲液19μL混匀是总体积为20μL,将BCA试剂按照A液(50)∶B液(1)的比例配置BCA工作液向上述每个孔中加入200μL,在37℃反应30 min,在562 nm处测定吸光度,最后根据标准曲线计算待测样本蛋白浓度。
1.6.2 三角帆蚌HcCA抗体筛选
用HcCA蛋白序列在NCBI数据库中筛选比对,选择同源性最高的人类CAI作为一抗。
1.6.3 Western-Blot检测组织中HcCA的含量
按照天根聚丙烯酰胺凝胶试剂盒配置浓度为10%的分离胶和5%的浓缩胶,灌胶后将上样液和四倍体积5×上样缓冲液混合于100℃沸水中煮沸5 min,使蛋白变性,冰上骤冷,3 000转· min-1离心1 min。上样并加入6μL预染彩色蛋白Marker进行电泳,根据蛋白Marker,判断目标蛋白的位置,然后终止电泳。电泳结束后在水中撬胶,修胶后将胶浸泡于转移缓冲液中平衡15 min。根据胶的形状裁剪与胶形状大小一致的加厚滤纸及PVDF膜,PVDF于无水甲醇中浸15 s,随后在半干转印槽中按照“滤纸-膜-胶-滤纸”的顺序依次铺好,进行转膜(20 V、30 min)。转膜结束后取出PVDF膜,用TBS缓冲液全部冲洗PVDF膜,然后转移到已配好的封闭液中,在脱色摇床上室温摇晃封闭2 h。取出膜,于摇床上用TBST洗膜5min×3次,在孵育袋中加入封闭液稀释的HcCA抗体(1∶1 000)和GAPDH抗体(1∶2 000),4℃孵育过夜,用TBST洗膜5 min×3次,辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶2 000)和辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶2 000)室温孵育2 h。最后用TBST洗膜15 min×5次。膜于化学发光检测试剂(试剂A∶试剂B=1∶1)反应2 min,取出膜,甩去多余的液体,用保鲜膜包好PVDF膜,放入iMageQuant Las4000成像系统中曝光,成像。

表1 本实验中所用到的PCR引物序列Tab.1 Primer sequences for the PCR used in the present study

表2 蛋白标曲溶液配比表Tab.2 Standard protein solution ratio curve table
将成像系统中的图像使用Quantity one软件分析,比较HcCA蛋白与GAPDH蛋白条带光密度值。
1.7 三角帆蚌碳酸酐酶活力测定
从上述蛋白裂解液中取出少量作为酶液,随后在分光光度计中依次加入1.9mL 15mmol·L-1Tris-H2SO4缓冲液(pH 7.6),0.1 mL的酶液和1 mL 3 mmol·L-1的乙酸对硝基苯酯,室温反应5 min后在348 nm处用分光光度计测定其吸光值,以不加酶液为空白对照。酶活定义为:在室温下,每min水解1μmol乙酸对硝基苯酯所需的酶量为一个酶活单位。
公式为:酶活力(U·gprot-1)=(测定乙酸对硝基苯酯体积-标准乙酸对硝基苯酯体积)×3/5 ÷样品中总蛋白含量
准确称取63 mg乙酸对硝基苯酯溶于10 mL甲醇中,将溶液以1∶10.6的比例溶于蒸馏水中制成3 mmol·L-1母液在酶标仪按下表分别加入试剂,按下表(表3)分别加入试剂,混合均匀,室温下于348 nm处比色,用相同体积的蒸馏水为空白对照。
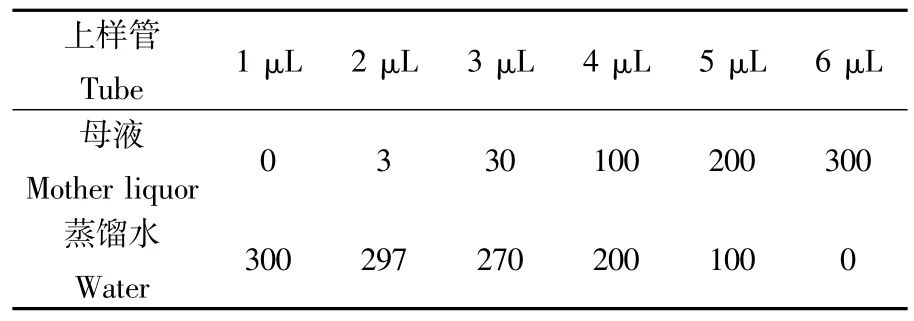
表3 乙酸对硝基苯酯标曲溶液配比表Tab.3 Ratio of acetic acid to nitrobenzene ester
1.8 统计学方法
所有数据采用SPSS软件ANOVA单因子方差分析显著性,使用Lsd检验,显著水平为P<0.05。
2 结果与分析
2.1 细胞内钙离子测定及水环境钙离子浓度对细胞内钙离子的影响
2.1.1 流式细胞仪数据设门分析
由于三角帆蚌的开放式循环系统,抗生素不能完全取出细菌,在分析流式数据前应先根据细胞分群设门以排除细菌及消化过度的细胞碎片影响(图1)。设门完成后使用FL1-A对FL1-H作图,再次设门以排除未完全消化的非单个细胞(图2)。最后用FL1-H对Count作图统计钙离子含量,以平均荧光强度代表细胞内钙离子浓度(图3)。

图1 排除细菌以及细胞碎片设门Fig.1 Set of removing bacteria and cell debris
2.1.2 不同环境钙离子浓度对外套膜细胞及内脏团细胞内钙离子荧光强度的影响
流式细胞仪数据统计发现,外套膜细胞内钙离子荧光强度在0 mM到2 mM,浓度均呈明显上升趋势(P<0.05),如图4所示细胞内钙离子荧光强度在2 mM浓度达到顶峰,而在3 mM浓度出现显著下降(P<0.05)。从0 mM到2 mM浓度,荧光强度总体呈上升趋势可能是因为受到水体中总的钙离子含量影响,3 mM浓度可能由于水体内钙离子含量过高引起细胞保护机制,抑制了钙离子的进入。而内脏团细胞中钙离子荧光强度随浓度变化趋势与外套膜细胞相同,但整体荧光强度大于外套膜细胞。环境钙离子浓度为0 mM时依然有荧光,钙的来源可能是豆浆投放。另外,外套膜细胞平均荧光强度均低于内脏团细胞,差异显著(P<0.05)。
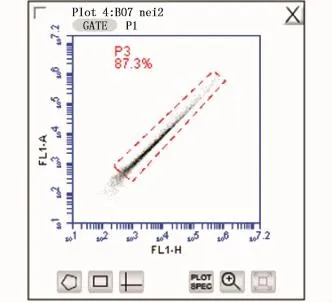
图2 排除非单一细胞设门Fig.2 Set for exclusion of non single cell

图3 荧光强度Fig.3 Fluorescence intensity
2.2 HcCA在不同环境钙离子下的基因相对表达和蛋白相对表达
2.2.1 HcCA在不同环境钙离子下的基因表达量
通过实时荧光定量PCR法检测HcCA基因在不同浓度Ca2+中的相对表达模式(图5)。结果表明,HcCA基因在实验中各个浓度均有表达,但0 mM与0.5 mM实验组表达量显著低于1.25、2、3 mM浓度表达量(除3 mM组内脏团表达量,P<0.05),但在同组织比较中(外套膜、内脏团)这两个浓度组差异不显著(P>0.05)。在1.25、2、3 mM浓度组中,浓度呈下降趋势,但1.25 mM组与2mM组差异不显著(P>0.05),与3mM组不管是内脏团组织还是外套膜组织表达量都显著下降,差异显著(P<0.05)。同浓度下不同组织进行比较,发现有3 mM浓度试验组外套膜与内脏团表达量差异显著(P<0.05),其它浓度组差异均不显著(P>0.05)。

图4 三角帆蚌外套膜和内脏团细胞内钙离子浓度Fig.4 Ca2+concentration in the mantle and visceral mass of mussel shell

图5 三角帆蚌HcCA基因在各个Ca2+浓度中的表达Fig.5 Expression of H.cumingii HcCA gene in various Ca2+concentrations
2.2.2 Western blot实验检测HcCA蛋白的表达
通过Western blot实验检测HcCA蛋白的表达情况,实验中条带大小结果如图6所示,HcCA表达水平在1.25、2 mM处理组明显强于其它3个处理组,0、0.5 mM处理组条带明显弱于其它试验组。所有浓度处理组HcCA与GAPDH光密度比如表4所示。

图6 三角帆蚌HcCA在各个Ca2+浓度相对表达量Fig.6 Relative expression of Hyriopsis cumingii HcCA protein in different Ca2+concentrations

表4 HcCA与GAPDH的蛋白光密度比Tab.4 Protein light density ratio of GAPDH and HcCA
2.3 不同钙离子浓度下对三角帆蚌碳酸酐酶活性影响
以吸光值为横坐标,乙酸对硝基苯酯的体积为纵坐标,做出标准曲线R2=0.998,以吸光值为横坐标,标准蛋白含量为纵坐标,绘制标准曲线做出标准曲线R2=0.996,把数据带入酶活性计算公式得出各浓度外套膜内脏团组织酶活性。不同钙离子浓度培养下对三角帆蚌碳酸酐酶活性影响可以由图7看出,外套膜及内脏团中的碳酸酐酶活性在环境钙离子浓度为0~0.5 mM时,均显著高于1.25~3 mM环境浓度的活性(P<0.05),并且1.25、2、3 mM环境浓度的碳酸酐酶活性是不显著的(P>0.05)。而外套膜碳酸酐酶活性在每个浓度都比内脏团细胞高,差异显著(P<0.05),与外套膜内脏团细胞内钙离子浓度情况相反。

图7 不同钙离子浓度三角帆蚌外套膜和内脏团的碳酸酐酶活性Fig.7 Activity of carbonic anhydrase of different Ca2+concentrations in Hyriopsis cumingii mantle and visceral mass
3 讨论
贝壳和珍珠都是贝类进行钙代谢后最终以碳酸钙结晶形式沉积而成的[11]。环境Ca2+浓度对三角帆蚌的生长和珍珠质的沉积具有十分重要的影响。因此,实时测定细胞内钙离子浓度的动态变化,是非常重要的。然而目前己有的研究结果对三角帆蚌养殖适宜的环境钙离子浓度仍存在较大争议,对细胞内的钙离子含量研究也鲜有报道。本研究发现外套膜与内脏团细胞内钙离子含量在0 mM到2 mM浓度均呈显著上升趋势(P<0.05),细胞内钙离子含量在2 mM浓度达到顶峰,而在3 mM浓度时出现快速下降,差异显著(P<0.05)。任岗[10]的研究表明2龄三角帆蚌不管是从体重增重还是从珍珠质沉积方面看水中钙离子浓度在1.25~1.75mM是最适浓度,有利于三角帆蚌生长,本实验发现当环境钙离子浓度达到2 mM时,细胞内钙离子接近饱和,在3 mM浓度出现细胞内钙离子大幅下降,这可能是任岗研究结果的原因之一。而从外套膜与内脏团细胞内钙离子浓度相互比较来看,呈现外套膜胞内钙离子浓度小于内脏团,而李文娟等[12]研究离体细胞培养后发现外套膜细胞对钙离子吸收远高于内脏团细胞,这可能是活体内与离体后所处环境造成细胞对钙吸收的影响,使得钙流入细胞量有所转变。
碳酸酐酶(Carbonic anhydrase,CA)是一种细胞内催化酶,是目前己知的催化反应速率最快的酶之一。单纯的CO2水合过程是十分缓慢的,一级反应速率常数仅为5×10-2·s-1,但在碳酸酐酶催化下,速率常数最高可提高到1.6×106· s-1[13-14],碳酸酐酶可逆催化CO2生成碳酸氢盐的水合反应,在生物体内承担着多样的生理学功能,具有高度的生物学意义。本研究表明,当环境Ca2+处于0 mM到0.5 mM浓度较低水平时,细胞内Ca2+含量受环境影响而表现为较低(荧光强度低于2×104)时,HcCA在内脏团和外套膜中的表达量也较低,均显著低于细胞内Ca2+含量较高的组(P<0.05),这说明过低的细胞内钙离子浓度会影响HcCA在细胞内的表达。当环境Ca2+浓度达到1.25mM浓度时,此时细胞内Ca2+荧光强度达到了5×104~6×104,HcCA表达量达到最高值(P<0.05),随着环境浓度继续上升到2 mM,此时细胞内Ca2+含量继续上升(荧光强度达到6×104~8×104)并达到了饱和,但发现HcCA基因及蛋白表达量并未随着继续上升,反而呈下降趋势,但差异不明显(P>0.05)。当环境浓度达到3 mM,此时细胞内Ca2+荧光强度已经下降到2×104(外套膜细胞)、2×106(内脏团细胞),HcCA表达量也随之下降(P<0.05),并出现了一个显著的不同组织间差异(P<0.05),这可能暗示着在细胞内Ca2+达到饱和前,三角帆蚌机体中的内脏团与外套膜间可能存在某种机制平衡HcCA的表达,具体原因仍需进一步研究。从总体趋势看,细胞Ca2+含量与HcCA的基因表达、HcCA蛋白表达量在0~2 mM存在上升趋势,但细胞内Ca2+荧光强度在8×104时达到最大值,转而开始下降;而HcCA的表达在细胞内Ca2+荧光强度6×104时已经最高,并随之开始下降。
本研究发现碳酸酐酶活性在1.25~3 mM钙离子浓度时显著低于0~0.5 mM浓度(P<0.05),这与任岗[10]发现Ca2+-ATPase的酶活性在钙离子浓度1~2 mM时显著低于其它钙离子浓度处理组的结论有相似性。碳酸酐酶是一种催化CO2水解可逆反应的Zn2+结合金属酶(CO2+H2O←→HCO-3+H+)。研究表明,CA参与了生物机体中的多种生理过程,如呼吸、pH平衡、离子运输、光合作用、脂肪酸和氨基酸的合成以及生物矿化等[15]催化CO2水合的碳酸酐酶是两种离子的中心,因为它提供空泡型氢离子H+-ATPase,Ca2+/H+交换产生的能量是Ca2+吸收的电压依赖性钙通道,而CO2水合提供HCO-3内源。因此,水化内源性CO2形成HCO-3钙化而氢离子被排出体外,从而导致Ca2+的持续吸收[6]。三角帆蚌碳酸酐酶与Ca2+-ATPase的活性一致性恰好证明了EBANKS等[6]发现的这一条钙离子吸收通道。而外套膜中碳酸酐酶活性普遍高于内脏团说明外套膜细胞的钙离子交换要多于内脏团细胞。但我们从HcCA表达发现,在0、0.5 mM组中非常低,有可能是较低的细胞内Ca2+能激发HcCA的酶活性,从而形成了一种Ca2+含量较低时,酶表达量较低但酶活力较高;而Ca2+含量较高时,酶活力低但酶表达量高的补充机制。这仍需进一步研究。
本研究采用高灵敏的Fluo-4/AM结合流式细胞术检测三角帆蚌内脏团和外套膜细胞的钙含量在国内尚属首次,为研究三角帆蚌体内细胞钙离子贮存提供了新的方法。
[1] 张根芳,方爱萍.浙江淡水珍珠产业化发展思考[J].中国渔业经济,2003:7-8.ZHANG G F,FANG A P.Thoughts on the industrialization of fresh water pearl in Zhejiang[J].Chinese Fisheries Economics,2003:7-8.
[2] NIELSEN S A,FRIEDEN E.Carbonic anhydrase activity in molluscs[J].Comparative Biochemistry&Physiology B Comparative Biochemistry,1972(41):461-468.
[3] MIYAMOTO H,MIYASHITA T,OKUSHIMA M,et al.A carbonic anhydrase from the nacreous layer in oyster pearls[J].Proceedings of the National Academy of Sciences of the United States of America,1996(93):9657-9660.
[4] VOIGT O,ADAMSKI M,SLUZEK K,et al.Calcareous sponge genomes reveal complex evolution of αcarbonic anhydrases and two key biomineralization enzymes[J].Bmc Evolutionary Biology,2014(14):230.
[5] NORIZUKI M,SAMATA T.Distribution and function of the nacrein-related proteins inferred from structural analysi[J].Marine Biotechnology,2008(10):234-241.
[6] EBANKS S C,O′DONNELL M J,MARTIN G.Characteriza-tion of mechanisms for Ca2+andacquisition for shell formation in embryos of the freshwater common pond snail Lymnaea stagnalis[J].Annals of Nuclear Energy,2010(213):4092-4098.
[7] ROY NL,MARIE B,GAUME B,et al.Identification of Two Carbonic Anhydrases in the Mantle of the European Abalone Haliotis tuberculata(Gastropoda,Haliotidae):Phylogenetic Implications[J].Journal of Experimental Zoology Part B Molecular&Developmental Evolution,2012(318):353-367.
[8] 高 纯,吴剑宏,冯永东,等.多种流式细胞术分选凋亡细胞后共聚焦显微镜分析[J].华中科技大学学报(医学版),2005(34):486-489.GAO C,WU J H,FENG Y D,et al.Analysis of apoptosis cells by using multiple flow cytometry in the confocal microscopy[J].Acta Medicinae Universitatis Scientiae Et Technologiae Huazhong,2005(34):486-489.
[9] GEEK R,BROWNK W,BISHOPS J,et al.Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes[J].Acta Crystallographica,2007(63):586-589.
[10] 任 岗.环境钙离子浓度影响三角帆蚌珍珠质形成的生物矿化机理研究[D].杭州:浙江大学,2013.REN G.Study on the mechanism of the effect of environmental calcium concentration on the formation of pearl in the Pearl Mussel[D].Hangzhou:Zhejiang University,2013.
[11] 刘士力,李家乐,张根芳,等.三角帆蚌稚蚌形态发育与生长特性[J].水产学报,2009(33):604-09.LIU SL,LIJ L,ZHANG G F,et al.The juvenile of Hyriopsis cumingii morphological development and growth characteristics[J].Journal of Fisheries of China,2009(33):604-609.
[12] 李文娟,施志仪,郝莹莹,等.应用激光共聚焦显微技术研究Ca2+在三角帆蚌组织内的积累与分布[J].水产学报,2011(35):214-220.LIW J,SHI Z Y,HAO Y Y,et al.Study on the accumulation and distribution of Ca2+in the tissue of the triangular sail by laser scanning confocal microscopy[J].Journal of Fisheries of China,2011(35):214-220.
[13] CHU-YOUNG K,WHITTINGTON D A,CHANG J S,et al.Structural aspects of isozyme selectivity in the binding of inhibitors to carbonic anhydrases II and IV[J].Journal of Medicinal Chemistry,2002(45):888-893.
[14] SUN M K,ALKON D L.Carbonic anhydrase gating of attention:memory therapy and enhancement[J].Trends in Pharmacological Sciences,2002(23):83-89.
[15] HENRY R P.Multiple roles of carbonic anhydrase in cellular transport and metabolism[J].Annual Review of Physiology,1996(58):523-538.
Calcium content of mantle and visceral tissue cells from Hyriopsis cumingii and its effect on carbonic anhydrase in different Ca2+culture conditions
ZHOU Zi-rui,SHI Zhi-yi,LI Wen-juan,SHANG Chao,SHANG Pan
(Key Laboratory of Freshwater Aquatic Genetic Resources of Ministry of Agriculture,College of Fisheries and Life Science,Shanghai Ocen University,Shanghai 201306)
To investigate visceral mass and mantle cell absorption of Ca2+in Hyriopsis cumingii cultured in different Ca2+concentrations,and the effect of intracellular Ca2+concentrations on carbonic anhydrase,five kinds of Ca2+concentrations were set for experiments(0 mM,0.5 mM,1.25 mM,2 mM,3 mM).The paper used flow cytometry for the determination of content of calcium in the visceral mass and mantle tissue cells,expressed by fluorescence quantitative PCR detection of alpha-carbonic anhydrase gene HcCA,and with acetic acid hydrolysis of p-nitrophenyl for indirect determination of carbonic anhydrase activity to clarify the effect,between different calcium content and carbonic anhydrase gene expression and enzyme activity in cells and tissues.Results showed that in the same environment of Ca2+concentration,calcium content in the cells of visceral mass was significantly higher than that in mantle cells(P<0.05),and from 0 mM to 2 mM concentrations intracellular calcium content increased significantly(P<0.05).In 3 mM concentration,calcium content decreased(P<0.05).At the same time,the expression of HcCA was significantly lower in high Ca2+concentration group(P<0.05).When the intracellular Ca2+fluorescence intensity reached 8× 104,calcium content reached saturation and began to decline.The expression of Ca2+in the cells with HcCA fluorescence intensity of 6×104reached the highest and began to decrease.With Ca2+concentration of 0 mM,0.5 mM,carbonic anhydrase activity was significantly higher than that of 1.25 mM,2 mM,3 mM concentration groups(P<0.05)and there was no significant difference between 1.25 mM,2 mM,3 mM concentrations groups(P>0.05).Therefore,we found that carbonic anhydrase in Ca2+concentration of0.5 mM showed high activity but the expression was relatively low,while the expression in 1.25 mM and 2 mM concentration was in high volume but low activity and carbonic anhydrase mantle cell enzyme activities in each concentration were significantly higher than those of visceral mass cells(P<0.05).This study provides an important basis for the optimal cultured concentration of calcium in freshwater mussel.
Hyriopsis cumingii;mantle;visceral mass;calcium ion;carbonic anhydrase
Q 782
:A
1004-2490(2017)01-0076-09
2016-04-05
国家自然科学基金(31201991);教育部博士点基金(20123104120003);上海市优青项目(ssc11004)
周子睿(1991-),男,湖南人,在读理学硕士,生物学方向。Tel:021-61900437,E-mail:zzr_19910518@163.com
施志仪,教授。Tel:021-61900437,E-mail:zyshi@shou.edu.cn

