间歇性低氧与规律运动对中老龄果蝇心脏泵血能力及生活质量的影响
王卉 郑澜 文登台 奉悦 倪柳 张民
湖南师范大学体适能与运动康复湖南省重点实验室(湖南 长沙 410012)
间歇性低氧与规律运动对中老龄果蝇心脏泵血能力及生活质量的影响
王卉 郑澜 文登台 奉悦 倪柳 张民
湖南师范大学体适能与运动康复湖南省重点实验室(湖南 长沙 410012)
目的:探讨适宜的规律运动与间歇性低氧对中老龄果蝇心脏泵血功能与生活质量的影响。方法:通过扩大培养收集8 h内羽化的W1118品系处女蝇4500只,随机分为三个低氧年龄段(n=1500):青年低氧组(1~2周)、中年低氧组(3~4周)与老年低氧组(5~6周)。低氧结束后利用心力衰竭模型筛选出最佳低氧年龄段与低氧持续时间。再通过扩大培养收集8 h内羽化的W1118品系处女蝇1200只,随机分为常氧安静组(NC组)、常氧运动组(NE组)、低氧安静组(HC组)和低氧运动组(HE组)。HC与HE组果蝇采用6%O2与94%N2的混合气体,每天低氧6 h,NE与HE组果蝇每天运动2.5 h,低氧与运动干预结束的第二天进行心脏泵血能力与生活质量相关指标的检测。结果:(1)果蝇的心力衰竭率随年龄的增长而上升,中年组及老年组果蝇心力衰竭率随低氧暴露时间的延长逐渐下降。(2)NE组果蝇心脏舒张直径显著高于NC组与HC组(P<0.05,P<0.01),HC组显著低于NC组与HE组(P<0.05,P<0.01);HC组果蝇收缩直径显著低于NC组与HE组(P<0.05,P<0.01);NC组果蝇心脏射血分数显著低于NE组(P<0.01)。(3)NE组、HC组与HE组果蝇攀爬速度均显著高于NC组(P<0.05,P<0.01)。(4)HC组及HE组果蝇夜晚睡眠总时间显著长于NC组(P<0.05,P<0.01),HC组果蝇夜晚睡眠段数显著小于NC组(P<0.01)。(5)NE组果蝇活动总量显著高于其他三组(P<0.05),而HC组显著低于NC组(P<0.05),NE组果蝇清醒睡眠时间比以及单位活动时活动量均显著高于其他三组(P<0.05),HC组果蝇单位活动时活动量显著高于NC组与HE组果蝇(P<0.05),其日间活动时间显著低于NC组。(6)HC组果蝇最高寿命显著高于NC组与NE组(P<0.01)。HC组果蝇平均寿命显著高于其他三组(P<0.01),HE组果蝇平均寿命显著高于NC组与NE组(P<0.05)。结论:规律运动与间歇性低氧均能增强中老龄果蝇的攀爬能力与日常活动能力,但与规律运动能增强中老龄果蝇心脏泵血能力不同,间歇性低氧能减小其心管直径、增强夜间睡眠质量、延长寿命,而低氧联合运动能提高中老龄果蝇的攀爬能力、延长其平均寿命和夜间睡眠时间。
间歇性低氧;规律运动;心力衰竭模型;心脏泵血能力;生活质量
充足的氧气供应对维持机体各组织器官的正常生理活动十分重要,尤其是对于能量需求大的心脏而言。但在很多生理病理情况下,组织缺氧的现象时有发生,而缺氧是导致心脏患病的重要因素,其引起的心脏疾患在各种心脏疾病中居首位[1]。因此,通过增加心脏对缺血、缺氧的耐受性从而达到心脏保护的目的一直是医学和运动科学研究关注的热点之一。
间歇性低氧(intermittent hypoxia,IH)是指一定时间间断地暴露于低氧环境,而其余时间处于常氧环境,从而增强机体对低氧刺激导致的机体低氧损伤的耐受力,而不会对机体产生严重的不可逆损伤[2],其重要特点是重复或周期性的常氧与低氧交替。近年研究[3,4]揭示了心脏对IH的应答呈时间依赖性,即IH对心脏的效应与低氧时间的持续和变化情况有关,这很好地解释了低氧对机体产生损伤[5,6]和保护[7,8]两种相反作用的原因。因此,低氧刺激是提供益处还是造成损伤主要取决于低氧方案的选择。
果蝇已经被证明是强大的人类遗传疾病模式生物[9],其心脏功能的衰退和人类的心脏具有高度相似性[10]。此外,果蝇的气管及其分支作为呼吸系统输送氧气的管道[11]这一特殊结构,能通过改变环境氧含量直接作用于果蝇机体内环境而便于进行低氧的研究。适宜的运动能延缓心脏结构和功能的退行性变化[12],使果蝇心肌收缩功能增强[13],心舒张期容量增加[14]。而不同的低氧方案会对机体产生“保护”和“损伤”两种相互矛盾的作用。本研究旨在通过心力衰竭模型筛选出果蝇最适低氧方案,在低氧产生保护作用的基础上研究适宜的规律运动与间歇性低氧对果蝇心脏泵血功能与生活质量的影响。
1 材料与方法
1.1 果蝇的品系与分组
采用野生型W1118品系果蝇(由湖南师范大学心脏发育研究中心馈赠,体适能与运动康复湖南省重点实验室保存),扩大培养后收集8 h内羽化处女蝇4500只,随机分为3组:青年低氧组(YH组)、中年低氧组(MH组)和老年低氧组(OH组),采用标准培养基饲养[12],1500只/组,20只/管,放置于标准培养箱(恒温25℃、恒湿50%、12小时昼/夜循环)内。这3组果蝇用于心力衰竭模型的测试,以此结果确定最佳低氧年龄。再通过扩大培养收集8 h内羽化的雌性果蝇1200只,随机分为4组:空白对照组(NC组)、常氧运动组(NE组)、低氧安静组(HC组)和低氧运动组(HE组),300只/组,20只/管,放置于标准培养箱、用标准培养基饲养,于此前通过心力衰竭模型确定的最佳低氧年龄进行低氧与运动训练。
1.2 果蝇低氧及运动方案
1.2.1 心力衰竭组低氧方案
为了确定最佳低氧年龄段与低氧持续天数,我们将MH组与OH组分别划分为15个小组(编号0至14)、YH划分为14个小组(编号0至13,因为果蝇羽化第1天即1天龄时不进行低氧训练),0组为对照组,其余各组均采用6%氧气与94%氮气的混合气体分别于第2天龄(青年)、15天龄(中年)和29天龄(老年)开始进行低氧,低氧装置如图1,每天低氧6 h,各组果蝇低氧持续天数为所在组数的数值大小。YH组、MH组、OH组所有果蝇分别于第15天龄、第29天龄、第43天龄(即各组分别低氧2周后)进行心力衰竭模型的测试,具体低氧方案见表1。
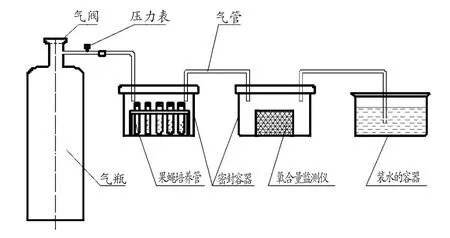
图1 果蝇低氧装置

表1 心力衰竭组果蝇低氧时间段(单位:天龄)
1.2.2 间歇性低氧与规律运动方案
HC组与HE组采用6%氧气与94%氮气的混合气体进行低氧处理,每组果蝇自15天龄至42天龄进行低氧(由心力衰竭模型确定),每周低氧5天,每天于14:00~20:00时间段内进行低氧,各组果蝇于全部低氧方案结束的第2天(即43天龄)进行各项指标的测试。
NE组与HE组采用本小组自主研发的果蝇运动训练装置(专利号为ZL201420707075.9)进行规律运动,运动装置电机转速为24 s/r,每组果蝇自15天龄至42天龄进行运动训练(与低氧年龄段相同),每天训练2.5 h[12],训练时间为9:30~12:00,每周运动5天,各组果蝇于全部运动训练方案结束的第2天(即43天龄)进行各项指标的测试。
1.3 指标检测
1.3.1 果蝇心力衰竭率检测
每组果蝇随机选取60只,按照Robert[15]实验小组的操作方法,利用脉冲电激仪(PHIPPS&BIRD,美国)对每只果蝇进行20 s循环交流电刺激以改变果蝇心跳节律,然后利用体视-冷光源显微镜观察电刺激结束后果蝇心跳正常节律的恢复情况,若果蝇心跳恢复有节律的收缩和跳动则为正常,若出现心跳停止或者纤维性震颤[16](表现为剧烈收缩、回旋,或缓慢蠕动等不正常行为)而1 min内不能恢复正常的,视为心力衰竭[17]。统计各组果蝇电刺激后恢复正常心跳节律的比例,得出各组果蝇心力衰竭率。
1.3.2 M--mmooddee检测果蝇心脏泵血功能
每组果蝇随机取40只,用三酰胺麻醉剂(FlyN-apTM)麻醉约5 min。将果蝇腹部朝上、头尾顺序一致地整齐粘贴于底部涂有凡士林的玻璃皿中,倒入氧化的果蝇人工血淋巴[18],在体视显微镜下进行解剖,剪去其头部与胸部、腹部上表皮,去除腹部内脂肪与脏器,暴露心管。采用高速EM-CCD数码摄像机(Hamamatsu)进行果蝇心动视频的拍摄,帧数为130帧/s,每只果蝇拍摄时长为20 s。采用半自动光学心跳分析软件(Semi-automatic Optical Heartbeat Analysis software,SOHA)分析果蝇心动视频,得到反映果蝇心脏泵血功能的各项指标[19]。
1.3.3 DDAAMMSS监测果蝇活动行为
1.3.3.1 果蝇活动行为监测装置
果蝇活动行为监测装置包括果蝇活动监测系统(Drosophila Activity Monitoring System,DAMS)和数据采集系统(Data Acquisition System,DAS)。DAMS由运动监视器(Drosophila Activity Monitor)、环境监测器(Drosophila Environment Monitor)、电源和记录软件构成。每个运动监视器(共3块)可分别监测32只果蝇的活动情况,将每只果蝇单独放在各自特制的小管(由一种透明的碳聚酸脂(polycarbonate)塑料制成,它的任何一个点都能被光穿透)中,小管一端放置标准培养基并用配套橡皮套封闭,另一端由海绵塞封闭。将小管水平嵌入运动监视器的监测孔中,活跃的果蝇会在管子中来回走动,打断垂直穿过管子的红外光束,这一行为将会被作为运动参数记录下来。记录软件可以连续记录数天甚至数周每只果蝇每个特定周期(可在1秒到1小时之间设置)内的活动情况,这种详细的日常活动记录不但可以体现果蝇昼/夜活动行为情况,还可提示果蝇昼/夜休息与睡眠规律。
环境监视器可持续测量周围空气的湿度和温度,以及监视器表面光的亮度。在整个测量期间,每个瞬时值都会被记录下来,包括最小值、平均值和最大值,以提供瞬时和长时程的果蝇活动行为监测过程中的环境参数,并定时上传至电脑。
1.3.3.2 果蝇活动行为监测方法
各组果蝇随机选取32只,于全部低氧或运动训练结束的第2天(即43天龄)15点以前放入果蝇活动监测系统,保持环境温度25℃,湿度50%,12小时昼/夜循环(每天7点开灯,19点关灯),记录每只果蝇每分钟的活动次数。通常让果蝇在DAMS中预先适应至少12小时,自第二天早上7点开始,其后的48 h所采集的数据被用作果蝇活动行为分析。在DAMS中,果蝇任意一次停止活动时间大于或等于5 min(即在连续至少5 min的时间内果蝇活动次数为0),则被定义为睡眠状态[13],睡眠状态以外的时间为清醒状态,包括停止活动时间小于5 min的休息状态和活动状态。因此,我们可以通过果蝇活动监测记录来统计各组果蝇昼/夜平均睡眠总时间(total sleep duration)、清醒总时间(total waking duration)、休息时间(resting duration)、活动时间(active duration)、睡眠段数(sleep bout number,即醒来后再次入睡的次数)、平均持续睡眠时长(average sleep episode duration)、活动总量(total time of activity)、清醒时间睡眠时间比、单位活动时间活动量(活动总次数与活动时间之比)等指标[20]。
1.3.4 果蝇攀爬能力的检测
各组果蝇随机选取100只,于全部低氧或运动训练结束的第2天(即43天龄)17点至18点之间进行攀爬能力的检测。将果蝇放入长20 cm、直径2.8 cm的透明玻璃管中,每管20只,玻璃管上下各塞入长1 cm的海绵塞,避免果蝇震落时的机械损伤,中间预留18 cm用以供果蝇进行攀爬运动。利用果蝇的负趋地性[21]检测各组果蝇全部被机械性震落至玻璃管底部后,15 s内每只果蝇攀爬的垂直高度,重复震落5次,计算各组中每只果蝇15 s内的平均攀爬速度(攀爬速度=攀爬高度/攀爬时间)。
1.3.5 生命周期检测
每组果蝇各取200只,从第43天龄(全部运动与低氧方案结束)开始,于每天17点至18点之间观察并记录果蝇死亡数,直至各组果蝇全部死亡为止。全部果蝇寿命的算术平均数为果蝇的平均寿命[22]。统计各组果蝇平均寿命与最高寿命。
1.5 统计学处理
本实验各组间采用SPSS19.0进行双因素方差分析(全因子)检验各指标中低氧与运动有无交互作用,若存在交互作用,并且方差齐性时,各组间采用单因素方差分析(Scheffe)进行多重比较;若低氧与运动之间不存在交互作用,则分析两者间的主效应,方差齐性时各组间采用单变量中观测均值的两两比较(Scheffe)进行检验。两种情况下方差不齐时均采用非参数检验的两个独立样本检验(K-S)进行比较,实验数据用平均数±标准差表示,显著性水平取α=0.05。
2 结果
2.1 果蝇心力衰竭率检测结果
果蝇心力衰竭率检测是利用外部电刺激增加果蝇心脏收缩频率,引起果蝇心脏纤维性震颤样节律,观察撤去外部电刺激后,果蝇心跳节律的恢复情况,评价不同组别果蝇心脏受到外部刺激后正常心跳节律的恢复能力。由表2、图2中青年、中年和老年组的0组可知,随着年龄的增长,果蝇心力衰竭发生率逐渐上升。青年组果蝇心力衰竭率随着低氧时间的延长逐渐增加,而中年组和老年组果蝇心力衰竭率随着低氧时间的延长而逐渐降低。
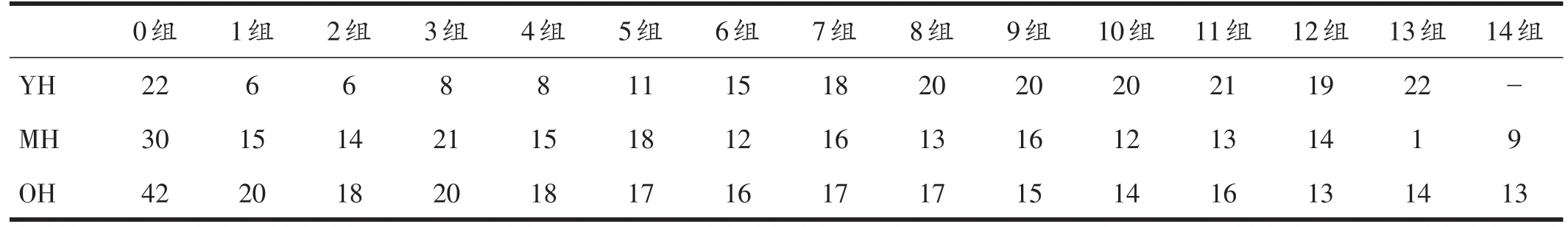
表2 不同年龄组果蝇心力衰竭发生率随低氧持续时间变化结果(单位:%)
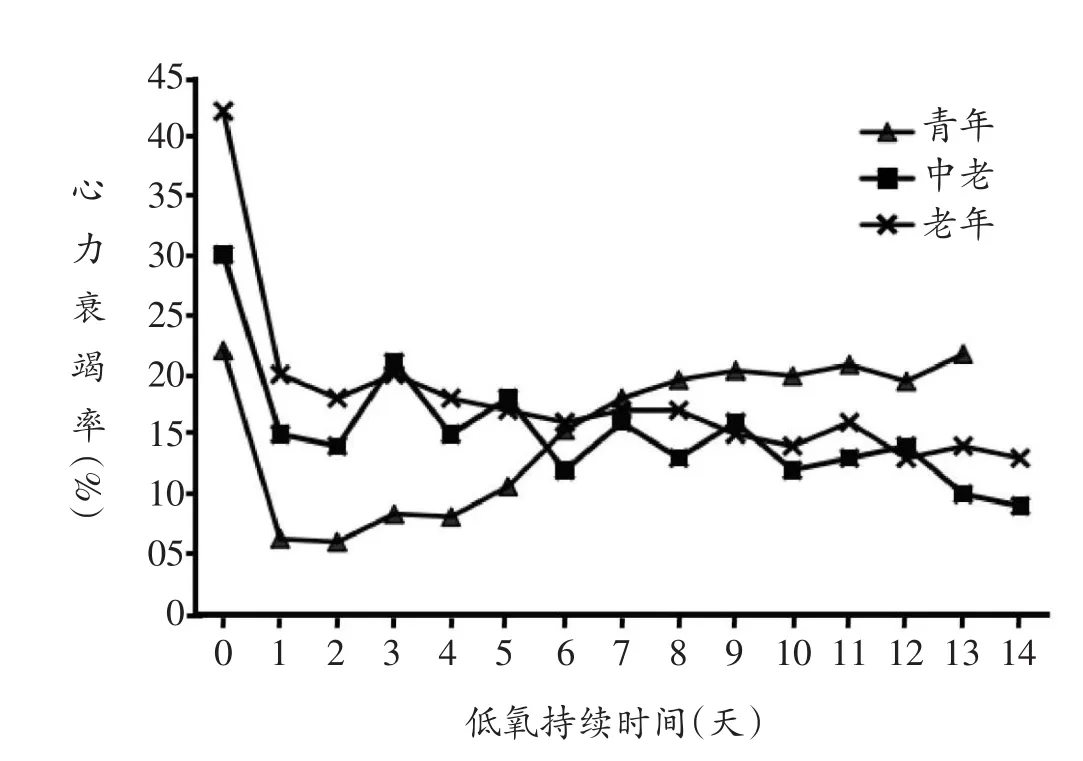
图2 不同年龄组果蝇心力衰竭发生率随低氧持续时间变化图
2.2 果蝇心脏泵血功能检测结果
果蝇的心脏是一个线形的管状结构,它横向螺旋排列的心肌纤维通过收缩或舒张来改变心管的直径,从而射出或回流血淋巴[23],通过M-mode心动图可定量测得各组果蝇心脏射血分数等评价果蝇心脏泵血功能的指标(如表3、图3)。NE组果蝇心脏舒张直径显著高于NC组(P<0.05)和HC组(P<0.01),HC组显著低于NC组(P<0.05)和HE组(P<0.01)。HC组果蝇收缩直径显著低于NC组(P<0.05)和HE组(P<0.01)。NC组果蝇心脏射血分数显著低于NE组(P<0.01)。对于HE组果蝇来说,运动与低氧对其心脏舒张功能均有显著影响、对心脏收缩功能具有交互作用,而运动对果蝇心脏射血能力的影响起主要作用。
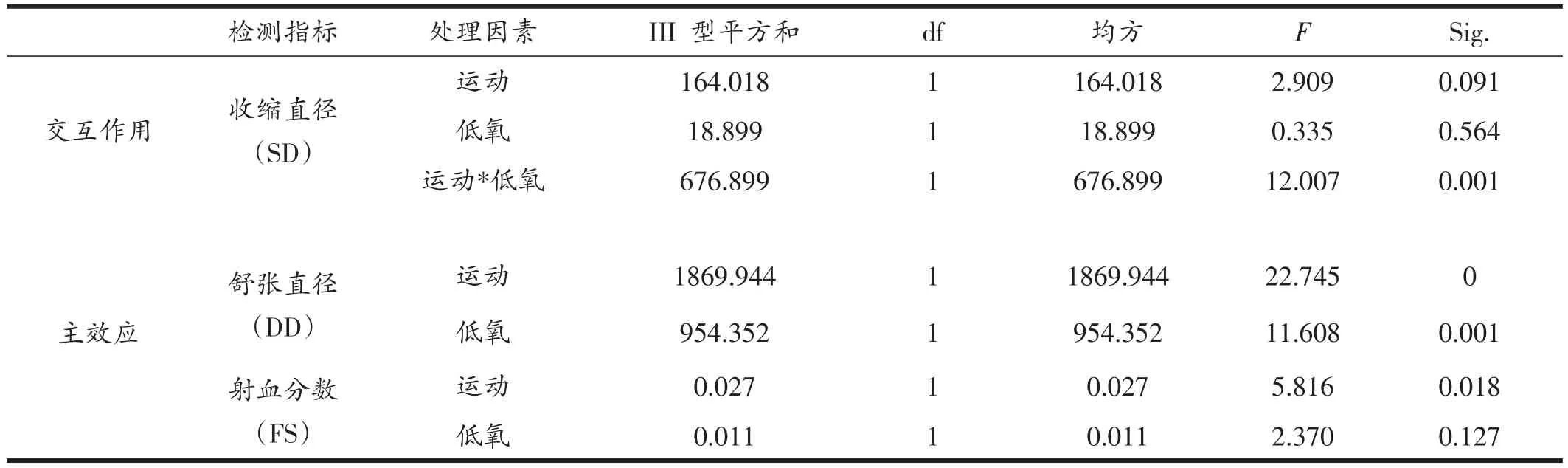
表3 果蝇心脏泵血能力相关指标双因素方差分析结果
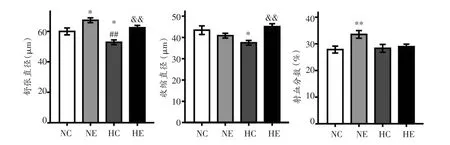
图3 果蝇心脏泵血功能相关指标检测结果
2.3 果蝇攀爬能力检测结果
利用果蝇的负趋地性特点可检测果蝇低氧与运动训练后攀爬能力的变化情况,用以比较低氧与运动干预对果蝇运动能力的影响。由表4、图4可知,15 s内NE、HC与HE组果蝇攀爬速度均显著高于NC组(P<0.05),运动与低氧干预对HE组果蝇攀爬速度起交互作用。

表4 果蝇攀爬速度双因素方差分析结果

图4 果蝇攀爬速度检测结果
2.4 果蝇昼//夜活动情况检测结果
2.4.1 果蝇夜晚睡眠情况
绝大多数生命体都存在生理上或行为现象上的节律性,这些节律性都由生物体内的生物钟控制,当生物体内的节律系统出现异常时,常导致其机体许多疾病的发生。由表5和图5A、B可知,HC组和HE组果蝇夜晚睡眠总时间较NC组显著延长(P<0.05,P<0.01),HC组果蝇夜晚睡眠段数显著小于NC组(P<0.01),低氧对HE组果蝇睡眠时间的延长起主要作用,运动和低氧对其夜晚睡眠段数的变化存在交互作用。
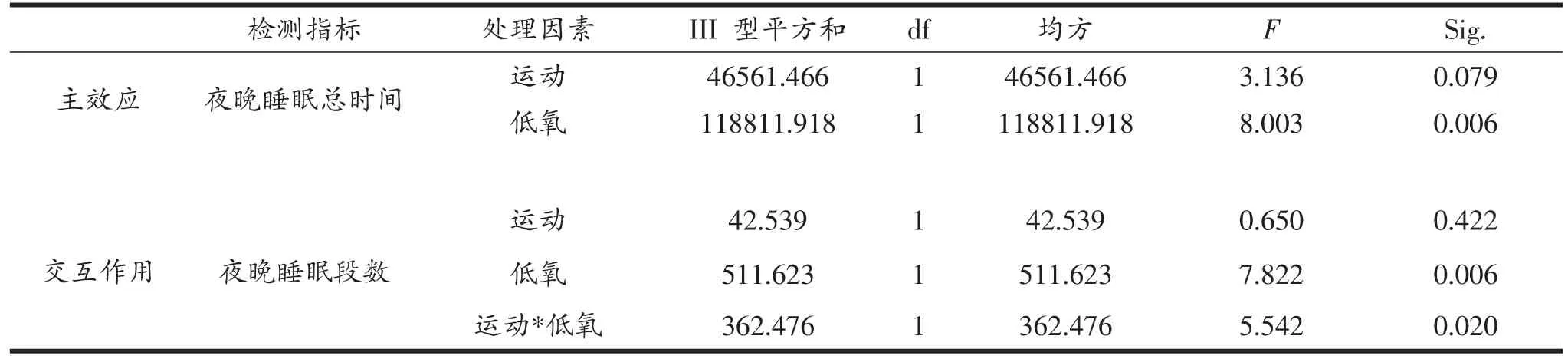
表5 果蝇夜间睡眠质量相关指标双因素方差分析结果

图5 果蝇夜间睡眠质量及日间活动检测结果
2.4.2 果蝇日间活动情况
日间活动情况用于评价果蝇白天清醒时的活动情况,包括对活动时间与活动量的监测,它可以用于评定各种干预处理后果蝇活动行为规律的变化,判断果蝇是否处于患病懒动状态或过度活跃状态[24]。由表6和图5C、D、E、F可知,NE组果蝇日间活动总量显著高于其他三组(P<0.05),而HC组显著低于NC组(P<0.05),NE组果蝇日间清醒睡眠时间比以及单位活动时活动量均显著高于其他三组(P<0.05),HC组果蝇单位活动时活动量显著高于NC组和HE组果蝇(P<0.05),日间活动时间显著低于NC组,低氧与运动对HE组果蝇日间活动总量、日间活动时间和清醒睡眠时间比起显著作用、对单位活动时间活动量存在交互作用,低氧对日间活动时间起主要作用。

表6 各组果蝇日间活动情况相关指标双因素方差分析结果
2.5 果蝇寿命检测结果
野生型果蝇的平均寿命为60天左右,通过对果蝇寿命的统计,我们可以了解其身体各组织器官正常生理功能的维持情况。由表7、图6可知,HC组果蝇最高寿命显著高于NC组和NE组(P<0.01),低氧对HE组果蝇最高寿命具有主要影响。HC组果蝇平均寿命显著高于其他三组(P<0.01),HE组果蝇平均寿命显著高于NC组和NE组(P<0.05),低氧与运动对其具有相互作用。
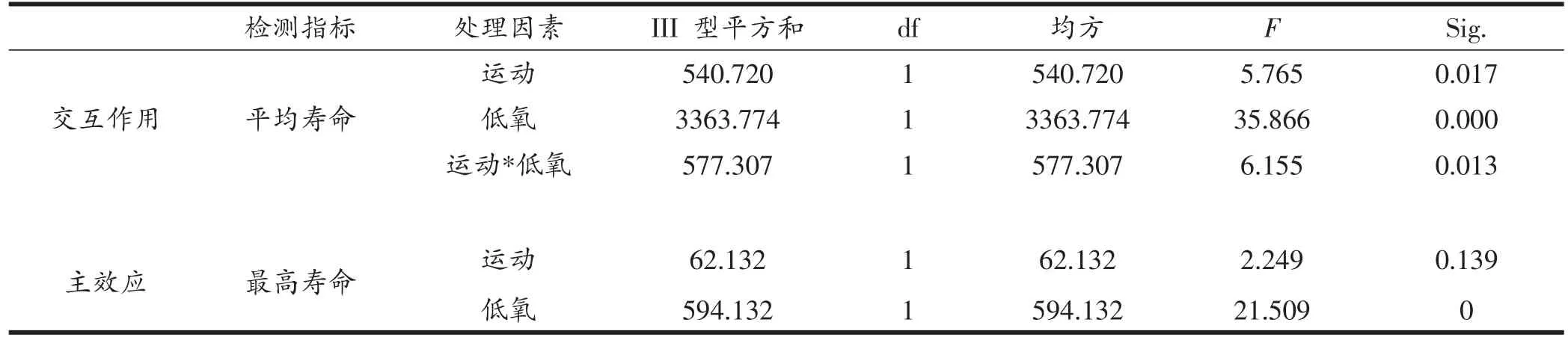
表7 果蝇寿命相关指标双因素方差分析结果

图6 果蝇寿命检测结果
3 讨论
3.1 低氧方案的选择
IH的重要特点是重复或周期性的常氧与低氧交替,心脏对IH的应答呈时间依赖性这一特点导致了IH对心脏保护和损伤的双重作用,因此,选择何种低氧刺激强度、低氧-常氧交替频率、每天低氧暴露时长以及总的低氧天数来构造合适的低氧模型显得至关重要。部分研究[25,26]以8%为起始低氧浓度,能耐受5%氧浓度的果蝇需通过13代逐步培育得到,而6%氧浓度是“比较温和的低氧条件”,虽然果蝇存活率有所降低,但与对照组相比无显著差异[9],能在保证果蝇正常生理功能的前提下研究低氧对果蝇机体健康产生的影响。通过心力衰竭模型的测试,我们发现(图2),随着年龄的增长,经外部电刺激后果蝇的心力衰竭率逐渐升高,即正常心跳恢复率逐渐降低,这与Mayuko等人[27]的研究结果一致,是增龄性心脏功能衰退的一个表现。中年组及老年组果蝇随着低氧暴露时间的延长,心力衰竭率逐渐下降,这可能与低氧诱导的心脏抗应激能力的增强有关。一般认为,幼年动物心脏对缺血的抵抗力大于成年动物心脏[2],而本研究中青年组果蝇呈现相反的结果(如图2),即越早(2天龄)开始进行低氧暴露,心力衰竭率越高。这可能是因为幼龄果蝇心脏尚未发育完全,对低氧的耐受能力低于成年果蝇,因而未显示出与中龄、老龄果蝇相似的低氧诱导的心力衰竭率的降低。Ostadalova等[28]的研究亦显示新生大鼠缺乏低氧诱发的心脏保护作用,而其确切机制有待进一步研究。因此,根据心力衰竭模型对果蝇年龄和低氧持续时间的综合评价,本研究观察采用6%氧气与94%氮气的混合气体、每天低氧6 h[29,30]、从果蝇的第15天龄持续低氧至第42天龄的低氧方案与适宜的规律运动对中老龄果蝇身体机能所产生的影响及其差异。
3.2 低氧与运动干预对果蝇心脏泵血能力的影响
心脏作为全身血液循环的动力装置,其主要功能是泵出足够的血液以满足机体各组织器官代谢所需的各种物质,同时也推动了全身血液循环的进行和静脉血的回流。运动对心脏泵血能力的增强作用已被众多研究所证实,主要是由于运动能使心腔扩大,通过工作肌的节律性舒缩促进静脉回流,从而增加心脏收缩的前负荷[31],本研究亦发现适宜的规律运动能显著提高中老龄果蝇心脏的射血分数(图3),使其泵血能力显著增强,这主要是通过增大其心脏的舒张直径来实现的。IH的作用类似于缺血预适应(ischemic preconditioning,IPC)和长期高原低氧适应(long-term high-altitude hypoxia adaptation,LHA),具有明显的心脏保护作用,雷志平等[32]的研究结果表明低氧暴露可引起心脏泵血能力增强,而本研究证实低氧会显著减小中老龄果蝇心脏收缩直径与舒张直径,但其射血分数与安静对照组没有显著差异,这与Rachel等人[33]的研究结果一致,这可能是因为低氧环境下心脏的有氧代谢过程受阻,导致合成ATP量减少,但心肌氧合能力增加,使其能够在低氧的环境中更经济地工作。而低氧运动组果蝇心脏泵血能力与安静对照组没有显著性差异。由表3可见,运动与低氧对低氧运动组果蝇舒张直径均存在主效应,导致低氧运动组果蝇舒张直径未像运动组一样较安静对照组显著增大,也未像低氧组显著变小,可能是低氧与运动干预对其心脏舒张功能产生相反作用的结果。低氧联合运动对低氧运动组果蝇心脏收缩直径存在交互作用,使得其收缩直径稍大于安静对照组,这可能是因为低氧与运动的双重刺激使得中老龄果蝇心肌收缩能力下降,而其射血分数与安静对照组无明显差别。
3.3 低氧与运动干预对果蝇生活质量的影响
夜间睡眠质量、日间活动情况、运动能力以及寿命可以综合地评价老年人各组织器官的功能状况,从而全面地评价老年人的生活质量。衰老会导致睡眠深度的降低、睡眠时间的减少以及夜晚入睡后醒来次数的增多。Joseph等人[34]的研究表明,平均水平的体育活动和日常劳作均不能提高睡眠质量,而从事较多体育活动、白天能量消耗较高的人夜间平均觉醒时间较短,并且总的睡眠质量会提高。本研究中运动组果蝇夜间睡眠总时间和睡眠段数与安静对照组无显著性差异(如图5),这提示运动组果蝇的日间运动量可能较小。而运动组果蝇日间活动时间与活动总量显著高于其他三组,说明长期的规律运动使中老龄果蝇日间的活跃度更高,这可能与运动习惯的形成有关。间歇性低氧与睡眠质量之间的关系鲜有报道,秦宇飞等人[35]认为间歇性低氧刺激能降低大脑皮层的兴奋性,抑制交感神经的活动,从而有效地改善运动员的睡眠质量。本研究亦发现间歇性低氧能显著增加中老龄果蝇夜间睡眠总时间、减少夜间睡眠段数,显著提高睡眠质量,但其具体机制尚不清楚。Buman[36]的研究结果表明,夜间睡眠质量好的个体在日间表现出更高的活跃度,本研究中低氧组果蝇夜间睡眠质量显著提高(如图5),但其日间活动总量显著低于其他三组,这似乎预示着低氧组果蝇出现了嗜睡懒动的情况[24]。然而其日间清醒时间睡眠时间之比与安静对照组无显著性差异,活动时间虽显著低于安静对照组,但单位活动时间活动量显著高于安静对照组,说明低氧组果蝇日间休息时间变长,而活动能力较安静对照组有显著提高,这可能是长期间歇性低氧所导致的能量节省化的表现。低氧运动组果蝇夜晚睡眠总时间受低氧影响而显著多于安静对照组,而其日间活动情况无显著变化。
本研究中运动组果蝇的攀爬能力结果与其泵血能力结果一致(如图4),显著高于安静对照组,说明适宜的规律运动能延缓因增龄导致的运动能力的衰退。虽然低氧组果蝇心脏泵血能力较安静对照组无显著性差异,但其攀爬能力显著提高,这可能是因为低氧刺激使线粒体数量增多、线粒体在ADP降低情况下产能增多[2],但具体机制还需进一步研究。低氧运动组果蝇运动能力较安静对照组显著提高,由表4可知这是由低氧联合运动的交互作用导致的。
目前,关于运动是否能延长寿命报道结果不一,一些研究[12,21]认为适宜运动能够有效延长果蝇平均寿命,而Garcia-Valles等人[37]的研究表明大鼠终身自发运动能够提高大鼠生活质量却不能增进寿命,本实验结果(如图6)与后者相似,即每天2.5 h、每周5 d、持续4 w的规律运动未能延长野生型果蝇平均寿命和最高寿命,而低氧显示出了显著延长果蝇平均寿命和最高寿命的效果。这可能与低氧导致的代谢率的降低、抗氧化能力的增强以及端粒长度延长等生理和生化机制有关[38,39],低氧运动组的最高寿命受到运动与低氧的交互作用而与安静对照组无显著性差异,其平均寿命受到低氧的主要作用而显著高于安静对照组和运动组。
综上所述,规律运动能增强中老龄果蝇心脏泵血能力、攀爬能力与日常活动能力,而间歇性低氧对中老龄果蝇心脏泵血能力无显著影响,但能提高其攀爬能力与日常活动能力、提高夜间睡眠质量、延长寿命,提高中老龄果蝇的生活质量。低氧联合运动能通过交互作用提高中老龄果蝇的攀爬能力、延长其平均寿命,低氧对低氧联合运动组果蝇夜间睡眠时间的增加起主要作用。
4 结论
规律运动与间歇性低氧均能增强中老龄果蝇的攀爬能力与日常活动能力,但与规律运动能增强中老龄果蝇心脏泵血能力不同,间歇性低氧能减小其心管直径、提高夜间睡眠质量、延长寿命,而低氧联合运动能提高中老龄果蝇的攀爬能力、延长其平均寿命和夜间睡眠时间。
[1]王璐.慢性间歇性低压低氧对大鼠心脏保护作用的性别差异[D].河北:河北医科大学,2009.
[2]张翼,杨黄恬,周兆年.间歇性低氧适应的心脏保护[J].生理学报,2007,59(5):601-613.
[3]Schega L,Peter B,Torpel A,et al.Effects of intermittent hypoxia on cognitive performance and quality of life in elderly adults:a pilot study[J].Gerontology,2013,59(4):316-323.
[4]Raphaël Faiss,Olivier Girard,Grégoire P Millet.Advancing hypoxic training in team sports:from intermittent hypoxic training to repeated sprint training in hypoxia[J]. Br J Sports Med,2013,47(1):i45-i50.
[5]Costa AD,Jakob R,Costa CL,et al.The mechanism by which the mitochondrial ATP-sensitive K+channel opening and H2O2 inhibit the mitochondrial permeability transition[J].J Biol Chem,2006,281(30):20801-20808.
[6]Sadoshima J.Redox regulation of growth and death in cardiac myocytes[J].Antioxid Redox Signal,2006,8(8):1621-1624.
[7]Schega L,Peter B,Torpel A,et al.Effects of intermittent hypoxia on cognitive performance and quality of life in elderly adults:a pilot study[J].Gerontology,2013,59(4):316-323.
[8]SarahLMilton,KenDawson-Scully.Alleviatingbrain stress:whatalternativeanimalmodelshaverevealed about therapeutic targets for hypoxia and anoxia[J].Future Neurol,2013,8(3):287-301.
[9]Dan Zhou,Jin Xue,James C.K.Lai.Mechanisms UnderlyingHypoxiaToleranceinDrosophilamelanogaster:hairy as a Metabolic Switch[J].PLoS Genetics,2008,10(4):1-3.
[10]Buechling T,Akasaka T,Vogler G.Non-autonomous modulation of heart rhythm,contractility and morphology in adult fruit flies[J].Dev Biol,2009,328(2):483-492.
[11]Wagner C,Isermann K,Fehrenbach H,et al.Molecular architecture of the fruit fly’s airway epithelial immune system[J].BMC Genomics,2006,9(1):1-12.
[12]郑澜,吴越,王小月,等.不同运动方案对果蝇运动能力、生命周期及心脏功能的影响[J].中国运动医学杂,2012,31(7):611-616.
[13]Lan Zheng,Yue Feng,Deng Tai Wen,et al.Fatiguing exercise initiated later in life reduces incidence of fibrillation and improves sleep quality in Drosophila[J].AGE,2015,37(77):1-12.
[14]王勇慧.运动对心脏的影响[J].山西师大学报(自然科学版),1996,10(3):78.
[15]Robert J.Wessells,Rolf Bodmer.Screening assays for heart function mutantsin Drosophila[J].Bio Techniques,2004,37:58-66.
[16]张艳阳,唐旻,夏琼,等.利用果蝇心力衰竭模型筛选果蝇第2号染色体缺失系[J].生命科学研究,2010,14(3):195-198.
[17]Edwards BS,Zimmerman RS,Schwab TR,et al.ExperimentalSelectionforDrosophilaSurvivalinExtremely Low O2 Environment[J].Plos one,2007,2(5):1-8.
[18]Wang JW,Wong AM,Flores J,et al.Two-photon calcium imaging reveals an odor-evoked map of activity in the fly brain[J].Cell,2003,112(2):271-282.
[19]Fink M,Callol-Massot C,Chu A,et al.A new method for detection and quantification of heartbeat parameters in drosophila,zebrafish,and embryonic mouse hearts[J]. Biotechniques,2009,46(2):101-103.
[20]Andretic R,Shaw PJ.Essentials of sleep recordings in Drosophila:moving beyond sleep time[J].Methods Enzymol,2005,393:759-772.
[21]Kamikouchi A,Inagaki HK,Effertz T,et al.The neural basis of Drosophila gravity-sensing and hearing[J].Nature,2009,458(7235):165-171.
[22]文登台,郑澜,田旭,等.耐力运动联合NAD合成酶基因CG9940过表达对中老龄果蝇心脏功能、运动能力和寿命的影响[J].中国运动医学杂志,2015,34(10):982-988.
[23]Nicole Piazza,R.J.Wessells.Drosophila Models of Cardiac Disease[J].Prog Mol Biol Transl Sc,2011,100:155-210.
[24]Joanna C.Chiu,Kwang Huei Low,Douglas H.Pike,et al.AssayingLocomotorActivitytoStudyCircadian Rhythms and Sleep Parameters in Drosophila[J].Journal of Visualized Experiments,2010,(43):1-8.
[25]Merril Gersten,Dan Zhou,Priti Azad,et al.Wnt Pathway Activation Increases Hypoxia Tolerance during Development[J].PLoS ONE,2014,9(8):1-11.
[26]Priti Azad,Dan Zhou,Rachel Zarndt,et al.Identification of Genes Underlying Hypoxia Tolerance in Drosophila by a P-element Screen[J].G3-Genes Genomes Genetics,2012,2(10):1169-1178.
[27]Mayuko Nishimura,Karen Ocorr,Rolf Bodmer,et al.Drosophila as a model to study cardiac aging[J].Exp Gerontol,2011,46(5):326-330.
[28]Ostadalova I,Ostadal B,Jarkovska D,et al.Ischemic preconditioning in chronically hypoxic neonatal rat heart[J]. Pediatr Res,2002,52(4):561-567.
[29]Chen Y,Epperson S,Makhsudova L,et al.Functional effects of enhancing or silencing adenosine A2B receptors in cardiac fibroblasts[J].AmJ Physiol Heart Circ Physiol,2004,287(6):2478-2486.
[30]Zhang Y,Zhong N,Zhou ZN,et al.Effects of intermittent hypoxia on action potential and contraction in non-ischemic and ischemic rat papillary muscle[J].Life Sci,2000,67(20):2465-2471.
[31]姚宝元,邓树勋.两种训练方式对男大学生心泵血功能的影响[J].体育学刊,2002,9(6):49-51.
[32]雷志平,王伟,姜涛,等.间歇性低氧暴露对大学生心脏收缩功能和泵血功能影响的观察[J].中国运动医学杂志,2005,24(2):207-208.
[33]Rachel Zarndt,Sarah Piloto,Frank L.Powell,et al.Cardiac responses to hypoxia and reoxygenation in Drosophila [J].Am J Physiol Regul Integr Comp Physiol,2015,309(11):R1347-1357.
[34]Joseph M Dzierzewski,Matthew P Buman,Peter R Giacobbi Jr.Exercise and Sleep in Community-Dwelling Older Adults:EvidenceforaReciprocalRelationship[J].J Sleep Res,2014,23(1):61-68.
[35]秦宇飞,张华.间歇性低氧训练对男子赛艇运动员大负荷训练期间生理机能的影响[J].中国运动医学杂志,2007,26(3):321-325.
[36]Buman MP,King AC.Exercise as treatment to enhance sleep[J].Am J Lifestyle Med,2010,4(6):500-514.
[37]Garcia-Valles R,Gomez-Cabrera MC,Rodriguez-Ma L,et al.Life-long spontaneous exercise does not prolong lifespan but improves health span in mice[J].Longevity& Healthspan,2013,14(2):1-12.
[38]Anastasia Krivoruchko,Kenneth B.Storey.Mechanisms of natural anoxia tolerance and potential links to longevity [J].Oxidative Medicine and Cellular Longevity,2010,3(3):186-198.
[39]王亚平,格日力.不同海拔及时间下大鼠白细胞TERT及HIF-1α mRNA的表达及其对机体细胞寿命的影响和可能机制[J].青海医学院学报,2015,36(4):217-220.
Effects of Intermittent Hypoxia and Regular Exercises on Myocardial Systolic Function and Life Quality of Middling Aging Drosophilae
Wang Hui,Zheng Lan,Wen Dengtai,Feng Yue,Ni Liu,Zhang Ming
Key Laboratory of Physical Fitness and Exercise Rehabilitation of Hunan Province,Hunan Normal University,Changsha 410012,China Corresponding Author:Zheng Lan,Email:lanzheng@hunnu.edu.cn
ObjectiveTo study the effects of intermittent hypoxia and regular exercise on myocardial pump function and life quality of middling aging drosophilae.MethodsTotally 4,500 virgin W1118female flies were collected and divided into three groups by age:young-hypoxia group(YH)receiving hypoxia of one to two weeks,middle-age-hypoxia group(MH)undergoing hypoxia of 3 to 4 weeks and oldhypoxia group(OH)receiving hypoxia of 5 to 6 weeks,each of 1500.The best hypoxic age group and duration were selected after hypoxia treatment.Then 1,200 virgin W1118female flies were collected anddivided into a normoxic control(NC)group,a normoxic exercise(NE)group,a hypoxic control(HC)group and a hypoxic exercise(HE)group,each of 400.The HC and HE groups stayed in environment with oxygen content of 6%for 6 h per day,and the daily exercise of NE and HE groups were 2.5 h.The myocardial pump function and life quality were evaluated for all groups after the intervention.Results(1)The heart failure rate increased with age,and that of MH and OH groups decreased with the extension of hypoxic duration.(2)The diastolic diameter of group NE was significantly higher than group NC and HC(P<0.05,P<0.01),and that of group HC was significantly lower than group NC and HE(P<0.05).The systolic diameter of group HC was significantly lower than group NC and HE(P<0.05). The cardiac ejection fraction of group NE was significantly higher than group NC(P<0.01).(3)The average climbing speed of group NE,HC and HE were all significantly faster than group NC(P<0.05,P<0.01).(4)The total sleep duration at night of group NC was significantly shorter than group HC and HE(P<0.05),but the number of sleep bouts at night of the former was significantly more than group HC(P<0.01).(5)The average total activity of group NE was significantly higher than the other 3 groups(P<0.05),and that of group HC was significantly lower than group NC(P<0.05).The awakening/sleep value and activity amount in active time was significantly higher than the other three groups(P<0.05). The activity amount of group HC was significantly higher than group NC and HE(P<0.05),but the active duration at daytime of group HC was significantly lower than group NC(P<0.05).(6)The maximum lifespan of the HC group was significantly higher than the NC and NE groups(P<0.01).The average lifespan of group HC was significantly higher than group NC,NE and HE(P<0.01),and the average lifespan of group HE was significantly higher than group NC and NE(P<0.05).ConclusionBoth regular exercise and intermittent hypoxia can enhance the climbing ability and daily activity of middling aging drosophilae.Regular exercise can increase myocardial systolic function,and intermittent hypoxia can improve sleep quality at night and extend life span;hypoxia combined with exercises can enhance climbing ability,extend life span and total sleeping time at night.
intermittent hypoxia,regular exercises,heart failure model,myocardial systolic function,life quality
2016.02.24
教育部博士点基金资助项目(20134306110009)
郑澜,Email:lanzheng@hunnu.edu.cn

