白花蛇舌草对宫颈癌细胞增殖、凋亡及Ki-67表达的影响
文雪梅 陈 瑛 李 婷 宋雪妮 王 妮
(西藏民族大学附属医院妇产科,陕西 咸阳 712082)
白花蛇舌草对宫颈癌细胞增殖、凋亡及Ki-67表达的影响
文雪梅 陈 瑛1李 婷2宋雪妮3王 妮3
(西藏民族大学附属医院妇产科,陕西 咸阳 712082)
目的 探讨白花蛇舌草对Hela细胞增殖、凋亡及Ki-67表达的影响。方法 运用动物血清学方法制备白花蛇舌草药物血清,MTT检测白花蛇舌草血清浓度为10%、20%、40%,作用时间为24、48、72 h后的Hela细胞的存活率,并计算药物的抑制率。原位末端标记法(TUNEL)检测白花蛇舌草血清浓度为10%、20%、40%,作用时间为24、48、72 h后的Hela细胞的凋亡率,进一步验证白花蛇舌草抑制宫颈癌细胞增殖是否与促进细胞凋亡有关。RT-PCR检测白花蛇舌草血清浓度为10%、20%、40%,作用时间为24、48、72 h后的Hela细胞中Ki-67 mRNA水平。免疫组化检测白花蛇舌草血清浓度为10%、20%、40%,作用时间为24、48、72 h后的Hela细胞中抗原Ki-67的表达情况。结果 白花蛇舌草药物血清作用后的Hela细胞与对照组相比细胞生长增殖明显受到抑制,随着药物作用浓度和药物作用时间的增加,Hela细胞抑制率也明显增加。TUNEL检测结果显示,白花蛇舌草药物血清作用后的Hela细胞凋亡率比对照组增多,药物作用浓度越高,凋亡率也越高;药物作用时间越长,凋亡率越高。RT-PCR结果显示,与对照组相比,白花蛇舌草药物血清作用后的Hela细胞中Ki-67 mRNA的表达量随着作用时间和作用浓度的增加而减小。免疫组化结果显示,白花蛇舌草药物血清作用后的Hela细胞中抗原Ki-67的表达量与对照组相比明显降低。白花蛇舌草药物血清可以明显降低Hela细胞中Ki-67的表达。结论 白花蛇舌草对宫颈癌细胞Hela的增殖具有抑制作用,可以促进细胞凋亡,抑制Ki-67基因表达。
白花蛇舌草;宫颈癌;增殖;凋亡
手术治疗、放射治疗和化学疗法是目前常用的治疗宫颈癌的方法,但这些治疗方法效果具有局限性,预后差〔1〕。白花蛇舌草是一种我国传统的中草药,具有抗肿瘤作用〔2〕,在临床上已经得到广泛应用,多用于治疗支气管癌、直肠癌、淋巴癌、鼻咽癌等。但目前对白花蛇舌草抗宫颈癌的作用机制尚未研究。Ki-67基因表达与癌细胞增殖有密切关系,在癌细胞增殖分化过程中具有重要意义,编码的Ki-67蛋白是癌细胞增殖过程中必需的一种DNA结合蛋白〔3〕。本研究利用动物血清学原理制备了白花蛇舌草药物血清,与宫颈癌Hela细胞作用后,观察细胞增殖分化及凋亡情况,并分析Ki-67 mRNA水平,初步探讨白花蛇舌草对宫颈癌细胞增殖分化的作用机制。
1 材料与方法
1.1 材料 Hela细胞本实验室保存,成年雌性SD大鼠20只购于中科院上海实验动物中心,鼠龄为90日龄,体重260~290 g。主要仪器和试剂:酶标仪(美国sigma),水浴锅(苏州精密仪器公司),CO2培养箱(日本SANYO),超净工作台(苏州净化设备有限公司),PCR仪(美国PE),倒置显微镜(日本尼康),离心机(上海医用设备厂),RPMI1640培养基(美国Sigma),PBS(鼎国生物试剂有限公司),胎牛血清(FBS)(杭州四季青有限公司),MTT(碧云天生物技术有限公司),青链霉素(美国Sigma),胰蛋白酶(美国Sigma),反转录试剂盒(碧云天生物技术有限公司),细胞RNA提取试剂盒(碧云天生物技术有限公司),TUNEL试剂盒(北京中山生物科技有限公司),二甲基亚砜(DMSO)(美国Sigma),Ki-67单克隆抗体(北京中山生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 Hela细胞用含有10% FBS的RPMI1640细胞生长液培养,培养条件为37℃,5%CO2培养箱中培养,细胞传代用0.125%的胰蛋白酶消化。
1.2.2 制备白花蛇舌草血清 取300 g白花蛇舌草加入1 000 ml水中,小火煎制2 h,弃渣后浓缩为300 ml,配制成白花蛇舌草的灌胃水。每天给予20只成年雌性大鼠2次灌胃,每次4 ml,持续给药3 d。第3天给药后1 h用乙醚麻醉大鼠,在大鼠腹主动脉处采血,1 500 r/min离心10 min,分离的血清灭活后分别稀释含药血清倍数为10、5、2.5倍,制成浓度10%、20%、40%的白花蛇舌草血清,分装,保存于4℃冰箱备用。
1.2.3 噻唑蓝(MTT)法检测Hela细胞增殖 取培养至对数生长期的宫颈癌Hela细胞,弃去细胞生长液,加入磷酸盐缓冲液(PBS)洗涤2次,加入胰蛋白酶消化细胞后,1 000 r/min离心10 min,弃酶消化液,加PBS重悬细胞,1 000 r/min离心10 min,弃去上清,加入细胞生长液,在显微镜下调整细胞浓度为6×104个/ml,取混合均匀的细胞悬浮液100 μl接种到96孔细胞培养板中,将细胞培养板置于5%CO2培养箱中,37℃,培养时间大约为24 h,观察细胞贴壁后,分别在细胞中加入白花蛇舌草血清。实验组中加入终浓度为10%、20%、40%的白花蛇舌草血清培养基,置于37℃、5%CO2培养箱中培养,培养时间分别为24、48、72 h。为了减小误差,每组设置8个复孔,同时设置阴性对照组和空白组,阴性对照组中不加含药血清,只加入等量的细胞生长液;空白组中无细胞加入等量的含药血清。含药血清作用时间结束后,在细胞中加入体积20 μl、浓度5 mg/ml的MTT溶液,置于37℃反应4 h,弃含药培养基后,加入150 μl二甲基亚砜(DMSO)溶液,避光条件孵育充分反应10 min,用酶联免疫检测仪检测492 nm处各孔的吸光度(OD值),计算每组Hela细胞抑制率。
存活率=100%×(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)。抑制率=1-细胞存活率。
1.2.4 原位末端标记法(TUNEL)检测细胞凋亡 终浓度为10%、20%、40%的白花蛇舌草血清与Hela细胞作用24、48、72 h后,用浓度为4%的多聚甲醛在室温下固定细胞30 min,吸除上清,加入适量的PBS洗涤细胞3次,每次3 min,加入3%的H2O2甲醇阻断剂,孵育30 min,阻断内源性氧化物酶,PBS洗片。加入含有0.1%TritonX-100的枸橼酸钠溶液作为通透液,放置于冰盒中孵育2 min,小心吸除液体,加入转化剂POD 50 μl,盖上盖玻片,37℃于湿盒中反应30 min,洗片。加入100 μl显色剂二氨基联苯胺(DAB),在室温下结合反应15 min,酒精脱水后用二甲苯透明封片。同时设置对照组。显微镜下观察细胞核为棕红色为阳性,计算凋亡率。凋亡率的计算方法:胞核为红棕色的细胞数与总细胞的数量百分比。
1.2.5 RT-PCR检测药物作用细胞后Ki-67 mRNA水平 对数生长期的Hela细胞经终浓度为10%、20%、40%的白花蛇舌草血清培养基作用24、48、72 h后,弃去含药培养基,放置于冰上,加入300 μl冰预冷的匀浆液变性,移液枪缓慢吹打细胞,观察细胞裂解后,转移至EP管中,加入2 mol/L的pH4.0的醋酸钠溶液60 μl,上下颠倒EP管5次混匀,再加入600 μl的氯仿和酚的混合液,上下颠倒EP管5次混匀,在振荡器上震荡15 s。放置于4℃孵育15 min,4℃,14 000 r/min离心20 min。吸取水相层至新EP管中,加入与水相层相等体积的异丙醇,上下颠倒EP管5次混匀,置于-30℃静置60 min。4℃,14 000 r/min,离心15 min,弃上清,在RNA沉淀中加入500 μl 冰预冷的80%乙醇混匀,置于-30℃、静置60 min。4℃,14 000 r/min离心15 min,弃上清,将EP管放置于超净工作台中晾干,加入RNase-free 水溶解保存。提取的RNA按照反转录试剂盒操作说明书反转录合成Ki-67 mRNA的cDNA。观察分析细胞中Ki-67水平 。
1.2.6 药物作用后Hela细胞Ki-67抗原检测 对数生长期的Hela细胞经终浓度为10%、20%、40%的白花蛇舌草血清培养基作用24、48、72 h后,弃含药培养基,加入PBS洗涤3次,每次3 min。放置于室温下30 min,待风干后,加入4%多聚甲醛固定30 min,空气中干燥5 min,PBS洗涤3次,每次3 min,加入0.5% Triton X-100孵育15 min,洗片,加入封闭血清孵育20 min。Ki-67抗体用抗体稀释液以1∶100稀释后,加入封闭后的细胞爬片中,37℃反应60 min,PBS洗片。加入ploymer Helper放置于37℃中孵育20 min,PBS洗片。加入poly peroxicase-anti-rabbit IgG后37℃反应30 min,PBS洗片,加入DAB显色,置于显微镜下观察至棕色,5 min后自来水洗,分别用75%、85%、95%的酒精脱水,每个浓度梯度3 min。二甲苯透明2次,每次3 min,中性树胶封片。同时设置对照组,对照组中不加Ki-67抗体,加等量的PBS液。计算细胞核呈棕红色的细胞数与总细胞数的比值为抗原表达率。
1.3 统计学方法 应用SPSS19.0软件进行t检验、χ2检验。
2 结 果
2.1 MTT检测药物作用后细胞抑制情况 10%、20%、40%白花蛇舌草血清作用后的Hela细胞抑制率与对照组相比差异显著(P<0.05)。相同药物浓度,药物作用时间为72 h的Hela细胞与作用时间48 h相比差异显著(P<0.05);相同药物浓度,药物作用时间为48 h的Hela细胞与作用时间24 h相比差异不显著(P>0.05)。随着药物浓度的增加,抑制率呈上升趋势;随着作用时间的增加,抑制率逐渐上升。见表1。
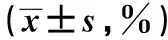
表1 MTT法检测白花蛇舌草血清作用后的Hela 细胞抑制率
与对照组比较:1)P<0.05;与48 h比较:2)P<0.05;表2同
2.2 TUNEL检测白花蛇舌草药物血清作用后Hela细胞凋亡情况 白花蛇舌草血清作用后的Hela细胞凋亡率与对照组相比差异显著(P<0.05)。相同作用浓度的白花蛇舌草血清作用72 h后Hela细胞凋亡率较作用时间为48 h的凋亡率差异显著(P<0.05);随着作用时间的增加,药物作用后的Hela细胞凋亡率也明显增加;随着作用浓度的增加,药物作用后的Hela细胞凋亡率显著增加。说明白花蛇舌草血清通过促进Hela细胞凋亡而抑制细胞增殖。见表2。
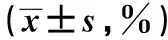
表2 TUNEL法检测白花蛇舌草血清 作用后的Hela细胞凋亡率
2.3 RT-PCR检测白花蛇舌草作用后Hela细胞中Ki-67 mRNA水平 白花蛇舌草血清作用后的Hela细胞中Ki-67水平与对照组相比差异显著(P<0.05)。40%的白花蛇舌草血清作用时间为72 h组比作用时间为48 h组Hela细胞中Ki-67水平降低很多(P<0.05);40%的白花蛇舌草血清作用时间为48 h组比作用时间为24 h组Hela细胞中Ki-67水平降低很多(P<0.05)。20%的白花蛇舌草血清作用时间为72 h组比作用时间为48 h组Hela细胞中Ki-67水平降低很多(P<0.05);20%的白花蛇舌草血清作用时间48 h比作用时间为24 h的Hela细胞中Ki-67水平降低很多(P<0.05)。10%的白花蛇舌草血清作用时间72 h组比作用时间为48 h组Hela细胞中Ki-67水平降低很多(P<0.05);10%的白花蛇舌草血清作用时间48 h组比作用时间为24 h组Hela细胞中Ki-67水平降低很多(P<0.05)。药物作用后的Hela细胞中Ki-67 mRNA水平随着药物浓度和作用时间的增加而减小。见表3。
2.4 免疫组化检测白花蛇舌草血清作用后的Hela细胞Ki-67的表达情况 白花蛇舌草血清作用后的Hela细胞与对照组相比Ki-67抗原表达量受到明显抑制作用(P<0.05)。10%白花蛇舌草血清作用24、48、72 h后抗原Ki-67的表达率依次为0.612 3±0.060 1,0.547 8±0.045 1,0.507 9±0.042 1。20%白花蛇舌草血清作用24、48、72 h后抗原Ki-67的表达率依次为0.534 6±0.051 1,0.471 6±0.041 2,0.426 8±0.040 2。40%白花蛇舌草血清作用24、48、72 h后抗原Ki-67的表达率依次为0.442 6±0.041 2,0.390 6±0.035 1,0.325 0±0.029 1。对照组中作用时间为24、48、72 h后抗原Ki-67的表达率依次为0.792 4±0.07,0.801 7±0.082 0,0.785 9±0.074 1。白花蛇舌草血清药物浓度越高,Hela细胞抗原Ki-67表达量越小,药物作用时间越长,Hela细胞抗原Ki-67表达量越小。这与RT-PCR检测的Ki-67 mRNA表达结果一致,说明白花蛇舌草血清可以减少Ki-67的表达。
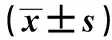
表3 RT-PCR检测白花蛇舌草作用后的细胞中 Ki-67表达率
与相同作用时间对照组比较:1)P<0.05;与相同作用浓度作用时间24 h比较:2)P<0.05
3 讨 论
宫颈癌是一种常见的恶性肿瘤,我国每年宫颈癌死亡人数在全部恶性肿瘤死亡人数的第四位。宫颈癌的发病率在女性恶性肿瘤中仅次于乳腺癌。在农村的发病率明显高于城市,发展中国家的发病率高于发达国家〔4〕。30~40岁年龄阶段的女性是宫颈癌高发人群,20岁以下宫颈癌发病率较少〔5〕。白花蛇舌草属于茜草科植物,广泛生长于亚热带地区,在我国主要分布在长江以南地区,具有抗肿瘤、消炎、灭菌、增加免疫力等多种功效〔6〕。白花蛇舌草的抗肿瘤作用在食道癌、淋巴癌、直肠癌、胃癌中已经得以证实。研究表明白花蛇舌草具有抑制癌细胞增殖分化、促进癌细胞凋亡、调控细胞凋亡信号等多种作用〔7〕。
细胞凋亡是细胞正常情况下的一种程序性死亡,在维持内环境稳定中起到重要作用。细胞凋亡是一系列复杂的过程,受多种相关因子和蛋白的多重调控作用。基因Bcl-2、Bax、p53等在细胞的凋亡过程中起重要作用。Bcl-2是一种抑癌基因,在细胞凋亡过程中具有抗凋亡的作用;而Bax、p53基因在细胞凋亡过程中起到促进作用。细胞凋亡过程中,钙离子浓度的改变与凋亡信号传递有关〔8〕。白花蛇舌草可以显著提高癌细胞内钙离子浓度,增加细胞内游离钙的浓度,从而发挥抑癌作用。
本研究通过TUNEL〔9〕检测细胞凋亡情况,结果显示,白花蛇舌草血清作用后的Hela细胞凋亡率明显增高,且随着作用浓度的增加和作用时间的增加,凋亡率增加。白花蛇舌草可以促进宫颈癌Hela细胞凋亡。
Ki-67增多标志着细胞处于增殖状态,是临床上常用的一种评价细胞增殖的指标。Ki-67表达增多表示癌细胞增长分化处于活跃状态。Ki-67蛋白是一种拥有200多个的磷酸化的部位的非组蛋白,很容易受到相关蛋白酶的作用,这为提取和分离该蛋白带来了困难。Ki-67半衰期短,拥有3个酰肽化部位,19个豆蔻酰化区域和50个富含谷氨酸、苏氨酸、脯氨酸的部位〔10〕。Ki-67蛋白是由两个大小分别约为8 000 bp和9 000 bp的相关mRNA编码的蛋白质。Ki-67的cDNA由15个外显子和14个内含子组成。研究表明,细胞中Ki-67不表达的时候,细胞周期循环不受影响,说明Ki-67不是细胞增殖必需的。已经有研究表明,Ki-67可以作为膀胱癌患者中诊断肿瘤分级的一个重要指标,Ki-67可以作为早期前列腺癌和前列腺增生的诊断依据,另外Ki-67可以作为诊断大肠肿瘤良性还是恶性的指标〔11〕。本研究通过RT-PCR检测药物作用后的Hela细胞中Ki-67 mRNA的表达情况,药物作用后的Hela细胞中Ki-67 mRNA的表达受到抑制。免疫组化结果显示,药物作用后的Hela细胞中Ki-67抗原表达降低,说明白花蛇舌草抑制宫颈癌Hela细胞增殖与Ki-67有关。
综上所述,白花蛇舌草可以抑制宫颈癌细胞的增殖分化,促进细胞凋亡,抑制机制与Ki-67的表达有关。本研究通过体外实验观察白花蛇舌草的作用机制,为进一步研究白花蛇舌草在宫颈癌治疗和诊断中的价值提供了理论依据。
1 傅 炜.4种不同检查方法在宫颈癌筛查中的临床应用价值〔J〕.中外医学研究,2016;14(6):72-3.
2 逯 双,杨培民,曹广尚.白花蛇舌草活性成分多糖与黄酮研究进展〔J〕.中国中医药信息杂志,2016;23(3):122-5.
3 李 雯,冯彦林.SUVmax、Ki-67、p53、EGFR对三阴性乳腺癌新辅助化疗疗效的预测价值〔J〕.肿瘤防治研究,2016;43(1):45-7.
4 舒丽莎,黄先涛,武雪亮.2012~2013年张家口地区妇科住院患者调查〔J〕.中国老年学杂志,2016;36(6):1455-7.
5 罗 强,任 鸿,孙 黎.没食子酸诱导人宫颈癌Hela细胞凋亡的机制〔J〕.中国老年学杂志,2015;35(17):4755-6.
6 翟学佳,吕永宁.HPLC法同时测定白花蛇舌草中7种活性成分的含量〔J〕.中国药师,2016;19(1):70-2,81.
7 朴连花.评价分析白花蛇舌草方剂联合放疗对食道癌患者生活质量的影响及临床疗效〔J〕.中国卫生标准管理,2015;6(29):137-8.
8 赵丫卉,张 薇,骆爱萍.分化抑制因子1抑制化疗药物及紫外线诱导结肠癌 HCT116细胞凋亡〔J〕.中华肿瘤杂志,2016;38(1):4-10.
9 王洪磊,张振兴,刘 珩.白藜芦醇对大鼠脑出血后血肿周围组织细胞凋亡的影响研究〔J〕.中国现代医学杂志,2016;26(1):11-7.
10 吴志峰,徐晓芳,魏梁锋.垂体零细胞腺瘤内皮细胞特异性分子1的表达及其意义〔J〕.中华神经医学杂志,2016;15(2):140-4.
11 史汉蒙,司君利,崔伟丽.大肠癌组织中肿瘤相关巨噬细胞计数与MMP-2、Ki-67表达的相关性研究〔J〕.中国现代普通外科进展,2015;18(2):94-8.
〔2016-04-11修回〕
(编辑 袁左鸣)
文雪梅(1966-),女,副主任医师,主要从事妇产科疾病研究。
R739.5
A
1005-9202(2017)03-0561-03;
10.3969/j.issn.1005-9202.2017.03.016
1 武警西藏总队医院妇产科
2 信阳市中心医院
3 西藏民族大学临床医学院妇产科

