硫酸锌对血管内皮细胞氧化应激保护作用的研究①
刘 佳 李肖楠 孙思铭 王越晖
(吉林大学第一医院老年病科,长春130041)
·基础免疫学·
硫酸锌对血管内皮细胞氧化应激保护作用的研究①
刘 佳 李肖楠 孙思铭②王越晖
(吉林大学第一医院老年病科,长春130041)
目的:研究硫酸锌对体外培养的人脐静脉内皮细胞(HUVECs)氧化应激的保护作用。方法:用过氧化氢(H2O2)建立血管内皮细胞氧化应激损伤模型, 观察正常对照组、H2O2组、硫酸锌组及硫酸锌治疗组各组细胞的各项指标。采用硝酸还原酶法测定细胞培养液中一氧化氮(NO),采用酶联免疫吸附法(ELISA)测定培养液中内皮素(ET)含量,用蛋白免疫印迹技术(Western blot)检测细胞的血红素加氧酶(HO-1)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)水平,用末端标记法(TUNEL)检测HUVEC的凋亡情况。结果:硫酸锌能显著提高H2O2诱导的HUVEC培养液中的NO含量,降低ET含量,提高细胞HO-1、SOD和CAT水平,减少H2O2诱导的内皮细胞凋亡数量。结论:硫酸锌具有较强对抗内皮细胞氧化应激的能力,并具有一定预防作用,硫酸锌有望成为提高HUVECs抗氧化损伤能力的有效药物。
氧化应激;硫酸锌;过氧化氢;内皮细胞
血管内皮细胞的改变与诸多疾病的发生和发展密切相关,许多疾病早期即存在血管内皮功能的失调,而内皮细胞功能障碍是糖尿病血管并发症的始动因素和中心环节[1]。氧化应激是糖尿病血管内皮功能障碍的重要原因之一[2],氧化应激早在糖耐量异常时就已经出现,随着糖代谢异常的加重,氧化应激损伤也与之成正比,从而引起微血管和大血管病变,进而导致糖尿病发病率和死亡率的显著增加[3]。因此,寻找合适的抗氧化应激保护血管内皮细胞的药物,对预防和治疗糖尿病心血管并发症有着重要意义。
锌(Zn)作为人体必需的微量元素之一,有许多生物功能。Zn参与胰岛素的合成、分泌,调节胰岛素的生物活性和抗原性,因此,Zn与糖尿病的发生、发展及并发症的发生都密切相关[4]。Zn亦可作为多种酶和蛋白质的辅助因子参与抗氧化作用[5]。我们前期研究发现,老年2型糖尿病患者血清离子紊乱,其中锌离子、镁离子在糖尿病组患者血清中明显下降,氧化损伤明显增加,内皮功能显著受损。目前的研究结果提示我们,给糖尿病患者尤其是老年糖尿病患者补充Zn可能缓解糖尿病及其相关的血管并发症[6]。因此,本文研究目的在于探讨锌是否具有抵抗氧化应激发挥保护血管内皮的作用,为防治糖尿病心血管并发症提供研究基础。本研究用H2O2诱导的HUVEC建立氧化应激损伤细胞模型,观察和评价了硫酸锌对内皮细胞氧化应激损伤的预防和治疗作用。
1 材料与方法
1.1 材料 HUVEC是购自Biosun公司,牛血清(FBS)及Trypsin-EDTA(1×)(浓度0.25%)均购自Gibco公司,倒置显微镜(CKX)为日本Olympus,NO及ET检测试剂盒均购自凯基公司,TUNEL细胞凋亡检测试剂盒购自公司YEASEN,HO-1、SOD和CAT抗体购自Proteintech公司。
1.2 方法
1.2.1 细胞培养及分组 将细胞培养于含有10%胎牛血清的DMEM培养基中,置37℃,5%CO2饱和湿度培养箱内常规培养,待细胞传代3~6代至稳态后,将细胞3×105ml-1浓度均匀铺于6孔板内,培养24 h后,分为4组:①正常对照组:不加H2O2处理;②硫酸锌组:加硫酸锌组(终浓度为50 μmol/L);③H2O2造模组:加H2O2处理(终浓度为250 μmol/L);④硫酸锌治疗组:加H2O2和硫酸锌(H2O2终浓度为250 μmol/L+硫酸锌终浓度为50 μmol/L) ;每次检测每组设6个复孔,置于37℃,5%CO2饱和度恒温培养箱内常规培养24 h后开始实验。
1.2.2 NO含量的测定 将细胞按照上述分组方法进行培养,分别收集细胞上清液,采用NO检测试剂盒(KGT00725-KGT00750),应用硝酸还原酶法,依照试剂盒中描述的实验方法和步骤,检测HUVCE上清液中NO浓度。
1.2.3 ET含量的测定 将细胞按照上述分组方法进行培养,分别收集细胞上清液,应用ELISA法,按照ET检测试剂盒中描述的实验方法和步骤,检测HUVEC上清液中ET浓度。
1.2.4 细胞凋亡情况的测定 接种于6孔板中的细胞按上述分组方法进行培养,将已爬好细胞的爬片用500 μl PBS浸洗1次,时间1 min ;加入4% 的多聚甲醛固定爬片15 min ,用0.5% Triton X-100(PBS配置) 200 μl室温通透20 min。清洗爬片后,加入100 μl DNA酶Ⅰ室温孵5 min,并用去离子水洗3~4次,按照TUNEL试剂盒说明书描述进行细胞染色,在荧光显微镜下分析样本,在651 nm下检测Alexa Fluor 647红色荧光来检测细胞凋亡。
1.2.5 免疫蛋白电泳 胰酶消化分组培养的细胞,用PBS冲洗2次,收细胞悬液于1.5 ml EP管中,加入4℃ 预冷蛋白裂解液7.6 ml ,冰上裂解30 min ;4℃ 离心,13 200 r/min,15 min ;收取细胞裂解液。将玻璃板洗干净,固定于电泳槽上,经过加样、电泳后,将蛋白质从SDS聚丙烯酰胺凝胶转移至固相支持体,用5%脱脂奶粉 (TBST配制),封闭。平放于摇床平台上,室温温育1~2 h后取出膜在TBST中洗涤1次;将膜放入可加热封接的塑料袋中,分别加入SOD、CAT、HO-1(工作浓度1∶100)一抗,4℃过夜。取出膜在TBST中洗涤每次10 min,共3次;将膜放入可加热封接的塑料袋中,根据说明书加入适当浓度的二抗,室温温育2 h。ECL发光检测,在暗室用X线片曝光,显影、定影后观察结果。

2 结果
2.1 硫酸锌对不同分组的内皮细胞NO含量的影响 分别对正常对照组(HUVEC),H2O2造模组(HUVEC+ H2O2),硫酸锌组(HUVEC+ZnSO4)及硫酸锌治疗组(HUVEC+ H2O2/ZnSO4)内皮细胞培养基中的NO含量进行测定,结果发现,在H2O2造模组,NO含量显著降低,ET含量明显升高,与正常对照组、硫酸锌组及硫酸锌治疗组相比有统计学意义(P<0.01),见图1。
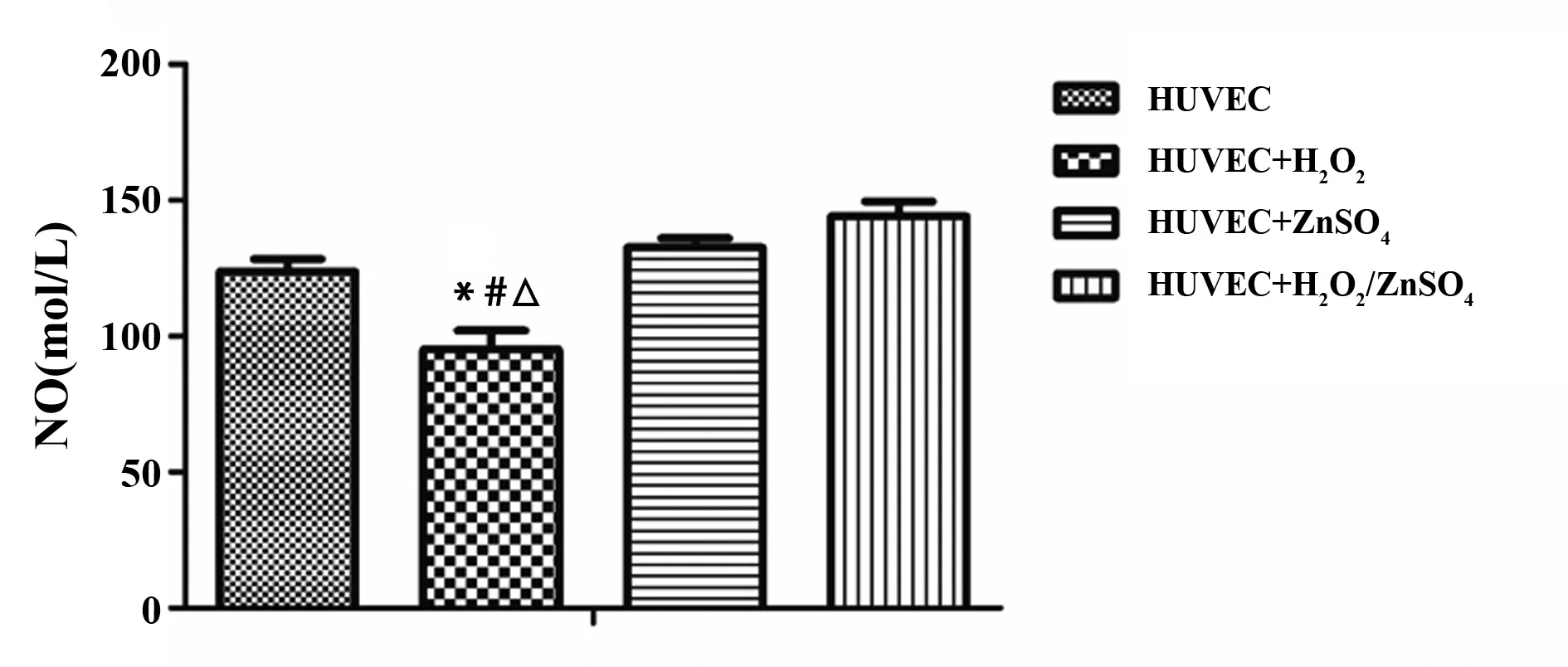
图1 硫酸锌对不同分组的内皮细胞NO表达的影响Fig.1 Effects of Zinc sulfate on NO expression in different HUVECs groupsNote: *.vs HUVEC,P<0.01; #.vs HUVEC+ZnSO4,P<0.01;△.vs HUVEC+H2O2/ZnSO4,P<0.01,n=6.

图3 硫酸锌对不同分组的内皮细胞凋亡的影响Fig.3 Effect of Zinc sulfate on apoptosis in different HUVECs groups

图4 硫酸锌对不同分组的内皮细胞SOD、CAT及HO-1蛋白表达的影响Fig.4 Effect of Zinc sulfate on SOD,CAT,HO-1 protein expression of different HUVECs groupsNote: H2O2 vs control,*.P<0.01;H2O2 vs ZnSO4,#.P<0.05;H2O2 vs H2O2/ZnSO4,△.P<0.05.

图2 硫酸锌对不同分组的内皮细胞ET表达的影响Fig.2 Effects of Zinc sulfate on ET expression in different HUVECs groupsNote: vs HUVEC,*.P<0.01;vs HUVEC+ZnSO4,#.P<0.01;vs HUVEC+H2O2/ZnSO4,△.P<0.01,n=6.
2.2 硫酸锌对不同分组的内皮细胞ET含量的影响 分别对正常对照组(HUVEC),H2O2造模组(HUVEC+ H2O2)、硫酸锌组(HUVEC+ZnSO4)及硫酸锌治疗组(HUVEC+ H2O2/ZnSO4)内皮细胞培养基中的ET含量进行测定,结果发现,在H2O2造模组, ET含量明显升高,与正常对照组、硫酸锌预防组及硫酸锌治疗组相比有统计学意义(P<0.01),见图2。
2.3 TUNEL试剂盒检测内皮细胞凋亡变化 在荧光显微镜下分析样本,在651 nm下检测Alexa Fluor 647红色荧光,只在凋亡的细胞核中才有Alexa Fluor 647-12-dUTP掺入而定位的红色荧光,TUNEL染色结果显示加入H2O2孵育24 h的细胞组中大量细胞破碎、皱缩,同时加入硫酸锌和H2O2细胞组被染成红色的细胞较H2O2组减少,只加入硫酸锌的细胞组中极个别的细胞被染成红色,发生凋亡(见图3)。
2.4 硫酸锌对细胞内HO-1、SOD和CAT表达情况的影响 免疫蛋白电泳结果显示:加入H2O2处理的细胞组与正常对照组相比,SOD、CAT、HO-1蛋白表达量明显减少(P<0.01);与加入H2O2同时用硫酸锌处理的细胞较H2O2处理组细胞在SOD、CAT、HO-1表达有明显提高,二者之间差异显著(P<0.05),见图4。
3 讨论
内皮功能障碍不仅是动脉粥样硬化发病机制中的早期关键因素[7],也是糖尿病血管并发症的始动因素和中心环节[1],因此对抗内皮细胞氧化应激造成的细胞凋亡、细胞损伤,改善内皮细胞功能障碍是防治糖尿病及其并发症发生、发展的有效治疗手段。
锌是人体非常重要的微量元素,摄入量虽少,但与糖尿病的发生、发展及并发症的发生都密切相关[4]。研究表明,锌离子具有抗氧化、抗凋亡及维持膜稳定性的作用,通过维持血管内皮的完整性来保护血管内皮对抗氧化应激[8,9]。锌在胰岛β细胞中参与了胰岛素的生成、储存和分泌[4]。研究发现老年糖尿病患者补充Zn可能缓解糖尿病及其相关的血管并发症[6]。因此,本实验主要通过H2O2建立氧化应激细胞损伤模型模拟糖尿病状态下对血管内皮的氧化应激损伤,进而研究硫酸锌对血管内皮损伤的保护作用。
NO是血管内皮释放的最重要的血管舒张因子之一,对于维持内皮细胞的完整性和平衡性非常重要[10]。ET是广泛存在于各种组织和细胞中调节心血管功能的重要因子,ET-1水平则反映了内皮细胞的损伤程度,对维持血管系统稳态也发挥重要作用[11]。
当血管内皮的稳态被破坏后,血管内皮细胞分泌的多种活性因子,如NO、ET等,改变血管的紧张度和血液中白细胞、血小板及内皮细胞的相互作用,导致血管舒缩功能障碍和启动内皮炎症网络系统引发内皮细胞功能障碍,进而引发心血管疾病,因此,内皮功能障碍已成为心血管疾病的一个重要靶点[10,11]。高糖条件下血管活性因子含量的失衡可致血管内皮损伤,进而促进糖尿病血管并发症的发生[12]。
本研究对内皮细胞上清液中NO、ET含量测定,发现上清液中NO含量降低、ET含量增加,NO水平降低将导致血管收缩,ET导致内皮细胞功能障碍。而硫酸锌可以提高内皮细胞培养上清中NO水平,减少ET的分泌,说明硫酸锌可以显著对抗H2O2产生的氧化应激损伤,从而发挥保护内皮细胞的作用。
氧化应激主要来源于抗氧化组织破坏增加及自由基生成增多,打破机体的氧化与抗氧化平衡,机体便会产生氧化应激损伤[3]。SOD、CAT、HO-1是细胞内的抗氧化剂,本研究发现,与H2O2组细胞相比,加入硫酸锌的细胞SOD、CAT、HO-1表达明显增加,结果表明硫酸锌可以清除细胞内自由基,上调氧化防御系统活性,对抗氧化应激损伤,发挥对内皮细胞的保护作用 。
高糖诱导内皮细胞凋亡与脂肪酸代谢的变化、线粒体功能障碍、细胞凋亡蛋白酶-3的激活及胰岛素激活蛋白激酶能力的下降有关[13]。我们研究发现,H2O2组细胞较正常对照组细胞凋亡率显著增加,加入硫酸锌后,细胞凋亡率显著降低,说明细胞模型系统中增加锌离子浓度能显著对抗氧化应激造成的细胞凋亡,提高细胞存活率。
综上所述,本文通过H2O2建立对脐静脉内皮细胞氧化应激损伤模型,模拟糖尿病患者体内高糖对血管内皮的损伤,研究硫酸锌对血管内皮氧化应激损伤条件下的治疗及预防作用。实验结果发现,硫酸锌能显著对抗细胞内氧化应激,促进损伤细胞内NO分泌,抑制ET分泌,维持血管收缩和舒张的平衡,提高各种抗氧化剂如SOD、CAT、HO-1在体内的活性,进而上调体内抗氧化系统的活性,清除过多自由基,降低细胞凋亡率,保护血管内皮细胞。我们的研究证实了锌对血管内皮细胞的保护作用。研究结果提示我们,补锌可能会改善糖尿病患者氧化应激状态,通过补锌的辅助治疗可能在一定程度上减缓糖尿病及糖尿病并发症进展,为糖尿病患者的治疗和预后带来了新的前景。
[1] Moreno G,Mangione CM.Management of cardiovascular disease risk factors in older adults with type 2 diabetes mellitus: 2002-2012 literature review[J].J Am Geriatr Soc,2013,61(11):2027-2037.
[2] Maiese K.New insights for oxidative stress and diabetes mellitus[J].Oxid Med Cell Longev,2015,2015:875961.
[3] Wu H,Li R,Wei ZH,etal.Diabetes-induced oxidative stress in endothelial progenitor cells may be sustained by a positive feedback loop involving high mobility group Box-1[J].Oxid Med Cell Longev,2016,2016: 1943918.
[4] Ruz M,Carrasco F,Rojas P,etal.Zinc as a potential coadjuvant in therapy for type 2 diabetes[J].Food Nutr Bull,2013,34(2):215-221.
[5] Jansen J,Karges W,Rink L.Zinc and diabetes-clinical links and molecular mechanisms[J].J Nutr Biochem,2009,20(6):399-417.
[6] EI Dib R,Gameiro OL,Ogata MS,etal.Zinc supplementation for the prevention of type 2 diabetes mellitus in adults with insulin resistance[J].Cochrane Database Syst Rev,2015,5: CD005525.
[7] Tabas I,García-Cardea G,Owens GK.Recent insights into the cellular biology of atherosclerosis[J].J Cell Biol,2015,209(1): 13-22.
[8] Martín-Gallán P,Carrascosa A,Gussinyé M,etal.Biomarkers of diabetes-associated oxidative stress and antioxidant status in young diabetic patients with or without subclinical complications[J].Free Radic Biol Med,2003,34(12): 1563-1574 .
[9] Beattie JH,Kwun IS.Is zinc deficiency a risk factor for atherosclerosis?[J]. Br J Nutr,2004,91(2):177-181.
[10] Vanhoutten PM,Zhao Y,Xu A,etal.Thirty years of saying NO: sources,fate,actions,and misfortunes of the endothelium-derived vasodilator mediator[J].Circ Res,2016,119(2): 375-396.
[11] Davenport AP,Hyndman KA,Dhaun N,etal.Endothelin[J].Pharmacol Rev,2016,68(2): 357-418.
[12] Roumenina LT,Rayes J,Frimat M,etal.Endothelial cells: source,barrier,and target of defensive mediators[J].Immunol Rev,2016,274(1): 307-329.
[13] Peng H,Zhong W,Zhao H,etal.Lack of PGC-1α exacerbates high glucose-induced apoptosis in human umbilical vein endothelial cells through activation of VADC1[J].Int J Clin Exp Pathol,2015,8(5): 4639-4650.
[收稿2016-12-13 修回2017-01-03]
(编辑 倪 鹏)
Effects of Zinc sulfate on preventing vascular endothelial cells from oxidative stress
LIUJia,LIXiao-Nan,SUNSi-Ming,WANGYue-Hui.
DepartmentofGeriatrics,theFirstHospitalofJilinUniversity,Changchun130041,China
Objective:To investigate the effects of Zinc sulfate on preventing human umbilical veins endothelial cells (HUVECs) from oxidative stress.Methods: Hydrogen peroxide was used to stimulate HUVECs to build the oxidative stress model in vitro.HUVECs were divided into normal group,H2O2group,Zinc sulfate group and Zinc sulfate treated group.Method of nitrate reductase was used to detect the content of nitric oxide(NO) and ELISA was used to detect the content of endothelin(ET) in supernatant in different groups.The level of HO-1,SOD and CAT of HUVECs were measured by Western blot.Apoptosis of HUVECs was examined by TUNEL as well.Results: Zinc sulfate could enhance the content of NO and decrease the content of ET in the supernatant,which induced by hydrogen peroxide on HUVECs.Zinc sulfate could also increase the level of HO-1,SOD and CAT obviously and decrease the apoptosis cells significantly induced by H2O2.Conclusion: Zinc sulfate play an important role in resisting oxidative stress in HUVECs,and maybe prevent HUVECs from oxidative stress damage.Zinc sulfate is expected to be an effective medicine on improving endothelial cells anti-oxidative ability.
Oxidative stress;Zinc sulfate;Hydrogen peroxide;Endothelial cells
10.3969/j.issn.1000-484X.2017.02.002
①本文受国家自然基金项目(81671378,81470061)和吉林省科技厅中青年科技创新领军人才及团队项目(20140519012JH)资助。
刘 佳(1989年-),女,在读硕士,主要从事糖尿病内皮功能方面研究,E-mail:412132123@qq.com。
及指导教师:王越晖(1970年-),女,博士,教授,硕士生导师,主要从事糖尿病心血管并发症发病机制与防治方面的研究,E-mail: yuehuiwang300@hotmail.com。
R453.9
A
1000-484X(2017)02-0170-04
②吉林农业大学生命科学学院,长春130118。