稻叶提取液促进蛋白核小球藻的生长和色素合成
张毅宁
(杭州市学军中学,浙江杭州 310012)
稻叶提取液促进蛋白核小球藻的生长和色素合成
张毅宁
(杭州市学军中学,浙江杭州 310012)
蛋白核小球藻是开发营养食品和药物的新材料,本文以新鲜稻叶提取液代替蒸馏水配制BG11培养基,研究了不同浓度稻叶提取液对蛋白核小球藻生长和叶绿素a含量的影响,采用SDS-PAGE技术分析了藻细胞蛋白组分变化。结果表明,稻叶提取液在0.5%~2.0%的浓度范围内均能大幅促进蛋白核小球藻的生长,提高藻细胞叶绿素a的含量,并改变藻细胞的蛋白组分。培养8 d后,2.0%稻叶提取液处理组藻细胞浓度是同期对照组的3.13倍,与1%处理组结果相似。培养4 d后,所有处理组藻细胞叶绿素a的含量达到最大值,其中2.0%稻叶提取液处理组藻细胞叶绿素a含量高达14.91 mg·g-1干重,是对照组的2.58倍。稻叶提取液培养使蛋白核小球藻细胞8种主要蛋白组分相对含量降低,同时产生了4种新蛋白组分。本文结果为水稻叶片的开发应用和蛋白核小球藻的生产养殖提供了新思路。
稻叶提取液;蛋白核小球藻;生长;叶绿素a;蛋白组分
蛋白核小球藻(Chlorella pyrenoidosa)属于绿球藻目小球藻科小球藻属,营养丰富,细胞干物质中蛋白质占50%~65%,油脂占5%~10%,碳水化合物占10%~20%,含有大量具有抗氧化活性的维生素,如维生素C和维生素E,被FAO命名为绿色健康食品[1]。从蛋白核小球藻中还分离出具有增强机体免疫力、抑制肿瘤、降血压、血球凝集素等功效的生物活性成分[2-4],因此,蛋白核小球藻已成为开发营养食品和药物的新材料,我国于2012年批准人工养殖的蛋白核小球藻为新型食品资源。此外,小球藻油脂产率约是所有陆生作物品种的10~100倍,是开发生物柴油的优质原料[5]。如何促进蛋白核小球藻生长、提高其生物量已成为国内外研究的热点。研究发现,天然植物提取液具有促进小球藻生长的效应。郭长城等[6]从芦苇粗提液中分离出能促进蛋白核小球藻生长的生物活性物质;李庆华等[7]发现,采用低浓度的柳树叶浸提液培养7 d可使蛋白核小球藻密度提高16.9%~30.9%。应用植物粗提物提高小球藻的生物量具有成本低廉、操作方便等优点,对小球藻的生产具有重要价值。
水稻是我国的主要农作物,光合作用效率高,植株生长快,分蘖期叶片产量大。Li等[8]报道水稻秸秆酶解物能显著促进蛋白核小球藻的生长,培养48 h后,蛋白核小球藻生物量和油脂产率均比对照提高约2倍。本文以分蘖期的水稻鲜叶为材料,初步研究了稻叶提取液对蛋白核小球藻生长速率、叶绿素a含量和细胞蛋白质组分的影响,为稻叶的应用和蛋白核小球藻的开发提供支持。
1 材料与方法
1.1 材料
水稻品种日本晴种植于浙江省富阳市中国水稻研究所试验基地,取分蘖盛期叶片,置于60℃烘箱中烘干24 h,然后将水稻叶片粉碎,过40目筛(筛孔径0.25~0.50 mm)得到稻叶干粉,密封于干燥容器中避光备用。蛋白核小球藻藻种购于武汉水生生物研究所淡水藻种库。
1.2 方法
1.2.1 稻叶提取液的制备
称取水稻叶片干粉2.5、5、10 g,分别加500 m L蒸馏水在黑暗中室温(25℃)浸提48 h,提取液用布氏漏斗经普通定性滤纸抽虑,用蒸馏水定容至500 m L,得到质量比为0.5%、1.0%、2.0%的稻叶提取液。
1.2.2 培养方法
采用BG11基本培养基,处理组以稻叶提取液代替蒸馏水配制BG11培养基,121℃高压灭菌后,分装至100 m L三角瓶中,每瓶50 m L培养基,在无菌条件下分别接入处于对数生长期的蛋白核小球藻藻种,细胞初始接种浓度为2×106个·mL-1。在温度为26℃、光照/黑暗为16 h/8 h的光周期条件下培养,早上与晚上各摇瓶1次。于培养的第0、2、4、6、8天进行细胞生长量和叶绿素a含量测定,每组试验设3个重复,结果取平均值。
1.2.3 小球藻生长量和细胞叶绿素a含量测定
蛋白核小球藻的生长量测定采用血球板计数法和细胞干重法。30 m L藻细胞培养液8 000 r· m in-1离心10 min后去上清,在60℃烘箱中干燥至恒重,称取对应的藻细胞干重(W)。藻细胞叶绿素a的提取和含量的测定方法参照文献[9]。取5 m L藻液,8 000 r·min-1离心10 min,弃上清;将藻细胞沉淀重悬于5 mL甲醇中,置于4℃冰箱中过夜提取小球藻叶绿素a,次日离心取上清。以甲醇为参比,在波长665 nm处测定吸光度值(D665)。应用以下公式计算细胞叶绿素a含量:
叶绿素a/(mg·g-1)=13.9×D665/W。
1.2.4 蛋白核小球藻蛋白质组分的SDS-PAGE电泳分析
以添加1%稻叶提取液培养至第8天的藻细胞为材料,蛋白核小球藻蛋白提取根据王伟等[10]方法略加修改。取30 m L藻培养液于8 000 r·m in-1离心10 min收集藻细胞,加入300μL SDS样品提取缓冲液(64 mmol·L-1Tris-HCl,2%SDS,10%甘油,5%巯基乙醇,pH 6.8),通过4次加热(95℃,2 min)/冷冻(-20℃,5 min)循环破碎小球藻细胞,置室温下浸提0.5 h,然后离心(12 000 r·min-1,5 min)除去不溶物,上清即为蛋白提取液。应用文献[11]的方法进行蛋白质含量的测定,根据样品提取液的蛋白浓度进行适当调整,保证每泳道蛋白上样量一致,均为30μg。
蛋白组分的SDS-PAGE电泳参照Laemm li方法[12]。分离胶浓度为10%,浓缩胶为5%,电泳后的凝胶用考马斯亮蓝染色液染色1 h,再采用脱色液(10%乙醇和10%乙酸)脱色约4 h至条带清晰,拍照记录结果,并根据蛋白质分子量标准物迁移率计算蛋白组分的相对分子量。蛋白质分子量标准物购于Takala公司。
2 结果与分析
2.1 对蛋白核小球藻生长的影响
图1表明,稻叶提取液在8 d培养期内均能促进蛋白核小球藻的生长。对照组小球藻在前2 d增殖缓慢,至第4天增殖开始加速,第8天培养液藻细胞浓度达到2.98×107个·m L-1,较初始接种藻细胞浓度增加了14.9倍。稻叶提取液在0.5%~2.0%能使小球藻的生长速率明显加快,第2天时,3个处理组藻浓度与对照组相比显著增高,说明在培养初期就有促进效果。前2 d内,0.5%和2.0%稻叶提取液对小球藻的生长促进幅度相近,均低于1.0%添加浓度;第2~4天内,小球藻生长速率与稻叶提取液浓度表现为正相关;此后,1.0%和2.0%稻叶提取液对小球藻的生长促进效应相近,显著高于0.5%稻叶提取液处理组;第8天时,1.0%和2.0%稻叶浸提物的处理组藻浓度分别达到9.51×107和9.33×107个·m L-1,是同期对照组的3.19和3.13倍。而0.5%低浓度处理组到第6天时,对小球藻生长的促进效果最大,藻浓度比同期对照增加了1.42倍,之后趋于平缓。
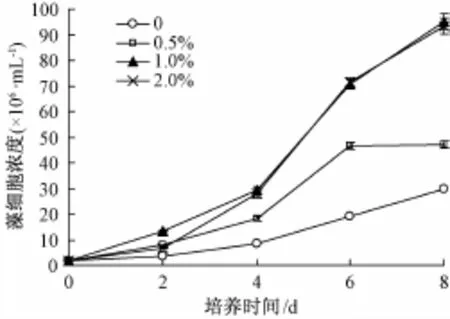
图1 稻叶提取液对蛋白核小球藻藻细胞生长的影响
2.2 对蛋白核小球藻叶绿素a含量的影响
8 d培养期内稻叶提取液对蛋白核小球藻细胞叶绿素a含量的影响结果如图2。

图2 稻叶提取液对蛋白核小球藻叶绿素a含量的影响
图2显示,对照组蛋白核小球藻在0~8 d生长期内,叶绿素a含量在5.26~5.96 mg·g-1变动,相对稳定。除0.5%稻叶提取液处理6~8 d对小球藻叶绿素a含量的影响不明显之外,其他处理组藻细胞叶绿素a的含量均有较大幅度提升。前2 d以1.0%稻叶提取液对藻细胞叶绿素a含量的促进效果最佳,这和小球藻的生长表现一致。第4天,几乎所有处理组藻细胞叶绿素a的含量达到最大峰值,2.0%稻叶提取液处理组藻细胞叶绿素a含量高达14.91 mg·g-1干重,同比分别是1.0%和0.5%处理组的1.34和2.09倍,是对照组的2.58倍。6 d后,1.0%和2.0%稻叶提取液处理组藻细胞叶绿素a含量增幅开始下降,至8 d时,仍显著高于对照,同比分别是对照的1.64和2.18倍。
2.3 对蛋白核小球藻蛋白质组分的影响
蛋白质是基因表达的产物,与藻类细胞的生长环境和生理状态密切相关,培养基中的有效成分可能通过影响细胞蛋白组分而发挥功能。以培养至第8天的藻细胞为材料,应用SDS-PAGE技术分析1%稻叶提取液对蛋白核小球藻细胞蛋白组分的影响,结果如图3。由于对照组和处理组电泳时上样量均为30μg蛋白,因此电泳图谱上条带数目和颜色深浅的差异能直接反映藻细胞蛋白组分和相对含量的变化。
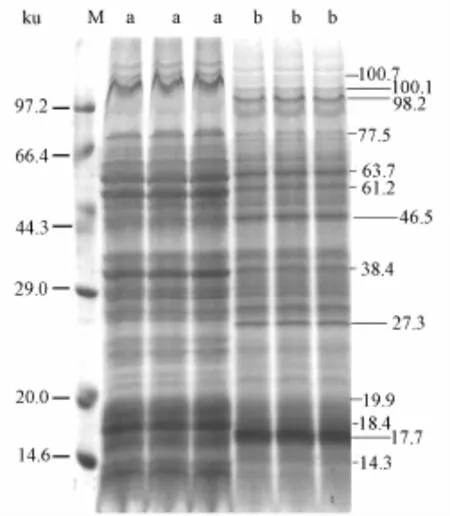
图3 稻叶提取液对蛋白核小球藻蛋白质组分的影响
从图3可知,对照组藻细胞含有丰富的蛋白质组分,分子量分布范围从14.3~110.5 ku(样品a)。相比对照组,经稻叶提取液处理的藻细胞蛋白组分发生了明显变化(样品b),主要表现为分子量大于100.7 ku的条带和分子量为77.5、63.7、61.2、38.4、19.9、18.4和14.3 ku的变淡或消失,说明这些组分蛋白质相对含量降低;另一方面,稻叶提取液处理组的蛋白核小球藻细胞46.5 ku蛋白条带颜色变浓,相对含量增加,还出现了分子量分别为100.1、98.2、27.3和17.7 ku的4种新蛋白组分。
3 小结与讨论
天然植物提取液中既含有抑制蛋白核小球藻生长的生物活性物质,也含有促进蛋白核小球藻生长的活性物质[6-7]。本文研究发现,鲜稻叶提取液对蛋白核小球藻的生长具有显著的促进作用。第8天时,1.0%和2.0%稻叶浸提物的处理组藻浓度分别达到同期对照组的3.19和3.13倍,促进效果优于前人报道的芦苇活性组分(2.79倍)[6]、柳树叶浸提液(1.31倍)[7]和水稻秸秆酶解液(2.00倍)[8]。稻叶提取液促进蛋白核小球藻生长的原因一方面可能是其中的糖类、蛋白质等营养物质提供了优质碳源和/或氮源;另一方面稻叶提取液可能含有内源激素或其他生物活性成分,这些成分改变了蛋白核小球藻的基因表达模式,从而加速了细胞生长和分裂。本研究发现添加稻叶提取液后,蛋白核小球藻细胞的蛋白组分确实发生了明显改变,说明稻叶提取液中存在改变藻细胞基因表达模式的生物活性物质。
藻体中叶绿素a含量往往与藻细胞生长状态和光合作用密切相关,是藻类生长的特征参数[6]。本文以藻细胞干重的叶绿素a含量为指标,发现藻细胞生长量与细胞叶绿素a含量的增加趋势并不完全一致。如在培养的2~4 d,对照组和稻叶提取液1.0%处理组,藻细胞仍在增殖,但叶绿素a含量维持恒定;在培养4~8 d,藻细胞生长量仍在增加,但叶绿素a含量维持恒定之后下降或直接下降,说明稻叶提取液对藻细胞分裂速度、细胞干物质积累量和细胞叶绿素合成的影响并不完全同步。但总体上,稻叶提取液处理能使藻细胞叶绿素a的含量明显提高,如第4天,2.0%稻叶提取液处理组藻细胞叶绿素a含量高达14.91 mg·g-1,干重同比达到对照组的2.58倍,至8 d时,同比为对照的2.18倍,效果极为显著。
本研究表明,稻叶提取液能显著促进蛋白核小球藻的生长,提高其生物量和叶绿素a含量。我国是农业生产大国,农作物种植面积大,叶片易收获,将农作物叶片提取液应用于培养营养物质丰富的蛋白核小球藻,这为蛋白核小球藻的生产养殖提供了新思路。
[1] HU Q,PAN B,XU J,et al.Effects of super critical carbon dioxide extraction conditions on yields and antioxidant activity of Chlorella pyrenoidosa extracts[J].Journal of Food Engineering,2007,80(4):997-1001.
[2] 汪炬,蒲含林,洪岸,等.蛋白核小球藻提取物的抑瘤作用及对免疫功能的影响[J].营养学报,2004,26(2):136-138.
[3] YANG S C,YANG H Y,YANC Y C,et al.Chlorella pyrenoidosa ameliorated L-NAME-induced hypertension and cardiorenal remodeling in rats[J].European Journal of Nutrition,2013,52(2):601-608.
[4] CHU C Y,HUANG R,LING L P.Purification and characterization of a novel haemagglutinin from Chlorella pyrenoidosa[J].Journal of Industrial M icrobiology and Biotechnology,2006,33(11):967-973.
[5] TATE J J,GUTIERREZ-W ING M T,RUSCH K A,et al. The effects of p lant growth substances and mixed cultures on growth and metabolite production of green algae Chlorella sp.:a review[J].Journal of Plant Growth Regulation,2012:1-12.
[6] 郭长城,李鑫,胡洪营.芦苇生物活性组分对小球藻生长的促进效应[J].中国环境科学,2009,29(11):1186-1189.
[7] 李庆华,郭沛涌,田美燕,等.柳树叶浸提液对蛋白核小球藻的化感作用[J].生态学杂志,2009,28(5):884-888.
[8] LIP,M IAO X,LIR,et al.In situ biodiesel p roduction from fast-growing and high oil con tent Chlorella pyrenoidosa in rice straw hyd rolysate[J].Journal of Biomedicine and Biotechnology,2011.doi:10.1155/2011/141207.
[9] LICH IENTHALER H K.Chlorophylls and carotenoids:Pigmenis of photosynthetic biomembranes[J].Methods in Enzymology,1987,148(1):350-382.
[10] 王伟,林均民,王伟岗.不同光质下中华盒形藻蛋白质合成的SDS-PAGE初步分析[J].台湾海峡,1999,18(1):67-70.
[11] BRADFORD M M.A rapid and sensitive method for the quan titation of microgram quantities of protein u tilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[12] LAEMMLI U K.Cleavage of structural p roteins during the assembly of the head of bacteriophage T4[J].Natu re,1970,227(5259):680-685.
(责任编辑:张瑞麟)
S963
A
0528-9017(2017)01-0176-04
文献著录格式:张毅宁.稻叶提取液促进蛋白核小球藻的生长和色素合成[J].浙江农业科学,2017,58(1):176-179.
10.16178/j.issn.0528-9017.20170155
2016-08-30
张毅宁(1999-),男,浙江杭州人,在校学生,进行小球藻应用研究科技实践活动,E-mail:815975625@qq.com。
注:中国水稻研究所国家水稻生物学重点实验室为本研究提供了水稻材料,杭州师范大学生命与环境科学学院于彦春教授在实验操作和论文写作方面给予了指导,特此表示感谢!

