米非司酮对孕激素受体M阳性子宫肌瘤细胞增殖、凋亡的影响
封全灵,熊祯祯,王智霆,张倩雯,刘弘扬,胡兴韶,倪凌佩
(郑州大学第三附属医院,郑州450052)
米非司酮对孕激素受体M阳性子宫肌瘤细胞增殖、凋亡的影响
封全灵,熊祯祯,王智霆,张倩雯,刘弘扬,胡兴韶,倪凌佩
(郑州大学第三附属医院,郑州450052)
目的 观察米非司酮对孕激素受体M(PR-M)阳性子宫肌瘤细胞增殖、凋亡的影响。方法 收集因子宫肌瘤行全子宫切除术患者的子宫肌瘤标本,原代培养子宫肌瘤细胞成功后,采用Western blotting法筛选出PR-M阳性细胞(阳性组)和PR-M阴性细胞(阴性组)。取对数生长期的两组细胞,分别加入0、1×10-6、1×10-5、1×10-4mol/L的米非司酮,培养48 h后采用MTT法观察细胞增殖抑制情况,采用流式细胞仪观察细胞凋亡情况。结果 米非司酮作用24 h后子宫肌瘤细胞生长明显减慢,细胞开始皱缩,48 h后细胞开始碎解。随米非司酮浓度增加,两组细胞增殖抑制率和凋亡率均逐渐增加(P均<0.05)。当米非司酮浓度>1×10-6mol/L时,阳性组细胞增殖抑制率和凋亡率低于阴性组(P均<0.05)。结论 米非司酮用药后PR-M阳性的子宫肌瘤细胞增殖受到抑制、凋亡增多,但与PR-M阴性细胞相比,增殖、凋亡变化程度较小。
米非司酮;孕激素受体M;子宫肌瘤细胞;细胞增殖;细胞凋亡
孕激素受体M(PR-M)是2003年发现的定位于细胞核外线粒体的孕激素受体[1]。研究[2,3]发现孕激素可诱导PR-M使线粒体膜电位增加,抑制乳腺癌细胞、原代及永生化子宫平滑肌细胞的凋亡。我们前期研究[4]发现PR-M、孕激素受体A(PR-A)和孕激素受体B(PR-B)在子宫肌瘤组织中的表达均显著高于瘤旁正常子宫平滑肌组织,提示孕激素可能通过孕激素受体促进子宫肌瘤生长,这种作用可被孕激素受体拮抗剂(如米非司酮)阻断。本研究在上述研究基础上,培养原代子宫肌瘤细胞并筛选PR-M阳性细胞,观察米非司酮对PR-M阳性子宫肌瘤细胞增殖、凋亡的影响,现报告如下。
1 材料与方法
1.1 主要实验材料 随机选取2015 年9月~2016年6月在我院因子宫肌瘤行腹腔镜下全子宫切除术或腹式肌瘤挖除术的患者10例,年龄33~50岁,均无其他性激素相关合并症,术前至少6个月内未服用类固醇激素。标本收集均经患者知情同意。术中无菌条件下取体积约1 cm3的肌瘤组织2~4块,立即置于4 ℃含双抗的DMEM培养基中。米非司酮,DMEM,DMEM-F12培养基,胎牛血清,四甲基偶氮唑蓝(MTT),青、链霉素,胰蛋白酶-EDTA,PBS,Ⅰ型胶原酶,SP试剂盒,DAP染色试剂盒。
1.2 子宫肌瘤细胞的分离培养及鉴定 根据文献[5,6]方法并加以改良。将子宫肌瘤组织块放入含双抗PBS液的无菌培养皿中浸泡3~5 min后漂洗3次,剪碎组织,加入组织体积3~5倍的Ⅰ型胶原酶(浓度0.2%),37 ℃水浴消化2~3 h,加入完全培养基终止消化,用200目不锈钢细胞筛过滤收集滤液,1 000 r/min离心10 min后弃上清,加入10%浓度的完全培养基,37 ℃、5% CO2培养箱中孵育培养。培养24 h后待细胞贴壁进行第1次换液,以后每2~3 d换液1次,待细胞融合达80%时用0.25%胰蛋白酶-EDTA消化传代。倒置相差显微镜下观察细胞形态:密集处多呈旋涡状生长,并出现层叠排列及典型的“峰-谷”样现象。待第3代细胞长满后制作单细胞悬液,接种于带6孔板的盖玻片上,待细胞融合度在70%~80%时吸弃培养基,采用免疫组化染色,镜下观察鉴定子宫肌瘤细胞(见图1)。
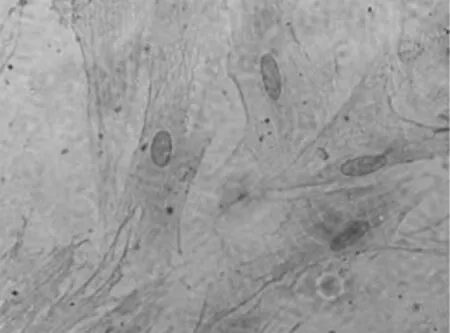
图1 倒置相差显微镜下子宫肌瘤细胞形态(免疫组化染色,400×)
1.3 PR-M阳性子宫肌瘤细胞的筛选 采用Western blotting法。取第3代子宫肌瘤细胞,接种于6孔板中,培养细胞融合至80%~90%时,提取细胞总蛋白,取25 μg/孔进行10% SDS-PAGE凝胶电泳,然后将蛋白质电转移至NC膜上,5%脱脂奶粉室温封闭1 h,TBST漂洗3次,加入1∶800稀释的PR兔源多克隆抗体,4 ℃冰箱过夜,加入1∶4 000稀释的红色荧光标记的羊抗兔IgG,室温反应2 h,TBST漂洗,采用Odyssey双色红外荧光成像系统扫描并分析蛋白条带灰度值,从而筛选出PR-M阳性细胞(阳性组,反表达PR-M、不表达PR-A/B)和PR-M阴性细胞(阴性组,无PR-M表达、有PR-A/B表达)。
1.4 米非司酮用药后子宫肌瘤细胞增殖情况观察 收集对数生长期的阳性组和阴性组细胞,以1×104/孔接种于96孔板,分别加入0、1×10-6、1×10-5、1×10-4mol/L的米非司酮,培养48 h后倒置显微镜下动态观察细胞生长情况。酶标仪在450 nm波长测定各孔光密度(OD)值,重复3次,取均值。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.5 米非司酮用药后子宫肌瘤细胞凋亡情况观察 收集对数生长期的阳性组和阴性组细胞,以2.5×105/mL接种于6孔板,培养24 h;待细胞贴壁后,分别加入终浓度为0、1×10-6、1×10-5、1×10-4mol/L的米非司酮,每组设3个重复孔。培养48 h后收集细胞,加入适量的PBS缓冲液,1 500 r/min离心5 min,弃上清,此步骤反复2次。加入500 μL的Binding Buffer悬浮细胞,再加入5 μL的Annexin V混匀后,加入5 μL的PI,混匀;反应15 min后,于1 h内采用流式细胞仪观察Annexin V/PI染色阳性细胞数,计算其占总细胞数百分比,即为细胞凋亡率。
2 结果
2.1 米非司酮用药后子宫肌瘤细胞增殖变化 米非司酮用药24 h后细胞生长明显减慢,细胞开始皱缩,48 h后细胞开始碎解。且随米非司酮浓度增加,两组细胞增殖抑制率均逐渐增加(P均<0.05)。当米非司酮浓度>1×10-6mol/L时,阳性组细胞增殖抑制率低于阴性组(P均<0.05)。详见表1。
2.2 米非司酮用药后子宫肌瘤细胞凋亡变化 随着非米司酮浓度增加,两组细胞凋亡率均逐渐增高(P均<0.05)。当米非司酮浓度>1×10-6mol/L时,阳性组细胞凋亡率低于PR-M阴性组(P均<0.05)。详见表1。
3 讨论
体外培养的子宫肌瘤细胞是研究子宫肌瘤发病机制和治疗药物的理想材料,但由于子宫肌瘤并非恶性肿瘤,缺少无限增殖的特性,高纯度且生长状态稳定的肌瘤细胞的提取与培养是一个难题。本研究参考文献[5,6]的方法,通过缩短标本送实验室时间及消化前清洗处理时间,提高了细胞提取率和细胞纯度,扩大了细胞数量,成功建立了子宫肌瘤体外细胞模型。
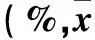
表1 不同浓度米非司酮用药后两组细胞增殖抑制率和凋亡率比较±s)
Ishikawa等[7]推断子宫肌瘤体积的维持和增大受孕激素影响,孕激素可能通过增加细胞外基质量并延长细胞寿命而发挥作用。PR-M结构上较传统孕激素受体PR-A、PR-B缺少氨基末端的A/B结构域、核定位信号区和DNA结构域,仅有激素结合结构域和铰链区;另外,PR-M氨基末端存在由16个氨基酸构成的线粒体定位序列,这可能与其特有的线粒体定位功能相关[8]。有研究[9]表明,孕激素可以剂量依赖的形式诱导原代培养和永生化子宫平滑肌细胞线粒体膜电位增加,且这种反应能被孕激素受体拮抗剂所抑制。PR-M在孕激素诱导下能控制细胞呼吸,增加细胞能量的产生,从而供细胞存活和增殖[10]。有学者[11]提出孕激素受体能直接激活信号通路引起子宫肌瘤细胞增殖。我们前期研究[12]发现PR-M在子宫肌瘤中的表达明显高于瘤旁组织,提示孕激素可能通过PR-M增强子宫肌瘤细胞的能量代谢,导致细胞异常增殖[13]。PR-M阳性子宫肌瘤细胞异常增殖和凋亡抑制机制可能与激活Fas/FasL通路有关,同时伴随Caspase-3、Caspase-7活性下调。米非司酮是炔诺酮11-β-二甲基-氨基-苯基衍生物,可调节孕激素受体表达,阻滞子宫肌瘤细胞于G0/G1期,从而抑制细胞增殖、促进其凋亡[14]。
本研究在原代培养的子宫平滑肌瘤细胞中发现了PR-M,分别筛选出PR-M阳性和阴性的子宫肌瘤细胞,加入不同浓度的米非司酮作用,观察细胞增殖和凋亡情况。本研究结果显示,米非司酮作用24 h后细胞生长明显减慢,细胞开始皱缩,48 h后细胞开始碎解;随米非司酮浓度增加,两组细胞增殖抑制率和凋亡率均逐渐增加;当米非司酮浓度>1×10-6mol/L时,阳性组细胞增殖抑制率和凋亡率均小于阴性组。由此可见,米非司酮对PR-M阳性的子宫肌瘤细胞具有增殖抑制和促凋亡作用,作用呈剂量依赖性,作用强度较PR-M阴性细胞弱。我们推测孕激素可能通过PR-M抑制子宫肌瘤细胞凋亡、促进子宫肌瘤发生发展,这种作用可被孕激素受体拮抗剂阻断,具体机制和相关信号通路仍待进一步探索发现。
[1] Saner KJ, Welter BH, Zhang F, et al. Cloning and expression of a novel, truncated, progesterone receptor[J]. Mol Cell Endocrinol, 2003,200(1-2):155-163.
[2] Tantibhedhyangkul J, Hawkins KC, Dai Q, et al. Expression of a mitochondrial progesterone receptor in human spermatozoa correlates with a progestin-dependent increase in mitochondrial membrane potential[J]. Andrology, 2014,2(6):875-883.
[3] Kim JJ, Kurita T, Bulun SE. Progesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer[J]. Endocr Rev, 2013,34(1):130-162.
[4] 封全灵,刘弘扬.孕激素受体和线粒porin蛋白在子宫肌瘤组织中的表达[J].现代妇产科进展,2013,22(11):897-899.
[5] 韩虹娟,李冬华,钱睿亚,等.人子宫肌瘤细胞原代培养方法的比较研究[J].中国妇幼保健,2014,29(22):3656-3659.
[6] Wu HL, Chuang TY, Al-Hendy A, et al. Berberine inhibits the proliferation of human uterine leiomyoma cells[J]. Fertil Steril, 2015,103(4):1098-1106.
[7] Ishikawa H, Ishi K, Serna VA, et al. Progesterone is essential for maintenance and growth of uterine leiomyoma[J]. Endocrinology, 2010,151(6):2433-2442.
[8] Dai Q, Shah AA, Garde RV, et al. A truncated progesterone receptor (PR-M) localizes to the mitochondrion and controls cellular respiration[J]. Mol Endocrinol, 2013,27(5):741-753.
[9] Patel B, Elguero S, Thakore S, et al. Role of nuclear progesterone receptor isoforms in uterine pathophysiology[J]. Hum Reprod Update, 2015,21(2):155-173.
[10] Feng Q, Crochet JR, Dai Q, et al. Expression of a mitochondrial progesterone receptor (PR-M) in leiomyomata and association with increased mitochondrial membrane potential[J]. J Clin Endocrinol Metab, 2014,99(3):E390-E399.
[11] Kim JJ, Sefton EC. The role of progesterone signaling in the pathogenesis of uterine leiomyoma[J]. Mol Cell Endocrinol, 2012,358(2):223-231.
[12] 封全灵,刘弘扬.子宫平滑肌瘤组织中孕激素受体和porin mRNA的表达[J].郑州大学学报(医学版),2014(1):116-118,119.
[13] Price TM, Dai Q. The Role of a Mitochondrial Progesterone Receptor (PR-M) in Progesterone Action[J]. Semin Reprod Med, 2015,33(3):185-194.
[14] Cuevas CA, Tapia-Pizarro A, Salvatierra AM, et al. Effect of single post-ovulatory administration of mifepristone (RU486) on transcript profile during the receptive period in human endometrium[J]. Reproduction, 2016,151(4):331-349.
Effects of mifepristone on proliferation and apoptosis of progesterone
receptor M positive uterine leiomyoma cellsFENGQuanling,XIONGZhenzhen,WANGZhiting,ZHANGQianwen,LIUHongyang,HUXingshao,NILingpei
(TheThirdAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To observe the effect of mifepristone on proliferation and apoptosis of progesterone receptor M (PR-M) positive uterine leiomyoma cells. Methods The specimen were collected from patients undergoing hysterectomy because of uterine fibroids. After the uterine leiomyoma cells were successful primarily cultured, the PR-M positive cells (positive group) and PR-M negative cells (negative group) were screened by Western blotting. Cells in the logarithmic growth phase of two groups were added with 0.1, 1×10-6, 1×10-5and 1×10-4mol/L mifepristone, respectively. After 48-hour culture, the inhibition of cell proliferation was observed by MTT, and the apoptosis was observed by flow cytometry.Results The growth of uterine leiomyoma cells slowed down and began to shrink after treatment of mifepristone for 24 h, and began to break at 48 h. With the increasing concentrations of mifepristone, the cell proliferation inhibition rate and apoptosis rate were increased gradually in the two groups (allP<0.05). When the concentration of mifepristone >1×10-6mol/L, the proliferation inhibition rate and the apoptosis rate of cells in the positive group was lower than that of the negative group (allP<0.05).Conclusion The proliferation is inhibited and the apoptosis increased in the PR-M positive uterine leiomyoma cells after mifepristone intervention, but the degree changed less as compared with PR-M negative cells.
mifepristone; progesterone receptor M; uterine leiomyoma cells; cell proliferation; apoptosis
河南省高等学校重点科研项目计划(16A320047)。
封全灵(1965-),女,博士,教授,主任医师,主要研究方向为妇科肿瘤及内分泌基础与临床。E-mail: 614992855@qq.com
封全灵
10.3969/j.issn.1002-266X.2017.03.004
R711.7
A
1002-266X(2017)03-0013-03
2016-09-19)

