综合生物防控烟草青枯病及其对土壤微生物群落结构的影响*
李 想 刘艳霞陆 宁 蔡刘体 袁有波 石俊雄
(贵州省烟草科学研究院,贵阳 550000)
综合生物防控烟草青枯病及其对土壤微生物群落结构的影响*
李 想 刘艳霞†陆 宁 蔡刘体 袁有波 石俊雄
(贵州省烟草科学研究院,贵阳 550000)
利用生物有机肥结合相应的农艺措施进行生物防控是近年来的研究热点。分别采用常规施肥(T1)、常规施肥+生石灰(T2)、常规施肥+L-25生物有机肥(T3)、常规施肥+生石灰+ L-25生物有机肥(T4)四个处理来探究生物防控烟草青枯病的效果。结果表明:2014年T4处理在烟草全生育期的防控效果显著高于T2和T3处理,在90d后防控效果分别是T2和T3的6.26倍和1.99倍。经过三年修复,青枯病综合防控效果高达61.3%。2013年和2014年T4处理产量显著高于其他各处理。2013年生物有机肥各处理的拮抗菌在70 d之前均显著高于各自对应的病原菌数量,2014年T4病原菌数量则始终处于106cfu g-1数量级以下,其他处理在烟草移栽90 d后病原菌数量均增长至107cfu g-1以上。T4处理的根际土壤微生物物种丰度水平、运算分类单位(OTU)、香农多样性指数(Shannonindex)均高于T1处理,主成分与聚类分析表明T3和T4处理的微生物区系结构相似,明显不同于T1处理。综合的生物防控措施可以有效防控重病区青枯病,对烤烟产量产值具有明显的提高作用,并能有效改良土壤微生物区系,具有良好的推广应用前景。
烟草青枯病;综合防控;病原菌;拮抗菌;根际微生物平衡
烟草青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的一种以土壤传播为主的毁灭性细菌性烟草病害,烟草青枯病是影响贵州烟叶生产的最主要的细菌性病害[1]。近年来,随着科技进步和人们环保意识的加强,生物防控方法逐渐引起了人们的重视,目前对青枯病病原菌的防控都停留在实验室中拮抗菌对病原菌的平板拮抗作用,直接应用于温室试验或田间试验的防控效果甚微,Anuratha和Gnanamanickam[2]将平板筛选得到的荧光假单胞杆菌直接用于田间试验,其对番茄青枯病的防控率仅为36%左右。
拮抗菌单独施入土壤后不易定殖,提高拮抗菌在土壤根际的定殖成为生物防控的研究重点。目前主要采用施用拮抗菌结合有机肥或经过2次发酵制成生物有机肥调节土壤微生态、改善土壤微生物多样性、抑制病原菌的生长或提高植物自身抗性,从而抑制病害的发生[3-4]。Qiu等[5]利用生物有机肥显著降低黄瓜枯萎病的发病率并改善土壤的微生物群落结构;Zhao等[6]利用SQR21拮抗菌的生物有机肥降低西瓜枯萎病真菌尖镰孢菌的数量级进而达到防控效果;Wu等[7]利用解淀粉芽孢杆菌和枯草芽孢杆菌制成生物有机肥施用抑制病原菌的生长取得很好的防控效果;Ding等[8]研制的BIO-36和BIO-23生物有机肥防控马铃薯青枯病防控效果分别可以达到96%和91%。但由于环境的复杂性及单一防控措施的局限性对病害发病严重田块的防控效果并不理想[9],比如李红丽等[10]研制的抑制烟草青枯病生物有机肥在2005年的抑制烟草青枯病效果不显著。采用综合防控的方法能够消除单一措施带来的短板效应,是实现土传病害生物防控的有效措施之一[11-12]。
本研究采用综合防控手段对烟草青枯病发病严重的烟田进行三年长期定位修复,并通过研究土壤中病原菌与拮抗菌的消长关系及土壤微生物区系变化特征,探索综合防控对烟草青枯病的有效防控修复机理。
1 材料与方法
1.1 供试材料
烟草品种采用云烟85,该品种品质好但易感青枯病。拮抗菌采用前期自健康烟草根际土壤分离筛选到的L-25(短短芽孢杆菌,Brevibacillus brevis),L-25经中国微生物菌种保藏管理委员会普通微生物中心保藏(CGMCC No.3175)[13]。有机肥载体为菜粕酶解的氨基酸有机肥与牛粪以1∶1(质量比)混合,含有机质338 g kg-1、氨基酸43.0g kg-1、N 42.0g kg-1、P2O522.6g kg-1和K2O 10.8g kg-1。
1.2 抑制烟草青枯病型生物有机肥的制备
将拮抗菌L-25接种于牛肉膏蛋白胨液体培养基,三角瓶装液量为1/5,30℃、170 r min-1振荡48 h。将上述发酵液6 000×g离心10 min,收集菌体按5%接种量接种于灭菌后的有机肥载体。调节有机肥含水量为40%,发酵5~6 d,定期翻抛。发酵结束后,通过荧光定量PCR测定L-25生物有机肥有效活菌数及拮抗菌数量,重复3次(表1)[14]。
1.3 田间试验设计
分别于2012―2014年在贵州省黔南州长顺县广顺镇石洞村(26.03°N,106.45°E)连续开展三年长期定位修复试验。所选的长期定位修复试验点试验前青枯病发病率达到100%,连续1 0年以上种植烤烟,当年已经决定不再种植烟草。田间试验共设四个处理:常规施肥(T1):只施用975 kg hm-2的烟草专用复合肥料(N∶P2O5∶K2O=10∶15∶25);常规施肥+生石灰(T2):在T1处理基础上在移栽前20天施用600 kg hm-2生石灰调节土壤pH;常规施肥+L-25生物有机肥(T3):在施用817.5 kg hm-2烟草专用复合肥料基础上加施375 kg hm-2的L-25生物有机肥,磷和钾不足的部分分别用过磷酸钙和硫酸钾补齐;常规施肥+生石灰+ L-25生物有机肥(T4):在移栽前20天施用600 kg hm-2生石灰调节土壤pH,施肥处理与T3相同。

表1 拮抗菌二次发酵前后微生物数量Table 1 Counts of microbes before and after the secondary fermentation of antagonistic bacteria(cfu g-1)
供试土壤类型为普通黄色湿润铁铝土。pH 5.45,有机质48.6 g kg-1,全氮2.29 g kg-1,碱解氮158 mg kg-1,有效磷48.9 mg kg-1,速效钾543 mg kg-1。每处理4个重复区组,每区组120株烟株,加保护行等共占地0.05 hm2。田间管理及追肥的施用与当地其他烟田相同。
1.4 田间试验病害调查及相关性状测量
分别于烟草移栽后40~90 d,每隔10 d观测烟草发病情况并测定根际土壤微生物病原菌与拮抗菌数量及群落结构和功能多样性,烟叶采摘并烘烤后计算各处理产量。
青枯病调查分级标准(以株为单位):调查病情指数以及防控效果,采用刘艳霞等[14]方法进行测定。病情指数与防控效果的计算如下:

烟草移栽后约60~70 d,叶片开始自下而上逐渐成熟,根据烟叶成熟情况由下至上分次采收并放于烤房中烘烤,烘烤后计算其产值量[15]。
1.5 土壤病原菌与拮抗菌数量的检测
土壤基因组D N A采用土壤欧米伽D N A提取试剂盒(Soil DNA Isolation Kit,Omega)提取,采用1%琼脂糖凝胶电泳检测D N A的纯度和浓度。以样品D N A作为扩增模板,分别用病原菌(R. s o l a n a c e a r u m)特异引物(flicF:GAACGCCAACGGTGCGAACT;flicR:GGCGGCCTTCAGGGAGGTC)与拮抗菌(B.b re v i s)的特异性引物(B r e-F:AGACCGGGATAACATAGGGAAACTTAT;Bre-R:GGCATGCTGATCCGCGATTACTAGC)在荧光定量PCR仪(StepOne Plus Real-time PCR System,ABI,美国)上进行扩增反应,反应结束后确认扩增曲线和融解曲线,记录每个样品的Ct值,并将Ct值代入标准曲线方程,计算出样品模板的初始基因拷贝数,最终换算出每克干土的茄科劳尔氏菌或短短芽孢杆菌的基因拷贝数[12]。
荧光定量PCR结果显示,茄科劳尔氏菌的扩增效率达到91.0 %,短短芽孢杆菌的扩增效率达到100%,标准曲线R2>0.99。茄科劳尔氏菌标准曲线方程为Ct=-3.56C0+38.7,短短芽孢杆菌标准曲线方程为:Ct=-3.32C0+37.2。
1.6 根际土壤微生物区系检测
移栽90 d后采集根际土壤,将烟株慢慢连根拔起,轻轻震荡掉附着的土块,将根连同根上震荡不掉的土壤置于10 ml灭菌水中,超声波震荡15 min后得到的土壤即为根际土壤[16-17]。
上述提取的土壤DNA,取适量的样品于离心管中,使用无菌水稀释至1 ng μl-1。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带标签序列(Barcode)的特异引物,使用纽英伦生物技术(New England Biolabs)公司的高保真(Phusion® High-Fidelity)含有GC缓冲液的PCR混合液(Master Mix with GC Buffer)。使用高效和高保真的酶进行扩增,确保扩增效率和准确性。引物对应区域:16S V4区引物为515F-806R。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,使用赛默科学公司(Thermo Scientific)的凝胶回收试剂盒(GeneJET)回收产物。
使用纽英伦生物技术(New England Biolabs)公司亿美达(Illumina)的超DNA文库制备试剂盒(NEB Next® Ultra™DNA Library Prep Kit for Illumina)进行文库的构建,构建好的文库经过量子位(Qubit)定量和文库检测,合格后,使用MiSeq进行上机测序。基于个人基因组分析测序平台(MiSeq Personal Sequencing System,Illumina,美国)[18],利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。
测序得到的原始数据,存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据。然后基于有效数据利用Uparse[19]软件(Uparse v7.0.1001,美国)对所有样品的全部有效标签序列聚类,以95%的一致性(Identity)进行运算分类单位(Operational taxonomic units,OTUs)聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果[20]。再对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。最后在以上分析的基础上,可以进行一系列的基于OTUs和物种组成的聚类分析、主成分分析(Principal component analysis,PCA)等[21]。
1.7 数据处理
试验数据采用Microsoft Excel 2003处理,显著性分析采用SPSS Base Ver.13.0统计软件(SPSS,IL,Chicago,美国)进行,最小显著差异法(LSD)或邓肯(Duncan)新复极差进行多重比较(p<0.05)。
2 结 果
2.1 烟草青枯病的综合防控效果
2013年对照T1在生育末期青枯病发病率达到100%,而T4处理发病率远远小于对照(图1)。采用生物防控综合措施后,2012年移栽53 d后各处理烟株全部暴发青枯病,各处理间的防控效果无显著差异(表2)。2013年T4处理在烟草全生育期的防控效果显著高于T2和T3处理,在烟草生育90 d后仍分别较T2和T3高78.1%和18.2%。2014年T4和T3处理的青枯病发生较对照推迟40 d,T4处理在60 d后防控效果显著高于T3和T2处理,在90 d后防控效果分别为T2和T3的6.26倍和1.99倍。

图1 烟草青枯病综合防控田间防效(2013年)Fig. 1 Tobacco bacterial wilt controlling effect of the integrated control measures

表2 综合防控烟草青枯病防控效果动态变化Table 2 Dynamics of controlling effect of the integrated control measures on tobacco bacterial wilt
2.2 烟草青枯病的综合防控试验产值量
由于2012年移栽60 d后各处理烟株全部暴发青枯病,各处理间的产值量均为零(表3)。2013年T4处理产量显著高于其他各处理,分别为T1、T2和T3处理的3.71倍、1.61倍和1.13倍,T4、T3和T2处理的产值分别为T1的3.44倍、2.62倍和1.87倍。2014年T4处理产量和产值显著高于其他处理,T1 与T2的产量和产值之间无显著差异,且均显著低于T3处理。
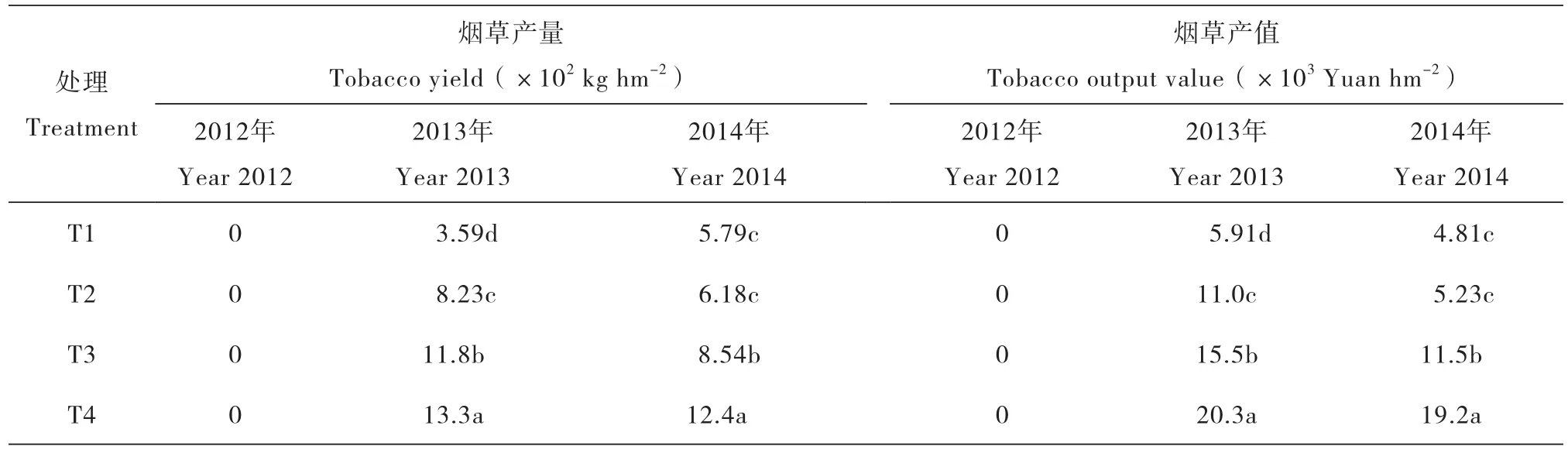
表3 综合防控试验产值量Table 3 Tobacco yield and output value of different treatments
2.3 土壤病原菌与拮抗菌的消长关系
从图2中可以看出,修复1年时(2012年)各处理病原菌数量在烟草移栽30 d后居高不下,一直保持在107cfu g-1土以上,而T2、T3和T4处理的拮抗菌数量全生育期基本呈直线下降,最后降为104cfu g-1土;经过2年修复后(2013年),T1处理的病原菌数量在30 d后即达到107cfu g-1土,经过生物有机肥处理的T3和T4处理病原菌数量呈现缓慢上升的趋势,但生物有机肥各处理的拮抗菌在70 d之前均显著高于各自对应的病原菌数量,在80 d,T3和T4处理的病原菌数量与拮抗菌数量之间无显著差异,而T2处理的病原菌数量是拮抗菌的1.49倍,呈显著差异;2014年T1和其他处理病原菌数量在50 d前呈现缓慢上升趋势,在50 d 后T1处理病原菌数量迅速上升,T2处理病原菌数量在70 d后才呈现上升趋势,而T4病原菌数量则始终处于106cfu g-1土数量级以下,在烟草移栽90 d后,各处理除T4外土壤中病原菌数量均增长至107cfu g-1土以上。拮抗菌的数量在全生育期呈现逐渐降低的趋势,T2处理病原菌与拮抗菌的数量交汇时间在72 d,T3处理的交汇时间为78 d,而T4的拮抗菌数量在90 d后仍然高于病原菌数量,达到1.23×106cfu g-1土,随着生物修复防控时间的延长,拮抗菌的数量降低速度趋于缓慢。
2.4 根际土壤微生物物种丰度及群落构成主要影响因素
从不同处理土壤微生物物种丰度水平上看(图3),T1与T4处理的微生物门水平分布差异明显,T1处理的Planctomyces、Sphingobium、Rhodanobacter、Gemmata、Candidatus_Nitrososphaera和Stenotrophomonas六个门为丰度水平较高的种群,而Chitinophaga、Niastelia、Methylotenera等门相对丰度水平较低;T4处理丰度水平较高的种群只有Nitrospira和Novosphingobium,较低的只有Phenylobacterium门,其他微生物门之间丰度差异较小,分布水平相近,整体微生物群落处于平衡、均匀的状态。
主成分分析(PCA)是一种从复杂的多维变量数据中提取主要变量,并进行可视化的方法。对β多样性进行PCA分析后,T3与T4处理土壤微生物多样性关系较近(图4),均处在左下半部,T2处理的土壤微生物多样性在像限的左上部,而T1处理与T2、T3和T4处理之间关系较远,处于像限的右上部。
3 讨 论

图2 不同年限间土壤中病原菌与拮抗菌的消长关系Fig. 2 Populations of pathogens and antagonistic bacteria in soils in different years
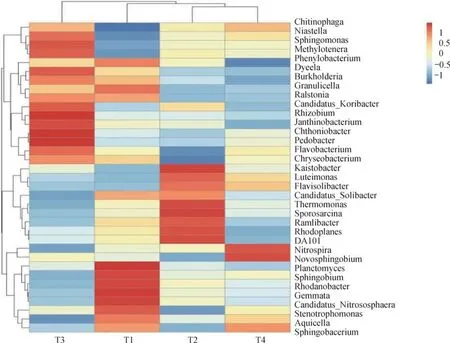
图3 不同处理物种丰度聚类图Fig. 3 Species abundance cluster map relative to treatment

图4 不同处理β多样性主成分分析Fig. 4 Principal component analysis(PCA)analysis of β diversity relative to treatment
有机肥与功能微生物(生防菌等)相结合制成微生物有机肥后施用,对各种土传病害的防控体现出很好的效果[22]。在本试验中,与对照(T1)相比,单施用生石灰处理(T2)对青枯病90d的防控效果分别为40.2%(2013年)和9.8%(2014年),防控效果十分不理想,单施用L-25生物有机肥(T3)对青枯病90 d的防控效果分别为60.6% (2013年)和30.8%(2014年),但综合防控T4处理的防控效果最高分别达到75.2%(2013年)和61.3%(2014年)。由此可见,在本试验中单一地采用生石灰或者生物有机肥处理均不能有效防控青枯病的发生,通过生石灰和施用生物有机肥这2项农艺措施结合后可以改良土壤结构,促进烟草根系深扎,进而提高植物抗逆性[23]。生石灰调节土壤pH减少土传病原菌的数量[11](图2),进而达到很好的生物防控效果。此外,通过田间试验发现施用生物有机肥处理能延缓青枯病的发病时间,2013年与2014年青枯病初发期分别推迟30 d和40 d。这主要由于采用的拮抗微生物均从烟草根际土筛选获得,在烟草根际具有很强的定殖能力;同时拮抗菌以有机肥为载体,经过二次固体发酵后施入土壤中,在前期对病原菌起到较好的抑制作用[24],进而推迟烟草植株发病时间。
各处理防控效果随烟草生育期先增加后降低,这是由于生物有机肥在初期抑制了烟草青枯病的发生,具有延缓发病的功效。而随时间增加,对照烟株基本已经枯萎死亡,发病率和病情指数均不再变化,后期处理青枯病仍有少量发生,因此防控效果会逐渐下降。相比较而言,T3和T4处理2014年烟草生育前期防控率均高于2013年相应处理,而到后期又低于2013年,这主要是由于2013年移栽30 d后多为高温(>30℃)高湿(>80%)气候,2013年青枯病在30 d就发生,此时T3和T4处理病原菌数量呈现缓慢上升的趋势,但其拮抗菌数量在70 d之前均显著高于病原菌(图2),在90 d后病原菌数量仍未达到发病浓度107cfu g-1[12],进而防控效果在60%以上;但在2014年移栽70 d后进入高温高湿气候,此时T4和T3的拮抗菌数量减少到与病原菌数量持平或者低于病原菌数量,且病原菌数量达到发病浓度107cfu g-1,进而导致青枯病的发生,因此2014年表现为T3和T4处理前期的防控效果较高,后期有所下降。施用拮抗菌二次发酵的生物有机肥结合农作措施,使根表和根际土中的病原菌数量降低到发病浓度以下,是生物防控的主要机理之一[25]。
在高通量测序中选取样品中土壤微生物物种相对丰度排名前35进行横纵向聚类(图3)[19],主要展现的是优势物种相对丰度在各个样本之间的差别。由于本试验田处理前为烟草青枯病发病率100%的土壤,故劳尔氏菌属丰度水平在物种丰度聚类图中得以体现;而本试验施用的L-25拮抗菌随着时间的延长数量逐渐降低,尤其在烟草生育后期的根际土壤中L-25菌属的相对丰度排在35种微生物物种之外,故在物种丰度聚类图上未体现,随着处理时间的延长可能会在高通量测序物种丰度聚类图中找到该菌属,而本文选用引物fliCF/ fliCR 和Bre-F/Bre-R建立了劳尔氏菌和短短芽孢杆菌荧光定量PCR 体系进行检测,与陈巧玲等[26]的结果一致。
综合防控措施对土壤中青枯病病原菌有较好的抑制作用,主要是因为其有效改善土壤微生物平衡,恢复被破坏的土壤生态系统,从而建立起复杂而健康的土壤微生物体系[27]。拮抗菌在有机肥协助下形成“基质-菌群”生态系统,更有利于调节土壤微生态环境,可改变根际土壤微生物生态特征和物理化学特征,从而起到防病、抑病的作用[28]。本试验中采用的PCA分析是从多维数据中提取出最主要的元素和结构进行分析,较物种相对丰度的聚类更加说明问题[29],其结果表明T3和T4处理微生物区系在同一范围内,说明两处理土壤微生物结构、功能等多样性基本处于相同的水平;而T1处理在PCA分析中距离T4处理最远,因而土壤微生物结构、功能等多样性最不相同,这一结果与张慧等[30]和Lang等[31]类似。当土壤肥力水平提高、微生态环境得到改善、微生物活性增强时,土壤微生物群落功能多样性会提高[32],青枯病生物综合防控技术能较好地恢复土壤微生物达到健康区系的水平,具有很好的应用前景[33-34]。
4 结 论
施用抑制烟草青枯病型生物有机肥配合生石灰防控措施,可以有效降低青枯病发病率,增加烟叶产量和产值,降低土壤中病原菌浓度,有利于病害土壤生态系统向健康可持续发展的方向转化,进而达到对重病烟区烟草青枯病良好的防控效果。
[1]Liu Y,Li X,Cai K,et al. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms. Applied Soil Ecology,2015,93:78—87
[2]Anuratha C S,Gnanamanickam S S. Biological control of bacterial wilt caused by Pseudomonas solanacearum in India with antagonistic bacteria. Plant and Soil,1990,124(1):109—116
[3]Abawi G S,Widmer T L. Impact of soil health management practices on soilborne pathogens,nematodes and root diseases of vegetable crops. Applied Soil Ecology,2000,15(1):37—47
[4]李胜华,谷丽萍,刘可星,等. 有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控. 植物营养与肥料学报,2009,15(4):965—969
Li S H,Gu L P,Liu K X,et al. Effect of combined application of organic fertilizers on the control of soilborne diseases and the regulation of soil microbial diversity(In Chinese). Journal of Plant Nutrition and Fertilizer,2009,15(4):965—969
[5]Qiu M,Zhang R,Xue C,et al. Application of bioorganic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil. Biology and Fertility of Soils,2012,48(7):807—816
[6]Zhao S,Liu D,Ling N,et al. Bio-organic fertilizerapplication significantly reduces the Fusarium oxysporum population and alters the composition of fungi communities of watermelon Fusarium wilt rhizosphere soil. Biology and Fertility of Soils,2014,50(5):765—774
[7]Wu Y,Zhao C,Farmer J,et al. Effects of bio-organic fertilizer on pepper growth and Fusarium wilt biocontrol. Scientia Horticulturae,2015,193:114—120
[8]Ding C,Shen Q,Zhang R,et al. Evaluation of rhizosphere bacteria and derived bio-organic fertilizers as potential biocontrol agents against bacterial wilt (Ralstonia solanacearum)of potato. Plant and Soil,2012,366(1):453—466
[9]陈雯廷.马铃薯黑痣病综合防控技术的研究与集成. 呼和浩特:内蒙古农业大学,2014
Chen W T. Study and integration on synthetically prevention technology of Rhizoctonia solanifrom potato(In Chinese). Huhehaote:Inner Mongolia Agricultural University,2014
[10]李红丽,郭夏丽,李清飞,等. 抑制烟草青枯病生物有机肥的研制及其生防效果研究. 土壤学报,2010,47 (4):798—801
Li H L,Guo X L,Li Q F,et al.Tobacco wilt suppressing bio-manure and its bio-control effect(In Chinese). Acta Pedologica Sinica,2010,47(4):798—801
[11]王丽丽,石俊雄,袁赛飞,等. 微生物有机肥结合土壤
改良剂防治烟草青枯病. 土壤学报,2013,50(1):153—159
Wang L L,Shi J X,Yuan S F,et al.Control of tobacco bacterial wilt with biomanure plus soil amendments(In Chinese). Acta Pedologica Sinica,2013,50(1):153—159
[12]刘艳霞,李想,曹毅,等. 抑制烟草青枯病型生物有机肥的田间防效研究. 植物营养与肥料学报,2014,20 (5):1203—1211
Liu Y X,Li X,Cao Y,et al. Field control efficiency of tobacco specific bio-organic fertilizer on tobacco bacterial wilt(In Chinese). Journal of Plant Nutrition and Fertilizer,2014,20(5):1203—1211
[13]Liu Y X,Shi J X,Feng Y G,et al. Tobacco bacterial wilt can be biologically controlled by the applicaiton of antagonistic strains in combination with organic fertilizer. Biology and Fertility of Soils,2013,49 (4):447—464
[14]刘艳霞,李想,蔡刘体,等. 生物有机肥对烟株和土壤酶活性以及烟草超微结构的影响. 中国烟草学报,2013,19(6):78—84
Liu Y X,Li X,Cai L T,et al. Effect of bio-organic fertilizer on enzyme activity and ultramicro-structure of xylem vessel in tobacco(In Chinese). Acta Tabacaria Sinica,2013,19(6):78—84
[15]张翔,毛家伟,李彰,等. 氮用量及基追比例对烟叶产量、品质及氮肥利用效率的影响. 植物营养与肥料学报,2012,18(6):1522—1527
Zhang X,Mao J W,Li Z,et al. Effects of nitrogen fertilizer rates and ratios of base and topdressing fertilizer on yield,quality of tobacco leaves and N-use efficiency(In Chinese). Plant Nutrition and Fertilizer Science,2012,18(6):1522—1527
[16]刘艳霞. 土传烟草青枯病的生物防控及其机理研究. 南京:南京农业大学,2012
Liu Y X. Study on pathogenic factors of tobacco bacterial wilt,its biological control and mechanism of action(In Chinese). Nanjing:Nanjing Agricultural University,2012
[17]Carlsen S C K,Pedersen H A,Spliid N H,et al. Fate in soil of flavonoids released from white clover (Trifoliumrepens L.). Applied & Environmental Soil Science,2012,2012:Article ID:743413
[18]Luo C. Direct comparisons of illumina vs. Roche 454 sequencing technologies on the same microbial community DNA sample. PLoSone,2012:e30087
[19]Edgar R C. Uparse:Highly accurate otu sequences from microbial amplicon reads. Nature methods,2013,10 (10):996—998
[20]Wang Q,Garrity G M,Tiedje J M,et al. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology,2007,73(16):5261—5267
[21]林新坚,林斯,邱珊莲,等. 不同培肥模式对茶园土壤微生物活性和群落结构的影响. 植物营养与肥料学报,2013,19(1):93—101
Lin X J,Lin S,Qiu S L,et al. Effect of different fertilization strategies on structure and activity of microbial community in tea orchard soils(In Chinese). Plant Nutrition and Fertilizer Science,2013,19 (1):93—101
[22]Trillas M I,Casanova E,Cotxarrera L,et al. Composts from agricultural waste and the Trichoderma asperellumstrain t-34 suppress Rhizoctonia solaniin cucumber seedlings. Biological Control,2006,39 (1):32—38
[23]Maderia M V A,Melo M G,Alexandre C A. Effects of deep ploughing and superficial disc harrowing on physical and chemical soil prperties and biomass in a new plantation of Eucalyptus globulus. Soil and TillageResearch,1989,14(2):163-175
[24]El-Abyad M S,El-Sayed M A,El-Shanshoury A R,et al. Towards the biological control of fungal and bacterial diseases of tomato using antagonistic Streptomyces spp. Plant and Soil,1993,149(2):185—195
[25]Zhao Q,Dong C,Yang X,et al. Biocontrol of Fusarium wilt disease for Cucumismelo melon using bio-organic fertilized. Applied Soil Ecology,2011,47 (1):67-75
[26]陈巧玲,胡江,汪汉成,等. 生物有机肥对盆栽烟草根际青枯病原菌和短短芽孢杆菌数量的影响. 南京农业大学学报,2012,35(1):75—79
Chen Q L,Hu J,Wang H C,et al. Effects of bioorganic fertilizer application on population of Ralstonia solanacearum and Brevibacillus brevis in tobacco rhizosphere(In Chinese). Journal of Nanjing Agricultural University,2012,35(1):75—79
[27]Liu Y,Shi J,Feng Y,et al. Tobacco bacterial wilt can be biologically controlled by the applicaiton of antagonistic strains in combination with organic fertilizer. Biology and Fertility of Soils,2013,49 (4):447—464
[28]张志红,李华兴,韦翔华,等. 生物肥料对香蕉枯萎病及土壤微生物的影响. 生态环境,2008,17(6):2421—2425
Zhang Z H,Li H X,Wei X H,et al. Infulence of biological fertilizers on banana wilt disease and microorganisms in soil(In Chinese). Ecology and Environment,2008,17(6):2421—2425
[29]Fierer N,Leff J W,Adams B J,et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences,2012,109(52):21390—21395
[30]张慧,杨兴明,冉炜,等. 土传棉花黄萎病拮抗菌的筛选及其生物效应. 土壤学报,2008,45(6):1095—1101
Zhang H,Yang X M,Ran W,et al. Screening of bacteria antagonistic against soil-borne cotton Verticilllium wilt and their biological effects on the soilcotton system(In Chinese). Acta Pedologica Sinica,2008,45(6):1095—1101
[31]Lang J,Hu J,Ran W,et al. Control of cotton Verticillium wilt and fungal diversity of rhizosphere soils by bio-organic fertilizer. Biology and Fertility of Soils,2012,48(2):191—203
[32]张志明,许艳丽,韩晓增,等. 连续施肥对农田黑土微生物功能多样性的影响. 生态学杂志,2012,31 (3):647—651
Zhang Z M,XuY L,Han X Z,et al. Effects of continuous fertilization on microbial functional diversity in black soil under cropland(In Chinese). Chinese Journal of Ecology,2012,31(3):647—651
[33]佀国涵,王瑞,袁家富,等. 绿肥与化肥配施对植烟土壤微生物群落的影响. 土壤,2013,45(6):1070—1075
Si G H,Wang R,Yuan J F,et al. Effects of green manure application combined with chemical fertilizers on soil microbial community structure of tobaccoplanting soil(In Chinese). Soils,2013,45(6):1070-1075
[34]罗佳,刘丽珠,王同,等. 养猪发酵床垫料有机肥对辣椒产量及土壤微生物多样性的影响. 土壤,2015,47 (6):1101—1106
Luo J,Liu L Z,Wang T,et al. Effect of organic fertilizer from deep-litter pig rearing on pepper yield and soil microbial diversity(In Chinese). Soils,2015,47(6):1101—1106
Integrated Bio-control of Tobacco Bacterial Wilt and Its Effect on Soil Microobial Community Structure
LI Xiang LIU Yanxia†LU Ning CAI Liuti YUAN Youbo SHI Junxiong
(Guizhou Academy of Tobacco Science,Guiyang 550000,China)
【Objective】Tobacco bacterial wilt is one of the most serious soil-borne pests affecting tobacco production in Southwest China. Biocontrol of tobacco bacterial wilt has been a hot research topic in recent years. For control of the pest,a kind of biomanure prepared out of microbes antagonistic to the pest is used together with some proper agronomic measures,so as to achieve sustainable and healthy development of tobacco production.【Method】In this study,a three-year long field experiment was conducted in aseverely wilt infected tobacco field in Guizhou Province to explore effects of the pest control measures. The experiment was designed to have four treatments or measures,that is,T1(Conventional fertilization),T2(Conventional fertilization + liming),T3(Conventional fertilization + L-25 Biomanure)and T4 (Conventional fertilization + liming + L-25 Biomanure). High-throughput sequencing was done of the microbial genome in the rhizosphere to explore effects of the integrated control measures on soil microflora. 【Result】The experiment indicated thatin 2013 Treatment T4 was significantly(p<0.05)higher than Treatments T2 and T3 in controlling effect during the entire tobacco growing period,and in 2014,Treatment T4 was significantly higher than Treatments T2 and T3 in controlling effect,60 days after transplanting and 6.26 and 1.99 times as high as Treatments T2 and T3,respectively,90 days after transplanting. At the end of the experiment,the pest controlling effect reached up to 61.30%. In 2013,Treatment T4 was significantly higher than all the other treatments in tobacco yield or 3.71,1.61 and 1.13 times as high as Treatment T1,T2 and T3,respectively. In 2014,Treatment 4 was the highest in tobacco yield and output value and Treatment T3 was significantly higher than the other two,which were more or less the same. In 2013,although the pathogen in the treatments amended with biomanure slowly increased in population,the counts of antagonistic bacteria in the treatments were higher than those of pathogen during the initial 70 days after transplanting,while in 2014,the population of pathogen in Treatment T4 was always kept below the level of 106cfu g-1soil,but the counts of pathogen in all the other treatments grew beyond the level of 107cfu g-1soil,90 days after transplanting and on. Treatment T4 was higher than Treatment T1 in microbial species abundance,operational taxonomic unit(OTU)and Shannon index. Principal component and cluster analysis shows that Treatments T3 and T4 were quite similar,but significantly different from Treatment T1 in microfloral structure. 【Conclusion】The integrated measure,(like Treatment T4)can effectively control tobacco bacterial wilt and significantly improve yield and output value of cured-tobacco,and soil microflora as well,which demonstrates that the measure has a promising application and extension prospect.
Tobacco bacterial wilt;Integrated control measure;Pathogen;Antagonistic bacteria;Rhizosphere microbial balance
S144.1
A
10.11766/trxb201601140582
(责任编辑:陈荣府)
* 国家自然科学基金项目(41461068)、贵州省科学技术基金项目(黔科合J字[2013]2197、2198)和中国烟草总公司贵州省公司科技项目(201410)共同资助 Supported by the National Natural Science Foundation of China(No. 41461068),the Science and Technology Foundation of Guizhou Province(No.[2013]2197 and 2198)and the Science and Technology Foundationof Guizhou Tobacco Monopoly Bureau of China(No. 201410)
† 通信作者Corresponding author,E-mail:iversonlyx@163.com
李 想(1982—),辽宁省鞍山市人,博士,副研究员,主要从事土壤养分管理与循环研究。E-mail:newcool1361214@163.com
2016-01-14;
2016-08-05;优先数字出版日期(www.cnki.net):2016-09-21

