唑来膦酸注射液联合金天格胶囊治疗绝经后骨质疏松症的临床观察
符 琴,贾利平,刘玉珠,王咸菊,王 桂(.海南省屯昌县人民医院妇产科,海南屯昌 57600;.海南省农垦总医院妇产科,海口 57003)
唑来膦酸注射液联合金天格胶囊治疗绝经后骨质疏松症的临床观察
符 琴1*,贾利平2,刘玉珠2,王咸菊1,王 桂1(1.海南省屯昌县人民医院妇产科,海南屯昌 571600;2.海南省农垦总医院妇产科,海口 570203)
目的:探讨唑来膦酸注射液联合金天格胶囊治疗绝经后骨质疏松症(PMOP)的临床疗效及安全性。方法:选取海南省屯昌县人民医院2012年11月-2015年2月就诊的PMOP患者99例,按照随机数字表法分为对照组、单药组和联合组,各33例。对照组患者给予碳酸钙D3咀嚼片(Ⅱ)2片,po,qd+骨化三醇胶丸0.50 μg,po,bid抗骨质疏松;单药组患者在对照组基础上给予唑来膦酸注射液5 mg,ivgtt,1次/年;联合组患者在单药组基础上给予金天格胶囊1.2 g,po,tid。3组患者均治疗12个月。比较3组患者治疗前后骨密度(BMD)、视觉模拟量表(VAS)评分和日常生活能力量表(ADL)评分,并记录不良反应发生情况。结果:治疗前,3组患者上述指标比较,差异均无统计学意义(P>0.05)。治疗后,单药组和联合组患者BMD水平均较治疗前明显升高,且明显高于对照组,差异均有统计学意义(P<0.05);单药组和联合组患者膝关节、腰背部VAS评分和ADL评分均较治疗前明显降低,且单药组明显低于对照组(ADL评分除外),联合组明显低于单药组,差异均有统计学意义(P<0.05)。单药组和联合组患者的远期不良反应发生率(6.1%和3.0%)均明显低于对照组(21.2%),差异有统计学意义(P<0.05)。结论:唑来膦酸注射液联合金天格胶囊可提高PMOP患者BMD,减轻患者膝关节及腰背部疼痛,且安全性较高。
唑来膦酸;金天格胶囊;绝经后骨质疏松症;骨密度
骨质疏松症是一种以骨矿盐和骨基质含量下降、骨皮质变薄、骨小梁减少、骨脆性和骨折风险增加为特征的全身性骨骼疾病[1]。绝经后骨质疏松症(PMOP)是一种原发性骨质疏松症,发病率呈逐年上升趋势,绝经后女性机体血清雌激素水平降低、骨钙丢失与PMOP的发病密切相关[2]。50岁以上绝经女性髋部骨折的发病率达17%,脊柱压缩性骨折发病率达32%,髋部骨折或脊柱骨折术后1年的病死率高达20%~24%[3-4]。PMOP的临床治疗药物主要有补钙药、降钙素、活性维生素D3、雌激素类似物、雌激素受体调节剂和双膦酸盐等,其中双膦酸盐可通过影响破骨细胞的活性,有效抑制骨吸收和骨溶解过程,提高患者骨密度(BMD)[5]。唑来膦酸作为一种新型的双膦酸盐,可有效提高PMOP患者髋部和腰椎BMD,降低骨折风险,患者使用的依从性和安全性均较高,已逐渐成为PMOP治疗的首选药物[6]。金天格胶囊是天然虎骨粉的仿生药物,也是预防和治疗PMOP的有效药物[7-8]。鉴于此,本研究观察了唑来膦酸注射液联合金天格胶囊治疗PMOP的疗效及安全性,现报道如下。
1 资料与方法
1.1 纳入、排除与脱落标准
纳入标准:(1)经双能X线骨密度仪(美国Hologic公司)测量确诊为骨质疏松症;(2)绝经后女性;(3)存在髋、膝、腰或背部疼痛;(4)既往未接受过系统抗骨质疏松治疗。
排除标准:(1)继发性骨质疏松者;(2)肝肾功能严重损害者;(3)代谢性骨病或低钙血症者;(4)多发性骨髓瘤或骨转移瘤者;(5)长期服用糖皮质激素或免疫抑制剂者;(6)对本研究药物存在禁忌证者。
1.2 研究对象
选取海南省屯昌县人民医院2012年11月-2015年2月就诊的99例PMOP患者,采用随机数字表法分为对照组、单药组和联合组,各33例。3组患者的年龄、绝经时间、体质量指数(BMI)、血清肌酐(Scr)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、血钙和并发症等临床资料比较,差异无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
表1 3组患者临床资料比较()Tab 1 Comparison of clinical information of patients among 3 groups()
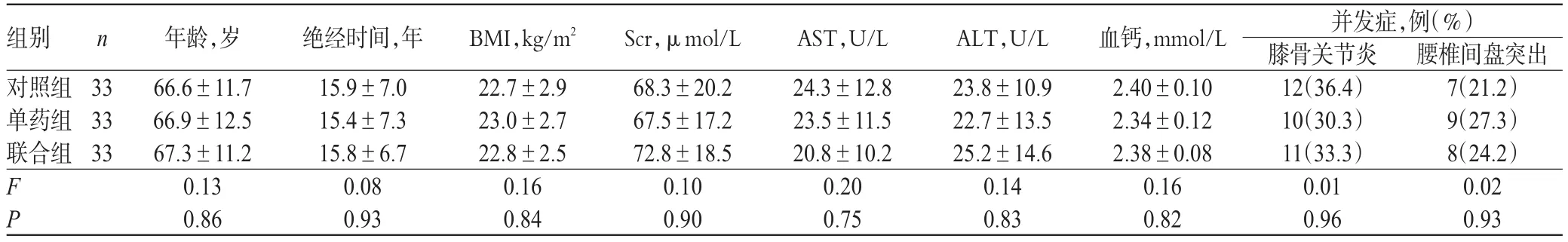
表1 3组患者临床资料比较()Tab 1 Comparison of clinical information of patients among 3 groups()
组别对照组单药组联合组n 33 33 33 F P年龄,岁66.6±11.7 66.9±12.5 67.3±11.2 0.13 0.86绝经时间,年15.9±7.0 15.4±7.3 15.8±6.7 0.08 0.93 BMI,kg/m222.7±2.9 23.0±2.7 22.8±2.5 0.16 0.84 Scr,μmol/L 68.3±20.2 67.5±17.2 72.8±18.5 0.10 0.90 AST,U/L 24.3±12.8 23.5±11.5 20.8±10.2 0.20 0.75 ALT,U/L 23.8±10.9 22.7±13.5 25.2±14.6 0.14 0.83血钙,mmol/L 2.40±0.10 2.34±0.12 2.38±0.08 0.16 0.82并发症,例(%)膝骨关节炎12(36.4)10(30.3)11(33.3)0.01 0.96腰椎间盘突出7(21.2)9(27.3)8(24.2)0.02 0.93
1.3 治疗方法
对照组患者给予碳酸钙D3咀嚼片(Ⅱ)(惠氏制药有限公司,批准文号:国药准字H10950030,规格:每片含钙300 mg+维生素D360国际单位)2片,po,qd+骨化三醇胶丸[瑞士Roche Pharma(Schweiz)Ltd.,注册证号:H20140597,规格:0.25 μg)0.50 μg,po,bid抗骨质疏松;单药组患者在对照组基础上给予唑来膦酸注射液(Novartis Pharma Schweiz AG,注册证号:H20140335,规格:100 mL∶5 mg)5 mg,ivgtt(>30 min),1次/年,滴注前后分别给予0.9%氯化钠注射液250 mL,ivgtt进行水化;联合组患者在单药组基础上给予金天格胶囊[金花企业(集团)股份有限公司西安金花制药厂,批准文号:国药准字Z20030080,规格:0.4 g]1.2 g,po,tid。3组患者均治疗12个月。
1.4 观察指标
(1)采用双能X线骨密度仪检查3组患者治疗前后股骨颈Ward三角区和腰椎的BMD水平。(2)测定3组患者治疗前与治疗后3、6、12个月的膝关节、腰背部视觉模拟量表(VAS)评分和日常生活能力量表(ADL)评分。VAS评分为0~10分,分值越高表示疼痛越剧烈;ADL评分为14~56分,分值越高表示存在的功能障碍越严重。(3)记录3组患者近期(治疗后1个月内)和远期(治疗后1年内)的不良反应发生情况。
吉林省是一个农业大省,每年可收集秸秆量在3600万吨左右,每年可利用于秸秆能源化的总量在1200万吨左右,等同于600万吨标准煤。吉林省内秸秆资源分布区域的差别很大,其中长春、吉林、四平和辽源等中部地区占全省秸秆总量的63.5%,西部地区如白城和松原等占全省秸秆总量的26.6%,东部地区如延边、通化、白山等占全省秸秆总量的9.9%[14]。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以表示,同组治疗前后采用配对t检验,组间比较采用独立样本t检验,重复测量数据采用方差分析;计数资料以例(率)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者治疗前后BMD水平比较
治疗前,3组患者股骨颈、Ward三角区和腰椎BMD水平比较,差异均无统计学意义(P>0.05)。治疗后,单药组和联合组患者上述部位BMD水平均较治疗前明显升高,且明显高于对照组患者,差异均有统计学意义(P<0.05);但单药组和联合组患者组间比较,差异无统计学意义(P>0.05)。3组患者治疗前后BMD水平比较见表2。
2.2 3组患者治疗前后膝关节VAS评分比较
治疗前,3组患者膝关节VAS评分比较,差异无统计学意义(P>0.05)。治疗后3、6、12个月,单药组和联合组患者膝关节VAS评分均较治疗前明显降低,且单药组明显低于对照组,联合组明显低于单药组,差异均有统计学意义(P<0.05)。3组患者治疗前后膝关节VAS评分比较见表3。
表2 3组患者治疗前后BMD水平比较(,g/cm2)Tab 2 Comparison of BMD among 3 groups before and after treatment(,g/cm2)
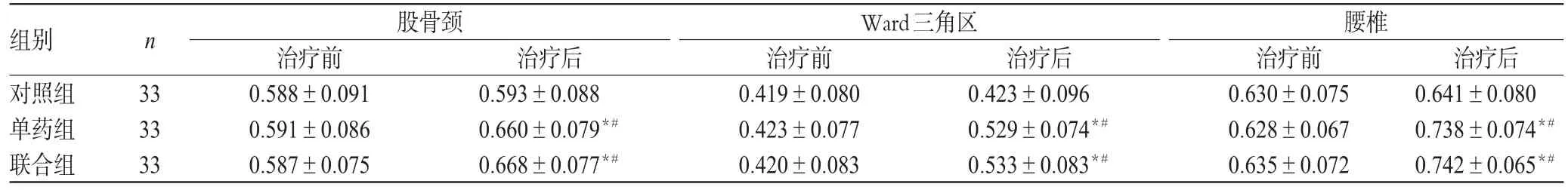
表2 3组患者治疗前后BMD水平比较(,g/cm2)Tab 2 Comparison of BMD among 3 groups before and after treatment(,g/cm2)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组单药组联合组股骨颈治疗后0.641±0.080 0.738±0.074*#0.742±0.065*#n 33 33 33治疗前0.588±0.091 0.591±0.086 0.587±0.075治疗后0.593±0.088 0.660±0.079*#0.668±0.077*#Ward三角区治疗前0.419±0.080 0.423±0.077 0.420±0.083治疗后0.423±0.096 0.529±0.074*#0.533±0.083*#腰椎治疗前0.630±0.075 0.628±0.067 0.635±0.072
表3 3组患者治疗前后膝关节VAS评分比较(,分)Tab 3 Comparison of VAS score of knee joint among 3 groups before and after treatment(,score)

表3 3组患者治疗前后膝关节VAS评分比较(,分)Tab 3 Comparison of VAS score of knee joint among 3 groups before and after treatment(,score)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05;与单药组比较,&P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05;vs.single drug group,&P<0.05
组别对照组单药组联合组治疗后12个月3.98±1.26 2.76±1.20*#1.78±1.17*#&n 33 33 33治疗前4.20±1.09 4.18±1.10 4.22±1.05治疗后3个月4.10±1.16 3.41±1.13*#2.48±1.02*#&治疗后6个月4.05±1.12 2.86±1.15*#1.93±1.07*#&
治疗前,3组患者腰背部VAS评分比较,差异均无统计学意义(P>0.05)。治疗后3、6、12个月,单药组和联合组患者腰背部VAS评分均较治疗前明显降低,且单药组明显低于对照组,联合组明显低于单药组,差异均有统计学意义(P<0.05)。3组患者治疗前后腰背部VAS评分比较见表4。
2.4 3组患者治疗前后ADL评分比较
治疗前,3组患者ADL评分比较,差异均无统计学意义(P>0.05)。治疗后3、6、12个月,单药组和联合组患者ADL评分均较治疗前明显降低,且联合组明显低于对照组和单药组,差异均有统计学意义(P<0.05)。3组患者治疗前后ADL评分比较见表5;而对照组和单药组比较,差异无统计学意义(P>0.05)。
表4 3组患者治疗前后腰背部VAS评分比较(,分)Tab 4 Comparison of VAS score of the back among 3 groups before and after treatment(,score)

表4 3组患者治疗前后腰背部VAS评分比较(,分)Tab 4 Comparison of VAS score of the back among 3 groups before and after treatment(,score)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05;与单药组比较,&P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05;vs.single drug group,&P<0.05
组别对照组单药组联合组治疗后12个月4.14±1.25 2.85±1.22*#1.95±1.19*#&n 33 33 33治疗前4.33±1.08 4.30±1.15 4.35±1.12治疗后3个月4.24±1.09 3.50±1.03*#2.65±1.10*#&治疗后6个月4.16±1.17 2.86±1.05*#2.05±1.20*#&
表5 3组患者治疗前后ADL评分比较(,分)Tab 5 Comparison of ADL score among 3 groups before and after treatment(,score)

表5 3组患者治疗前后ADL评分比较(,分)Tab 5 Comparison of ADL score among 3 groups before and after treatment(,score)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05;与单药组比较,&P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05;vs.single drug group,&P<0.05
组别对照组单药组联合组治疗后12个月42.25±11.78 38.77±10.22*32.84±10.19*#&n 33 33 33治疗前46.29±8.78 46.68±8.55 46.35±8.25治疗后3个月44.36±11.57 40.69±9.63*34.25±10.53*#&治疗后6个月43.50±11.45 39.55±8.25*33.26±9.50*#&
2.5 不良反应
3组患者治疗过程中均未见肝肾功能及血钙水平异常。3组患者近期不良反应比较,差异无统计学意义(P>0.05)。单药组和联合组患者的远期不良反应发生率(6.1%和3.0%)明显低于对照组(21.2%),差异有统计学意义(P<0.05),详见表6。
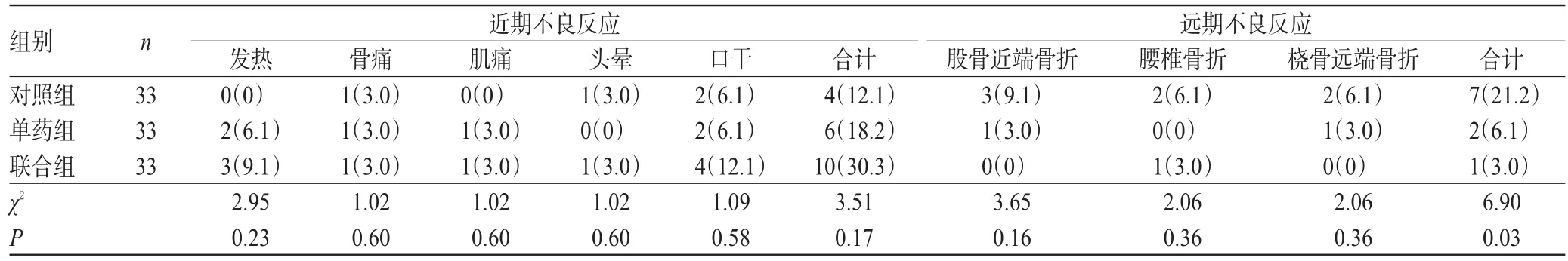
表6 3组患者不良反应发生情况比较[例(%%)]Tab 6 Comparison of the occurrence ofADR among 3 groups[case(%%)]
3 讨论
雌激素可明显抑制破骨细胞活性,促进破骨细胞凋亡,可有效调节骨吸收相关血清因子[如白细胞介素(IL)6、IL-1和肿瘤坏死因子α(TNF-α)等]的水平,进而抑制骨吸收和骨溶解过程;还可抗成骨细胞凋亡,促进成骨细胞增殖分化,参与调节成骨细胞氧化应激反应[2]。绝经女性的血清雌激素水平呈明显下降趋势,骨吸收增强,虽通过骨吸收和骨形成之间的耦联刺激骨形成,但骨形成活动明显弱于骨吸收,因此PMOP表现为高转换型骨质疏松[9]。研究显示,绝经后5~10年间,松质骨每年骨量丢失约为1%~2%,松质骨占比为2%~4%;>10年时,皮质骨每年骨量丢失10%~15%,松质骨占比为25%~30%[10]。骨质疏松性疼痛和脆性骨折是PMOP的主要表现,骨量丢失超过12%峰值骨量时可表现出不同程度的疼痛,骨量丢失>30%时骨折风险显著增加[10]。
唑来膦酸作为一种新型的第三代双膦酸盐,可有效抑制破骨细胞焦磷酸合成酶,抑制破骨细胞的活性和骨吸收活动,其骨吸收抑制强度约为传统双膦酸盐(如阿仑膦酸钠)的25~114倍[11];而且,传统双膦酸盐需长期口服,患者依从性较差,药物生物利用度较低,唑来膦酸每年只需给药1次,即可直接与骨表面结合,具有较高的用药依从性和药物生物利用度。Black DM等[12]的一项随机、双盲、多中心对照研究发现,每年给予1次唑来膦酸5 mg,患者连续3年的股骨颈BMD提高程度可稳定在5.06%,髋部BMD为6.02%,腰椎BMD为6.71%。林华等[13]的研究发现,唑来膦酸可显著提高PMOP患者的BMD,降低跌倒风险,且不良反应较少,安全性较高。本研究结果显示,对照组患者治疗后的BMD水平、VAS评分、ADL评分均无明显改善,单药组患者以上指标均优于治疗前和对照组(ADL评分除外),显示出唑来膦酸在PMOP治疗中的疗效。
金天格胶囊成分与天然虎骨相似,具有丰富的微量元素和胶原蛋白,钙离子比例合理,利于人体吸收,可有效提高成骨细胞活性,促进骨形成活动,同时抑制破骨细胞活性,阻断骨吸收和骨溶解过程,进而达到提高患者BMD的作用[14]。中医理论认为,虎骨具有镇痛、抗炎、促进骨折愈合和增强机体免疫力等功效[15]。何保玉等[16]的研究发现,金天格胶囊可以显著缓解原发性骨质疏松症患者腰背疼痛、下肢痿弱、腰膝酸软和步履艰难等症状,显著提高BMD,改善生活质量。本研究结果显示,联合组患者治疗后的膝关节及腰背部VAS评分、ADL评分均明显优于单药组,提示唑来膦酸和金天格胶囊联用较唑来膦酸单用能更明显地改善患者症状。联合组和单药组患者的远期不良反应发生率均明显低于对照组,可见唑来膦酸联合金天格胶囊并未增加药品不良反应,安全性较高。
综上所述,唑来膦酸注射液联合金天格胶囊可提高PMOP患者BMD,减轻患者膝关节及腰背部疼痛,且安全性较高。但是,本研究样本量较小,同时并未对患者进行长期的跟踪随访,有待大样本、长期的随机对照研究对本研究结论加以论证。
[1] Chen B,Li GF,Shen Y,et al.Reducing iron accumulation:a potential approach for the prevention and treatment of postmenopausal osteoporosis[J].Exp Ther Med,2015,10(1):7-11.
[2] Modi A,Sen S,Adachi JD,et al.Rationale and design of MUSIC OS-EU:an international observational study of the treatment of postmenopausal women for osteoporosis in Europe and Canada[J].Clin Exp Rheumatol,2015,33(4):537-544.
[3] Melton LR.Who has osteoporosis?A conflict between clinical and public health perspectives[J].J Bone Miner Res, 2000,15(12):2309-2314.
[4] Leibson CL,Tosteson AN,Gabriel SE,et al.Mortality,disability,and nursing home use for persons with and without hip fracture:a population-based study[J].J Am Geriatr Soc,2002,50(10):1644-1650.
[5] Majithia N,Atherton PJ,Lafky JM,et al.Zoledronic acid for treatment of osteopenia and osteoporosis in women with primary breast cancer undergoing adjuvant aromatase inhibitor therapy:a 5-year follow-up[J].Support Care Cancer,2016,24(3):1219-1226.
[6] 宣淼,杨军,李颖,等.唑来膦酸与替勃龙对绝经后骨质疏松症骨密度、骨代谢指标及骨折影响的临床研究[J].中华内分泌代谢杂志,2013,29(6):504-508.
[7] 赵玉玺,张彬,湛梅圣,等.金天格胶囊对骨质疏松性骨折大鼠BGP、TRACP表达的影响[J].中国骨质疏松杂志,2014,20(11):1302-1305.
[8] 甘强,谭祖建,周明全,等.金天格胶囊在预防绝经后女性骨质疏松性骨折中的作用[J].中国骨质疏松杂志,2015,21(12):1498-1506.
[9] Leder BZ,Tsai JN,Uihlein AV,et al.Denosumab and teriparatide transitions in postmenopausal osteoporosis(the DATA-Switch study):extension of a randomised controlled trial[J].Lancet,2015,doi:10.1016/s0140-6736(15)61120-5.
[10] Mori H,Okada Y,Tanaka Y.Incidence of vitamin D deficiency and its relevance to bone metabolism in Japanese postmenopausal women with type 2 diabetes mellitus[J]. Intern Med,2015,54(13):1599-1604.
[11] Anastasilakis AD,Polyzos SA,Efstathiadou ZA,et al. Denosumab in treatment-naive and pre-treated with zoledronic acid postmenopausal women with low bone mass:effect on bone mineral density and bone turnover markers [J].Metabolism,2015,64(10):1291-1297.
[12] Black DM,Delmas PD,Eastell R,et al.Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis [J].N Engl J Med,2007,356(18):1809-1822.
[13] 林华,徐天舒,范璐,等.5 mg唑来膦酸治疗绝经后骨质疏松及其骨折[J].中华创伤骨科杂志,2012,14(1):31-35.
[14] 范明宇,周少怀,李宏亮,等.金天格胶囊在治疗骨质疏松中的疗效观察[J].中国骨质疏松杂志,2015,21(11):1374-1375.
[15] 赵岩,李爱强,倪力刚,等.虎骨及人工虎骨治疗骨质疏松症的研究进展[J].中国骨质疏松杂志,2012,18(1):95-98.
[16] 何保玉,滕涛,刘宝戈,等.金天格胶囊治疗原发性骨质疏松症的临床疗效观察[J].中国骨质疏松杂志,2015,21(2):168-174.
(编辑:陶婷婷)
Clinical Observation of Zoledronic Acid Injection Combined with Jintiange Capsules in the Treatment of Postmenopausal Osteoporosis
FU Qin1,JIA Liping2,LIU Yuzhu2,WANG Xianju1,WANG Gui1(1.Dept.of Gynaecology and Obstetrics,Tunchang County People’s Hospital of Hainan Province,Hainan Tunchang 571600,China;2.Dept.of Gynaecology and Obstetrics,Hainan Nongken General Hospital,Haikou 570203,China)
OBJECTIVE:To explore clinical efficacy and safety of Zoledronic acid injection combined with Jintiange capsule in the treatment of postmenopausal osteoporosis(PMOP).METHODS:99 PMOP patients from Tunchang County People’s Hospital of Hainan Province during Nov.2012 to Feb.2015 were selected and divided into control group,single drug group and combination group according to random number table,with 33 cases in each group.Control group received Calcarea carbonica D3chewable tablets(Ⅱ)2 tablets,po,qd+Calcitriol soft capsules 0.50 μg,po,bid for osteoporosis;single drug group additionally received Zoledronic acid injection 5 mg,ivgtt,once a year,on the basis of control group;combination group was additionally given Jintiange capsule 1.2 g,po,tid,on the basis of single drug group.3 groups received treatment for 12 months.BMD,VAS score and ADL score of 3 groups were compared as well as the occurrence of ADR.RESULTS:Before treatment,there was no statistical significance in above indexes of 3 groups(P>0.05).After treatment,BMD of single drug group and combination group were increased significantly compared to before treatment,which were significantly higher than that of control group,with statistical significance(P<0.05).VAS score and ADL score of knee joint and the small of the back were decreased significantly in single drug group and combination group;the single drug group were significantly lower than the control group(except for ADL score);the combination group were significantly lower than the single drug group,with statistical significance(P<0.05).The incidence of long-term ADR in single drug group and combination group(6.1%,3.0%)were significantly lower than in control group(21.2%),with statistical significance(P<0.05).CONCLUSIONS:Zoledronic acid injection combined with Jintiange capsules could improve BMD of PMOP patients,relieving pain of knee and back with good safety.
Zoledronic acid;Jintiange capsules;Postmenopausal osteoporosis;Bone mineral density
R977
A
1001-0408(2017)02-0236-04
2016-04-14
2016-10-26)
*副主任医师。研究方向:骨质疏松。电话:0898-67817835。E-mail:3090785939@qq.com
DOI10.6039/j.issn.1001-0408.2017.02.26

