L-茶氨酸改善热应激引起的小鼠组织损伤和氧化逆境
郭晨,刘林峰,向奕,罗莉,林玲,肖文军,3*
L-茶氨酸改善热应激引起的小鼠组织损伤和氧化逆境
郭晨1,2,刘林峰1,2,向奕1,2,罗莉1,2,林玲1,2,肖文军1,2,3*
1. 湖南农业大学园艺园林学院茶学教育部重点实验室,湖南长沙410128;2. 湖南农业大学国家植物功能成分利用工程技术研究中心,湖南长沙410128;3. 湖南农业大学湖南省植物功能成分利用协同创新中心,湖南长沙410128
以SPF级Slca/KM雄性小鼠作为实验对象,在恒温恒湿模拟气候箱进行热处理,灌喂干预不同剂量L-茶氨酸,考察L-茶氨酸对小鼠采食量、体重变化、空肠切片病理情况、器官指数、血清谷丙转氨酶(ALT)与谷草转氨酶(AST)活性、血清肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)和干扰素-γ(IFN-γ)含量、肝组织丙二醛(MDA)含量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性以及肝组织病理学变化的影响,以探讨L-茶氨酸改善热处理引起的小鼠组织损伤和氧化逆境作用。结果表明,L-茶氨酸能在一定程度上促进热处理小鼠采食量和体重的增加,降低肝脏和脾脏器官指数,降低血清ALT、AST酶活性,抑制血清炎症介质TNF-α、IL-6、IFN-γ的含量,降低肝组织MDA含量,提高SOD、GSH-Px、CAT酶活性,减轻热处理对空肠及肝脏组织的损伤,且以L-茶氨酸中剂量处理效果较好。说明L-茶氨酸具有改善热处理引起的小鼠组织损伤和氧化逆境的作用,主要表现为提高小鼠营养物质吸收能力、减少炎性细胞因子表达,以及降低氧化损伤。
L-茶氨酸;热处理;组织损伤;氧化逆境
热应激是机体对高温应激原所产生的一种非特异性防御应答反应,在热应激条件下,机体须通过调节自身代谢率等途径来减少产热、增加散热,以适应高温环境[1],但当热应激超出机体自我调节范围时,则会导致生理功能紊乱,出现生长与生产性能降低等危害[2]。肝脏是机体内以代谢功能为主的一个器官,热应激可引起肝脏组织出现裂纹增多、排列疏松、肝细胞水肿变大以及肝脏氧化等损伤[3]。我国南方夏秋季气温高、相对湿度大、持续时间长,由此而引起的热应激不仅对畜禽养殖业造成巨大的经济损失,而且也严重影响了南方人们的身体健康[4-7]。研究表明,在饮用水或饲料中添加Vc、VE、特丁基对苯二酚(TBHQ)、葡萄籽提取物、γ-氨基丁酸或其他“中草药”[8-10],可较好地起到预防热应激危害的作用。L-茶氨酸是茶叶中的特征性氨基酸,占茶叶干重的1%~2%,属谷氨酰胺类化合物,具有抗氧化、调节免疫、降血压、安神镇静、拮抗谷氨酸过量而产生的细胞兴奋性毒性等多种生物活性,被誉为“天然镇静剂”[11-14],但目前尚未见L-茶氨酸应用于抗热应激的研究报道。本研究从采食量与体重、器官指数、炎性细胞因子、氧化酶活性及肝脏组织损伤等角度,探讨L-茶氨酸对热处理引起的小鼠组织损伤和氧化逆境的改善作用,为南方夏秋季高温高湿的环境下增强机体抗热应激能力,以及促进L-茶氨酸的高值化利用等提供参考。
1 材料与方法
1.1 材料、试剂与仪器设备
1.1.1 材料
L-茶氨酸(纯度≥98%),购于德国Sigma试剂公司。
1.1.2 试剂
肿瘤坏死因子(Tumor necrosis factor, TNF-α)、白细胞介素6(Interleukin-6, IL-6)、干扰素-γ(Interferon-γ, IFN-γ)ELISA试剂盒购于北京诚林生物科技有限公司;谷丙转氨酶(Alanine aminotranferease, ALT)、谷草转氨酶(Aspartate aminotransferase, AST)、丙二醛(Malondialdehyde, MDA)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(Superoxide Dismutase, SOD)试剂盒购于南京建成生物工程研究所;BCA蛋白质定量试剂盒购于天根生化科技(北京)有限公司。
1.1.3 仪器设备
多功能酶标仪(赛默飞世尔上海仪器有限公司)、MIKRO22R型台式冷冻离心机(德国Hettich公司)、紫外分光光度计UV-2550(日本岛津公司)、压力蒸汽灭菌锅(上海中安医疗器械厂)、电子天平(梅特勒-托利多仪器上海有限公司)。
1.2 方法
1.2.1 动物实验设计
SPF级Slca/KM 8周龄雄性小鼠,购于湖南斯莱克景达实验动物有限公司,饲料亦购于该公司。将60只小鼠随机分成正常组、热处理对照组、L-茶氨酸低剂量组、L-茶氨酸中剂量组、L-茶氨酸高剂量组和Vc组6组,每组10只,每笼5只混合饲养,自由采食和饮水。小鼠适应性喂养7 d后,开始正式实验。1~14 d:温度(25±1)℃、湿度(60±5)%,L-茶氨酸低、中、高剂量分别为100、300、400 mg·kg-1·d-1,Vc组为300 mg·kg-1·d-1;15~21 d对热处理对照组、L-茶氨酸低、中、高剂量组和Vc组进行热处理:每天11:00—13:00进行一定温度(39±1)℃和湿度(75±5)%的处理,其他同前期。正常组始终处于温度(25±1)℃、湿度(60±5)%条件下[15-16]。
L-茶氨酸和Vc用饮用水配成相应浓度,各组小鼠定时定点接受灌喂,每只灌喂0.3 mL,正常组和热处理对照组灌喂等体积饮用水,最后一次灌喂结束后禁食12 h,摘眼球取血,并解剖取心、肝、脾、肺、肾。
1.2.2 小鼠采食量和体重测定
各组小鼠每日定量添加(100±2)g日粮,定时回收并称量当日剩余日粮,同时每只小鼠隔日称量体重。
1.2.3 器官指数测定
将小鼠各器官用4℃生理盐水洗净血渍,滤纸吸干表面水分后称其湿重。
器官指数(%)=器官湿质量(g)/小鼠体质量(g)×100。
1.2.4 血清ALT与AST酶活性及TNF-α、IL-6、IFN-γ含量测定
各组小鼠摘眼球取血,冰上静置2 h,3 000 r·min-1、4℃离心10 min,取上清液,严格按试剂盒说明书步骤操作检测血清ALT、AST酶活性水平,同时严格按ELISA试剂盒说明书检测TNF-α、IL-6、IFN-γ含量。
1.2.5 肝组织匀浆液中MDA含量及SOD、GSH-Px、CAT酶活性测定
取冻存组织,置于组织匀浆机于冰上匀浆,加预冷生理盐水制备10%的肝匀浆,严格按试剂盒说明书步骤操作、检测肝脏MDA含量及SOD、GSH-Px、CAT酶活性。
1.2.6 空肠和肝脏组织病理学观察
分别取空肠和肝脏右叶同一部位经10%甲醛固定24 h,石蜡包埋切片,HE染色,光镜下分别观察空肠和肝脏组织病理变化。
1.3 统计处理
采用SPSS19.0统计软件对数据进行方差分析,各组间采用最小显著差数法(LSD)检验,统计结果以均数±标准差()表示,<0.05表示有显著性差异,具有统计学意义。
2 结果与分析
2.1 对小鼠采食量和体质量的影响
表1显示,各组小鼠在1~14 d期间,采食量均呈上升趋势。15~21 d热处理期间,与正常组相比,热处理对照组小鼠采食量呈下降趋势,说明热处理影响了小鼠的采食量;与热处理对照组相比,L-茶氨酸各剂量组均能提高热处理条件下的小鼠采食量;不同L-茶氨酸剂量组相比,以L-茶氨酸中剂量组效果最佳,且其效果优于Vc组。可见L-茶氨酸具有增加热处理条件下小鼠采食量的作用。
L-茶氨酸对小鼠体质量的影响见表2。从表中可以看出,各组小鼠在1~14 d期间,体质量呈上升趋势。15~21 d热处理期间,与正常组对比,热处理对照组小鼠体质量显著下降;与热处理对照组相比,L-茶氨酸各剂量组均能减缓热处理条件下的体质量下降,其中以L-茶氨酸中剂量组的效果更好,与正常组体质量最为接近,效果亦优于Vc组,说明L-茶氨酸具有增加热处理条件下小鼠体质量的作用。
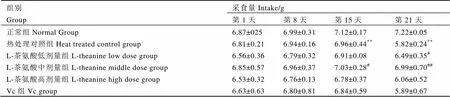
表1 L-茶氨酸对小鼠采食量的影响(n=10)
注:与正常组比较,*:<0.05,**:<0.01;与热处理对照组比较,#:<0.05,##:<0.01。下同。
Note: Compared with normal group, *:<0.05, **:<0.01. Compared with heat treated group, #:<0.05, ##:<0.01. The same below.
2.2 对小鼠器官指数的影响
对各处理小鼠器官指数进行了测定,结果如表3所示。从表中可以看出,与正常组相比,热处理引起小鼠器官指数上升,其中对肝脏和脾脏指数的影响达极显著水平(<0.01)。与热处理对照组相比,L-茶氨酸各剂量组均可显著降低小鼠肝脏和脾脏指数,且其中以L-茶氨酸中剂量组效果更佳,并优于Vc组,说明L-茶氨酸具有降低热处理条件下小鼠器官指数上升的作用。热处理对各处理组其他指数无显著影响。
2.3 对小鼠血清ALT、AST酶活性的影响
由表4可知,与正常组相比,热处理对照组小鼠血清ALT、AST酶活性显著升高(<0.01)。与热处理对照组相比,L-茶氨酸各剂量组及Vc组均能显著降低热处理条件下小鼠血清中ALT、AST酶活性的升高,其中以L-茶氨酸中剂量组效果最佳,说明L-茶氨酸能明显改善热处理条件下血清ALT、AST酶活性。
2.4 对小鼠血清中TNF-α、IL-6和IFN-γ含量的影响
由图1得知,与正常组对比,热处理对照组小鼠血清炎症因子TNF-α、IL-6和IFN-γ含量显著升高,说明热处理引起了小鼠体内炎症反应。与热处理对照组相比,L-茶氨酸各剂量组和Vc组均能显著降低炎症因子的含量,减轻炎症反应;L-茶氨酸各剂量组相比,以L-茶氨酸中剂量组的降低效果最佳,其效果亦优于Vc组,说明L-茶氨酸能减轻热处理条件下小鼠体内的炎症反应。
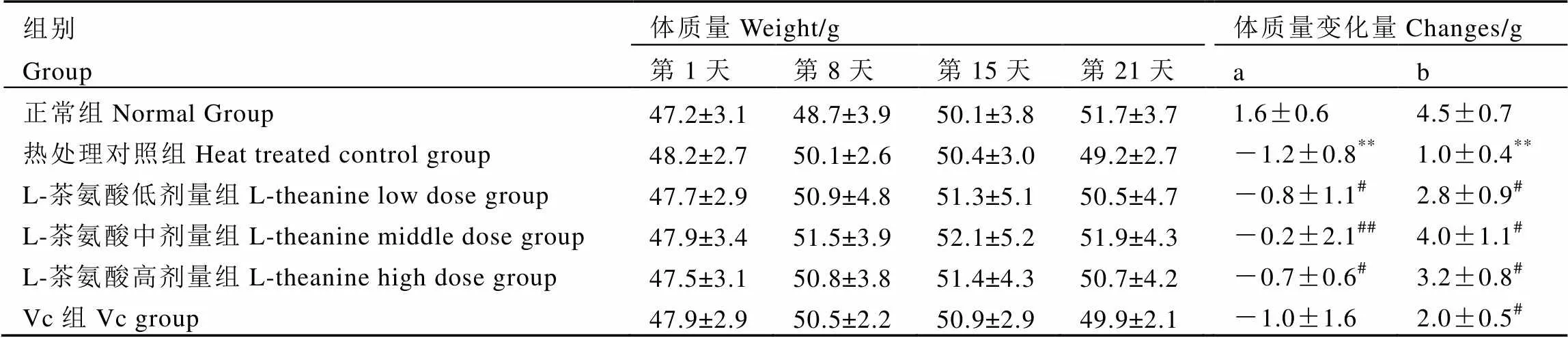
表2 L-茶氨酸对小鼠体质量的影响(n=10)
注:a:热处理期间体质量变化;b: 饲养期间体质量变化量。
Note: a: Weight changes during the heat treated, b: Increased weight.

表3 L-茶氨酸对小鼠器官指数的影响(n=10)

表4 L-茶氨酸对小鼠血清ALT、AST酶活性的影响(n=10)
2.5 对小鼠肝组织匀浆MDA含量及SOD、GSH-Px、CAT酶活性的影响
对各处理小鼠肝组织匀浆MDA含量及SOD、GSH-Px、CAT酶活性的测定结果(表5)表明,与正常组比较,热处理对照组小鼠肝组织匀浆中MDA含量显著升高(<0.01),抗氧化酶SOD、GSH-Px、CAT酶活性显著降低(<0.01)。与热处理对照组相比,L-茶氨酸各剂量组及Vc组MDA含量均显著降低;除L-茶氨酸高剂量组GSH-Px酶活力与热处理对照组间差异不显著外,其余各处理SOD、GSH-Px、CAT酶活力较热处理对照组均显著提高,其中以L-茶氨酸中剂量组效果最佳,说明L-茶氨酸可以改善热处理条件下小鼠的肝脏氧化逆境作用,且效果优于Vc。

表5 L-茶氨酸对小鼠肝组织匀浆MDA含量及SOD、GSH-Px、CAT酶活性的影响
2.6 对小鼠空肠组织和肝脏组织的影响
各处理小鼠空肠组织切片见图2。从图2可以看出,正常组小鼠空肠绒毛排列整齐;热处理条件下,小鼠空肠绒毛排列紊乱,绒毛出现变短、变粗,以及断裂的现象;与热处理对照组相比,L-茶氨酸各剂量组空肠绒毛排列较整齐,仅少量断裂,其中以L-茶氨酸中剂量组效果最佳,且优于Vc组。可见L-茶氨酸具有减轻热处理对小鼠空肠组织损伤的作用。
各处理小鼠肝组织切片的观察结果(图3)显示,正常组小鼠肝脏切片的肝小叶形态清晰可见,肝细胞整齐排列在中央静脉周围。与正常组相比,热处理对照组小鼠中央静脉周围出现细胞肿大,图3-b中箭头标记处可见胞浆呈半透明状,嗜酸性粒细胞单核细胞等炎性细胞聚集。与热处理对照组相比,L-茶氨酸各剂量组和Vc组肝索排列较为整齐,核仁明显,中央静脉周围仅轻微肿胀和少量炎性细胞浸润,其中以L-茶氨酸中剂量组效果最佳,说明L-茶氨酸具有减轻热处理对小鼠肝脏组织损伤的作用。

注:a:正常组;b:热处理对照组;c:L-茶氨酸低剂量组;d:L-茶氨酸中剂量组;e:L-茶氨酸高剂量组;f:Vc组。图3同。

图3 各组小鼠肝组织切片
3 讨论
热应激条件下,机体主要通过神经中枢的调节作用和减弱消化吸收能力两条途径来抗热应激[16]。空肠是机体肠道中获取营养物质的重要部位,空肠蠕动快,消化和吸收力强,当空肠组织受到损伤时,其消化吸收营养物质的能力减弱,进而导致机体生长性能下降。同时,在正常条件下,机体的免疫系统处于平衡状态,当发生热应激时,细胞因子表达量出现显著变化,免疫系统失调,机体出现炎症反应,并容易导致机体产生大量自由基,自由基积累过多时,造成营养物质蛋白质、脂类、糖等过氧化,造成氧化损伤。Vc因具有较好的抗氧化性能而被认为是一种理想的热应激添加剂[9],可起到较好的预防热应激危害的作用。本研究采用Vc作对比,其目的是为了比较L-茶氨酸与Vc对改善热处理引起的小鼠组织损伤和氧化逆境的效果差异。本研究从采食量与体质量、器官指数、炎症反应、氧化酶活性,以及空肠组织和肝脏组织病理等角度证实了L-茶氨酸具有改善热处理引起的小鼠组织损伤和氧化逆境的作用,其中以中剂量的L-茶氨酸效果最佳,且优于Vc。其原因主要有3个方面:一是虽然从分子结构以及体外抗氧化活性实验结果来看,Vc的抗氧化能力远高于L-茶氨酸,但Vc在溶液中很不稳定,且其稳定性随着温度的升高而降低[17],在热处理条件下容易被氧化失活;二是L-茶氨酸不仅具有可分别通过非酶促抗氧化,以及SOD、G GSH -Px抗氧化作为第一、第二防线来抑制过氧化物与过氧化氢等产生的双重抗氧化作用[18],而且还具有调节免疫、降血压、安神镇静、拮抗谷氨酸过量而产生的细胞兴奋性毒性等多种生物活性[12-14];三是尽管L-茶氨酸的安全剂量范围较大(100~300 mg·kg-1),但研究发现,剂量过高(如500 mg·kg-1)也会导致炎症因子产生等副作用[18]。本研究中L-茶氨酸中剂量处理效果最佳的结果与前人的研究结果[18]相吻合。由此说明,L-茶氨酸对热处理小鼠肝脏损伤及氧化逆境具有改善作用,主要表现为提高机体营养物质消化吸收,降低炎症因子TNF-α、IL-6和IFN-γ含量,减少肝脏中过氧化脂质降解产物MDA,以及提高抗氧化酶SOD、GSH-Px、CAT活性及减缓空肠组织和肝脏损伤,但其作用机制尚有待进一步研究。
[1] 戴四发. 谷氨酰胺和γ-氨基丁酸对肉鸡抗热应激和肉品质的影响及机理探讨[D]. 南京: 南京农业大学, 2012: 1-7.
[2] 周鑫, 黄毅, 李延森, 等. 叔丁基对苯二酚对热应激小鼠肝脏氧化损伤的缓解作用[J]. 动物营养学报, 2014, 26(9): 2779-2788.
[3] Liu LL, He JH, Xie HB, et al. Resveratrol induces antioxidant and heat shock protein mRNA expression in response to heat stress in black-boned chickens [J]. Poultry Science, 2014, 93(1): 54-62.
[4] 胡娟, 陈继兰, 文杰, 等. 急性热应激对北京油鸡生产性能的影响及Vc添加效应的研究[J]. 安徽农业大学学报, 2010, 37(3): 440-444.
[5] 何钦. 热应激对不同泌乳阶段奶牛生产性能及其营养代谢的影响[D]. 重庆: 西南大学, 2012: 7-9.
[6] 潘晓建, 彭增起, 周光宏, 等. 宰前热应激对肉鸡胸肉氧化损伤和蛋白质功能特性的影响[J]. 中国农业科学, 2008, 41(6): 1778-1785.
[7] 李静, 乔健, 高铭宇, 等. 40℃持续热应激对肉鸡股动脉压的影响[J]. 中国农业大学学报, 2004, 9(3): 41-44.
[8] 罗炳德, 邹飞, 万为人, 等. 复方人参制剂对热应激大鼠的保护作用研究[J]. 中国工业医学杂志, 2001, 14(3): 136-138.
[9] 肖敏华, 唐兴刚, 韩前彪, 等. 中药对热应激动物消化系统作用的研究进展[J]. 中国畜牧兽医, 2010, 37(9): 176-179.
[10] 施忠秋. γ-氨基丁酸调控采食量和缓解热应激的机制[J]. 动物营养学报, 2014, 26(1): 49-53.
[11] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003: 105.
[12] Ritsner MS, Miodownik C, Ratner Y, et al. L-theanine relieves positive, activation, and anxiety symptoms in patients with schizophre-nia and schizoaffective disorder: an 8-week, randomized, double-blind, placebo-controlled, 2-center study [J]. J Clin Psychiatry, 2011, 72(1): 34-42.
[13] Sadzuka Y, Yamashita Y, Kishimoto S, et al. Glutamate transporter mediated increase of antitumor activity by theanine, an amino acid in green tea [J]. The Pharmaceutical Society of Japan, 2002, 122(11): 995-999.
[14] Kimura K, Ozeki M, Juneja LR, et al. L-Theanine reduces psychological and physiological stress responses [J]. Biological Psychology, 2007, 74(1): 39-45.
[15] 彭彬, 刘仲华, 林勇, 等. L-茶氨酸改善慢性应激大鼠抑郁行为作用研究[J]. 茶叶科学, 2014, 34(4): 355-363.
[16] 陈静, 李丹丹, 邹慧, 等. 富硒女贞子对热应激小鼠内分泌及免疫功能的影响[J]. 畜牧与兽医, 2015, 47(6): 105-108.
[17] 李华. 维生素C稳定性研究[J]. 食品科学, 1989, 10(9): 3-5.
[18] Yanli Deng, Wenjun Xiao, Ling Chen, et al.antioxidative effects of L-theanine in the presence or absence of Escherichia coli-induced oxidative stress [J]. Journal of Functional Foods, 2016, 24(4): 527-536.
L-theanine AttenuatesTissue and Oxidative Damages in Heat Stressed Mice
GUO Chen1,2, LIU Linfeng1,2, XIANG Yi1,2, LUO Li1,2, LIN Ling1,2, XIAO Wenjun1,2,3*
1. Key Lab of Tea Science of Ministry of Education, 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, 3. Hunan Collaborative Innovation Center for Utilization of Botanical Functional Ingredients, Hunan Agricultural University, Changsha 410128, China
The effects of different dosages of L-theanine on SPF grade Balb/KM male mice under heat treatment, including feed intake, weight, organs index, histopathological features of jejunum, activities of serum alanine aminotranferease (ALT) and aspartate aminotransferase (AST), contents of tumor necrosis factor (TNF-α), interleukin-6 (IL-6), interferon-γ (IFN-γ) in serum, content of liver homogenate malondialdehyde (MDA), activities of liver homogenate superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px) and histopathological features of liver tissue were studied. Results showed that pretreatment with different dosages of L-theanine increased the feed intake and body weight of the mice, enhanced the activities of liver homogenate SOD, CAT, GSH-Px, decreased the index of liver and spleen, damages in the jejunum, activities of serum ALT, AST, contents of TNF-α, IL-6 and IFN-γ in serum, content of liver homogenate MDA and attenuated the damages of liver by heat treatment. The best attenuating effect of L-theanine on damages was under middle dosage treatment. It suggests that L-theanine mainly improves the absorptive capacity, reduces the expressions of inflammatory cytokines and oxidative damage in mice, which finally attenuate the tissue and oxidative damages caused by heat stress.
L-theanine, heat stress, tissue damage, oxidative stress
TS272;Q51
A
1000-369X(2017)01-017-08
2016-06-02
2016-09-18
国家“十二五”科技支撑计划项目(2011BAD10B00)
郭晨,女,硕士研究生,主要从事茶叶功能成分的利用研究。
xiaowenjun88@sina.com

