湖泊理论藻源内负荷估算方法研究
杨苏文,金位栋,闫玉红,王圣瑞 (中国环境科学研究院水所湖泊生态环境创新基地,环境与风险评估国家重点实验室,北京 100012)
湖泊理论藻源内负荷估算方法研究
杨苏文*,金位栋,闫玉红,王圣瑞 (中国环境科学研究院水所湖泊生态环境创新基地,环境与风险评估国家重点实验室,北京 100012)
在模拟不同温度和营养条件下,采用水质指标CODCr、CODMn、TP、TN表征湖泊典型藻类藻源内负荷、胞外负荷、胞内负荷,形成理论藻源内负荷理论估算的方法体系.5种藻源TP负荷ATP均值随贫、中和富营养水平升高而升高,藻源TN负荷ATN为负值,藻源CODCr负荷ACODCr随营养水平升高而显著升高.藻源胞外 TP负荷ETP、TN负荷ETN、CODCr负荷ECODCr、CODMn负荷ECODMn均随营养水平升高而降低,藻源胞内TP负荷BTP、TN负荷BTN、CODCr负荷BCODCr和CODMn负荷BCODMn总体随随营养水平升高而升高.根据藻源内负荷与藻密度显著相关关系,确定了藻源内负荷计算模型.藻源TP和COD在稳定期对水质的贡献均较大,为0.2~3.7倍,藻源TN内负荷对水质的贡献为负,减少的比例在 26%~58%之间.本研究表明,藻类在增殖过程中产生了超出系统物质总量的“额外”负荷,这些藻源内负荷是引起水质指标,特别是COD异常升高的重要原因.该估算方法为富营养化湖泊水华的定量削减控制提供科学依据.
湖泊;藻;理论藻源内负荷;胞外负荷;胞内负荷;估算
健康湖泊生态系统中外源输入的氮磷等营养元素在浮游藻类利用、沉积物沉降与吸附、水生植物与微生物利用、以及进入大气等物质循环间的比例是动态平衡的[1].由于富营养化湖泊藻类“水华”破坏了水生生态系统物质能量交换平衡,严重时甚至可引发生态灾变[2].通常内负荷指单位时间湖内产生的超出健康水生态系统需要的营养或其他物质的量,因此,湖泊“藻源内负荷”即超过健康水生态系统结构需求的过剩藻类生物量及其代谢量.目前国内外鲜有对“藻源内负荷”的相关研究,难以形成藻对水体主要生源要素贡献的定量认识.针对这一问题,国家水体污染控制与治理科技重大专项(下称水专项)“十一五”和“十二五”课题中,均把藻源内负荷估算作为重点科学问题进行深入研究.
水华爆发及形成机制的研究经历了氮磷营养盐限制理论[3-5]、非稳态种间竞争理论[6-8]、藻类休眠复苏理论[9-10]等过程.这些理论从优势藻类对营养需求、外界干扰、自身生理优势[11-12]等角度阐述了藻类异常增殖的机理,并运用宏观技术对水华规模开展了定性研究[13-15].这些研究有助于了解藻类种群结构特征与相应水质的动态变化关系,但未能将藻类生物量与对水质的贡献建立定量联系,进而确定湖泊水华生态灾害的定量控制目标.
广义上理解,湖泊藻源内负荷的估算是一个开放的体系,即藻源内负荷的计算应考虑藻自身负荷、藻代谢负荷、被摄食与分解、入湖与出湖负荷五部分的影响.事实上,由于牧食或分解藻类的水生动物和微生物的生命周期不同,摄食分解量不同,物质的循环次数不同,使这一计算过程变得异常复杂,误差控制难度较大,难以得到藻源内负荷的准确值.因此,本研究采用了理论藻源内负荷估算方法来计算藻负荷量.研究表明,藻源物质一般由胞内物质(IOM,如大分子蛋白质、碳水化合物、核酸、酶类、脂类和色素等[16]为主)和胞外物质(EOM[17-18],如酸性多糖类碳水化合物为主,并包括少量蛋白质和脂类[19]等)组成,其中氨基酸和蛋白质占25%~50%[20-21]、碳水化合物占40%[22],及少部分藻毒素[23-25]和异味物质[26-27]等亲水或疏水[30-32]的次生代谢物[28-29],这些藻源物质是湖泊溶解性有机质(DOM)的重要组成部分
[51].目前对藻源物质化学结构和定量表征已成为藻类研究的热点,但作为内负荷,藻源物质对湖泊水质贡献的定量响应关系尚未建立[33].
理论藻源内负荷是指在特定环境条件下,不考虑藻类被摄食、微生物摄取与分解、出入湖的藻类的生物量与代谢量,仅将藻类净增长过程中藻细胞自身和代谢物质(统称藻源物质),在一定时间内,超过模拟健康水生态系统所需藻生物量(换算为负荷)的“额外”贡献量作为藻源内负荷.
根据理论藻源内负荷的定义,藻源内负荷估值取决于藻源性物质即胞内物质与胞外物质(代谢)量的大小、湖泊水体C、N、P营养要素质量浓度水平的变化.本研究通过模拟自然实际湖泊春季与夏季不同温度与营养水平,开展室内藻类生长 AGP实验[34],通过膜滤手段实现胞内物质与胞外物质的分离,利用ρ(COD)、ρ(TN)、ρ(TP)等总体定量表征指标,建立了微观藻源物质与宏观水质指标的定量关系,提出理论藻源内负荷的估算方法.该方法以期为计算藻源物质对富营养化湖泊水质的实际贡献提供理论依据,并对藻类水华生态灾变的治理实践提供技术支撑.
1 材料与方法
1.1 受试藻种
我国多数浅水湖泊藻类群落主要由蓝藻、绿藻和硅藻3个门构成,本研究选择了其中5种典型藻类作为受试物种,通过模拟自然湖泊藻类结构的组成,估算不同藻类组成湖泊的藻源内负荷.其中包括夏季水华典型类群铜绿微囊藻(Microystis aerufinosa)和春季典型类群水华束丝藻(Aphanizomenon flos-aquae)2种蓝藻,典型四季常见类群四尾栅藻(Scenedesmus quadricauda)和小球藻(Chlorella vulgaris)2种绿藻、放射舟形藻(Navicula radiosa)1种硅藻,5种藻均由中国环境科学研究院藻种库(CRAES-AP)提供.
1.2 藻类的培养
设定春季模拟温度为 15℃,夏季 23℃,将M11培养基及D1培养基[8]分别配制成模拟贫营养、中营养、富营养3个不同营养水平的藻类培养液,考察不同营养水平湖泊藻源内负荷,包括藻胞内与胞外负荷对水质的贡献.藻类培养液配置水质见表1.
在500mL的培养瓶中加入200mL配置的培养液,将铜绿微囊藻、、水华束丝藻、四尾栅藻和小球藻分别接入3个营养级的M11培养液,接种浓度为8×l05cells/L.将放射舟形藻接入3个营养级的D1培养液,接种浓度为8×l05cells/L.每组均设 3个重复.光强 4000lux,光照周期为 12h:12h,每3h随机调换培养瓶位置.模拟春季的温度设为 (15±1)℃,模拟夏季的温度设为(23±1)℃.
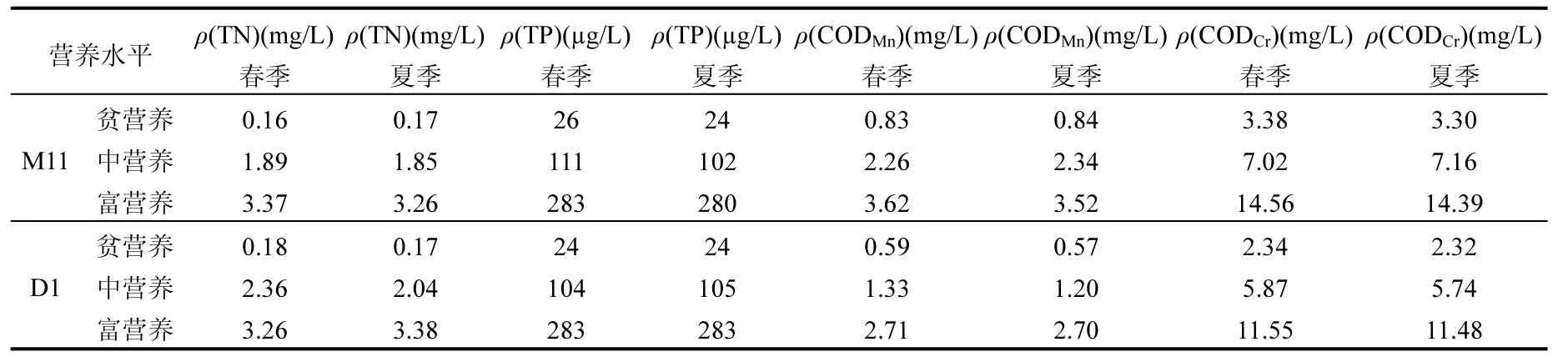
表1 藻类培养液配置水质Table 1 Culture set of algae growth process
1.3 测定方法
藻密度采用 OLYMPUS CX41(日本奥林巴斯公司)3目显微镜和血球计数法测定.达到藻类稳定增长期,蓝藻、绿藻在第 13d,硅藻在第 20d分别取藻液过 0.45μm玻璃纤维滤膜,过膜前后分别测定藻类培养液的ρ(COD)、ρ(TN)、ρ(TP),作为理论藻源内负荷、理论藻源胞外负荷与理论藻源胞内负荷计算的基础数据.ρ(COD)测定采用重铬酸钾法(CODCr)和酸性高锰酸钾法(CODMn), ρ(COD)、ρ(TN)、ρ(TP)的测定均按文献[35]方法进行.
1.4 计算方法
本研究中理论藻源内负荷,分别为胞外与胞内负荷,其计算公式为:
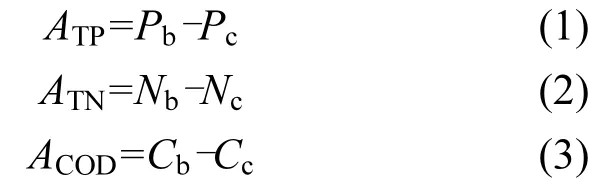
式中:ATP为藻源TP负荷,mg/L;Pb为稳定期藻水混合液过滤前ρ(TP),mg/L;Pc为加藻1d后(作为前述健康水生态系统所需藻生物量的基准值,即对照)培养液 ρ(TP),mg/L;ATN为藻源 TN负荷, mg/L;Nb为稳定期藻水混合液过滤前ρ(TN),mg/L; Nc为加藻1d后培养液ρ(TN) ,mg/L;ACOD为藻源COD负荷,mg/L;Cr法测的为ACODCr,Mn法测的为 ACODMn;Cb为稳定期藻水混合液过滤前ρ(COD),mg/L;Cc为加藻 1d后培养液 ρ(COD), mg/L.Cr法为Cc1,Mn法为Cc2.预研究发现,藻类对水质COD的贡献因Cr法与Mn法测定方法的系统性差异,表现出不一致的变化规律,因此本文将COD负荷分别采用Cr法与Mn法估算藻源负荷,以期解释差异性.
理论藻源胞外负荷定义为藻过0.45μm膜后各指标数值.由于藻类在一定磷浓度(≤1.0mg/L)范围内,在指数增长末期即可实现营养的全部吸收[36],同时该实验所配培养液氮磷比(质量)在7~20之间(质量比),符合藻类最适生长 Redfield比[37-38],因此该文假设培养液中各营养要素全部被藻类吸收,则过膜后藻代谢各指标数值即为理论藻胞外负荷,在此假设基础上进行各指标总量平衡的分析.其中ETP为藻源胞外TP负荷,mg/L,稳定期藻水混合液过膜后ρ(TP);ETN为藻源胞外TN负荷,mg/L,稳定期藻水混合液过膜后ρ(TN); ECOD为藻源胞外COD负荷,mg/L,稳定期藻水混合液过膜后ρ(COD),Cr法测的为ECODCr,Mn法测的为ECODMn.
理论藻源胞内负荷,是指过膜前藻水混合液各指标浓度减去相应加藻1d后浓度与理论藻源胞外负荷,计算公式为:

式中:BTP为藻源胞内TP负荷,mg/L;BTN为藻源胞内 TN负荷,mg/L;BCOD为藻源胞内 COD负荷, mg/L,Cr法测的为BCODCr,Mn法测的为BCODMn.
1.5 数据分析
藻密度及水质指标数据结果均采用 Excel2007软件分析,所有指标组内、组间及指标间相关性与回归模型采用SPSS 22.0软件拟合.
2 结果与讨论
2.1 模拟春季理论藻源内负荷计算
2.1.1 理论藻源内负荷 模拟春季15℃时,5种藻在不同营养条件下稳定增长期 ATP、ATN和ACOD负荷如图1所示.5种藻ATP平均值分别为0.044、0.044与0.133mg/L,贫营养与中营养无显著差异,分别与富营养有显著差异(P<0.05);3个营养水平下5种藻平均ATP占过膜前藻水混合培养液ρ(TP)的比例分别为63%、29%和32%,表现出随营养水平升高而降低的趋势;3个营养水平下均为水华束丝藻ATP值较小,四尾栅藻、铜绿微囊藻、小球藻ATP值较大;贫营养ATP最大与最小间相差31倍,富营养时相差24倍.
3个营养水平间ATN差异极显著(P<0.01).贫营养下5种藻ATN差异显著,中营养和富营养下差异不显著;不同营养水平下ATN均为负值,即加藻后培养液中 ρ(TN)低于对照,并随营养水平升高负值增大;贫营养、中营养和富营养条件下ATN最大与最小值分别相差7、5和3倍;ATN的减少量分别占稳定期过膜前藻水混合液 ρ(TN)的34%、105%与42%.
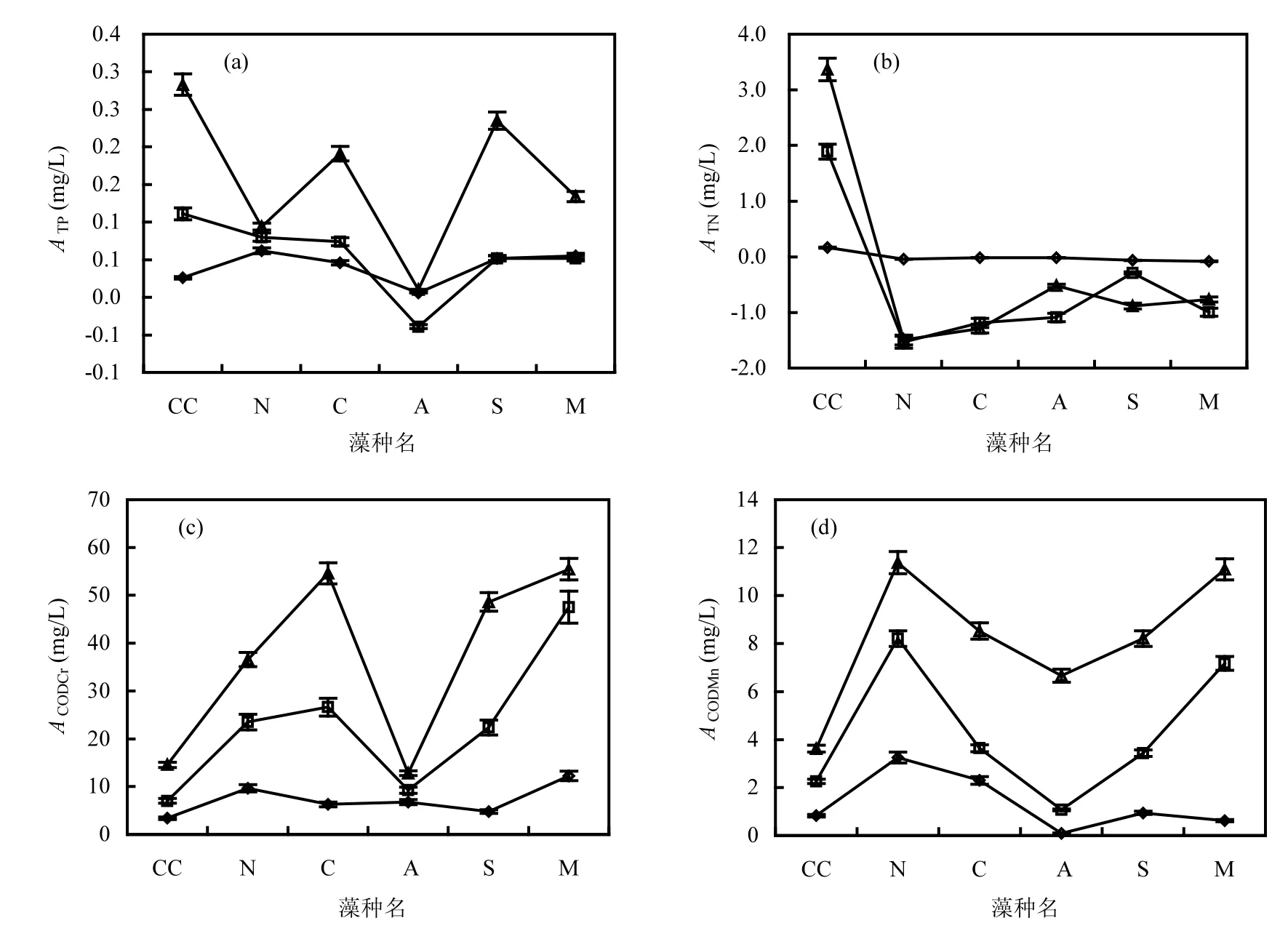
图1 模拟春季15℃5种藻藻源ATP、ATN、ACODCr和ACODMn负荷Fig.1 Algae loading of ATP, ATN, ACODCr, and ACODMnof 5species at 15℃simulating spring temperature

不同营养水平间ACODCr差异极显著(P<0.01),变化规律与 ATP相似,即各营养级水华束丝藻ACODCr最低,且不随营养水平升高而显著升高;小球藻、四尾栅藻和铜绿微囊藻ACODCr较高;贫营养、中营养和富营养 ACODCr的最大与最小值分别相差2、5和4倍;3个营养水平下ACODCr分别是稳定期过膜前藻水混合液的71%、79%与75%,占比与营养水平无显著相关性.
3个营养水平间ACODMn差异极显著(P<0.01),规律与 ACODCr相似;贫营养、中营养和富营养 5种藻ACODMn最大与最小值分别相差35、8和2倍,均值分别是稳定期过膜前藻水混合液的65%、69%与73%,占比随营养水平升高而升高. 2.1.2 理论藻源胞外负荷 15℃时 5 种藻源胞外负荷如图2所示.ETP、ETN、ECODCr和ECODMn表现出随营养水平升高而升高的趋势,ETP和ETN在不同营养水平间差异极显著(P<0.01);在贫营养、中营养和富营养条件下,ETP均值分别占稳定期过膜前藻水混合液 ρ(TP)的 43%、29%和16%;ETN均值分别占稳定期过膜前藻水混合液ρ(TN)的68%、42%和31%,不同营养水平间占比差异不显著(P>0.05);ECODCr分别占稳定期过膜前藻水混合液ρ(CODCr)的43%、27%和24%,其中铜绿微囊藻的 ECODCr随营养水平升高而显著升高;ECODMn分别占稳定期过膜前藻水混合液ρ(CODMn)的41%、21%和20%;ETP、ETN、ECODCr和ECODMn在过膜前藻水混合液中各指标质量浓度的占比,均随营养水平的升高而降低.
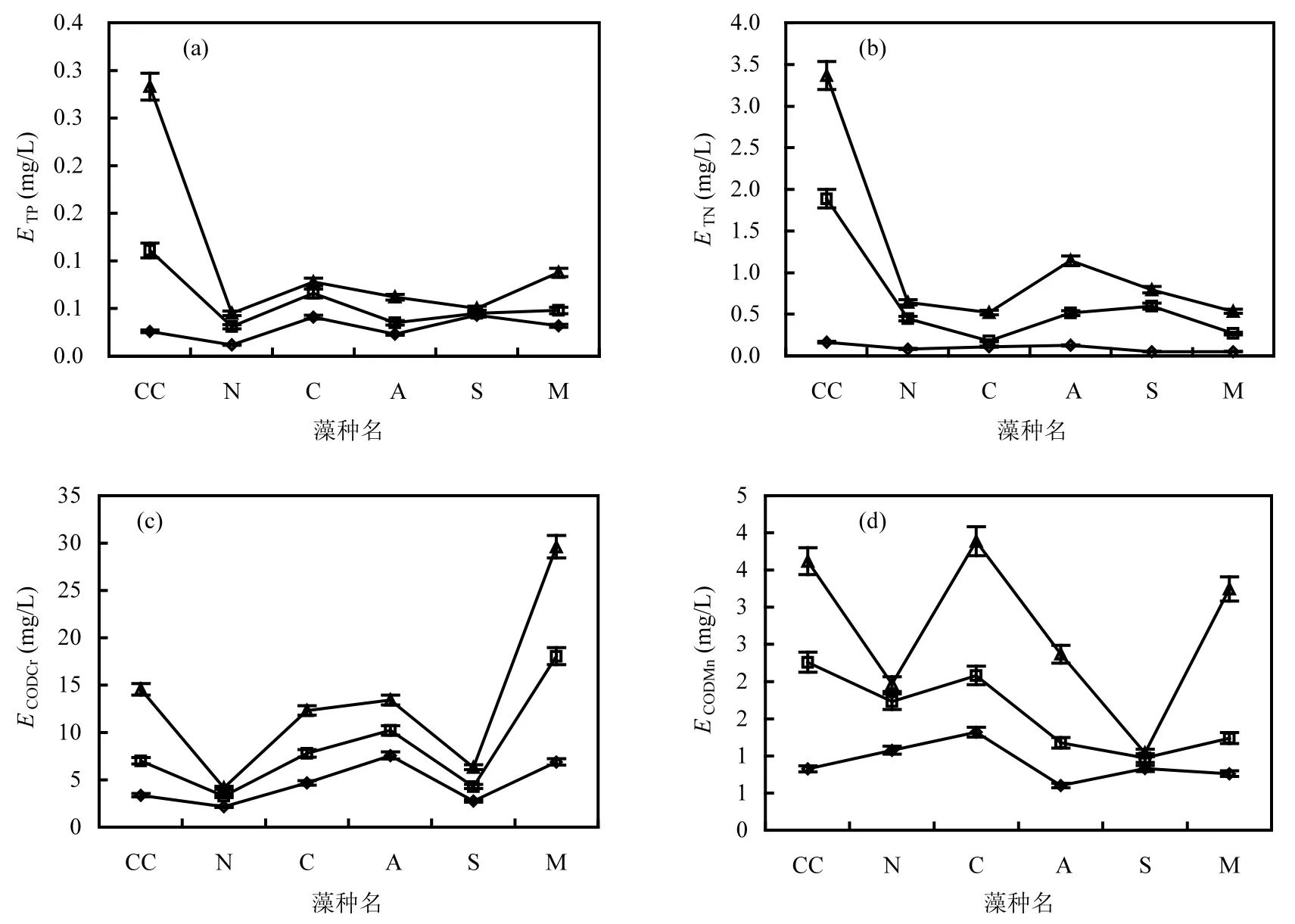
图2 15℃不同营养水平5种藻源胞外ETP、ETN、ECODCr和ECODMn负荷Fig.2 Algae extracellular loading of ETP, ETN, ECODCr, and ECODMnof 5species at 15℃
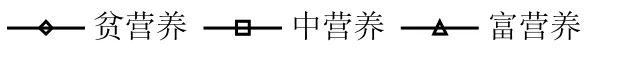
2.1.3 理论藻源胞内负荷 模拟春季15℃时,5种藻源胞内负荷如图 3所示.BTP、BTN、BCODCr和BCODMn总体呈现随营养水平升高而升高的趋势,其中BTN、BCODCr和BCODMn在不同营养水平间差异显著(P<0.05);在贫营养、中营养和富营养条件下,BTP均值分别为定期过膜前藻水混合液ρ(TP)的19%、-2%和16%,占比呈中营养较低,贫营养和富营养持平的趋势;BTN均值分别为稳定期过膜前藻水混合液ρ(TN)的-102%、-147%和-73%,藻胞内总氮负荷值显著小于相应对照值(P<0.05),2者相减为负值;BCODCr分别为稳定期过膜前藻水混合液ρ(CODCr)的26%、52%和50%,占比呈升高后持续保持的趋势;BCODMn分别为稳定期过膜前藻水混合液ρ(CODMn)的21%、45%和51%,占比持续升高.

图3 15℃不同营养水平5种藻源胞内BTP、BTN、BCODCr和BCODMn负荷Fig.3 Algae intracellular loading of BTP, BTN, BCODCr, and BCODMnof 5species at 15℃


图4 15℃时不同营养水平5种藻稳定期藻密度变化Fig. 4 Algae density at stable stage under different nutrient levels at 15℃
2.1.4 不同营养水平对藻类增殖的影响 15℃时,5种藻密度在3个营养水平间差异不显著(图4).贫营养水平下5种藻密度均较低,放射舟形藻藻密度达到 1.1×108cell/L,为最大值,最小为水华束丝藻2.3×106cell/L,2者相差50倍;中营养水平小球藻藻密度最大,达到 2.3×109cell/L,其次为四尾栅藻,最小为铜绿微囊藻 4.1×107cell/L,2者相差 57倍.富营养水平,最大值为小球藻达到7.9×109cell/L,最小为铜绿微囊藻 1.0×108cell/L,2者相差76倍.
2.2 模拟夏季理论藻源内负荷计算
2.2.1 理论藻源内负荷 模拟夏季 23℃时,5种藻不同营养水平稳定期藻源COD、TN和TP负荷如图5所示.ATP在贫营养、中营养和富营养水平下的均值分别为 0.017、0.034与0.081mg/L,营养级间差异不显著(P>0.05);贫营养条件下5种藻平均ATP占稳定期过膜前藻水混合液ρ(TP)的42%,铜绿微囊藻的ATP最大,放射舟形藻最小,2者相差3倍;中营养条件下5种藻平均 ATP占稳定期过膜前藻水混合液 ρ(TP)的25%;富营养条件下5种藻ATP占稳定期过膜前藻水混合液 ρ(TP)的 22%;ATP占稳定期藻水混合液过膜前 ρ(TP)的比例随营养水平升高而下降.
藻源 ATN变化趋势与春季相似,3个营养水平间差异极显著(P<0.01).各藻TN负荷均为负值,加藻后培养液中 ρ(TN)低于对照;中营养与富营养水平时 ATN负值程度大于贫营养;ATN的减少量分别为稳定期过膜前藻水混合液 ρ(TN)的61%、141%,56%.

图5 23℃时5种藻稳定期藻源ATP、ATN、ACODCr和ACODMn负荷Fig.5 Algae loading of ATP, ATN, ACODCr, and ACODMnof 5species at 23℃
ACODCr在不同营养水平间差异极显著(P<0.01),规律与春季相似.5种藻的 ACODCr在贫营养、中营养和富营养条件下,最大与最小值分别相差5、11和13倍,5种藻ACODCr均值分别为稳定期过膜前藻水混合液 ρ(CODCr)的 73%、79%与78%,占比随营养水平升高无显著变化.
ACODMn在不同营养水平间差异极显著(P<0.01),规律与春季相似,5种藻的ACODMn均随营养水平升高而增大.贫营养水平下放射舟形藻ACODMn最大,其余4藻无显著差异;富营养条件下5种藻的 ACODMn均显著高于中营养与贫营养.3个营养条件下5种藻最大与最小ACODMn分别相差57、16和1倍,5种藻均值分别为稳定期过膜前藻水混合液 ρ(CODMn)的 62%、70%与 76%,占比随营养水平升高而升高.
2.2.2 理论藻源胞外负荷 模拟夏季23℃时,5种
藻胞外负荷如图6所示.ETP、ETN、ECODCr和ECODMn均随营养水平升高而升高,ETP和 ETN在不同营养水平间差异极显著(P<0.01);3个营养水平下5种藻ETP均值分别占稳定期过膜前藻水混合液ρ(TP)的62%、24%和13%;ETN分别占64%、37%和34%; ECODCr在不同营养水平间无显著差异(P>0.05),分别占稳定期过膜前藻水混合液ρ(CODCr)的40%、25%和 23%;ECODMn在不同营养水平间差异显著(P<0.05),分别占稳定期过膜前藻水混合液ρ(CODMn)的38%、14%和14%.ETP、ETN、ECODCr和ECODMn在过膜前藻水混合液中各指标质量浓度的占比,均随营养水平的升高而降低.
2.2.3 理论藻源胞内负荷 模拟夏季 23℃时,5种藻藻源胞内负荷如图 7所示.与 15℃时相似,BTP、BTN、BCODCr和BCODMn总体呈现随营养水平升高而升高的趋势,且不同营养水平间差异显著(P<0.05).在贫营养、中营养和富营养条件下,BTP均值分别为定期过膜前藻水混合液ρ(TP)的-20%、1%和10%;BTN均值分别为稳定期过膜前藻水混合液 ρ(TN)的-125%、-173%和-88%,BTN显著小于相应对照值(P<0.05),2者相减为负值;BCODCr分别为稳定期过膜前藻水混合液ρ(CODCr)的32%、53%和54%,占比呈升高后持续保持的趋势;BCODMn分别为稳定期过膜前藻水混合液ρ(CODMn)的22%、53%和61%.BTP、BTN、BCODCr和 BCODMn在过膜前藻水混合液中各指标质量浓度的占比,均随营养水平的升高而升高.
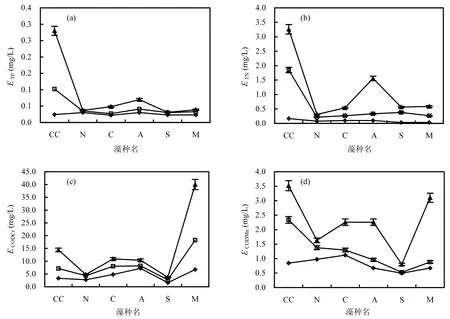
图6 23℃时不同营养水平5种藻的胞外ETP、ETN、ECODCr和ECODMn负荷Fig.6 Algae metabolism loading of ETP, ETN, ECODCr, and ECODMnof 5species at 23℃

2.2.4 不同营养水平对藻类增殖的影响 模拟夏季23℃时5种藻增殖规律与15℃时相似,但不同营养水平间存在显著差异(P<0.05)(图 8).5种藻藻密度在贫营养水平时均较低,藻密度最大值与最小值相差79倍;中营养水平下藻密度最高值为小球藻,达到 1.2×109cell/L,其次为四尾栅藻和铜绿微囊藻,最小为水华束丝藻 1.9×107cell/L,最大值与最小值相差60倍.富营养规律与中营养相似,最高值为小球藻达到 8.7×109cell/L,最小为水华束丝藻4.5×108cell/L,2者相差19倍.
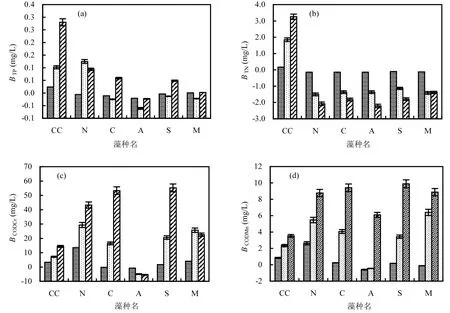
图7 23℃不同营养水平5种藻源胞内BTP、BTN、BCODCr、BCODMn负荷Fig.7 Algae intracellular loading of BTP, BTN, BCODCr, and BCODMnof 5species at 23℃

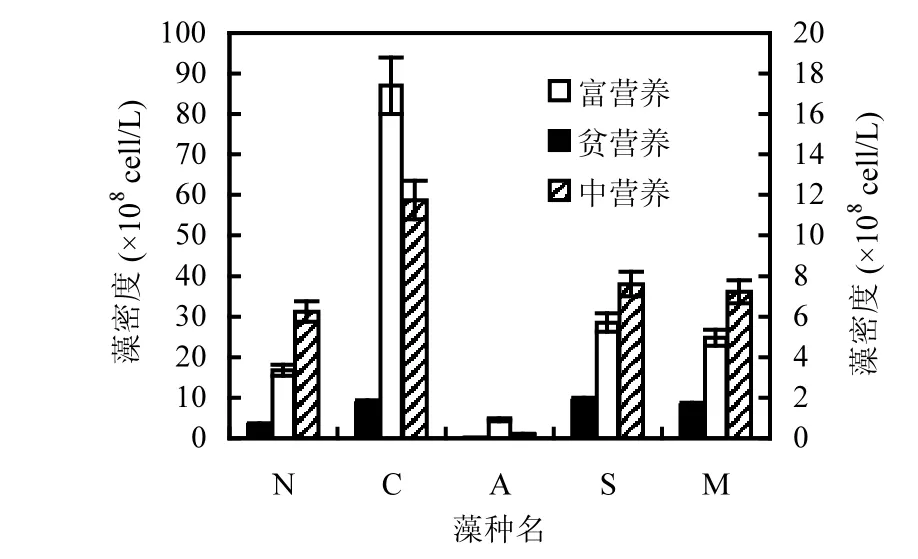
图8 23℃时不同营养水平藻类稳定期藻密度变化Fig.8 Algae density at stable stage and different nutrient levels at 23℃
2.3 模拟春季 15℃与夏季 23℃藻源负荷差异及与藻密度相关性
模拟春季与夏季两个不同温度下藻负荷各项指标中,仅贫营养水平时 ATP有显著差异(P<0.05),表明贫营养条件下藻ATP对温度较为敏感;ATN、ACODCr、ACODMn对温度均差异不显著(P>0.05),而对营养水平差异极显著(P<0.01),表明藻源TN和COD负荷对温度不敏感,对营养水平较敏感;藻胞外负荷ETP、ETN、ECODCr和ECODMn在不同温度下差异不显著(P>0.05),15℃时ETP、ETN和23℃时ECODMn在3个营养水平下分别为极显著差异和显著差异表明,藻胞外负荷对温度不敏感对营养水平敏感;藻胞内负荷BTP、BTN、BCODCr和BCODMn与胞外负荷相似,均表现为对温度不敏感对不同营养水平敏感;15℃时,藻密度与ATP和 BTP极显著相关,与 ACODCr和 ETN显著相关;23℃时,藻密度与 ACODCr、ACODMn、BCODCr和BCODMn为极显著正相关(P<0.01),与ETN和ETP显著负相关(P<0.05).
2.4 理论藻源内负荷估算模型的确定
2.4.1 藻源TP负荷ATP的估算 根据前述分析与讨论结果,藻源 ATP与藻密度的对数呈显著线性回归关系(P<0.05,图9),因此TP的理论藻源内负荷估算通量模型为:
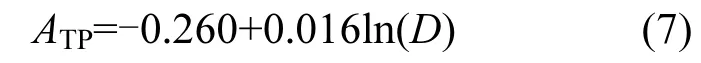
式中:D为藻密度,cell/L,此公式仅适用于藻密度大于1.2×107cell/L的情况.

图9 ATP与藻密度回归曲线Fig.9 Fit curve between ATPand algae density
2.4.2 藻源TN负荷ATN的估算 本研究中测得过膜前藻水混合ρ(TN)浓度均小于对照,ATN出现负值的现象,这可能与藻胞外物分解产生的含氮类挥发物质排入大气有关[39-40].因此,在计算理论藻TN负荷时采用了膜前减膜后TN浓度的方法估算藻类TN负荷,称为A’TN,与藻密度的回归模型见图10,计算模型如下:

式中:D为藻密度,cell/L,此公式仅适用于藻密度大于1.05×107cell/L的情况.
2.4.3 藻源CODCr负荷的估算 根据前述不同温度各藻 ACODCr差异不显著,并与藻密度成极显著的对数回归关系(P<0.01,图11),得到CODCr的理论藻源内负荷估算通量模型为:
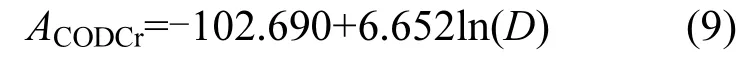
式中:D为藻密度,cell/L,此公式仅适用于藻密度大于5.2×106cell/L的情况.
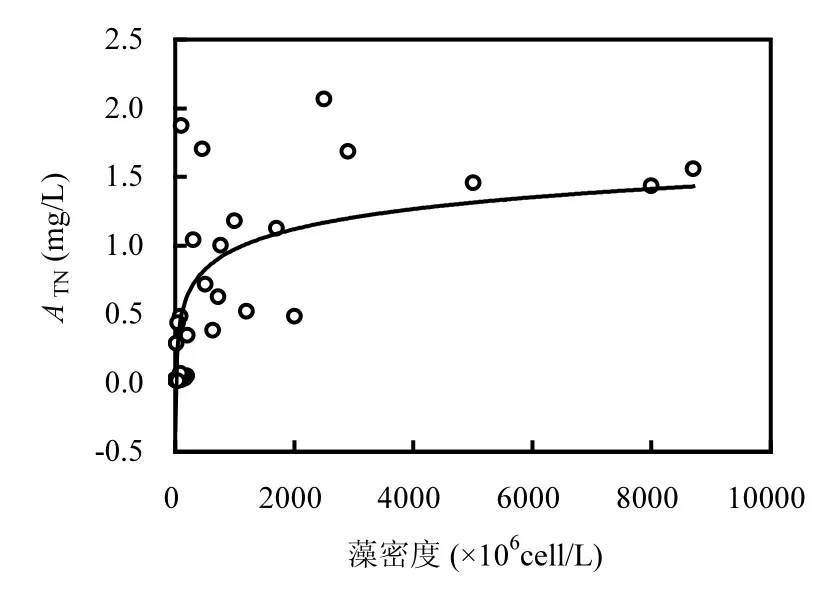
图10 A’TN与藻密度回归曲线Fig.10 Fit curve between ATNand algae density

图11 ACODCr与藻密度回归曲线Fig.11 Fit curve between ACODCrand algae density
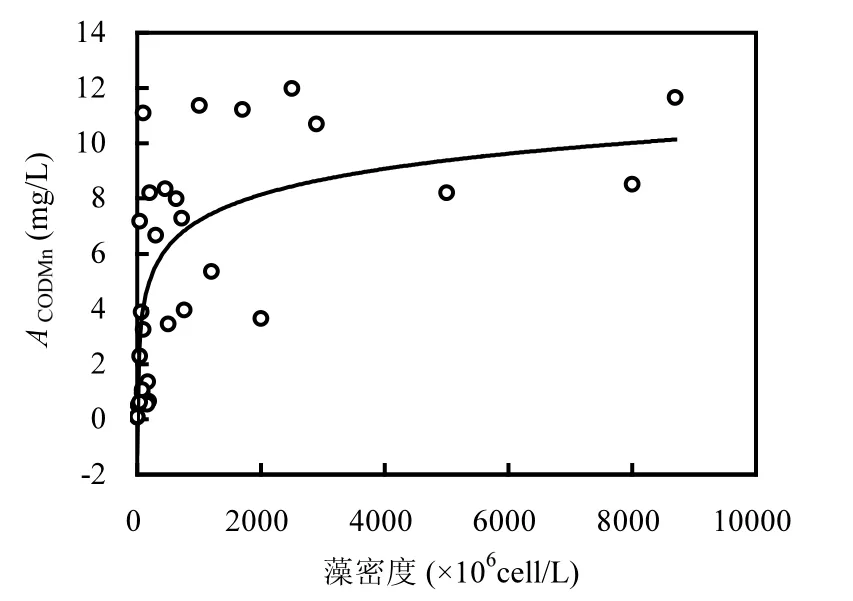
图12 ACODMn与藻密度回归曲线Fig.12 Fit curve between ACODMnand algae density
2.4.4 藻源 CODMn负荷 ACODMn的估算 根据前述ACODMn对不同温度差异显著,ACODMn与藻密度成极显著的对数回归关系(P<0.01,图 12),得到CODMn的理论藻源内负荷估算通量模型为:

式中:D为藻密度,cell/L,此公式仅适用于藻密度大于5.5×106cell/L的情况.
2.5 总量平衡分析
根据理论藻源内负荷计算公式,藻源内负荷应等于藻与培养液的各指标的混合液浓度减去相应对照浓度,即培养液中的C、N、P元素浓度全部转化为藻源胞内负荷与胞外负荷.但事实上,本研究发现ATP、ACODCr和ACODMn的量均高于藻类培养系统的初始基准浓度(表2),即因藻类的增殖将外界“额外的负荷”带入到系统中;ATN则显著低于各营养水平对照的 ρ(TN),为负值.对 ATP而言,藻类在磷缺乏的情况下,系统中“多出来的磷”可能来源于大气中可溶性总磷(TDP),大气TDP占大气总磷的比例超过65%[41],这种形态的磷极易被藻类吸收利用;ATN的“亏损”可能与藻类释放部分挥发性氮类物质有关[39,40];各营养水平下5种藻水混合液的ACODCr与ACODMn超出藻类基准ρ(COD)的1.5~3.7倍,表明藻类生长不仅利用了培养液中HCO3-作为碳源[42-43],更多的利用了空气中CO2合成自身有机物质[44].
长期以来对湖泊藻类的研究主要集中在水质与藻类种群结构及与水华形成关系等方面[45-47],随着湖泊富营养化研究的深入,藻类自身对湖泊营养要素的贡献和有效性受到关注[48].湖泊中溶解性有机质约占上覆水总 DOM的60%~75.9%[49-50],据推测,其中藻源性DOM的贡献占 25%~41%[51].与此推测相似,本研究发现,藻类在增殖过程中确实产生了远超过系统物质总量的“额外”负荷,这些藻源负荷可能是引起水质指标,特别是 COD异常升高的重要原因.更深入的研究涉及到对藻类全生命过程的吸收、降解或代谢有机物质动力学、物质平衡、结构表征与差异性等多方面机理的揭示,以及与环境污染因素之间的协同或抑制关系的深入研究,是今后研究的主要方向.

表2 理论藻源内负荷超过相应对照营养要素总量的比例Table 2 Proportions of the algae derived theory loading to the main nutrient more than corresponding control
3 结论
3.1 模拟春季夏季温度时,理论藻源ATP随营养水平升高对水质的贡献率下降,ACODCr和 ACODMn的贡献随营养水平升高而升高;胞外负荷 ETP、ETN、ECODCr、ECODMn均随营养水平升高而显著降低;胞内负荷BTP、BTN、BCODCr和BCODMn随营养水平升高而显著升高.
3.2 理论藻源内负荷计算模型分别为 ATP= -0.260+0.016ln(D)、A′TN=-3.406+0.211ln(D)、ACODCr=-102.690+6.652ln(D)和ACODMn=-20.912+ 1.357ln(D).
3.3 藻类在增殖过程中产生了超出系统外的“额外”负荷,这些藻源负荷可能是引起水质指标,特别是 COD异常升高的重要原因.藻源 TP和COD负荷在稳定期对水质的贡献较大,为 0.2~3.7倍,藻源 TN负荷的贡献为负,减少的比例在26%~58%之间.
[1] 吴丰昌,金相灿,张润宇,等.论有机氮磷在湖泊水环境中的作用和重要性 [J]. 湖泊科学, 2010,22(1):1-7.
[2] 吴庆龙,谢 平,杨柳燕,等.湖泊蓝藻水华生态灾害形成机理及防治的基础研究 [J]. 地球科学进展, 2008,23(11):1115-1123.
[3] Fujimoto N, Sudo R. Nutrient-limited growth of Microcystis aeruginosa and Phormidium tenue and competition under various N: P. supply ratio and temperatures [J]. Limnology and Oceanogrophy, 1997,42(2):250-256.
[4] 陈德辉,章宗涉,陈 坚.藻类批量培养中的比增长率最大值 [J].水生生物学报, 1998,22(1):26-32.
[5] 郑朔方,杨苏文,金相灿.铜绿微囊藻生长的营养动力学 [J]. 环境科学, 2005,26(2):152-156.
[6] Sommer U. Comparison between steady state and non-steady state competition: experiments with natural phytoplankton [J]. Limnology and Oceanography,1985,30:335-346.
[7] Grover J P, Chrzanowski T H. Limiting resources, disturbance and diversity inphytoplankton communities [J]. Ecological Monographs, 2003,74:533-551.
[8] Yang S W, Jin X C. Resource competition of Cyanobacteria, Chlorococcalesa and Diatom for ammonnium under steady and non-steady state [J]. International Journal of Environmental pollution, 2010,43(4):6-13.
[9] Brunberg A K, Blomqvist P. Recruitment of Microcystis (Cyanophyceae) from lakesediments: The importance of littoral inocula [J]. Journal of Phycology, 2003,39:58-63.
[10] 孔繁祥,高 光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考 [J]. 生态学报, 2005,25(3):589-595.
[11] 马健荣,邓建明,秦伯强,等.湖泊蓝藻水华发生机理研究进展[J]. 生态学报, 2013,33(10):3020-3030.
[12] Yang Suwen, Jin Weidong, Wang Shengrui, et al. Chlorophyll ratio analysis of the responses of algae communities to light intensity in spring and summer in Lake Erhai [J]. Environmental Earth Sciences, 2015,74:3877-3885.
[13] 赵家虎,高俊峰,刘聚涛,等.应用MODIS监测太湖蓝藻水华时空分布特征 [J]. 长江流域资源与环境, 2011,20(12):1475-1480.
[14] 刘聚涛,高俊峰,赵家虎,等.太湖蓝藻水华灾害程度评价方法[J]. 中国环境科学, 2010,30(6):829-832.
[15] 黄 君,庄 严,宋 挺,等.3S技术在太湖富营养化和蓝藻水华分布规律中的应用研究 [J]. 环境污染与防治, 2014,36(12): 31-42.
[16] Pivokonsky M, Safarikova J, Baresova M, et al. A comparison of the character of algal extracellular versus cellular organic matter produced by Cyanobacterium, Diatom and green alga [J]. Water Research, 2014,51:37-46.
[17] Carroll R E, Ostrovskiy D, Lee S, et al. Characterization of gastrin-releasing peptide and its receptor aberrantly expressed by human colon cancer cell lines [J]. Molecular Pharmacology, 2000, 58(3):601-607.
[18] Qu F, Liang H, He J, et al. Characterization of dissolved extracellular organic matter (dEOM) and bound extracellular organic matter (bEOM) of Microcystis aeruginosa and their impacts on UF membrane fouling [J]. Water Research, 2012, 46(9):2881-2890.
[19] Widrig D L, Kimberly A, Grayk S, et al. Removal of algalderived organic material bypreozonation and coagulation: Monitoring changes in organic quality by pyrolysis-GC-MS [J]. Water Research, 1996,30(11):2621-2632.
[20] Nebbioso A, Piccolo A. Molecular characterization of dissolved organic matter (DON): acritical review [J]. Analytical and Bioanalytical Chemistry, 2013,405(1):109-124.
[21] Korak J, Wert E, Fernando R O, et al. Evaluating fluorescence spectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water [J]. Water Research, 2015,68:432-443.
[22] Kawaguchit, Decho A W. A laboratory investigation of cyanobacterial extracellularpolymeric secretions (EPS) in influencing CaCO3polymorphism [J]. Journal of Crystal Growth, 2002,240:230–235.
[23] 张维昊,徐小清,丘昌强.水环境中微囊藻毒素研究进展 [J]. 环境科学研究, 2001,14(2):57-61.
[24] 王靖国,邹 华,张 强,等.太湖微囊藻毒素的时空分布特征[J]. 环境科学研究, 2014,27(7):696-703.
[25] Lee T A, Gretchen R B, Stephen M B, et al. Environmenal influence on cyanobacteria abundance and microcystin toxin production in a shallow temperate lake [J]. Ecotoxicology and Environmental Safety, 2015,114:318-325.
[26] 贾晓燕,刘 聪,储昭升,等.氮磷限制条件下螺旋鱼腥藻产生土嗅素特征研究 [J]. 中国环境科学, 2014,34(4):1026-1030.
[27] 邓绪伟,张 敏,张 路,等.洞庭湖水体异味物质及其与藻类和水质的关系 [J]. 环境科学研究, 2013,26(1):16-21.
[28] Licia L, Nicolaus B, Calandrelli V, et al. Effect of growth conditions on endo- and exppolymer biosynthesis in Anabaena cylindrical 10C [J]. Phytochemistry, 1996,42(3):655-659.
[29] Zhang F, Mourad H, Franco M, et al. Molecular and structural characterization of dissolvedorganic matter during and post cyanobacterial bloom in Taihu by combination of NMRspectroscopy and FTICR mass spectrometry [J]. Water Research, 2014,57:280-294.
[30] Leloup M, Nicolau R, Pallierv, et al. Organic matter produced by algae and cyanobacteria:quantitative and qualitative characterization [J]. Journal of Environmental Sciences, 2013,25(6):1089-1097.
[31] Xu H, Cai H, Yu G, et al. Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis [J]. Water Research, 2013,47(6):2005-2014.
[32] Li H, Pengx, Chenm, et al. Short-term bacterial community composition dynamics in responseto accumulation and breakdown of Microcystis blooms. [J]. Water Research, 2010, 45(4):1702-1710.
[33] 姚 昕,张运林,朱广伟,等.湖泊草藻来源溶解性有机质及其微生物降解的差异 [J]. 环境科学学报, 2014,34(3):688-694.
[34] 魏 徵,郑朔方,储昭升,等.应用藻类生长潜力试验的方法研究滇池藻类生长的控制因子 [J]. 环境科学学报, 2010,30(7): 1472-1478.
[35] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境出版社, 2002.
[36] 韩林林,徐冰冰,饶 杰,等.磷对四尾栅藻代谢有机物生成规律的影响 [J]. 环境科学研究, 2015,28(2):219-227.
[37] 孙 凌,金相灿,钟 远,等.不同氮磷比条件下浮游藻类群落变化 [J]. 应用生态学报, 2006,17(7):1218-1223.
[38] 李晓山,杨 敏,刘富舜,等.氮磷比对藻类竞争生长的影响 [J].安徽农业科学, 2011,39(16):9815-9817.
[39] 匡 燕.水体氨化细菌的分离鉴定及特性研究 [D]. 武汉:华中农业大学, 2012.
[40] 朱梦圆,朱广伟,王永平.太湖蓝藻水华衰亡对沉积物氮、磷释放的影响 [J]. 环境科学, 2011,32(2):409-415.
[41] 翟水晶,杨龙云,胡维平.太湖北部藻类生长旺盛期大气氮、磷沉降特征 [J]. 环境污染与防治, 2009,31(4):5-10.
[42] 杨苏文,姜 霞,金相灿.HCO3-对铜绿微囊藻、四尾栅藻和小环藻增长特性及竞争行为的影响 [J]. 生态环境, 2007,16(2):347-351.
[43] 康丽娟,潘晓洁,常锋毅,等. HCO3-碱度对通绿微囊藻生长于光合活性的影响 [J]. 武汉植物学研究, 2008,26(1):70-75.
[44] 吴天福,刘永定,宋立荣.蓝藻高CO2需求突变株的研究进展 [J].水生生物学报, 1999,23(5):510-516.
[45] Geoff S, Kamykowski D, Gliber PM. Growth, uptake and assimilation of ammonium, nitrate and urea by three strains of karenia brevis grown under low light [J]. Harmful Algae, 2009, 8(5):770-780.
[46] Bradley P B, Sanderson M P, Frischer M E, et al. Inorganic and organic nitrogen uptake by phytoplankton and heterotrophic bacteriain the stratified Mid-Atlantic Bight [J]. Estuarine, Coastal and Shelf Science, 2010,88:429-441.
[47] 徐 宁,刘静雅,赖海燕,等.海洋微藻对游离氨基酸的利用特性研究 [J]. 环境科学学报, 2013,33(4):1058-1065.
[48] Wang S R, Jiao L X, Jin X C, Niu D L. Characteristics of organic nitrogen fractions in sediments of the shallow lakes in the middle and lower reaches of the Yangtze River area in China [J]. Water and Environment Journal, 2012,26(4):473-481.
[49] Berman T, Bronk D A. Dissolved organic nitrogen: a dynamic participant in a aquatic ecosystems [J]. Aquatic Microbial Ecology, 2003,31:279-305.
[50] McCallister S L, Bauer J E, Cherrier J E, et al. Assessing sources and ages of organic matter supporting river and estuarine bacterialproduction: a multiple isotope (D14C, d13C, and d15N) approach [J]. Limnology and Oceanography, 2004,49:1687-1702.
[51] Bronk D A, Glibert P M, Ward B B. Nitrogen uptake, dissolved organic nitrogen release, and new production [J]. Sicence, 1994,265:1843-1846
Theoretic estimation method of algae derived loading for lakes.
YANG Su-wen*, JIN Wei-dong, YAN Yu-hong, WANG Sheng-rui
(State Key Laboratory of Environmental Criteria and Risk Assessment, State Environmental Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-environment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China). China Environmental Science, 2017,37(1):271~283
Water quality index such as CODCr, CODMn, TP, and TN were selected to characterize theory algae derived loading, extracellular loading,and algae derived intracellular loading to set up estimation method system of algae derived loading under the simulation of two temperatures and 3 nutrition levels conditions. Results showed that average ATPof 5species kept increasing with nutrition level rising. Meanwhile the theory algae derived TN loading ATNwas basically negative. ACODCrand ACODMnkept increasing withnutrition level rising. Algae derived extracellular TP loading ETP, extracellular TN loading ETN, extracellular CODCrloading ECODCr, and extracellular CODMnloading ECODMnkept dropping with nutrition level rising. Algae derived intracellular TP loading BTP, extracellular TN loading BTN, extracellular CODCrloading BCODCr, and extracellular CODMnloading BCODMnkept increasing withnutrition level rising. Results showed that theory algae derived loading was correlation with algae density significantly. Contribution to water quality of TP and COD loading waslarger. It was in the range of 0.2~3.7 times. That of TN was negative. The percentage of declining was in the range of 26%~58%. During the process of algae growth the "extra" loading of the total amount of system material was produced. It was an important reason for the water quality indicators, especially the increase of COD. This estimation method would be an important scientific basis on waterbloom control and quantitative reduction of eutrophication lakes.
lake;algae;theory algae derived loading;extracellular loading;intracellular loading;estimation
X524
A
1000-6923(2017)01-0271-13
杨苏文(1970-),女,内蒙古呼和浩特人,研究员,博士,主要从事湖泊水污染生态学研究.发表论文40余篇.
2016-03-31
国家水体污染控制与治理科技重大专项(2012ZX07102-004);国家自然科学基金项目(U1202235)
* 责任作者, 研究员, yangsw@craes.org.cn

