填埋初期水溶性有机物结构受电子转移的影响
杨 超,何小松,席北斗,张 慧,黄彩红,高如泰,檀文炳,崔东宇(1.中国环境科学研究院环境基准与风险评估国家重点实验室,北京 100012;2.中国环境科学研究院国家环境保护地下水污染模拟与控制重点实验室,北京 100012;3.兰州交通大学环境与市政工程学院,甘肃 兰州 730070)
填埋初期水溶性有机物结构受电子转移的影响
杨 超1,2,3,何小松1,2*,席北斗1,2,3,张 慧1,2,黄彩红1,2,高如泰1,2,檀文炳1,2,崔东宇1,2(1.中国环境科学研究院环境基准与风险评估国家重点实验室,北京 100012;2.中国环境科学研究院国家环境保护地下水污染模拟与控制重点实验室,北京 100012;3.兰州交通大学环境与市政工程学院,甘肃 兰州 730070)
采集填埋初期的生活垃圾并提取DOM,以希瓦氏菌MR-1和柠檬酸铁(FeCit)分别作为电子供体和电子受体,利用三维荧光光谱(EEM)结合平行因子分析(PARAFAC)对电子转移前后DOM结构变化进行解析,以期揭示DOM电子转移对其结构的影响.PARAFAC模型揭示DOM由4个荧光组分组成,组分1(类色氨酸)和组分3(类酪氨酸)为类蛋白物质且其是DOM荧光的主要贡献成分,组分2(类富里酸)和组分4 (类胡敏酸)为类腐殖质物质.类蛋白物质的荧光增强效应源于结构上含氮的杂环结构被破坏,疏水性增强.类腐殖质物质得到电子后其结构上的部分羰基变为醇基,荧光强度增加,且其荧光增加幅度在填埋过程中呈降低的趋势.类蛋白物质具有供电子能力,但其失去电子后结构改变荧光完全被猝灭.类腐殖质物质同样是DOM具有供电子能力的功能性组分且其荧光猝灭幅度受控于其结构上羧基和酚基等供电子基团的含量.类蛋白物质失去电子后不能重新被微生物还原返回原态,类腐殖质物质部分基团具有循环氧化还原能力,DOM 的电子穿梭能力源于类腐殖质物质且随填埋的进行不断增强.
DOM;三维荧光光谱;平行因子分析;电子转移
水溶性有机物(Dissolved Organic Matter, DOM)是多相的、不均匀的有机混合物,具有不同的结构和分子量,既包括小分子的有机酸和氨基酸等,又包括大分子的腐殖质和蛋白质物质等[1-5]. DOM 在自然环境中不仅能够作为微生物的营养源促进有机物的降解和营养物在生态系统的循环[2,6-7],而且能够吸附重金属和有机污染物等进而影响污染物迁移和赋存形态[8-9].近些年研究表明DOM具有电子穿梭体的功能,能够调节电子受体和电子供体间的电子转移[2],如DOM能够促进变价金属 Fe(III)和 Cr(VI)的还原[10],其同样能够强化微生物对于硝基苯的降解[11].
填埋垃圾在降解和稳定化的过程中产生大量垃圾渗滤液,其中 DOM是渗滤液重要组成成分,占总有机质的80%以上[12].填埋垃圾DOM的组成随填埋年限的延伸而发生变化,填埋初期DOM主要是类蛋白物质,而中、后期则是类腐殖质物质[13].在填埋垃圾降解的复杂环境中,存在微生物和H2S等能够作为DOM电子供体的还原性物质,同时也存在电子受体诸如有机污染物和重金属.在填埋垃圾降解过程中,DOM的电子穿梭作用能够将微生物代谢产生的电子传递给有机污染物和重金属,强化微生物对于渗滤液中有机污染物的降解和重金属的转化,在此过程中DOM 也在氧化态和还原态不断转变,因此了解电子转移过程中填埋垃圾 DOM的主要功能性组分和结构变化规律,能够为认识垃圾填埋场中有机污染物降解和重金属转化的途径提供科学依据,因此具有重要的环境意义.
自Klapper首次观察到腐殖质经微生物还原后其荧光强度发生改变以来[14],国内外学者对在腐殖质还原和氧化过程光学性质变化作了大量研究.当前研究表明腐殖质的光学性质改变源于结构上供电子基团和吸电子基团的电荷转移
[15-19],但是对于填埋垃圾 DOM 在电荷转移过程结构变化缺乏研究.三维荧光光谱(Excitation Emission Matrix Spectra, EEM)的不改变有机质结构、快速等优点被广泛用于河流、湖泊、垃圾渗滤液等 DOM 的结构分析[12-14],因此本文采集填埋初期 DOM,结合三维荧光-平行因子分析(Parallel Factor analysis, PARAFAC)技术对填埋初期 DOM电荷转移过程中光谱信息进行解析,以期揭示填埋初期 DOM电子转移过程中结构变化规律.
1 材料与方法
1.1 仪器与试剂
使用Analytik Jena Multi N/C 2100型TOC分析仪(德国耶拿公司)测量DOM浓度,以水溶性有机碳(Dissolved Organic Carbon, DOC)表示.Hitachi F-7000型荧光光谱仪(日本日立公司)进行荧光扫描,UV-1700型紫外分光光度计(日本岛津公司)进行紫外扫描.柠檬酸铁(FeCit),乳酸钠均为分析纯,购于国药集团.使用 Bioscreen全自动生长曲线分析仪测定希瓦氏菌 MR-1的生长曲线.
1.2 样品采集和制备
供试样品采自作业0~2年的北京某垃圾填埋场.样品取自不同深度(即 1~2m,2~4m,4~6m),依次编号S1、S2、S3,手工分选剔除其中的塑料、木块和砖块等杂物通过4分法采集典型样品,混合均匀后装入密封袋,运回实验室,置于4℃冰箱保存.
将采集的样品按干重质量与超纯水体积1:100[W(g)/V(mL)]混合,室温下200r/min水平震荡24h,在4℃、12000r/min下离心20min,上清液过0.45µm的滤膜即为DOM.
1.3 不同体系下荧光测定
1.3.1 实验预准备 使用 LB培养基将希瓦氏菌MR-1于室温下活化3代.根据MR-1生长曲线(图 1),取对数期(12h)的细菌离心(10min10000r/min)后移至无机培养液中,使用前加入乳酸钠(最终浓度5mmol/L)制成MR-1菌浊液备用.将柠檬酸铁制成浓度为1mmol/L的储备液.用超纯水将DOM的浓度稀释至DOC= 50mg/L备用.同时用 Mili-Q超纯水对样品进行稀释后DOC= 20mg/L后进行荧光扫描.
图1 希瓦氏菌MR-1生长曲线Fig.1 Growth curve of Shewanella MR-1
1.3.2 实验设计 研究 DOM 失去电子后结构变化,将DOM与柠檬酸铁按1:1体积混合形成“DOM+Fe”体系,反应24h后进行荧光扫描.归一化处理后,与原样相比,荧光强度降低量即为荧光猝灭幅度.
研究DOM得到电子后结构变化,将DOM与MR-1菌浊液按1:1混合形成“DOM+M”体系,反应 24h,过 0.22μm的纤维素膜后进行荧光扫描.归一化处理后,与原样相比,4组分荧光强度增加量即为荧光增加幅度.
研究 DOM得到电子再失去后结构变化设计“DOM+M-DOM+Fe”体系实验,即先将DOM与MR-1菌浊液按1:1混合反应24h,过0.22μm的纤维素,再将微生物处理反应液与柠檬酸铁按1:1混合,反应24h后进行荧光扫描.
研究 DOM反复得失电子结构变化设计“DOM+M+Fe”体系实验,即将DOM、柠檬酸铁和MR-1菌浊液按DOM:MR-1:FeCit =1:1:1的比例混合反应24h,过0.22 μm的纤维素膜后进行荧光扫描.
1.4 光谱分析
样品荧光光谱扫描参数如下:激发波长Ex=200~450nm,发射波长Em=280~550nm,扫描速度设为2400nm/min.
由于铁对紫外可见光谱有强烈吸收,因此只进行DOM和“DOM+M”体系的紫外光谱扫描.样品紫外光谱扫描参数如下:扫描范围为 200~700nm,扫描间距为1nm.分别测定样品DOM在254和436nm下的吸光度,记为a(254)和a(436),将其除以DOC浓度即为SUVA254和SUVA436.分别测定DOM在275~295nm和350~400nm范围内的紫外吸收曲线的光谱斜率,记为 S275-295和S350-400,S275-295和 S350-400的比值即为光比斜率SR[20].
1.5 PARAFAC分析
对三维荧光光谱的数据去除散射后,在Matlab 9.0b(Mathwork, Natick, MA)上用 DOM Fluor toolbox软件包进行平行因子分析.通过一致性分析和对半检验确定荧光组分数以及每个样品在对应组分的浓度得分值 Fmax.采用Origin9.0和Matlab 8.0b进行图形绘制与处理.
2 结果与讨论
2.1 DOM荧光组分特征
利用PARAFAC模型分析填埋垃圾DOM在不同反应体系下三维荧光谱并得到 4个荧光组分(图2),各组分对应最大激发发射波长见表1.
组分 1(270/340nm)为类色氨酸荧光峰,研究表明微生物的代谢产物同样能够在该处出现荧光峰[21].
组分2具有2个荧光峰,发射波长相同,均为390nm,激发波长分别为240和320nm.对比研究可判断该峰为类富里酸荧光峰,与腐殖质中类富里酸荧光峰有关.次峰240/390nm位于传统类腐殖质(237~260/380~460nm)区域[22],主峰 320/ 390nm位于 M 峰(290~310/380~420nm)区域,M峰除了代表海洋来源腐殖质组分,还与人类活动有关[23-24].
组分3的2个荧光峰(225,275/300nm)为高低激发波长下酪氨酸荧光峰[24-25],和组分 1同属于类蛋白荧光峰.
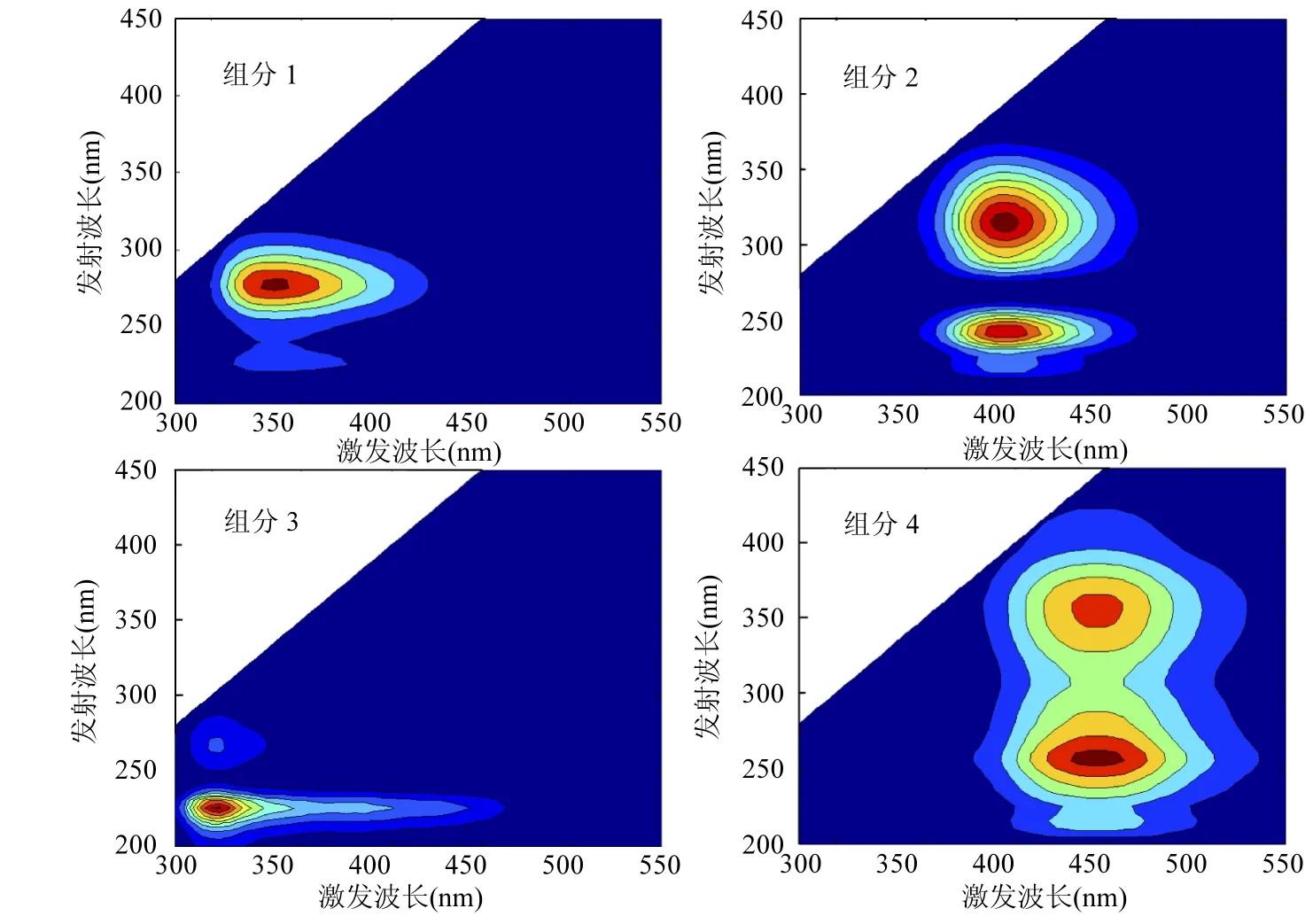
图2 DOM的4个荧光组分Fig.2 Four fluorescence components of DOM
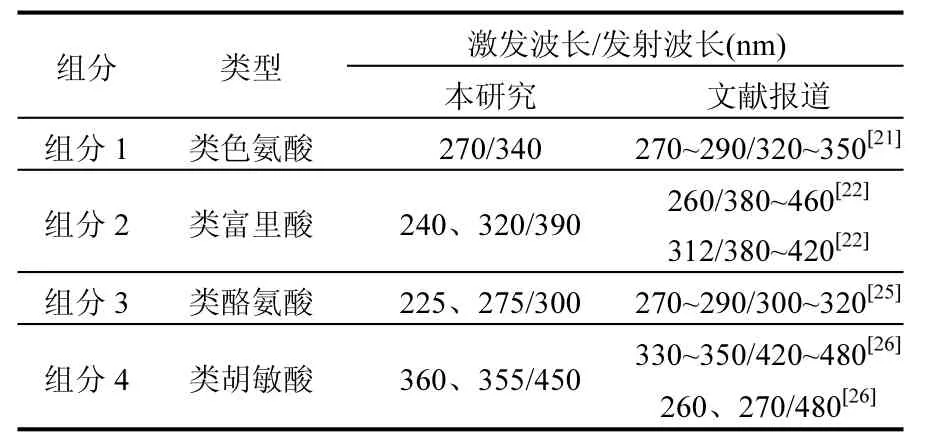
表1 DOM荧光组成特征Table 1 Fluorescence characteristic of the four fluorophoresin DOM
组分4的2个荧光峰发射波长均为450nm,激发波长分别为260和355nm,为类胡敏酸荧光峰[26].次峰 355/450nm 对应传统的类胡敏酸(330~350/420~480nm)荧光峰,主峰260/450nm相对于 260/480nm区类胡敏酸荧光峰发生激发波长蓝移,该峰为填埋垃圾稳定化的指标[27].
2.2 DOM提供电子后的结构变化
利用PARAFAC在DOM和“DOM+Fe”体系中所得4组荧光组分得分值Fmax进行制图,如图2所示,样品荧光差异表现为Fmax值大小.
由于柠檬酸根与铁的络合能力要强于DOM与铁的络合能力[28],故在“DOM+Fe”体系中DOM的荧光猝灭主要是动态荧光猝灭,即Fe(III)与 DOM接触后,DOM将自身的电子传递给Fe(III),失去电子后 DOM 的结构发生改变,荧光强度降低.
由图3可知,DOM的类蛋白物质(组分1和组分3)荧光强度显著强于类腐殖质物质(组分2和组分4),但是其在“DOM+Fe”体系中该组分荧光完全被猝灭,故DOM中类蛋白物质失去电子后结构可能发生改变,受到激发后不再产生荧光.与类蛋白物质不同,类腐殖质物质与柠檬酸铁接触后虽然同样出现荧光猝灭现象,但是荧光没有能够被完全猝灭.因此与类蛋白物质相比,类腐殖质物质结构稳定,失去电子后部分基团结构未发生改变.
DOM的荧光猝灭幅度与电子供给能力有关,荧光猝灭幅度越大,DOM结构上供电子基团含量越高,电子供给能力就越强.羧基和酚基等都是影响 DOM荧光变化的主要供电子基团且都与其芳香性有关[15,17,29].有机物的 SUVA254能够表征其芳香性[30],图3中SUVA254的变化说明DOM的芳香性在填埋过程中是增强的,同时结合类腐殖质物质的荧光猝灭幅度变化趋势表明在垃圾填埋过程中 DOM类腐殖质物质结构上的羧基和酚基等供电子基团含量不断增加,电子供给能力不断增强.
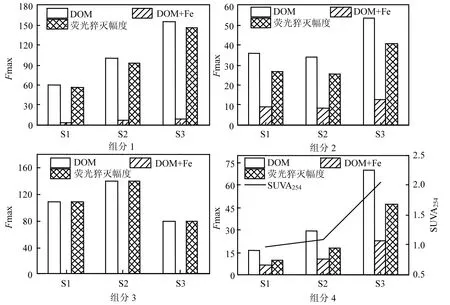
图3 DOM失去电子过程4组分的荧光强度变化Fig.3 Changes in fluorescence intensityof DOM after oxidation
2.3 DOM接受电子后的结构变化
微生物在降低填埋垃圾风险领域具有重要的作用,填埋垃圾中有机污染物和重金属等电子受体能够接受微生物代谢产生的电子从而改变自身赋存形态,降低污染物的环境风险.表2可知经MR-1还原后DOM的SR增大,有机质与分子量成反比[20],表明DOM与 MR-1反应 24h后DOM的分子量降低,因此DOM与MR-1反应过程中其能够作为营养源被微生物利用,相较于类腐殖质物质而言,类蛋白物质结构简单且易于分解,然而经微生物还原后类蛋白物质的荧光没有下降反而明显增强,荧光增强幅度明显.类蛋白物质得到微生物自身代谢产生电子,其结构上羰基等吸电子基团变为醇基[15,19],含氮的杂环结构被破坏[31],肽链展开,疏水性增强[32],荧光增强.组分 3的荧光增加幅度在填埋过程中呈降低的趋势,这可能源于类蛋白物质在填埋过程中结构趋于稳定,其结构上能够被微生物还原利用的组分减少.
比较图4中的组分2和组分4的荧光强度可发现,垃圾填埋过程中 DOM类富里酸的荧光增加幅度较为稳定,但是 DOM类胡敏酸的荧光增加幅度随填埋的进行呈现降低的趋势.相较于胡敏酸,富里酸结构简单,在填埋过程中部分富里酸能够作为胡敏酸合成的前驱物.填埋 DOM类富里酸具有较强的得电子能力,而且荧光增加幅度随填埋的进行保持稳定,因此其结构上吸电子基团在填埋过程中未发生显著改变.
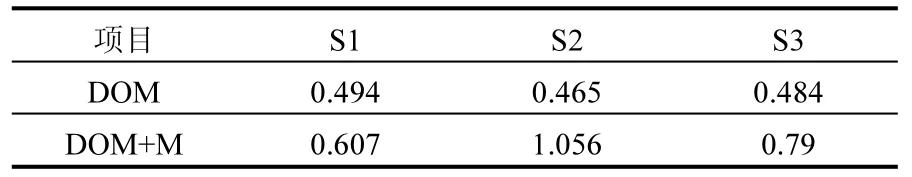
表2 DOM还原前后光比斜率比值Teble 2 The change of spectral slope ratioafter reduction
类胡敏酸荧光增加幅度在填埋过程中降低,荧光增加幅度受控于结构上吸电子基团的含量和类型.醌基和羰基是腐殖质的主要的吸电子基团,羰基得电子后变为醇基,分子间的氢键增加
[19],荧光增加,但是醌基得到电子后的荧光增加幅度却未发生显著改变[15,33-34],SUVA436与醌基具有很好的相关性[35],SUVA436在填埋过程不断增加表明 DOM的醌基含量不断升高,因此类胡敏酸荧光增加幅度随填埋的进行出现降低表明 DOM在填埋过程中类胡敏酸结构不断演变,简单结构的吸电子基团如羰基等聚合成结构稳定的吸电子基团(如醌基),缩合度和分子量不断改变,这与前人得到填埋垃圾 DOM结构演变规律是一致的[27,36-37].
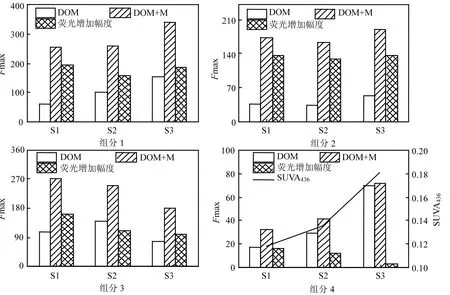
图4 DOM得到电子过程4组分的荧光强度变化Fig.4 Changes in fluorescence intensity of DOM after reducion
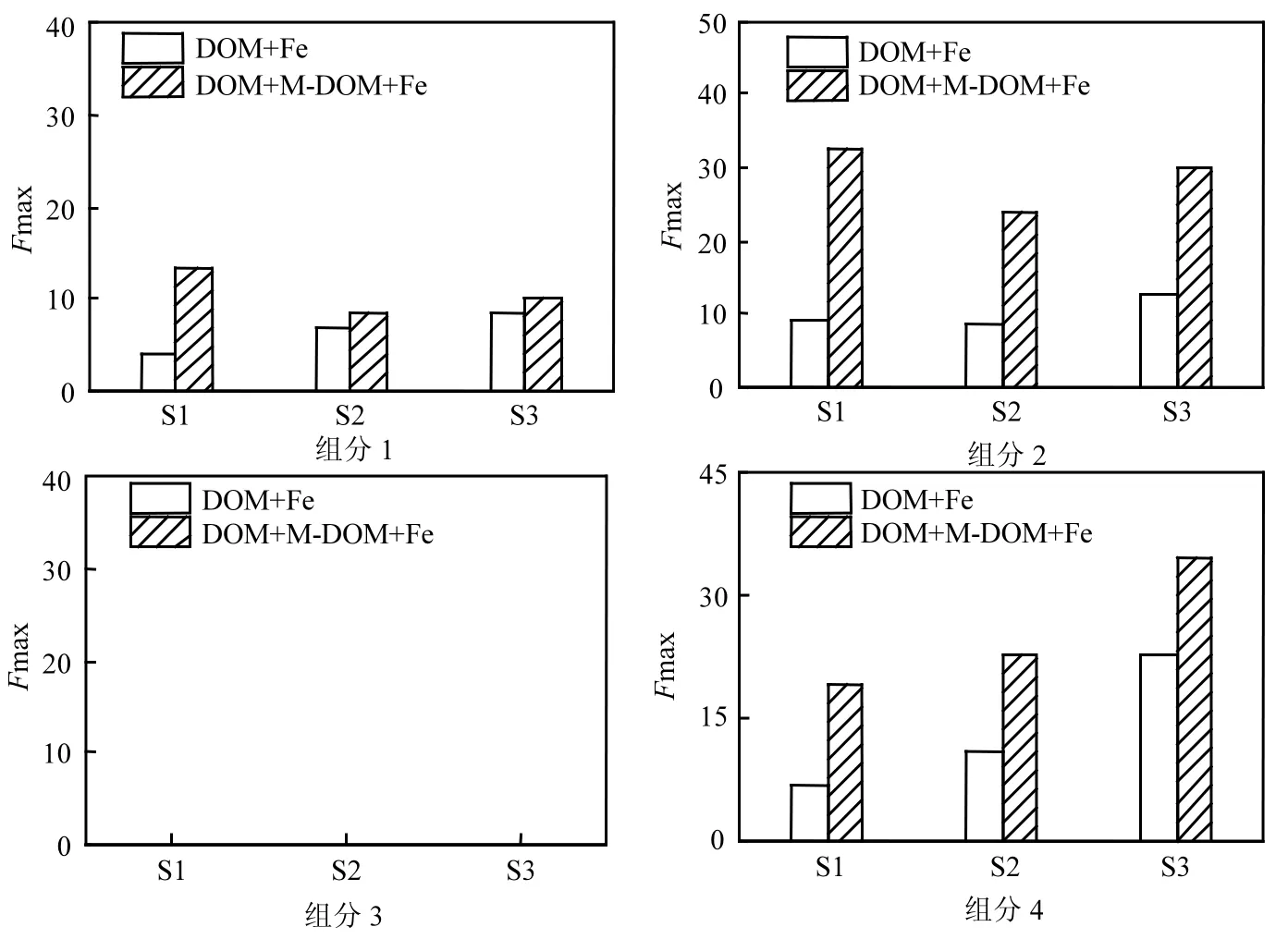
图5 还原态DOM失去电子4组分的荧光强度变化Fig.5 Changes in fluorescence intensity of DOM when the reduced DOM were oxidized
为了进一步研究在填埋过程中DOM接受电子再失去电子的结构变化,我们进行“DOM+ M-DOM+Fe”体系和“DOM+Fe”体系中4组分荧光强度比较(图5),发现“DOM+M-DOM+Fe”体系中4组分荧光强度要强于“DOM+Fe”体系.组分3代表类蛋白物质,两体系中组分3的荧光强度差别不大,都接近零,进一步证实了类蛋白物质失去电子后结构发生改变,不能产生荧光.由于本次实验采用填埋初期 DOM,其结构和组成不稳定,被MR-1降解后生成的小分子物质具有较强的荧光,因此“DOM+M- DOM+Fe”体系中组分1荧光强度要强于“DOM+Fe”体系.“DOM+M-DOM+Fe”体系中类腐殖质的荧光强度同样强于“DOM+Fe”体系,这可能源于DOM结构上部分吸电子基团诸如芳香酮,得到电子后变成醇类等基团后不再将电子传递出去[15,17],因此两体系下类腐殖质(组分 2和组分4)荧光强度相差很大.
2.4 DOM在持续电子穿梭过程中结构变化
上述研究表明 DOM在电子转移过程中结构发生变化,然而在真实的填埋环境中微生物、填埋DOM和电子受体(重金属和难降解有机物等)是共存的,因此为了模拟真实环境,研究微生物MR-1、DOM和电子受体FeCit共存情况下DOM的结构变化,结果如图6所示.
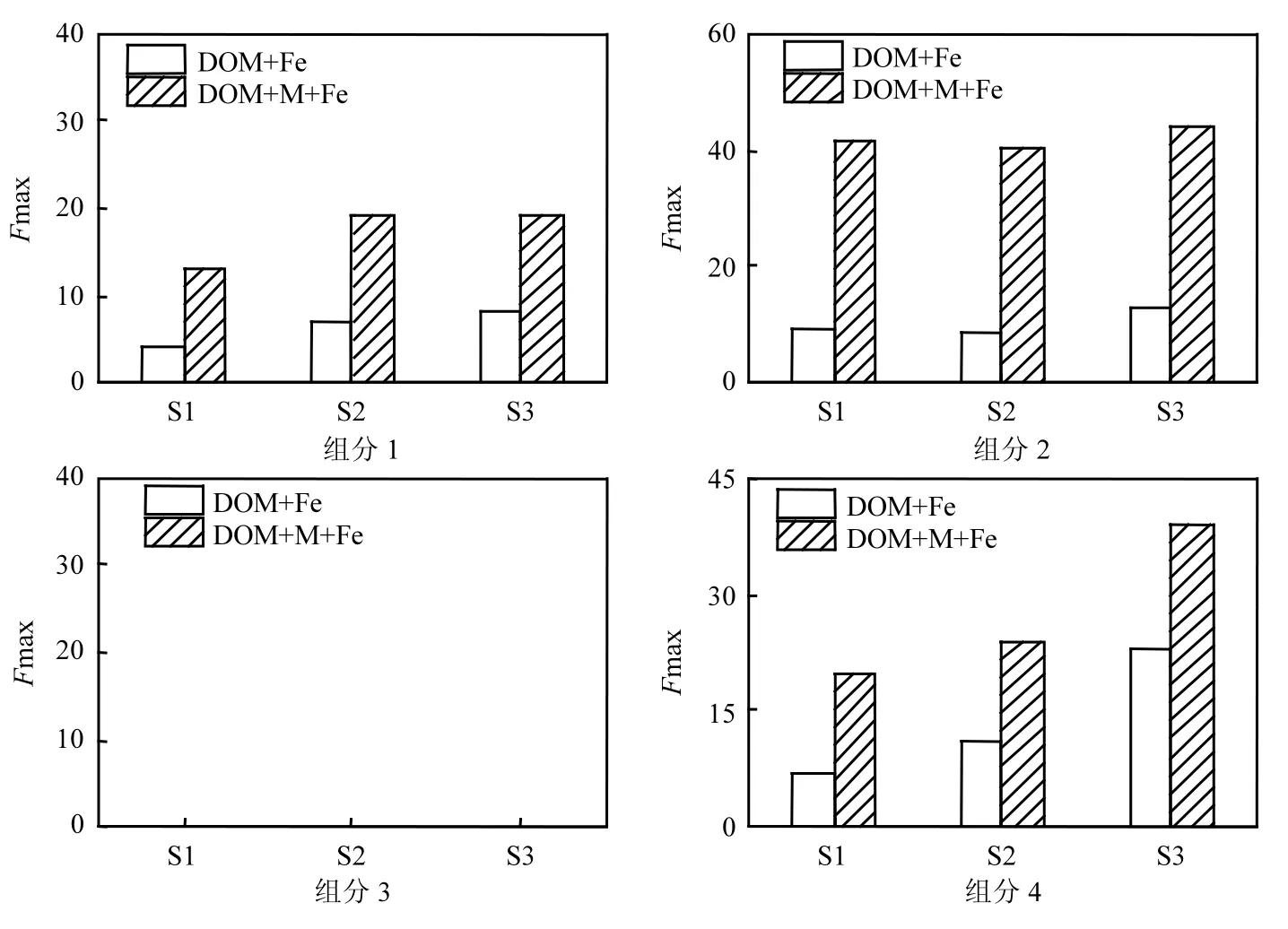
图6 DOM反复得失电子4组分荧光强度变化Fig.6 Changes in fluorescence intensity of DOM when DOM were used as electron shuttle
图6为“DOM+M+Fe”和“DOM+Fe”两体系中 4个组分的荧光强度,4个组分的荧光强度在不同体系下差距明显.组分1的类蛋白物质与微生物生命活动有关,“DOM+M+Fe”体系下存在微生物MR-1的生命活动,因此组分1在“DOM+ M+Fe”体系中的荧光强度显著强于其在“DOM+ Fe”体系中的荧光强度.组分 3在“DOM+M+Fe”体系和“DOM+Fe”体系均不产生荧光表明失去电子后的类蛋白物质结构改变不能重新接受微生物代谢产生的电子而回到初始状态,因此DOM 的类蛋白物质不能反复被氧化和还原.在“DOM+M+Fe”体系中类腐殖质物质(组分2和组分 4)荧光强度显著强于“DOM+Fe”体系中类腐殖质物质荧光强度,表明类腐殖质物质部分基团在“DOM+M+Fe”体系中能够携带电子,具有电子传递媒介作用,因此在“DOM+M+Fe”体系中类腐殖质物质部分基团在反复得失电子后结构未发生显著改变,能够连续接受微生物代谢产生的电子并将其传递出去,具有很强的电子穿梭功能.所以在填埋垃圾降解的复杂环境中,DOM类腐殖质物质的电子穿梭能力能够强化微生物对于污染物(难降解有机物和重金属等)的转化和降解,改变其赋存形态和生物可利用性,同时了解DOM的电子穿梭能力功能性组分能够为认识填埋垃圾场污染物迁移和转化提供科学依据.
3 结论
3.1 利用 EEM-PARAFAC模型识别出填埋初期DOM由2类物质4个荧光组分构成,即类蛋白物质(组分1和组分3)和类腐殖质物质(组分2和组分4),其中类蛋白物质对DOM的荧光贡献明显.
3.2 DOM 得到电子的过程中,类蛋白物质和类腐殖质物质都会产生荧光增强效应.类蛋白物质得到电子后含氮的杂环结构被破坏,肽链展开,疏水性增强.类腐殖质物质结构上的羰基得到电子后变为醇基,氢键增加.
3.3 DOM 失去电子过程中,类蛋白物质和类腐殖质物质都会产生荧光猝灭效应.类蛋白物质失去电子后结构改变,荧光完全被猝灭.填埋过程中类腐殖质物质荧光猝灭幅度受控于其结构上羧基和酚基等供电子基团的含量.
3.4 类蛋白物质失去电子后不能重新得到电子返回原态,而类腐殖质物质中部分基团能反复得失电子,DOM的电子穿梭能力源于类腐殖质物质且随填埋的进行不断增强.
[1] He X, XI B, Wei Z, Guo X, et al. Spectroscopic characterization of water-extractable organic matter during composting of municipal solid waste [J]. Chemosphere, 2011,2(4):541-548.
[2] Bi R, Lu Q, Yu W M, Zhou S G. Electron transfer capacity of soil dissolved organic matter and its potential impact on soil respiration [J]. Journal of Soils and Sediments, 2013,13(9): 1553-1560.
[3] He X S, Xi B D, Cui D Y, et al. Influence of chemical and structural evolution of dissolved organic matter on electron transfer capacity during composting [J]. Journal of Hazardous Materials, 2014,268(15):256-263.
[4] Wagner S, JaFFE R, Cawley K, et al. Associations between the molecular and optical properties of dissolved organic matter in the Florida Everglades, a model coastal wetland system [J]. Fronts in Chemistry, 2015,26(2):1-14.
[5] Lavonen E E, Kothawala D N, Tranvik L J, et al. Tracking changes in the optical properties and molecular composition of dissolved organic matter during drinking water production [J]. Water Research, 2015,85(15):286-294.
[6] Opsahl S, Benner R. Distribution and cycling of terrigenous dissolve dorganic matter in the ocean [J]. Nature, 1997,386(16): 480-482.
[7] Spencer R G M, Mann P J, Dittmar T, et al. Detecting the signature of permafrost thaw in Arctic rivers [J]. Geophysical Research Letters, 2015,42(8):2830-2835.
[8] Plaza C, Xing B, Fernández J M, et al. Binding of polycyclic aromatic hydrocarbons by humic acids formed during composting [J]. Environmental Pollution, 2009,157(1):257-263.
[9] Xi B D, He X S, Wei Z M, et al. The composition and mercury complexation characteristics of dissolved organic matter in landfill leachates with different ages [J].Ecotoxicology and Environmental safety, 2012,86(1):227-232.
[10] Yuan T, Yuan Y, Zhou S G, et al. A rapid and simple electrochemical method for evaluating the electron transfer capacities of dissolved organic matter [J]. Journal of Soils and Sediments, 2011,11(3):467-473.
[11] Zhu Z, Tao L, Li F. Effects of dissolved organic matter on adsorbed Fe(II) reactivity for the reduction of 2-nitrophenol in TiO2suspensions [J]. Chemosphere, 2013,93(1):29-34.
[12] 何小松,于 静,席北斗,等.填埋垃圾渗滤液中水溶性有机物去除规律研究 [J]. 光谱与光谱分析, 2012,32(9):2528-2533.
[13] Huo S L, Xi B D, Yu H C, et al. Characteristics of dissolved organic matter (DOM) in leachate with different landfill ages [J]. Journal of Environmental Sciences, 2008,20(4):492-498.
[14] Klapper L, McKnight D M, Fulton J R, et al.Fulvic acid oxidation state detection using fluorescence spectroscopy [J]. Environment Science and Technology, 2002,36(14):3170-3175.
[15] Ma J H, Vecchio R A, Golanoski K S, et al. Optical properties of humic substances and CDOM: effects of borohydride reduction [J]. Environment Science and Technology, 2010,44(14):6395-5402.
[16] Cory R M, Mcknight D M. Fluorescence spectroscopy eeveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter [J]. Environment Science and Technology, 2005,39(21):8142-8149.
[17] Boyle S, Guerriero S, Thiallet A, et al. Optical properties ofhumic substances and CDOM: relation to structure [J]. Environmental Science & Technology, 2009,43(7):2262-2268.
[18] Phillips S M, Smith G D. Further evidence for charge transfer complexes in brown carbon aerosols from excitation−emission matrix fluorescence spectroscopy [J]. The Journal of Physical Chemistry A, 2012,119(19):4545-4551.
[19] Guo R R, Ma J H. Reduction-induced molecular signature of humic substances: structural evidence for optical changes [J]. The Royal Society of Chemistry, 2014,4(49):25880-25885.
[20] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J]. Limnology and Oceanography, 2008,53(3):955-969.
[21] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003,37(24):5701-5710.
[22] 甘淑钗,吴 莹,鲍红艳,等.长江溶解性有机质三维荧光光谱的平行因子分析 [J]. 中国环境科学, 2013,33(6):1045-1052.
[23] 虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征 [J]. 中国环境科学, 2016,36(1):133-142.
[24] 冯伟莹,焦立新,张 生,等.乌梁素海沉积物溶解性有机质荧光光谱特性 [J]. 中国环境科学, 2013,33(6):1068-1074.
[25] Baker A, Curry M. Fluorescence of leachates from three ontrasting landfills [J]. Water Research, 2004,38(10):2605-2613.
[26] Yamashita Y, Jaffe R. Characterizing the interactions between trace metals and dissolved organic matter using excitationemission matrix and parallel factor analysis [J]. Environmental Science & Technology, 2008,42(19):7374-7379.
[27] Shao Z H, He P J, Zhang D Q, et al. Characterization of waterextractable organic matter during the biostabilization of municipal solid waste [J]. Journal of Hazardous Materials, 2009,164(2/3): 1191-1197.
[28] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J]. Marine Chemistry, 1996,51(4):325-346.
[29] Haas J R, Dichristina T J. Effects of Fe(III) Chemical Speciation on Dissimilatory Fe(III) Reduction by Shewanella putrefaciens [J]. Environment Science and Technology, 2002,36(3):373-380.
[30] Vecchio R D, Blough N V. On the origin of the optical properties of humic substances.[J]. Environmental Science & Technology, 2004,38(14):3885-3891.
[31] 何小松,席北斗,张 鹏,等.地下水溶解性有机物的季节变化特征及成因 [J]. 中国环境科学, 2015,35(3):862-870.
[32] Macalady D L, Walton-Doy K. New light on a dark subject: On the use of fluorescence data to deduce redox states of natural organic matter (NOM) [J]. Aquatic Sciences, 2009,71(2):135-142.
[33] 王志军,吴 群,雷海英.柠檬酸钠与牛血清白蛋白相互作用的荧光光谱研究 [J]. 光谱实验室, 2012,29(2):847-851.
[34] Klapper L, McKnight D M, Fulton J R, et al. Fulvic acid oxidation state detection using fluorescence spectroscopy [J]. Environmental Science & Technology, 2002,36(14):3170-3175.
[35] Aeschbacher M, Sander M, Schwarzenbach R P. Novel electrochemical approach to assess the redox properties of humic substances [J]. Environmental Science & Technology, 2010,44(1): 87-93.
[36] Stevenson F J. Humus chemistry: genesis, composition, reactions [M]. NewYork: John Wiley and Sons, 1982.
[37] He X S, Xi B D, Wei Z M, et al. Physicochemical and spectroscopic characteristics of dissolved organic matter extracted from municipal solid waste (MSW) and their influence on the landfill biological stability [J]. Bioresource Technology, 2011, 102(3):2322-2327.
[38] 李英军,何小松,刘 骏,等.城市生活垃圾填埋初期有机质演化规律研究 [J]. 环境工程学报, 2012,6(1):297-301.
Effect of electron transfer on the structure of dissolved organic matter during initial landfill stage.
YANG Chao1,2,3, HE Xiao-song1,2*, XI Bei-dou1,2,3, ZHANG Hui1,2, HUANG Cai-hong1,2, GAO Ru-tai1,2, TAN Wen-bing1,2, CUI Dong-yu1,2
(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.State Environmental Protection Key Laboratory of Simulation and Control of Groundwater Pollution, Chinese Research Academy of Environmental Science, Beijing 100012, China;3.School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China). China Environmental Science, 2017,37(1):229~237
In order to investigate the structural change of dissolved organic matter after electron transfer, dissolved organic matter (DOM) were extracted fromlandfilled wastes at different depthsduring initial landfill stage, and shewanella Shewanella MR-1 and citrate iron (FeCit) were used as electron donor and electronacceptor, respectively. Furtherover, fluorescence excitation-emission matrix (EEM) spectra combined with parallel factor (PARAFAC) analysis was used to analyze the structure change of DOM. The results indicated that four fluorescent components, i.e., two humic-like components (C2 and C4) and two protein-like components (C1 and C3), were identified by the PARAFAC analysis, and protein-like components was the major component. The nitrogen-containing heterocyclic structure was desassembled when protein-like components got electrons, and theirhydrophobicity and fluorescence intensities were increased during the process. Fluorescence intensities of humic-like components were increased as well when they obtained electrons, though their increased range became decrease during the landfill processs. The carbonyl group on humic-like components were turn into alcohol group when it obatained electrons. Fluorescence quenching phenomenon was observeredwhen DOM loss electrons. Protein-like components wereable to offerelectrons, and theirstructure changed after they loss electrons. Humic-like substances can offer electrons as well, and their fluorescence intensities decreased as well when they loss electrons. However, the decreased range was related to the content of carboxyl and phenolic groups on humic-like subtaneces. Humic-like components could bereoxided, However, protein-like components could not be reduced after they was oxided. The electron shuttle capacityof DOM were ascribed to humic-like components, which were persistentlyincreasedduring the landfill process.
dissolved organic matter;three-dimensional fluorescence spectrum;parallel factor analysis;electron transfer
X705
A
1000-6923(2017)01-0229-09
杨 超(1992-),男,河南信阳人,硕士研究生,主要研究方向为固体废弃物处理.发表论文2篇.
2016-06-28
国家自然科学基金青年基金(51408573,51325804)
* 责任作者, 副研究员, hexs82@126.com

