责任性颅内动脉粥样硬化性狭窄致首发缺血性脑卒中解剖模式与发病机制的关系
王炎强, 孙绍洋, 王玉鸽, 伍爱民, 杨 渝, 戴永强, 陆正齐, 胡学强
责任性颅内动脉粥样硬化性狭窄致首发缺血性脑卒中解剖模式与发病机制的关系
王炎强1, 孙绍洋2, 王玉鸽3, 伍爱民3, 杨 渝3, 戴永强3, 陆正齐3, 胡学强3
目的 探讨责任性颅内动脉粥样硬化性狭窄(Intracranial atherosclerotic stenosis,ICAS)致首发缺血性脑卒中(Ischemic stroke,IS)解剖模式与发病机制的关系。方法 回顾性分析261例责任性ICAS 致首发IS患者的临床资料。根据弥散加权成像(DWI)的影像学表现分为单发病灶(皮质-皮质下梗死、皮质梗死、皮质下梗死),弥散病灶,多发病灶(单侧前循环或后循环多发梗死);卒中机制分为动脉到动脉栓塞、原位血栓形成、穿支动脉闭塞、低灌注、多发机制等。结果 单发皮质下梗死是责任性ICAS 致首发IS最常见的卒中模式(41.38%,108/261);责任性ICAS 致IS主要发病机制为穿支动脉闭塞(41.38%,108/261);责任性ICAS 致IS的解剖模式与发病机制显著相关(r=0.384,P=0.001),穿支动脉闭塞与皮质下梗死相关 (r=0.805,P=0.001),弥散梗死、单侧前循环多发梗死、后循环多发性梗死,分别与动脉到动脉栓塞(r=0.853,P=0.001;r=0.860,P=0.001;r=0.281,P=0.001)、及多发机制(r=0.792,P=0.001;r=0.883,P=0.001;r=0.213,P=0.001)相关。结论 卒中解剖模式有助于明确责任性ICAS 致缺血性脑卒中的发病机制,有利于指导其临床诊治及预防措施的拟定。
缺血性脑卒中; 颅内动脉粥样硬化性狭窄; 解剖模式; 发病机制; 弥散加权成像
颅内动脉粥样硬化性狭窄 (Intracranial atherosclerotic stenosis,ICAS) 是世界范围内人群缺血性脑卒中(Ischemic stroke,IS)的常见病因,尤其在亚洲。症状性ICAS是所有卒中亚型患者复发的高危因素,研究报道 37%~51%缺血性脑卒中或短暂性脑缺血发作(TIA)患者与ICAS密切相关[1,2]。尽管ICAS卒中机制与损伤模式的研究已有报道,仅限于单一卒中模式、病因、机制分析,或仅由颈内动脉狭窄或大脑中动脉狭窄致卒中的探讨[3~7],对于责任性ICAS 致首发缺血性脑卒中发病机制与解剖模式的报道甚少。因此,本研究系统的探讨了责任性ICAS 致首发缺血性脑卒中发病机制与解剖模式的相关性,提高了判定其发病机制的准确性,对临床制定确实可行的、针对其发病机制的治疗策略有重要意义。
1 资料和方法
1.1 入选标准 回顾性分析2008年1月~2013年12月就诊于我院神经科的责任性ICAS致首发缺血性卒中患者261例,其中男157例,女104例,年龄35~91岁,平均年龄(65.71±11.34)岁,≥60岁175例(60.15%),其中81.61%(213/261)行CT血管造影(CTA,CT angiography)检查。入选标准:(1)责任性ICAS相关性首发缺血性卒中患者,病程<7 d,年龄≥18岁。(2)所有患者均符合全国第四届脑血管病学术会议通过的《各类脑血管疾病诊断要点》中脑梗死的诊断标准,并经头部弥散加权磁共振成像(DWI)和磁共振血管造影(MRA)和(或)CT血管造影确诊,所有患者均签署知情同意书。所有患者24 h内完成头部CT、经颅多普勒超声、颈动脉彩超、常规心电图,24 h动态心电图、超声心动图检查,3 d内完成磁共振成像(MRI)、磁共振血管造影(MRA)和(或)CT血管造影、弥散加权成像(DWI)检查,并视其病情予以冠状动脉造影检查,所有影像学资料均由两个神经科有经验医师独立地对其结果进行评阅分类[2]。
1.2 排除标准 DWI显示与临床表现不相符的急性梗死灶以及DWI显示的梗死病灶不在同侧颅内动脉供血区患者;既往有脑卒中、短暂性脑缺血发作、脑出血病史患者;无脑血管狭窄的缺血性脑卒中患者;有颅内外动脉同时存在粥样硬化及升主动脉或主动脉弓近端动脉粥样硬化的缺血性脑卒中患者;应用降脂药物治疗超过1 m者;进行溶栓或其他血管内介入治疗者;心源性相关的卒中包括近期心肌梗死(<4 w)、心房颤动、人工瓣膜、扩张型心肌病、风湿性二尖瓣或主动脉瓣病变、左心耳血栓形成、左心室附壁血栓、左心室室壁瘤、心房粘液瘤、感染性心内膜炎、升主动脉或主动脉弓近端动脉粥样硬化患者;患有动脉夹层、烟雾病、血管炎、风湿免疫病、恶性肿瘤、外伤、凝血功能障碍或血液系统疾病者;其他无法明确病因患者;皮质下病灶在DWI上表现直径小于15 mm者;各种腔隙综合征患者;双侧前循环或前后循环均有梗死病变者;检查及资料记录不全患者[2,8]。
1.3 临床资料 包括人口统计学,危险因素(高血压、糖尿病、高脂血症、心脏疾病病史,代谢综合征),吸烟,饮酒等,及磁共振成像(MRI)与磁共振血管造影(MRA)和(或)CTA,颈动脉多普勒超声,心电图,超声心动图等检查。各血项目入院后第2 d收取标本,影像学于入院后3 d内完成。
1.4 血管评估 颅内动脉包括颈内动脉(ICA)远端(包括海绵状与岩段),大脑中动脉(MCA),大脑前动脉(ACA),大脑后动脉(PCA),基底动脉,椎动脉(VA)远端(包括硬膜内V4段)[9]。颅内动脉粥样硬化性狭窄依据头部MRA检查,采用华法林阿司匹林治疗症状性颅内疾病(WASID)研究中描述的方法计算[10],狭窄率= (1-狭窄直径/正常直径)×100%,只有颅内血管狭窄≥ 50%或闭塞者纳入研究。
1.5 卒中机制与解剖模式的判定 卒中机制根据DWI 、血管造影、临床特征分为动脉到动脉栓塞,原位血栓形成、穿支动脉闭塞、低灌注、多发机制(两个或两个以上机制)[9,11]。卒中解剖模式据脑动脉血供分布[11,12],据DWI所示梗死灶部位、大小、分布分型:单发病灶(皮质-皮质下梗死、皮质梗死、皮质下梗死(其直径> 15 mm);弥散病灶(单血管支配的区域,包括<15 mm的弥散性病灶或≥ 15 mm融合性病灶伴另外病灶);多发病灶(多血管支配的区域,包括单侧前循环或单侧后循环);前循环包括ACA、MCA、脉络膜前动脉、分水岭等;后循环包括PCA、基底动脉的旋支、椎动脉、小脑动脉、小脑分水岭等[12,13]。
1.6 统计学方法 采用SPSS17.0软件进行统计学分析。计数资料以阳性例数、构成比表示。单因素计数资料采用R×C列联表表示,采用Spearman等级相关分析;两变量间采用皮尔森相关性分析,以P<0.05认为差异有统计学意义。
2 结 果
2.1 临床资料 纳入2008年1月~2013年12月于本科就诊住院的卒中患者共3137例,根据本研究排除标准,剔除2876例不符合入组条件患者,(如:DWI显示的急性梗死病灶与临床表现不相符及梗死病灶不在同侧颅内动脉供血区120例,脑卒中、短暂性脑缺血发作、脑出血123例,心源性卒中患者109例,无血管粥样硬化狭窄致缺血性脑卒中387例,颅外动脉粥样硬化性狭窄致缺血性脑卒中86例,颅内外动脉粥样硬化性狭窄致缺血性脑卒中127例,皮质下病灶在DWI上表现直径是小于15 mm 42例;各种腔隙综合征患者32例;双侧前循环或前后循环均有梗死病变患者24例,应用降脂药物治疗超过1 m患者1048例;进行溶栓或其他血管内介入治疗患者11例;其他明确病因患者41例;其他无法明确病因患者56例,检查及资料记录不全患者670例),261例ICAS导致的首发缺血性脑卒中患者纳入研究,年龄35~91岁,平均年龄(65.71±11.34)岁;男,157例,女104例;≥60岁175例(60.15%)。
2.2 卒中模式与发病机制分布 261例责任性ICAS致IS患者中,卒中模式以单发皮质下梗死多见(41.38%,108/261),其次为单侧前循环多发性梗死(28.74%,75/261),而皮质-皮质下及皮质梗死出现率较低,分别为1.15%(3/261)、0.766%(2/261);卒中机制中穿支动脉闭塞占41.38%(108/261),多发机制占34.10%(89/261),动脉到动脉栓塞占22.99% (60/261),单纯原位血栓形成与低灌注分别仅有0.766%(2/261)。其中多发机制包括动脉到动脉栓塞联合穿支动脉闭塞20.69%(54/261),动脉到动脉栓塞联合低灌注 9.2%(24/261),动脉到动脉栓塞联合穿支动脉闭塞与低灌注4.21%(11/261)。
2.3 卒中模式与发病机制相关性 卒中解剖模式与发病机制机制相关(r=0.384,P= 0.001)。其中皮质-皮质下梗死(r=0.197,P=0.001),皮质梗死(r=0.161,P=0.009),弥散梗死(r=0.853,P=0.001),单侧前循环多发梗死(r=0.860,P=0.001),后循环多发性梗死(r=0.281,P=0.001)分别与动脉到动脉栓塞机制相关;皮质下梗死主要由穿支动脉闭塞致的(r=0.929,P=0.001);弥散梗死(r=0.792,P=0.001)、单侧前循环多发梗死(r=0.883,P=0.001)、后循环多发性梗死(r=0.213,P=0.001)由多发机制致(见图 1、表1)。
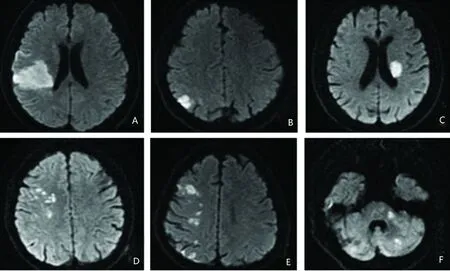
A:皮质-皮质下梗死;B:皮质梗死;C:皮质下梗死;D:弥散梗死;E:单侧前循环多发梗死;F:后循环多发性梗死
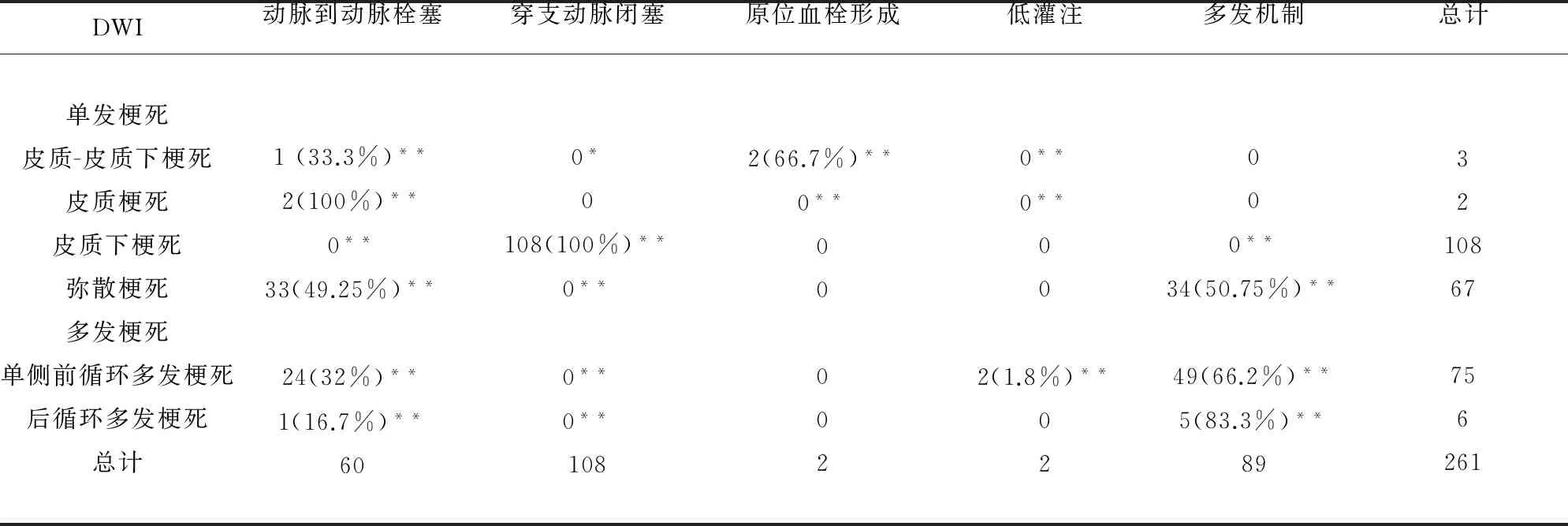
DWI动脉到动脉栓塞穿支动脉闭塞原位血栓形成低灌注多发机制总计单发梗死皮质-皮质下梗死皮质梗死皮质下梗死弥散梗死多发梗死单侧前循环多发梗死后循环多发梗死总计1(33.3%)**2(100%)**0**33(49.25%)**24(32%)**1(16.7%)**600*0108(100%)**0**0**0**1082(66.7%)**0**000020**0**002(1.8%)**02000**34(50.75%)**49(66.2%)**5(83.3%)**893210867756261
注:采用R×C列联表,Spearman等级相关分析r=0.384,P=0.001;两变量间以皮尔森相关性分析*P<0.05;**P<0.01
3 讨 论
脑动脉狭窄的卒中机制与损伤模式的研究已有报道,但由于种族、脑动脉狭窄的诊断标准及狭窄程度判定、颅内血管的范围、卒中发病与DWI成像的时间间隔、卒中模式与机制的定义、心源性因素是否剔除、样本量大小的不同[14~18],致使研究结果的准确性及可靠性尚存争议。本研究据WASID (warfarin aspirin symptomatic intracranial disease trial criteria)标准判定颅内动脉狭窄且多数患者行CTA检查、以DWI 评价卒中模式、卒中发生3 d内行DWI成像检查、颅内血管范围准确、排除心源性栓塞或颅外动脉病变的潜在因素,是初次全面探讨责任性ICAS致首发缺血性脑卒中患者的发病机制与解剖模式关系的大样本回顾性分析。
本研究发现责任性ICAS致首发缺血性脑卒中的解剖模式与发病机制密切相关。颅内大动脉粥样硬化性狭窄病变是单发皮质下梗死、弥散梗死、单侧前循环多发梗死主要病因。不同于Kang等以TOAST分型标准,未排除心源性及升主动脉或主动脉弓近端动脉粥样硬化病因的报道,皮质-皮质下梗死、多发性梗死病因为心源性栓塞,而单侧前循环多发梗死及小散发梗死病因多为大动脉粥样硬化型梗死[13]。责任性ICAS致首发缺血性脑卒中常见发病机制依次为穿支动脉闭塞、多发机制、动脉-动脉栓塞。而不同于Man B L报道 ICAS易导致穿支动脉、边缘带病变及Hwang等报道颅内动脉狭窄易出现动脉-动脉栓塞、血流动力学障碍的致病机制[19,20]。单发皮质下梗死是最常见的卒中模式,可能与皮质下解剖结构缺乏侧支循环,皮质支侧支循环丰富,导致梗死易局限于皮质下部位,而皮质免于受累有关。单发皮质下梗死与穿支动脉闭塞密切相关,穿支动脉闭塞是ICAS致的缺血性脑卒中最常见的单一机制,本研究排除了穿支动脉口的粥样硬化、穿支动脉脂质样变病因及各种腔隙性综合征,心源性因素,其次穿支动脉来源于颅内大动脉[21],可确认穿支动脉闭塞由ICAS影响穿支所致,即载体动脉狭窄、斑块或血栓堵塞穿支动脉口所致[22,23]。原位血栓形成机制仅为0.77%,推测可能与ICAS病变病理生理进展过程及侧支循环开放代偿有关。
其次,本研究结果发现弥散及单侧前循环多发梗死分别与动脉-动脉栓塞、多发机制密切相关,推测与存在ICAS前提下低灌注区栓子形成及清除障碍有关[17]。低灌注仅有0.766%,低灌注损伤最易合并多发机制,我们结果表明近端动脉狭窄致血流动力学障碍导致了栓子清除障碍,堵塞远端血管导致了梗死发生[16,17],动脉-动脉栓塞联合穿支动脉闭塞是在责任性ICAS致缺血性脑卒中最常见的多发机制,我们结果与Lee DK and Man BL 等报道一致,表明穿支动脉闭塞和栓子形成,存在或不存在血流动力学障碍致低灌注是责任性ICAS致缺血性脑卒中主要发病机制[16,19]。
本研究具有以下局限性:没有行脑血管造影(Digital subtraction angiography,DSA)、经食道超声、微栓子检测、病理组织检查,因此对责任性ICAS致缺血性脑卒中的发病机制只能进行推测,在以后的临床研究工作中应不断完善。
总之,本研究表明责任性ICAS致首发缺血性脑卒中发病模式中最常见的病变是单发皮质下梗死,其次单侧前循环多发梗死。单发机制主要为穿支动脉闭塞,多发机制以动脉到动脉栓塞联合穿支动脉闭塞多见。责任性ICAS致缺血性脑卒中解剖模式的研究有利于其发病机制的明确及指导治疗策略的制定,值得进一步探讨。
[1]Qian Y,Pu Y,Liu L,et al. Low HDL-C level is associated with the development of intracranial artery stenosis:analysis from the Chinese IntraCranial AtheroSclerosis (CICAS) study[J]. PLoS One,2013,8(5):e64395.
[2]王炎强,孙绍洋,张炳俊,等. 老年颅内动脉粥样硬化性狭窄致缺血性脑卒中患者危险因素分析[J]. 中华老年心脑血管病杂志,2015,(5):459-462.
[3]Lei C,Wu B,Liu M,et al. Risk factors and clinical outcomes associated with intracranial and extracranial atherosclerotic stenosis acute ischemic stroke[J]. J Stroke Cerebrovasc Dis,2014,23(5):1112-1117.
[4]陆正齐,王炎强. 中国颅内动脉粥样硬化性狭窄的研究现状与未来[J]. 中华老年心脑血管病杂志,2015(5):449-450.
[5]Ghosh M,Ghosh K,Chatterjee A,et al. Correlation of intracranial atherosclerosis with carotid stenosis in ischemic stroke patients[J]. Ann Indian Acad Neurol,2015,18(4):412-414.
[6]Dubow JS,Salamon E,Greenberg E,et al. Mechanism of acute ischemic stroke in patients with severe middle cerebral artery atherosclerotic disease[J]. J Stroke Cerebrovasc Dis,2014,23(5):1191-1194.
[7]Chen H,Hong H,Liu D,et al. Lesion patterns and mechanism of cerebral infarction caused by severe atherosclerotic intracranial internal carotid artery stenosis[J]. J Neurol Sci,2011,307(1/2):79-85.
[8]王炎强,孙绍洋,张炳俊,等. 大动脉粥样硬化性首发急性缺血性卒中的危险因素及分布特点分析[J]. 中国神经精神疾病杂志,2016,42(4):7-12.
[9]Kim JS,Nah HW,Park SM,et al. Risk factors and stroke mechanisms in atherosclerotic stroke:intracranial compared with extracranial and anterior compared with posterior circulation disease[J]. Stroke,2012,43(12):3313-3318.
[10]WASIDT Investigators. Design,progress and challenges of a double-blind trial of warfarin versus aspirin for symptomatic intracranial arterial stenosis[J]. Neuroepidemiology,2003,22(2):106-117.
[11]Yoon Y,Lee DH,Kang DW,et al. Stroke recurrence patterns are predicted by the subtypes and mechanisms of the past,non-cardiogenic stroke[J]. Eur J Neurol,2013,20(6):928-934.
[12]Tatu L,Moulin T,Vuillier F,et al. Arterial territories of the human brain[J]. Front Neurol Neurosci,2012,30:99-110.
[13]Kang DW,Chalela JA,Ezzeddine MA,et al. Association of ischemic lesion patterns on early diffusion-weighted imaging with TOAST stroke subtypes[J]. Arch Neurol,2003,60(12):1730-1734.
[14]Chen H,Hong H,Liu D,et al. Lesion patterns and mechanism of cerebral infarction caused by severe atherosclerotic intracranial internal carotid artery stenosis[J]. J Neurol Sci,2011,307(1-2):79-85.
[15]Kang DW,Chu K,Ko SB,et al. Lesion patterns and mechanism of ischemia in internal carotid artery disease:a diffusion-weighted imaging study[J]. Arch Neurol,2002,59(10):1577-1582.
[16]Lee DK,Kim JS,Kwon SU,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusion-weighted imaging study[J]. Stroke,2005,36(12):2583-2588.
[17]Wong KS,Gao S,Chan YL,et al. Mechanisms of acute cerebral infarctions in patients with middle cerebral artery stenosis:a diffusion-weighted imaging and microemboli monitoring study[J]. Ann Neurol,2002,52(1):74-81.
[18]Oyama N,Moriwaki H,Yamada N,et al. Estimation of stroke etiology from lesion patterns on diffusion-weighted magnetic resonance imaging in patients with carotid artery occlusive disease[J]. Eur Neurol,2013,69(3):142-148.
[19]Man BL,Fu YP,Chan YY,et al. Lesion patterns and stroke mechanisms in concurrent atherosclerosis of intracranial and extracranial vessels[J]. Stroke,2009,40(10):3211-3215.
[20]Hwang J,Kim SJ,Bang OY,et al. Ischemic stroke in Takayasu’s arteritis:lesion patterns and possible mechanisms[J]. J Clin Neurol,2012,8(2):109-115.
[21]Kim JS,Nah HW,Park SM,et al. Risk factors and stroke mechanisms in atherosclerotic stroke:intracranial compared with extracranial and anterior compared with posterior circulation disease[J]. Stroke,2012,43(12):3313-3318.
[22]Kim BJ,Kim JS. Ischemic stroke subtype classification:an Asian viewpoint[J]. J Stroke,2014,16(1):8-17.
[23]Gao S,Wang YJ,Xu AD,et al. Chinese ischemic stroke subclassification[J]. Front Neurol,2011,2:6.
Relationship between topographic patterns and mechanisms in intracranial atherosclerotic stenosis related first-ever Ischemic Stroke
WANGYanqiang,SUNShaoyang,WANGYuge,etal.
(DepartmentofNeurology,TheAffiliatedHospitalofWeifangMedicalUniversity,Weifang261031,China)
Objective To evaluate the relationship between topographic patterns and mechanism in ischemic stroke with intracranial atherosclerotic stenosis(ICAS). Methods We retrospectively investigated 261 patients who had ICAS with ischemic stroke. The patients’ characteristics were reviewed,ischemic patterns were divided into single (corticosubcortical,cortical,subcortical lesion),scattered,multiple lesions. Stroke mechanisms were categorized as artery to artery embolism (A-A),in situ thrombotic occlusion (STO),local branch occlusion (LBO),hemodynamic impairment (HI),and multiple mechanisms. Results In all of the patients who had ICAS with ischemic stroke,single subcortical (41.4) lesions were most commonly seen in all the lesion patterns,the most frequent lesion mechanism was LBO (66.3). There was a statistically significant association between topographic patterns on DWI and different stroke mechanisms (r=0.384,P=0.001). LBO was related with subcortical lesions (r=0.805,P=0.001),scattered,multiple lesions in unilateral anterior circulation,multiple lesions in posterior circulation were especially association with A-A (r=0.853,P=0.001;r=0.860,P=0.001;r=0.281,P=0.001) and multiple mechanisms (r=0.792,P=0.001;r=0.883,P=0.001;r=0.213,P=0.001). Conclusion Topographical patterns were helpful to verify etiology mechanism in ICAS with ischemic stroke.
Ischemic stroke; Intracranial atherosclerotic stenosis; Topographic patterns; Mechanisms; DWI
1003-2754(2017)01-0043-05
2016-09-30;
2016-12-16
山东省医药卫生科技发展计划项目(No. 2015WS0051)
(1.潍坊医学院附属医院神经内科,山东 潍坊 261031;2.青岛大学医学院附属医院神经内科,山东 青岛 266000;3.中山大学附属第三医院神经内科,广东 广州 510630)
王炎强,E-mail:Wangqiangdoctor@126.com
R743
A

