不同方法测定齐墩果酸脂质体的包封率
罗 肖,徐小超,高男男,何仲贵*
不同方法测定齐墩果酸脂质体的包封率
罗 肖1,徐小超2,高男男1,何仲贵2*
(1. 沈阳药科大学中药学院,辽宁沈阳,110016;2. 沈阳药科大学药学院,辽宁沈阳,110016)
目的建立齐墩果酸脂质体包封率测定方法。方法建立高效液相色谱(HPLC)法测定齐墩果酸脂质体含量的分析方法,并分别采用低速离心法、过膜法、阴离子交换树脂-微柱离心法和微柱离心法来分离脂质体和游离药物,比较该4种方法测定脂质体包封率的结果。结果低速离心法、过膜法和阴离子交换树脂-微柱离心法都不能将脂质体和游离药物完全分离,不适合齐墩果酸脂质体包封率的测定。微柱离心法测得脂质体的包封率为( 85.36±0.21 )%(=3)。结论最终选择微柱离心法测定脂质体包封率,该方法简便易行、准确可靠,可作为齐墩果酸脂质体的包封率测定方法。
药剂学;脂质体;高效液相色谱;齐墩果酸;包封率
齐墩果酸(oleanolic acid,简称OA,化学结构式见图1),又名庆四素,具有保肝降酶、抗炎、免疫调节、降血糖血压、抗心律失常、抑制血小板聚集和抗多氧化等多方面的药理作用[1],目前主要用于治疗急性黄疸型肝炎和慢性病毒性肝炎以及抗结核辅助用药。。
脂质体作为一种新型药物载体,以其能够提高难溶性药物的溶解性、保护被包封药物、促进肠黏膜吸收等优势成为研究的热点。齐墩果酸由于溶解度低、肠黏膜透过性差和严重的肝肠首过效应,导致生物利用度很低且个体间差异大[2]。为了提高其生物利用度,作者制备了齐墩果酸脂质体,建立了齐墩果酸体外分析方法,并考察低速离心法、过膜法和微柱离心法3种测定包封率的方法,以选出最合适的齐墩果酸脂质体包封率测定方法。
Fig.1 Structure of oleanolic acid
1 仪器与材料
2695 Waters高效液相色谱仪(美国Waters公司),KQ-100超声波清洗器(昆山超声仪器有限公司),RE-52 A旋转蒸发仪、SZ-96 A自动纯水蒸馏器(上海亚荣生化仪器厂),JY92-2D超声波细胞粉碎机(宁波新芝科器研究所),AR1140电子分析天平(美国Ohaus公司),ZEN 1600粒径测定仪(英国Malvern仪器有限公司),EU-pH 700 pH计(美国Eutech公司),LDZ5-2低速自动平衡离心机(北京医用离心机厂)。
齐墩果酸(四川世坤药物原料有限公司,纯度质量分数为98.00%,批号20130212),注射级大豆卵磷脂(上海太伟药业有限公司,纯度质量分数为98.00%,规格100 g,批号20140202),胆固醇(天津博迪化工有限公司,纯度质量分数为99.6%,批号20110712),葡聚糖凝胶G-50(上海如吉生物科技有限公司,规格25 g),磷酸二氢钾、氢氧化钠(天津博迪化工有限公司),甲醇(天津康科德化学试剂厂),磷酸(分析纯,沈阳化学试剂厂),二次重蒸水(实验室自制)。
2 方法与结果
2.1 空白脂质体的制备
取处方量的大豆卵磷脂和胆固醇,溶于一定量的二氯甲烷中,在旋转蒸发仪上减压蒸发,溶剂蒸干后呈半透明均匀薄膜,然后将pH值7.4的磷酸盐缓冲液作为水化介质,于45 ℃下水化,探头超声后,即得空白脂质体混悬液。
2.2 齐墩果酸脂质体的制备
取处方量的大豆卵磷脂、齐墩果酸和胆固醇,溶于一定量的二氯甲烷中,在旋转蒸发仪上减压蒸发,溶剂蒸干后呈半透明均匀薄膜,然后将pH值7.4的磷酸盐缓冲液作为水化介质,于45 ℃下水化,探头超声,即得齐墩果酸脂质体混悬液。经动态激光散射法测得脂质体的平均粒径为163.7 nm,多分散指数为0.3,zeta电位为-30.6 mV。
2.3 HPLC法测定齐墩果酸脂质体中的药物含量
2.3.1 色谱条件
色谱柱:COSMOSIL 5 C18-AR-Ⅱ柱(150 mm×4.6 mm,5 µm);流动相:甲醇-体积分数0.2%磷酸水溶液(体积比90∶10);流速:1.0 mL·min-1;检测波长:215 nm;柱温:30 ℃;进样量:20 µL。
2.3.2 对照溶液的配制
取齐墩果酸原料药约40 mg,精密称定。置于100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀作为储备液备用。精密量取齐墩果酸对照储备液1.0 mL置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,配制成质量浓度为40 mg·L-1齐墩果酸溶液,作为对照溶液。
2.3.3 供试溶液的配制
精密吸取齐墩果酸脂质体溶液0.2 mL,置于10 mL量瓶中,加入适量甲醇,超声使脂质体破坏,然后甲醇定容至刻度,摇匀,用0.45 µm滤膜过滤,作为供试溶液。
2.3.4 方法专属性试验
取空白脂质体0.2 mL,按“2.3.2”和“2.3.3”条方法配制对照溶液和供试溶液,其对照溶液和供试溶液终质量浓度均为40 mg·L-1。分别取空白溶剂、对照溶液和供试溶液各20 µL注入高效液相色谱仪,记录色谱图,结果见图2。
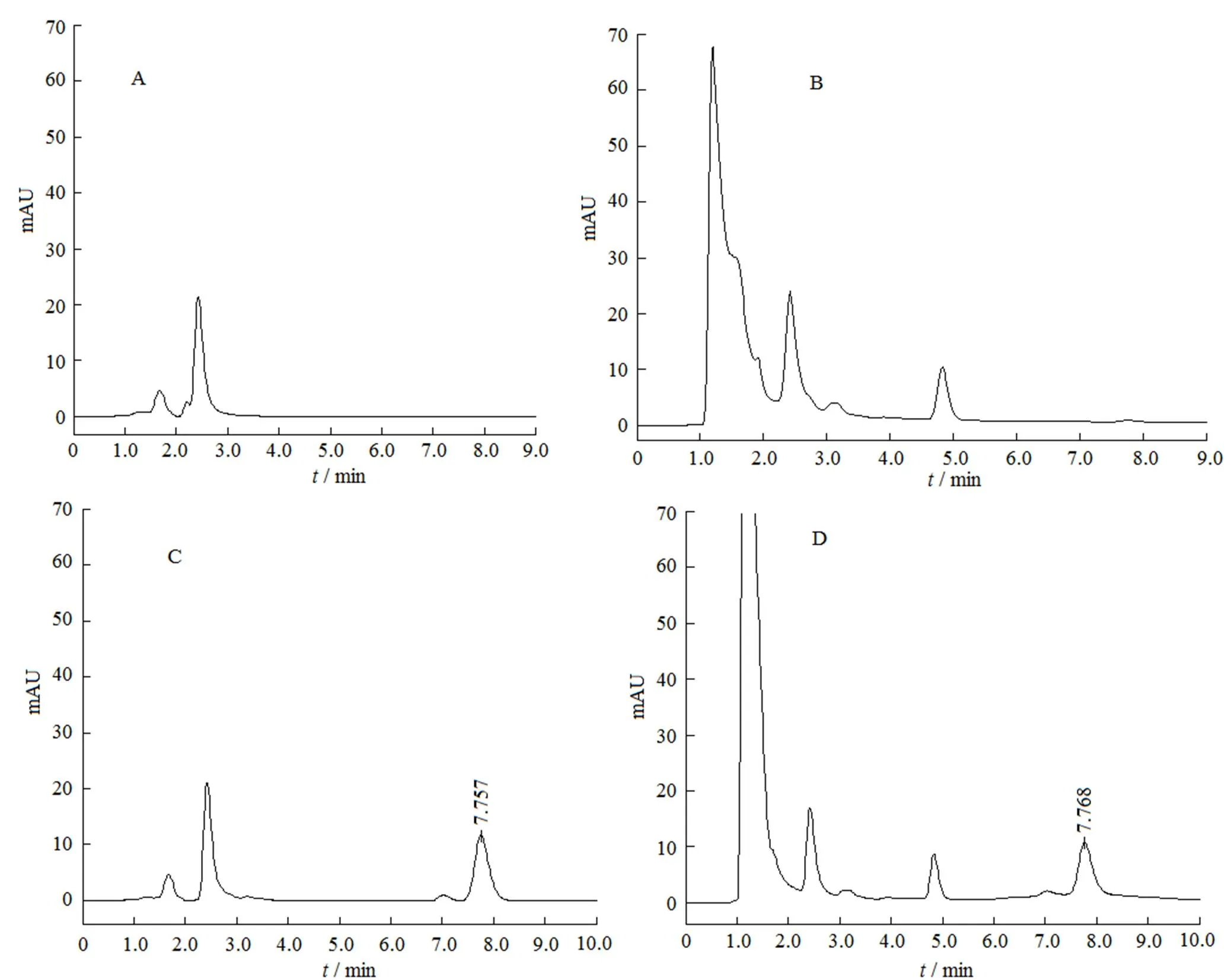
Fig. 2 HPLC chromatograms of solvent (A), blank liposome (B), oleanolic acid (C) and oleanolic acid-liposome (D)
齐墩果酸的出峰时间约为7.7 min,结果表明,空白溶剂和空白脂质体不干扰齐墩果酸的测定。
2.3.5 齐墩果酸标准曲线的制备
精密称取一定量的齐墩果酸粉末,加甲醇溶解制成质量浓度为200 mg·L-1的储备液。精密量取一定量储备液用甲醇稀释成质量浓度分别为8、20、40、80、160和200 mg·L-1的系列标准溶液。分别精密量取上述溶液各20 µL注入液相色谱仪,记录峰面积,以质量浓度(,mg·L-1)为横坐标,峰面积()为纵坐标进行线性回归,得回归方程为=5 735.4-3 755.5,2=0.999。结果表明,齐墩果酸的质量浓度在8~200 mg·L-1内与峰面积呈良好的线性关系。
2.3.6 色谱系统适用性试验
取质量浓度为40 mg·L-1的齐墩果酸标准溶液,精密量取20 μL,注入液相色谱仪,连续进样6次,记录色谱图。结果表明,6次进样后峰面积RSD为0.34%,表明仪器精密度良好。
2.3.7 方法稳定性考察
准确配置质量浓度为40 mg·L-1的齐墩果酸标准溶液,于室温下放置,分别于0、2、4、6、8和12 h按“2.3.1”条色谱条件测定齐墩果酸峰面积并计算齐墩果酸含量。结果表明,12 h内峰面积RSD为0.56%,可知溶液在室温下12 h内稳定。
2.3.8 精密度试验
取“2.3.5”条系列标准曲线溶液中的低(20 mg·L-1)、中(40 mg·L-1)、高(160 mg·L-1)3种质量浓度的齐墩果酸标准溶液,每个质量浓度的样品分别测定3次,记录色谱图和峰面积。计算峰面积的相对标准偏差(RSD)作为日内精密度;另外同一样品连续测定3 d,计算峰面积的相对标准偏差(RSD)作为日间精密度,结果见表1。结果精密度RSD值小于2%,可知仪器精密度良好。
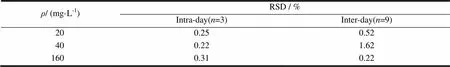
Table 1 Precision of the method for determination of oleanolic acid
2.3.9 回收率试验
分别精密称定齐墩果酸约3.2、4.0 和4.8 mg各3份,置于100 mL量瓶中,按处方量加入空白脂质体,用甲醇定容,摇匀,然后按“2.2.2”条方法配制对照溶液。分别取供试溶液和质量浓度为40 mg·L-1的对照溶液各20 μL注入高效液相色谱仪,记录峰面积。按外标法以峰面积计算供试品浓度,并计算回收率和相对标准偏差,结果见表2。结果平均回收率为99.97%,RSD小于2%,可知回收率良好。

Table 2 Recovery of oleanolic acid by HPLC
2.4 测定齐墩果酸脂质体包封率方法学的考察
2.4.1 齐墩果酸与空白脂质体混悬液的制备
取处方量的齐墩果酸,溶于一定量的二氯甲烷中,在旋转蒸发仪上减压蒸发,溶剂蒸干后,加入pH值7.4的磷酸盐缓冲液,于45 ℃下旋转溶解齐墩果酸,然后探头超声得齐墩果酸混悬液。精密量取上述混悬液5 mL置于量瓶中,用空白脂质体定容至10 mL,振荡混匀,即得含齐墩果酸与空白脂质体的混悬液。
2.4.2 分离度的计算
不同的脂质体包封率测定的分离度计算公式如下:分离度 =(1-样/总)×100%。
式中样为齐墩果酸与空白脂质体混悬液经过处理后,测得的游离药物质量浓度;总为未经处理的药物总质量浓度。
2.4.3 低速离心法对游离药物和脂质体分离作用的考察
取 “2.4.1”条下所制备的混悬液5 mL,精密量取上清液0.2 mL,加入甲醇溶解并定容至10 mL,测定游离药物总量。另取“2.4.1”条下所制备的混悬液5 mL,于3 500 r·min-1离心10 min,精密量取上清液0.2 mL,加入甲醇溶解并定容于10 mL的量瓶中,测定未被沉淀的游离药物含量。考察低速离心是否能将脂质体与游离药物完全分离,平行操作3次。结果表明,低速离心法对游离药物与脂质体的分离度为80.05%、81.21%和81.07%。说明低速离心法不能将脂质体与游离药物完全分离,故此方法不适合测定齐墩果酸脂质体的包封率。
2.4.4 过膜法对游离药物和脂质体分离作用的考察
取“2.4.1”条下所制备的混悬液5 mL,精密量取上清液0.2 mL,加入甲醇溶解并定容至10 mL,测定游离药物总量。另取“2.4.1”条下所制备的混悬液5 mL,用0.22 µm的微孔滤膜过滤,精密吸取上述续滤液0.2 mL加入甲醇溶解并定容于10 mL的量瓶中,测定未被滤膜滤过的游离药物的含量,考察微孔滤膜对游离药物和脂质体的分离作用。结果表明,过膜法对游离药物和脂质体的分离度为88.02%、87.98%和89.01%。说明过膜法不能将脂质体与游离药物完全分离,此方法不适合测定齐墩果酸脂质体的包封率。
2.4.5 阴离子交换树脂-微柱离心法对游离药物和脂质体分离作用的考察
2.4.5.1 微型阴离子交换树脂柱的制备
将树脂置饱和食盐水溶液中浸泡20 h,然后放净食盐水,用蒸馏水洗至排出水不带黄色。然后用质量分数5%的盐酸溶液浸泡4 h,放净酸液,用蒸馏水洗至中性。最后使用质量分数2%的氢氧化钠溶液浸泡4 h后,放净碱液,用蒸馏水洗至中性后,装入底部垫有滤纸片的2.5 mL注射器中,将注射器置于离心机中,3 000 r·min-1离心3 min,除去水分,待用。
2.4.5.2 微型阴离子交换树脂柱分离度的考察
取“2.4.1”条下所制备的混悬液5 mL,精密量取上清液0.2 mL,加入甲醇溶解并定容至10 mL,测定游离药物总量。另取“2.4.1”条下所制备的混悬液5 mL,精密量取混悬液0.2 mL上样于自制的阴离子交换树脂柱的顶端,平行操作3份,吸附10 min中后,3 000 r·min-1离心3 min,收集离心液。加入pH值7.4的磷酸盐缓冲溶液0.2 mL于微型凝胶柱的顶端,3 000 r·min-1离心3 min,分别连续操作3次,合并4次收集的洗脱液置于10 mL量瓶中,用甲醇溶解并定容,测定未被柱子吸附的游离药物的含量,考察阴离子交换树柱对游离药物的吸附作用。结果表明,阴离子交换树脂柱的分离度为100%。说明阴离子交换树脂柱可以将脂质体和游离药物分开
2.4.6 微柱离心法对游离药物和脂质体分离作用的考察
2.4.6.1 微型凝胶柱的制备
将葡聚糖凝胶颗粒(Sephadex G-50)浸泡在蒸馏水中,充分溶胀,放置12 h,装入底部垫有滤纸片的2.5 mL注射器中,待水分自然流下后,将注射器置于离心机中,2 000 r·min-1离心2 min,使凝胶柱失水皱缩,凝胶部分高约1.5 cm,待用。
2.4.6.2 微柱离心法分离度的考察
取“2.4.1”条下所制备的混悬液5 mL,精密量取上清液0.2 mL,加入甲醇溶解并定容至10 mL,测定游离药物总量。另取“2.4.1”条下所制备的混悬液5 mL,精密量取混悬液0.2 mL上样于自制的微型凝胶柱的顶端,平行操作3份,1 800 r·min-1离心1 min,收集离心液。加入pH值7.4的磷酸盐缓冲溶液0.2 mL于微型凝胶柱的顶端,2 000 r·min-1离心3 min,分别连续操作2次,然后同法加入上述缓冲液,1 800 r·min-1离心2 min,合并4次收集的洗脱液置于10 mL量瓶中,用甲醇溶解并定容,测定未被柱子吸附的游离药物的含量,考察微型凝胶柱对游离药物的吸附作用。结果表明,微型凝胶柱分离度分别为98.02%、97.98%和99.01%。说明微型凝胶柱可以将脂质体和游离药物分开。
实验结果表明,低速离心法、过膜法均不能完全将游离药物和脂质体分离,测得脂质体的包封率比实际偏高些,所以作者选择阴离子交换树脂法和微柱离心法进行齐墩果酸脂质体包封率的测定。
2.5 齐墩果酸脂质体包封率的测定
2.5.1 阴离子交换树脂-微柱离心法测定齐墩果酸脂质体的包封率
在“2.4.5”条方法的基础上,作者采用阴离子交换树脂-微柱离心法对齐墩果酸脂质体的包封率进行测定,结果没有测到脂质体的包封率(图3)。
没有测到包封率可能因为离子交换树脂法是根据游离药物和脂质体所带电荷的不同而分离的,齐墩果酸是弱酸性药物荷负电,游离药物可以被树脂柱完全吸附,但是作者所制备的脂质体也是荷负电,如图3所示,可以观察到荷负电的脂质体也被阴离子交换树脂吸附,所以不能进行齐墩果酸脂质体包封率的测定。
2.5.2 微柱离心法测定齐墩果酸脂质体的包封率
精密量取齐墩果酸脂质体溶液0.2 mL,加入甲醇溶解并定容于10 mL的量瓶中,测定药物含量(t)。另精密量取齐墩果酸脂质体溶液0.1 mL,缓慢加入已制备好的微型凝胶柱的顶端,1 800 r∙min-1离心1 min,收集离心液。然后加入pH值7.4的磷酸盐缓冲液0.2 mL于微型柱的顶端,2 000 r∙min-1离心3 min,连续操作2次,同法加入上述缓冲液,1 800 r∙min-1离心2 min。合并4次收集的洗脱液置于10 mL的量瓶中,用甲醇溶解并定容,测定药物含量(in)。计算齐墩果酸脂质体的包封率。公式如下:EE=in/t×100%。
结果表明,齐墩果酸脂质体的包封率为(85.36±0.21)%(=3)。
3 讨论
3.1 齐墩果酸含量测定方法的选择
文献报道齐墩果酸的分析方法有紫外分光光度法[3]、薄层扫描法[4]、高效液相色谱法[5]等,作者通过参照文献和《中华人民共和国药典》,决定采用高效液相色谱法对齐墩果酸含量进行测定,该方法准确、灵敏、专属性强、重现性好。COSMOSIL 5 C18-AR-Ⅱ与普通的十八烷基键合硅胶柱(ODS)相比,抗酸性有了很大的改善。即使分离弱酸性化合物接触酸性流动相,柱效也很稳定。
3.2 脂质体破膜剂的选择
在测定脂质体包封率时需要对脂质体溶液进行破坏,破坏脂质体双分子乳化层,释放出包封药物,进而准确地测定药物的含量。常用的方法为有机溶剂萃取法、有机溶剂破坏法、乳化剂破坏法等。传统的脂质体破膜剂为乳化剂曲拉通(Triton-X100)溶液,作者根据脂质体膜材和齐墩果酸的溶解性质,考虑到甲醇对齐墩果酸有良好的溶解作用,而且破乳完全,测定药物峰形较好,回收率符合要求。所以选择甲醇作为齐墩果酸脂质体的破膜剂。
3.3 包封率测定方法的选择
包封率是脂质体制剂质量评价的重要指标,脂质体包封率的测定是先将游离药物与被包封药物分离,再进行包封率的计算[6]。常用的包封率测定方法有透析法、低速离心法、超速离心法[7]、葡聚糖凝胶柱色谱法[8]、离子交换树脂法和微柱离心法[9]等。齐墩果酸极难溶于水,未被包封的药物呈结晶状态,透析法不能将游离药物除去,而且透析法测定脂质体包封率时耗时长[10]。超速离心法适合水溶性药物的分离,而且要有超速冷冻离心机,通常离心1 h左右,成本较高,样品批间重现性差[11]。有文献报道采用葡聚糖凝胶柱色谱法测定齐墩果酸脂质体的包封率,存在着洗脱介质用量大、用时长,洗脱过程中可能存在药物析出的问题[8],在葡聚糖凝胶柱的基础上,作者尝试用微柱离心法实现脂质体与游离药物的分离。作者先后比较了低速离心法、过膜法、阴离子树脂法和微柱离心法,结果发现低速离心法和过膜法均不能将游离药物和脂质体完全分离,离子交换树脂法是根据游离药物和脂质体所带电荷的不同而分离的,齐墩果酸是弱酸性药物荷负电,而作者所制备的脂质体也是荷负电,所以阴离子交换树脂法不适合齐墩果酸脂质体包封率的测定。而微柱离心法能将脂质体里包封的药物顺利地洗脱下来,并且游离药物能完全吸附在微型凝胶柱上,具有方便、快捷、所需样品量少和重现性好等优点,因此选择微柱离心法来测定齐墩果酸脂质体包封率。
[1]胡华杰. 齐墩果酸药理作用与临床应用研究进展[J]. 海峡药学, 2012, 24(3): 92-93.
[2] XI J, CHANG Q, CHAN C K, et al. Formulation development and bioavailability evaluation of a self-nanoemulsified drug delivery system of oleanolic acid[J]. AAPS Pharm Sci Tech, 2009, 10: 172-182.
[3] 李必波, 赵领, 张雪梅, 等. 紫外光谱法测定齐墩果酸缓释滴丸药物含量及体外释放度[J]. 重庆医科大学学报, 2009, 34(4): 447-452.
[4] 杨波, 徐丽云, 沈德风. 黄花败酱总皂苷胶囊中齐墩果酸的含量测定[J]. 时珍国医国药, 2008, 19(7): 1618-1619.
[5] 万元松, 杨文革, 黄一平. 高效液相色谱法测定肠泰颗粒中齐墩果酸含量[J]. 时珍国医国药, 2009, 20(10): 2445- 2446.
[6] 叶兆伟, 承伟. 脂质体包封率测定方法及影响因素[J]. 中国生物制品学杂志, 2007, 20(10): 789-792.
[7] ROUZI B. Retorolac tromethamine liposome: encapsulation and release studies[J]. Liposome Res, 2005, 15(3/4): 175-185.
[8] 许伯慧, 李晓霞, 孟璐. 等. 齐墩果酸脂质体包封率的测定[J]. 中国实验方剂学杂志, 2012, 18(32): 86-89.
[9] 王秀敏, 邓英杰, 郝艳丽, 等. 微柱离心-气相色谱法测定-榄香烯脂质体包封率[J]. 沈阳药科大学学报, 2004, 21(6): 416-419.
[10] 郭丹, 熊阳, 孙鹏, 等. Nobiliside-A脂质体包封率测定方法的研究[J]. 中成药, 2009, 31(2): 209-211.
[11] 叶兆伟, 承伟. 脂质体包封率测定方法及影响因素[J]. 中国生物制品学杂志, 2007, 20(10): 789-792.
(本篇责任编辑:赵桂芝)
Different methods for the determination of entrapment efficiency of oleanolic acid (OA) liposome
LUO Xiao1, XU Xiaochao2, GAO Nannan1, HE Zhonggui2*
(1.,,110016,; 2.,,110016,)
Objective To establish a method for the determination of entrapment efficiency of oleanolic acid (OA) liposomes. Methods The high efficient liquid chromatography (HPLC) method for the determination of the content of OA liposomes was developed. Low-speed centrifugation, filtration membrane, micro-column centrifugation of the anion-exchange resins and micro-column centrifugation method were used for separating free drugs and OA liposome, and these four methods for the determination of the entrapment efficiency of liposomes were compared. Results Low-speed centrifugation, filtration membrane and micro-column centrifugation of the anion-exchange resins could not separate free drugs and OA liposome completely, which couldn’t be used to determine the entrapment efficiency of OA liposomes. By micro-column centrifugation method, the entrapment efficiency of OA liposomes was (85.36±0.21)%. Conclusion Micro-column centrifugation method is finally selected to determine the entrapment efficiency of liposomes, which is simple, accurate and reliable, and can be used for the determination of the entrapment efficiency of OA liposomes.
pharmaceutics; liposome; HPLC; oleanolic acid; entrapment efficiency
(2017)01–0013–08
10.14146/j.cnki.cjp.2017.01.003
R 94
A
2015-05-28
罗肖(1991-), 女(汉族), 河南开封人, 硕士研究生, E-mail luoxiao201607@qq.com;
何仲贵(1965-), 男(汉族), 宁夏盐池人, 教授, 博士, 博士生导师, 主要从事生物药剂学与新剂型研究,Tel.024-23986321,E-mailhezhgui-student@yahoo. com.cn。
- 中国药剂学杂志(网络版)的其它文章
- 克里唑替尼脂质体的制备与含量测定
- 美洛昔康二乙胺盐贴剂的制备及渗透性和释放度的考察

