LPS对肝癌细胞TLR4及IL-23/IL17A表达的影响
康玉明,苏国爱,张艳丽
·论 著·
LPS对肝癌细胞TLR4及IL-23/IL17A表达的影响
康玉明1,苏国爱2,张艳丽3
目的 观察Toll样受体4(TLR4)的激动剂LPS (LPS)对肝癌HepG2细胞株表达 TLR4、IL-23/IL-17A的影响,探讨TLR4、IL-23/IL-17A在肝癌发生中的作用及可能机制。方法 用LPS 1 mol/L作用HepG2细胞24 h,或先用LPS作用HepG2细胞24 h后再用髓样分化因子-88(MyD88)的阻断剂ST2825作用HepG2细胞8 h,运用Q-PCR法检测TLR4、IL-23、IL-17A在HepG2细胞的转录水平;应用Western-blot方法测定TLR4、IL-23及IL-17A在HepG2细胞的表达,采用ELISA法检测HepG2细胞培养上清液中IL-23在12 h、24 h、36 h的分泌水平。结果 LPS可促进HepG2细胞株IL-23的分泌和TLR4、IL-23、IL-17A mRNA的转录及蛋白表达,阻断MyD88后其表达水平比LPS组明显降低,趋于正常组水平。结论 TLR4、IL-23及IL-17A参与原发性肝癌的发生与进展。
肝癌,Toll样受体;白介素-23;白介素质-17A
肝细胞癌(HCC)是全球常见恶性肿瘤,也是最难治疗的癌症之一[1]。炎症与肿瘤的发生和发展密切相关。研究表明,Toll样受体4(TLR4)高表达与乳腺癌、肺癌、前列腺癌、直肠癌和肝癌[2]的发生与进展有密切关系。TLR4和骨髓分化因子(MyD88)已被证明在炎症反应发挥重要作用,TLR4识别LPS并与其结合后,可激活TLR4信号转导通路,其中MyD88作为TLR4的链接蛋白继而活化NF-κB转录并产生相关促炎细胞因子。有报道称IL-23/IL-17 轴在肿瘤、自身免疫性疾病及感染性疾病中起重要作用[3-5],但TLR4活化与IL-23/IL-17在导致肿瘤发生和进展所处的炎症环境中的具体分子机制尚不清楚。
1 材料与方法
1.1 细胞:肝癌细胞株HepG2和人正常肝细胞HL-7702均由本校生化实验室杨怡教授馈赠。
1.2 主要试剂与仪器:LPS购自美国Sigma公司,ST2825为Med Chem Express公司产品;引物序列由上海生工科技有限公司合成;TLR4、IL-23及IL-17A单克隆抗体购自英国Abcam公司;RPMI 1640培养基购自Hyclone公司,DMEM培养基为GBICO公司产品;TRIZOL总RNA提取液为美国Invitrogen公司产品,逆转录试剂盒为Promega公司产品;SYBR Green Realtime PCR Master Mix试剂盒购自东洋纺(上海)生物科技有限公司;β-actin为北京中衫金桥有限公司产品;Nanodrop2000由美国Thermo公司制造,ABI-7300 型Real-time PCR 检测仪购自美国ABI公司。
1.3 方法
1.3.1 细胞培养:细胞常规复苏后,肝癌细胞株HepG2用DMEM(含10%胎牛血清)培养液、人正常肝细胞系细胞系HL-7702用RPMI1640完全培养液重悬细胞后移入培养瓶于37℃、5% CO2的培养箱中培养,逐日观察,取对数生长期的细胞进行实验。
1.3.2 引物设计与合成:由生工生物工程(上海)股份有限公司完成,经验证后使用。引物序列如表1所示。

表1 引物序列
1.3.3 Q-PCR法测定TLR4、IL-23及IL-17A mRNA的转录水平:生长旺盛状态的人肝癌细胞HepG2置于6孔板培养,按分组条件加样并培养。实验分为3组:第1组为正常对照组,第2组加LPS 1 mol/L培养24 h,第3组先加 LPS 1 mg/L培养24 h,之后加ST2825 40 μmol/L培养8 h)。严格按试剂盒说明提取细胞(细胞计数约为106个)总RNA并测定其浓度和纯度,采用美国Promega公司逆转录试剂盒进行反转录合成cDNA。PCR反应条件:50 ℃ 2 min,95 ℃ 10 min;PCR循环(×40循环),95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s(Data collection),熔解曲线分析(Melting Curve Analysis)。待PCR反应结束后,目的基因扩增产物的相对含量用2-ΔΔCt法计算,试验重复3次。
1.3.4 Western blot法检测TLR4、IL-23及IL-17A的表达:取对数生长期的HepG2细胞培养于6孔板,实验处理条件及分组同1.3.3。提取细胞总蛋白(细胞计数约为106个),调节样品蛋白浓度为10 μg/L。取10 μl蛋白样品行SDS-PAGE电泳,在60 V、300 mA、4 ℃恒流条件下转膜3 h,5%脱脂奶粉4 ℃封闭过夜;TBST洗3次,TLR4、IL-23、IL17A和β-actin抗体用5%脱脂奶粉PBS溶液1∶1 000稀释,37 ℃孵育3 h。TBST洗3次后加1∶2 000的羊抗兔二抗,37 ℃孵育2 h后用TBST 洗涤,DAB显色,ECL发光及曝光,胶片拍照。
1.3.5 ELISA试剂盒检测IL-23的水平:培养HepG2细胞于96孔板,5 000个细胞/孔,按实验分组并处理HepG2细胞,继续分别培养12 h、24 h和36 h并收集细胞上清液。严格按照ELISA试剂盒操作流程检测IL-23的分泌水平,酶标仪波长测OD值,根据标准曲线绘制图。
2 结果
2.1 LPS促进TLR4、IL-23 及IL-17A mRNA的转录:HepG2细胞用LPS或ST2825处理后,采用Q-PCR法测定TLR4、IL-23、IL-17AmRNA的转录水平,。经LPS 1 mg/L 培养24 h的HepG2细胞与正常肝细胞HL-7702比较,差异有统计学意义(P<0.05);在HepG2细胞,LPS组与对照组比较,TLR4 mRNA相对表达量提高(P<0.05),ST2825组与LPS组比较,TLR4mRNA的表达无明显变化。在HepG2细胞LPS组的IL-23、IL-17A的 mRNA转录水平明显高于HL-7702细胞的(P<0.05);LPS组与对照组比较,IL-23、IL-17A的 mRNA相对表达量明显提高(P<0.05);而ST2825组相对于LPS组的IL-23、IL-17A的 mRNA表达则明显降低(P<0.05)。
2.2 LPS促进TLR4 、IL-23 及IL-17A 在肝癌细胞的蛋白表达:Western-blot法观察在HepG2细胞株TLR4、IL-23、IL-17A蛋白的表达,经灰度扫描分析,以HepG2细胞TLR4、IL-23、IL-17A条带灰度值除以相应的β-actin条带灰度值作为HepG2细胞 TLR4、IL-23、IL-17A蛋白的相对表达量。结果显示LPS促进HepG2细胞株TLR4、IL-23、IL-17A的蛋白表达(P<0.05),阻断MyD88后IL-23和IL-17A蛋白表达则明显降低(P<0.05)。
2.3 LPS促进HepG2细胞培养上清IL-23的分泌水平:ELISA结果表明,HepG2细胞的上清液IL-23在不同时间内LPS组间差异有统计学意义(P<0.05),而在同一时间内LPS处理组与对照组比较IL-23的表达升高(P<0.05),ST2825组与LPS组比较,IL-23的表达明显下降(P<0.05),见表2。
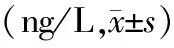
表2 ELISA法检测HepG2细胞中IL-23的表达量
注:*与对照组比较,P<0.05;#与ST2825组比较,P<0.05。
3 讨论
肝脏的慢性炎症是公认的致癌危险因素[6],TLR4识别并结合后,可激活依赖MyD88的信号转导通路,促进丝裂原活化蛋白激酶(MAPK)和IκB激酶家族(IKKs)磷酸化,最终分别活化转录因子激活蛋白-1(AP-1)和NF-κB,促进炎性反应因子如肿瘤坏死因子-α(TNF-α)、IL-6和IL-1等的分泌,引发炎性反应。本研究发现LPS刺激肝癌细胞株HepG2后,TLR4的表达在基因与蛋白水平明显提高,且在翻译与转录的水平保持一致,而经ST2825预处理后再加入LPS则TLR4表达无明显变化,提示肝癌细胞表面TLR4可以通过与其外源性配体LPS结合,活化依赖MyD88的TLR4信号传导通路,诱导众多炎症相关的特异基因的表达,从而使细胞分泌许多相关的炎症细胞因子,营造出有利于肿瘤生长的炎症微环境。
IL-23是IL-12家族成员之一,通过TLR4刺激DC和巨噬细胞诱导产生IL-23。许多研究显示诱导IL-23刺激Th细胞激活产生IL-17A,MyD88信号在CD4+T细胞缺乏损害了Th17细胞分化和IL-23信号,说明IL-17A和IL-23信号途径依赖MyD88[7]。坏死肝细胞释放高迁移率族蛋白1(HMGB1)刺激肝巨噬细胞产生IL-23其依赖TLR-4信号途径,IL-23帮助肝脏的γδ T细胞产生IL-17A。因此,TLR4通过上调巨噬细胞和γδT细胞的IL-23/17A轴从而促进中性粒细胞聚集,加重肝脏的炎症[8]。本研究发现,TLR4的外源性配体LPS可活化诱导肝癌HepG2细胞表达IL-23和IL-17A,其结果在基因和蛋白表达水平一致。阻断MyD88,与较单独LPS刺激HepG2细胞相比,IL-23和IL-17A的基因和蛋白表达明显下降。说明LPS-TLR4通路促进了肝癌HepG2细胞IL-23和IL-17A细胞因子的产生,参与或加重了肝癌炎症微环境的形成,从而促进肝癌细胞的生存、增殖和进展。
本研究结果说明,TLR4介导的信号转导通路可调控IL-23/IL-17A炎症轴,为肝癌的临床免疫治疗提供了一个有前途的干预策略,但调控的具体分子机制尚需本实验室后续更为详尽的研究。
[1] Arslanoglu A,Seyal AR,Sodagari F,et al.Current guidelines for the diagnosis and management of hepatocellular carcinoma:a comparative review[J].Am J Roentgenol,2016,4:1-11.
[2] Wang L,Zhu R,Huang Z,et al.Lipopolysaccharide-induced toll like receptor 4 signaling in cancer cells promotes cell survival and proliferation in hepatocellular carcinoma[J].Nature,2013,58:2223-2236.
[3] Burkett PR,Meyer zu Horste G,Kuchroo VK.Pouring fuel on the fire:Th17 cells,the environment,and autoimmunity[J].J Clin Invest,2015,125(6):2211-2219.
[4] Harris KM,Ramachandran G,Basu S,et al.The IL-23/Th17 axis is involved in the adaptive immune response to bacillus anthracis in humans[J].Eur J Immunol,2014,44(3):752-762.
[5] Xu M,Mizoguchi I,Morishima N,et al.Regulation of antitumor immune responses by the IL-12 family cytokines,IL-12,IL-23,and IL-27[J].Clinical & Dev Immunol,2010,107:832454.
[6] Grivennikov SI,Gretcn FR,Karin K.Immunity,inflammation,and cancer[J].Cell,2010,140:883-899.
[7] Chang J,Burkett PR,Borges CM,et al.MyD88 is essential to sustain mTOR activation necessary to promote T helper 17 cell proliferation by linking IL-1 and IL-23 signaling[J].Proc Natl Acad Sci,2013,110(6):2270-2275.
[8] Wang X,Sun R,Wei H,et al.High-mobility group box 1(HMGB1)-Toll-like receptor(TLR)4-interleukin(IL)-23-IL-17A axis in drug-induced damage-associated lethal hepatitis:interaction of γδ T cells with macrophages[J].Hepatology,2013,57(1):373-384.
Effect of LPS on the expression of TLR4,IL-23 and IL-17A in HepG2 cell line
KANGYuming1,SUGuoai2,ZHANGYanli3.
1.DepartmentofHepatobiliarySurgery,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China;2.BeijingRenheHospital,Beijing102600,China;3.LaboratoryofImmunology,BasicMedicineCollegeofNingxiaMedicalUniversity,Yinchuan750004,China
Correspondingauthor:ZHANGYanli,Email:wi_ntersweet@126.com
Objective To explore the effect of TLR4 agonist lipopolysaccharides (LPS)on the expression of interleukin -23 (IL-23)and IL-17A in HepG2 cell line,to analyze the mechanism of TLR4,IL-23 and IL-17A in carcinogenesis of hepatocellular carcinoma.Methods HepG2 cells were stimulated with LPS 24h,then treated HepG2 cells 8h with Myeloid differentiation factor 88 (MyD88)and inhibitors ST2825.The mRNA level of TLR4,IL-23 and IL-17A in HepG2 cells was detected by Q-PCR.The expression of TLR4,IL-23 and IL-17A was measured by Western-blot;The level of IL-23 was measured by ELISA at 12 h,24 h and 36 h.Results LPS promoted mRNA transcription level of TLR4,IL-23 and IL-17A in HepG2 cell lines and the protein expression of TLR4,IL-23,IL-17A,while ST2825 inhibited the expression of TLR4,IL-23,IL-17A.LPS enhanced the secreted level of IL-23 in different time-phase.Conclusion TLR4,IL-23 and IL-17A are involved in the occurrence and progress of hepatocellular carcinoma.
Hepatocellularcarcinoma;TLR4;IL-23;IL-17A
10.13621/j.1001-5949.2017.01.0006
宁夏自然科学基金资助项目(NZ14139)
1.宁夏医科大学总医院肝胆外科,宁夏 银川 750004 2.北京仁和医院,北京 102600 3.宁夏医科大学基础医学院,宁夏 银川 750004
康玉明(1972-),男,学士学位,主任医师,从事肝胆外科专业。
张艳丽,Email:wi_ntersweet@126.com
http://www.cnki.net/kcms/detail/64.1008.R.20170112.1708.022.html
R735.7
A
2016-08-17 [责任编辑]马兴忠

