利用酿酒酵母表达抗菌肽Lvcrunstin-B
黎 铭,何苹萍,陈 明,李丽萍,王 瑞,黄 婷,陈福艳,马春霞
(1.广西壮族自治区水产科学研究院/广西遗传育种与健康养殖重点实验室,广西 南宁 530021;2.广西壮族自治区兽医研究所,广西 南宁 530001)
利用酿酒酵母表达抗菌肽Lvcrunstin-B
黎 铭1,何苹萍1,陈 明1,李丽萍1,王 瑞1,黄 婷1,陈福艳1,马春霞2*
(1.广西壮族自治区水产科学研究院/广西遗传育种与健康养殖重点实验室,广西 南宁 530021;2.广西壮族自治区兽医研究所,广西 南宁 530001)
根据凡纳滨对虾抗菌肽Lvcrustin-B的核酸序列,采用PAS(PCR-based Accurate Synthesis)的方法合成Lvcrustin-B基因,通过双酶切及T4连接酶技术将Lvcrustin-B插入表达载体pYE-GAPα,获得重组酵母表达载体pYE-GAPα-Lvcrustin-B。pYE-GAPα-Lvcrustin-B经限制性内切酶AVr II线性化后,通过电穿孔法转化至毕赤酵母细胞GS115,并使用Zeocin进行抗性筛选,从而获得高拷贝转化子,筛选出的酵母菌转化子经扩大培养后使用YPD培养基进行诱导表达。PCR检测结果表明Lvcrustin-B基因被稳定整合至毕赤酵母染色体。SDS-PAGE电泳及WB实验显示,目的重组蛋白Lvcrustin-B可在毕赤酵母中表达,分子量大小为19.4 kD,且表达方式为可分泌性表达,重组菌最佳培养温度为30 ℃。
抗菌肽;凡纳滨对虾;GS115;蛋白表达
在我国,水产养殖是一个重要的产业,约束其可持续性发展的主要因素是病害问题:各种细菌或者病毒病经常引起鱼、虾大量死亡,从而给养殖业带来巨大的经济损失[1-2]。为了预防和控制鱼、虾病害发生,养殖户不得不大量使用池塘消毒化学药物或者在饲料中添加各种抗生素药物[3]。公众越来越意识到:大量使用化学药物或者抗生素类药物会严重破坏环境生态以及带来食品安全问题,因此,业内亟待开发无污染、无残留、安全有效的新型渔药用以代替化学或者抗生素类药物[4]。
抗菌肽(Antimicrobial peptides)又叫抗微生物多肽或肽抗生素,是生物细胞特定基因编码并由特定外界条件诱导产生的一类多肽[5]。抗菌肽在动、植物体内分布广泛,是天然免疫防御系统的重要组成部分[5-6]。与抗生素比较,抗菌肽有以下特点:可以抗革兰氏阳性菌和阴性菌,对寄生虫、真菌甚至病毒具有抵抗作用;分子量小,容易被吸收,杀菌作用迅速,不易产生耐药性;抗菌浓度小,浓度单位一般在μmol/L级水平。抗菌肽作为传统抗生素的替代物正越来越受到人们的关注,是目前国际学术研究的活跃领域之一[7]。
抗菌肽作为饲料添加剂具有较好的应用前景。抗菌肽能耐受饲料制粒时的高温,特别是利用酵母表达的抗菌肽经高温浓缩工序,可充分杀灭酵母菌体而不导致抗菌肽失活,产品应用后不出现工程菌扩散而导致的环境生态问题[8]。部分抗菌肽具有抵抗胃蛋白酶和胰蛋白酶的能力,使之不被胃肠道分解而进入机体发挥作用[8]。
抗菌肽在甲壳类动物饲料生产中具有广阔的应用前景。与脊椎动物不同,甲壳类动物不产生特异性抗体,其抵御病原入侵主要依赖非特异性免疫系统。凡纳滨对虾的非特异性免疫系统重要组分在抵御病原入侵过程中扮演重要角色[9-10]。据报道,凡纳滨对虾基因组含有大量抗病免疫基因,比如凝集素、抗菌肽、溶菌酶、过氧化物酶等,这些基因有的已经被应用于鱼虾抗病药物的开发[9-10]。
Lvcrustin-B是笔者在凡纳滨对虾中新发现的抗菌肽基因。本研究利用分子生物学方法构建该基因的真核表达载体,并转化酵母菌进行表达,旨在为Lvcrustin-B的生产应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂和耗材 pYE-GAPα质粒及TOP10菌株(本实验室保种),GS115(Life公司),Protein Marker(北京全式金),PVDF膜(美国Millipore公司),X光片(美国柯达公司),ECL显色液(中国普利莱公司),鼠抗His单抗(北京全式金),兔抗鼠HRP二抗(北京全式金),Acr、Bis、Tris等(Sigma公司),SDS(Amresco公司),Tryptone、Yeast Extract(购自OXOID公司),PCR反应管,0.22 μm无菌滤器和透析袋(购自Millipore公司),Ni2+IDA亲和层析胶(北京全式金公司),Agarose,DNA胶纯化试剂盒、质粒小提试剂盒(北京全式金公司),限制性内切酶(大连宝生物公司),常规生化试剂(均为国产分析纯)。
pYE-GAPα质粒(见图1)为环状双螺旋质粒,空载质粒含3080个碱基,含有1个博莱霉素筛选基因Zeocin,多克隆位点可以插入外源基因,多克隆位点上游含有6个组氨酸编码序列,因此所表达的蛋白含有由6个组氨酸组成的蛋白标签。
1.1.2 主要实验仪器 Allegra 21R台式高速冷冻离心机(美国BECKMAN公司),台式高速离心机(德国SORVAL公司),Biologic LP层析系统、Mini Protean II垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统(美国BIO-RAD公司),PTC-200基因扩增仪(美国MJ Research公司),320-S pH计(美国Mettler Toledo公司),AR5120电子天平(美国AHOM S公司),MultiTemp III恒温水浴锅、Hofer ΜV-25紫外透射仪(美国Amersham Pharmacia公司),雪花状制冰机(日本SANYO公司),JY92-2D超声波细胞粉碎机(中国新芝科器研究所),蛋白核酸检测仪(南京大学普阳科学仪器厂),Gene Pulser Xcell电穿孔系统(美国BIO-RAD),超净工作台(中国苏净集团),NANODROP2000(美国Thermo公司)。
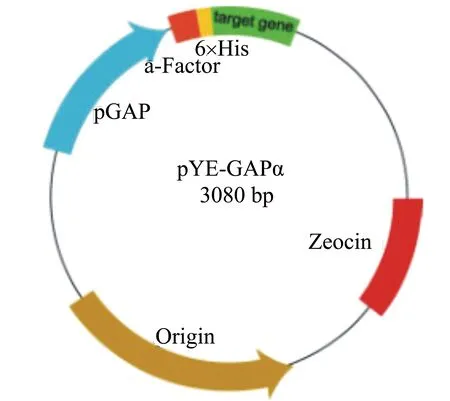
图1 pYE-GAPα质粒示意图
1.2 方法
1.2.1 pYE-GAPα-Lvcrustin-B质粒的构建 通过凡纳滨对虾转录组测序及分析结果获得Lvcrustin-B序列,采用PAS(PCR-based Accurate Synthesis)的方法合成基因Lvcrustin-B,使用双酶切(EcoR I和Xba I)对目的基因片段酶切产生特异接口,然后利用T4连接酶将酶切片段连接至pYE-GAPα载体相应位点,获得重组质粒pYE-GAPα- Lvcrustin-B。将重组质粒转化到大肠杆菌感受态细菌TOP10,将重组菌涂布到含有氨苄青霉素(终浓度为100 μg/mL)的LA平板,然后放置在37 ℃的恒温箱内培养,约18 h后挑取阳性菌落,放入LB液体培养基进行扩大培养。
1.2.2 pYE-GAPα-Lvcrustin-B质粒的提取及鉴定 取扩大培养菌液,放入1.5 mL离心管,以3000 r/min离心,抛弃上清,所得细菌沉淀用于质粒提取,提取方法参照质粒提取试剂盒(北京全式金)操作说明。将提取的质粒分成2份,取其中1份交由华大基因公司进行测序,1份进行双酶切(EcoR I和Xba I)鉴定,酶切鉴定方法参照限制性内切酶说明书(大连宝生物公司)。
1.2.3 pYE-GAPα-Lvcrustin-B电转酵母细胞GS115 冰浴电转杯,将10 μL线性化质粒pYE- GAPα-Lvcrustin-B加入到装有80 μL毕赤酵母感受态酵母细胞的1.5 mL EP管内,混匀后加入到直径为0.2 cm的电转化杯中,将310 μL等渗溶液加入到电转化杯中,然后把电转化杯冰浴5 min。电击条件为:电压1700 V、时间8 ms、电击2次。电击完成后,将1 mL冰上预冷的浓度为1 mol/L的山梨醇溶液加入到电击转化杯里,用枪头轻轻地吹打溶液,使之均匀。把电转化杯中的全部液体转移到新的2 mL EP管中,在30 ℃下静置培养2 h。分别吸取50、100和200 μL线性化质粒pYE-Lvcrustin-B-capsid的混合液,将其涂布于含有100 μg/mL Zeocin抗生素的YPD平板上,在30 ℃下恒温培养48 h,待平板长出菌落后,用接种环挑取平板上生长的单菌,将它接入到装有10 YPD液体培养基的试管中(抗生素Zeocin浓度为100 μg/mL),在30 ℃下以180 r/min震荡过夜培养。
1.2.4 PCR鉴定阳性克隆菌株 挑选6株阳性克隆,分别提取基因组DNA(编号分别为1、2、3、4、5、6),使用引物5′pGAP priming(5′pGAP-F:5′-GTCCCTATTTCAATCAATTGAA-3′)和3′AOX1 priming(3′AOX1:5′-GCAAATGGCATTCTGACATCC-3′)进行PCR扩增。
1.2.5 小试表达 取上述鉴定为阳性的表达菌株(3号菌株),将其接入装有9 YPD(抗生素Zeocin 200 μg/mL)的试管中,在30 ℃下以220 r/min培养24 h,然后取500 μL接入到50 YPD(抗生素Zeocin 200 μg/mL)液体培养基中,在30 ℃下以220 r/min培养,当培养时间达0、24、48、72、96 h时分别从培养基中取样,以10000 r/min离心2 min,收集上清液,使用SDS-PAGE电泳检测结果。
1.2.6 WB鉴定重组蛋白 取鉴定为阳性的表达菌株,加loading buffer,煮沸冷却后取20 μL上样。电泳条件:5%浓缩胶,90 V 30 min;10%分离胶,120 V 20 min。转膜:分别叠放好3层滤纸、SDS-PAGE胶和PVDF膜(PVDF膜事先需要用甲醇活化15 s左右),使用转膜仪进行湿法转膜,恒压100 V 60 min。封闭:用5%脱脂奶粉PBST溶液封闭膜,摇床37 ℃ 2 h,用PBS漂洗5 min。抗体孵育及染色(一抗为Mouse Anti-His mAb)。一抗孵育:抗体1∶500稀释,4 ℃过夜; PBST在37 ℃漂洗5 min×3。二抗孵育:抗体1∶1500稀释,37 ℃ 1 h;PBST在37 ℃漂洗5 min×4。曝光2 min,获取图像。
2 结果与分析
2.1 pYE-GAPα-Lvcrustin-B质粒的构建结果
基于PAS(PCR-based Accurate Synthesis)的方法合成基因Lvcrustin-B,通过克隆位点EcoR I和Xba I连入酵母表达载体pYE-GAPα,转入Top10克隆菌株,然后抽提阳性菌株质粒送华大基因公司测序。测序结果如图2所示,其中下划线区域为Lvcrustin-B基因区域,灰色区域为酶切位点。

图2 阳性菌株pYE-GAPα-Lvcrustin-B质粒的测序结果
将测序结果与设计的预期序列进行比对,比对结果显示两者100%匹配。截取部分比对序列,如图3所示。

图3 部分序列比对结果
2.2 pYE-GAPα-Lvcrustin-B酶切鉴定结果
用限制性内切酶EcoR I和Xba I对抽提得到的表达质粒pYE-GAPα-Lvcrustin-B进行酶切,酶切产物经琼脂糖凝胶电泳,结果见图4。

M为核酸分子量标尺Marker,由下至上各条带的大小分别为100、250、500、750、1000、1500、2000、3000、5000 bp;1为酶切后质粒;2为酶切前质粒。
图4 pYE-GAPα-Lvcrustin-B质粒酶切鉴定结果
2.3 将pYE-GAPα-Lvcrustin-B电转化至酵母细胞GS115
实验结果显示,培养品经48 h培养后长出多个白色菌落(图5)。

图5 pYE-GAPα-Lvcrustin-B电转化GS115的结果
2.4 PCR鉴定阳性克隆菌
挑选6株阳性克隆,分别提取基因组DNA,使用引物5′pGAP priming和3′AOX1 priming对目的基因进行PCR鉴定,结果显示均为阳性。PCR鉴定阳性克隆子,预期条带大小约1.0 kD(图6)。
2.5 小试表达SDS-PAGE电泳检测结果
SDS-PAGE电泳检测结果(图7)显示,培养24、48、72、96 h时菌株均有阳性,目的蛋白条带如箭头所示。
2.6 Lvcrustin-B蛋白WB鉴定结果
经Western blot验证,纯化的蛋白被抗his抗体识别,条带大小与预期相符,证明Lvcrustin-B表达成功(图8)。
3 讨论
作为先天防御系统的主要成分,抗菌肽具有广谱的生物学活性,杀菌迅速,不受传统抗生素耐药菌株的影响,与典型的抗生素具有协同作用的特点。随着对抗菌肽结构与功能的破译,以及基因工程等批量生产手段的出现,抗菌肽有望成为防治水产养殖主要病害的新型药物[11]。现有相关研究表明,将抗菌肽制剂添加到水产饲料中不仅可以提高水产动物的抗病免疫力,甚至还可以提高水产品质量,从而缓解水产养殖中细菌耐药性及水产品抗生素污染等问题。陈冰等在凡纳滨对虾的研究中发现,在一定添加水平范围内,家蝇抗菌肽能显著提高凡纳滨对虾的存活率、增重率、特定生长率[12]。王四新等研究发现,在饲料中添加100~150 mg/kg的凡纳滨对虾抗菌肽能显著提高草鱼的生长速度和相对增重率,而添加150 mg/kg天蚕素抗菌肽对草鱼存活率和肥满度的提高效果不明显[13]。林鑫等(2013年)将饲喂添加抗菌肽饲料的锦鲤感染维氏气单胞菌,10 d后其累积死亡率显著降低,充分证实口服抗菌肽可以显著提高锦鲤的抗病能力[14]。

M为DNA Marker,从下到上各条带的大小分别为100、250、500、750、1000、2000 bp;1~6为阳性克隆子PCR条带。
图6 PCR鉴定阳性克隆菌的结果

M: protein marker; 1、2、3、4、5: pGAPZaA-Lvcrustin-B-capsid转化GS115菌株分别培养0、24、48、72、96 h。
图7 小试表达SDS-PAGE电泳检测结果
尽管至今有数千种天然抗菌肽已经被发现,但目前可应用于生产实践的相关产品比较少,重要原因在于抗菌肽工业化生产技术有待突破。抗菌肽最初是直接从动植物组织中提取获得的,由于其分子量小、组织中含量低,因此分离提纯存在一定的困难。化学合成抗菌肽可以实现规模化生产,但目前使用该方法成本较高,目前国内肽合成价约150元/mg , 而多肽作为药物广泛应用的社会可承受价格上线为10美元/mg。小于10个氨基酸残基的多肽合成较为经济,大于10 个残基的多肽合成成本较高[15],同时由于缺乏天然化学修饰,其活性也难以保证。所以通过基因工程在微生物中直接表达抗菌肽基因是最佳方案。本研究利用毕赤酵母GS115成功表达了对虾抗菌肽Lvcrustin-B,与动植物组织提取法、化学合成方法相比,其操作简便,生产成本较低,非常适用于未来的大规模发酵生产。

M: protein marker;1:空白对照;2~5:不同浓度的Lvcrustin-B蛋白样品。
图8 Lvcrustin-B蛋白WB鉴定结果
利用基因工程方法在微生物中表达抗菌肽有两种方法,一种是原核表达方法,另外一种是真核表达方法。这两种方法各有优点:原核表达方法的表达量比较高,但是不具有真核生物的基因表达调控机制和蛋白质翻译后加工修饰能力,其产物往往形成没有活性的包涵体,须经过变性、复性等处理才能应用,某些表达菌内毒素含量高,表达产物需要经过严格的纯化处理;利用真核表达方法在微生物中表达抗菌肽时,由于经过真核细胞内特有的各种化学修饰,因此表达出来的抗菌肽活性较高,利用酵母菌表达还可以避免内毒素的出现,但缺点是表达载体构建较为困难,有些重组蛋白不适合在真核细菌中表达,因此表达量较低[16-17]。本研究利用毕赤酵母GS115表达对虾抗菌肽Lvcrustin-B,在30 ℃下以220 r/min培养24 h后,取发酵液离心后的上清液进行SDS电泳及Western blot分析,发现从24 h开始就检测到有重组蛋白的存在,而且随着培养时间的延长,重组蛋白的含量越来越高,说明利用毕赤酵母GS115表达Lvcrustin-B是可行的,而且分泌表达更有利于表达产物的提纯。以往有不少研究利用酵母菌表达重组蛋白,往往需要甲醇的诱导,因此表达产物中可能存在着甲醇的残留,因此表达产物需要进一步提纯去除甲醇成分才能作为药物或者添加剂使用。本研究采用pYE-GAPα质粒构建重组表达载体,实验结果表明,该载体转化的酵母菌不需要甲醇诱导即可表达,更有利于今后表达产物的使用。
[1] 吴淑勤,王亚军.我国水产养殖病害控制技术现状与发展趋势[J].中国水产,2010(8):9-10.
[2] 卓然江,蔡小琴,洪徐鹏,等.南美白对虾“偷死病”的病因分析及防治措施[J].科学养鱼,2015(8):58-59.
[3] 唐江芳.水产药物残留的研究现状[J].南方农业,2007(1):39-41,52.
[4] 潘葳,罗钦,刘文静,等.水产品与水产饲料中药物残留问题的分析及对策[J].福建农业学报,2011(6):1096-1100.
[5] 牛德料,孟日增,刘彩侠.抗菌肽的研究进展[J].江西饲料,2013(3):21-24.
[6] 孙龙.两种鞘翅目昆虫抗菌肽的分离纯化与活性研究[D].北京:中国林业科学研究院,2012.
[7] 胡梦红,王有基.传统抗生素替代物抗菌肽在水产养殖中的应用前景[J].北京水产,2007(1):47-49.
[8] 李莉蓉.以DNA为靶标的抗菌肽设计及抑菌机制研究[D].无锡:江南大学,2013.
[9] 于爱清.虾蟹类免疫相关基因的研究[D].上海:华东师范大学,2014.
[10] 罗展.凡纳滨对虾两种C-型凝集素的基因克隆和功能研究[D].北京:中国科学院研究生院海洋研究所,2010.
[11] 李晓华,陶冉,孙杰.对虾抗菌肽的研究进展及其在水产养殖业的应用前景[J].安徽农业科学,2009(1):167-168.
[12] 陈冰,曹俊明,陈平洁,等.家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响[J].中国水产科学,2010(2):258-266.
[13] 王四新,季海峰,刘辉,等.抗菌肽对草鱼生长性能的影响[J].饲料研究,2011(4):29-31.
[14] 林鑫,毛述宏,杨阳,等.饲料中添加抗菌肽对锦鲤生长、非特异性免疫力和抗病力的影响[J].动物营养学报,2013(8):1860-1865.
[15] 孔凡红,仲维霞,崔勇,等.生物抗菌肽毕赤酵母表达系统研究进展[J].中国病原生物学杂志,2009(9):700-702.
[16] 刘晓明,姜宁,张爱忠,等.杂合抗菌肽在毕赤酵母中的表达及其活性测定[J].中国生物工程杂志,2016(2):81-89.
[17] 刘忠渊.利用毕赤酵母系统表达功能蛋白的研究[D].乌鲁木齐:新疆大学,2004.
(责任编辑:黄荣华)
Expression ofLitopenaeusvannameiAntimicrobial Peptide Lvcrunstin-B inPichiapastoris
LI Ming1, HE Ping-ping1, CHEN Ming1, LI Li-ping1, WANG Rui1,HUANG Ting1, CHEN Fu-yan1, MA Chun-xia2*
(1. Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture, Nanning 530021, China; 2. Guangxi Veterinary Research Institute, Nanning 530001, China)
According to the nucleotide sequence of antimicrobial peptide Lvcrunstin-B inLitopenaeusvannamei, the method of PAS (PCR-based Accurate Synthesis) was used for the synthesis of gene Lvcrustin-B. The synthetic gene Lvcrustin-B was doubly digested by EcoR I and Xba I, then it was ligated into the expression vector pYE-GAPα by using T4 ligase method, and the obtained recombinant yeast expression vector was named as pYE-GAPα-Lvcrustin-B. The plasmid pYE-GAPα-Lvcrustin-B was transformed intoPichiapastorisGS115 through electroporation method after linearizing by AVr II method. The transformants were screened according to their resistance to Zeocin, and then high-copy transformants were obtained. After being cultivated in a large-scale, the screened yeast transformants were induced to express with YPD medium. The results of PCR testing showed that the gene Lvcrustin-B had been steadily integrated into the chromosome ofPichiapastoris. The results of SDS-PAGE electrophoresis and Western blot experiment confirmed that the recombinant target protein Lvcrustin-B could express in a secretory manner in the yeast GS115, its molecular weight was 19.4 kD, and the optimum culture temperature for the recombinant yeast was 30 ℃.
Antimicrobial peptides;Litopenaeusvannamei; GS115; Protein expression
2016-08-31
广西水产畜牧科技推广应用项目(桂渔牧科201528012);广西科学基金项目(2015GXNSFAA139067)。
黎铭(1980─),副研究员,主要从事海洋生物研究工作。*通讯作者:马春霞。
TQ927
A
1001-8581(2017)02-0009-05

