自发性高血压大鼠外周血淋巴细胞连接蛋白43与炎性因子表达水平的相关性研究
王 爱,潘立君,于秀石,李 丽,司军强,马克涛*,李新芝
·论著·
自发性高血压大鼠外周血淋巴细胞连接蛋白43与炎性因子表达水平的相关性研究
王 爱1,2,潘立君3,于秀石1,2,李 丽1,2,司军强1,2,马克涛1,2*,李新芝1,4
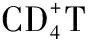
高血压;连接蛋白43;炎症;淋巴细胞
王爱,潘立君,于秀石,等.自发性高血压大鼠外周血淋巴细胞连接蛋白43与炎性因子表达水平的相关性研究[J].中国全科医学,2017,20(2):177-181.[www.chinagp.net]
WANG A,PAN L J, YU X S,et al.Correlation between connexin 43 in peripheral blood lymphocytes and expression level of inflammatory factors among spontaneously hypertensive rats[J].Chinese General Practice,2017,20(2):177-181.
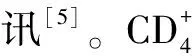
1 材料与方法
1.1 材料
1.1.1 实验动物 于2015年4月—2016年4月,选取自发性高血压(SH)大鼠和正常血压的Wistar京都(WKY)大鼠各20只,16~18周龄,雄性,体质量150~220 g,均购自北京维通利华实验动物技术有限公司(许可证编号SCXK京2007-0001),已达到清洁级标准,动物质量为一级标准。饲养环境要求:良好通风、空气过滤系统,环境安静,室温保持20 ℃、湿度控制在45%左右,每日更换垫料和饮用水,自由摄取水和食物。
1.1.2 仪器及试剂 流式细胞仪(E6)购自深圳迈瑞生物医疗电子股份有限公司,水浴锅(H216)购自上海博讯实业有限公司,低速大容量离心机(LC-4016)购自安徽中科中佳科学仪器有限公司,相差倒置显微镜(XD30)购自宁波舜宇仪器有限公司,生物安全柜(BHC-1300ⅡA2)购自阿尔泰实验室设备(北京)有限公司,CO2恒温培养箱(HF151)购自上海力申科学仪器有限公司,凝胶成像仪(BioDoc Imaging)购自美国UVP公司,梯度PCR仪〔TC-96/G/H(b)C〕购自杭州博日科技有限公司,酶标仪、微量分光光度计(K5500)购自北京凯奥科技发展有限公司,荧光定量PCR仪(TIB-8000)购自泰普生物科学(中国)有限公司。
别藻青蛋白(allophycocyanin,APC)标记小鼠抗大鼠CD4抗体(B159112)、藻红蛋白(phycoerythrin,PE)标记小鼠抗大鼠CD8a抗体(B166485)、PE标记IgG1、кIsotype Ctrl同型对照(B179044)均购自Bio Legend公司,小鼠来源抗大鼠Anti-Cx43(ab-79010)购自Abcam公司,山羊抗小鼠IgG/异硫氰酸荧光素(FITC)标记二抗(ZF-0312)购自北京中杉金桥生物科技有限公司,大鼠白介素(IL)-2(230240922)、IL-6(230641023)酶联免疫吸附试验(ELISA)试剂盒均购自杭州联科生物技术股份有限公司,淋巴细胞分离液(LTS10770125)购自天津灏洋生物制品科技有限责任公司,RPMI 1640培养基(1279443)购自美国Gibco公司,Concanavalin A(C-2010)购自美国Sigma公司,缝隙连接阻断剂Gap27(A1045)购自Apexbio公司,实时荧光定量PCR试剂购自北京庄盟国际生物基因科技有限公司,Trizol购自life technologies公司,引物序列由生工生物工程(上海)股份有限公司设计合成。
1.2 方法
1.2.1 大鼠血压测定 应用BP-6无创血压监测仪测量大鼠尾动脉血压,避免大鼠躁动,于大鼠清醒安静状态下连续测量3次,每次间隔至少1 min,测量3次取平均值即为大鼠收缩压。
1.2.2 样本采集 3%戊巴比妥钠麻醉大鼠,乙二胺四乙酸(EDTA)抗凝管采集腹主动脉外周血5 ml,1 500 r/min离心5 min(离心半径20 cm),取血浆于-20 ℃保存,离心后的下层血细胞用于分离外周血淋巴细胞。
1.2.3 炎性因子IL-2和IL-6表达 取冻存于-20 ℃的血浆样品,ELISA法检测IL-2和IL-6表达水平,操作严格按照试剂盒说明书进行。
1.2.4 淋巴细胞分离 将血细胞与0.9%氯化钠溶液1∶1等体积稀释,吹打混匀。取无菌15 ml离心管,加入淋巴细胞分离液,将淋巴细胞悬液缓慢按照1∶1比例加到淋巴细胞分离液上层,保证血液置于淋巴细胞分离液上层。根据密度梯度离心法分离淋巴细胞,低速离心机水平离心30 min(1 500 r/min,缓升缓降,离心半径20 cm)。将分离的白色浑浊淋巴细胞层吸出至无菌15 ml离心管内,加入3倍体积0.9%氯化钠溶液洗涤,以1 800 r/min离心6 min(离心半径20 cm)。洗涤2次,弃上清液,沉淀即淋巴细胞。加入1 ml培养基重悬,吸取50 μl到1.5 ml离心管,加450 μl磷酸盐缓冲液(PBS)稀释10倍,显微镜下计数并用锥虫蓝染色观察淋巴细胞活性。淋巴细胞活性为95%以上,调整淋巴细胞浓度为1×106个/ml,将淋巴细胞接种在24孔板中。
1.2.6 实时荧光定量PCR检测IL-2 mRNA和IL-6 mRNA表达 计数分离出的淋巴细胞,调整培养基至淋巴细胞浓度为1×106个/ml。将淋巴细胞分为空白对照组、刀豆蛋白A(Concanavalin A,ConA)组(培养48 h后加入5 μg/ml ConA)和Gap27+ConA组(培养前加入500 μmol/L Gap27,培养48 h后加入5 μg/ml ConA)。加入10%自体血清(血清处理步骤:56 ℃灭活30 min,以4 000 r/min离心30 min,离心半径20 cm,4 ℃保存),于37 ℃,5% CO2培养箱中培养48 h。
Trizol法提取上述培养的淋巴细胞mRNA,核酸蛋白含量检测仪测定A260/A280值,1%甲醛溶液变性凝胶电泳检测提取淋巴细胞mRNA的质量。选用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,GAPDH引物序列:上游:5′-CTCTCTGCTCCTCCCTGTTC-3′,下游:5′-GCCAAATCCGTTCACACCG-3′;IL-2引物序列:上游:5′-ACGCTTGTCCTCGCTA-3′,下游:5′-GCACCTGTAAGTCCAGCAAC-3′; IL-6引物序列:上游:5′-TTGGGACTGATGTTGTTGAC-3′,下游:5′-TGTGGGTGGTATCCTCTGT-3′。将提取的mRNA样品、随机引物、Rtmix、dNTP混合液、焦碳酸二乙酯(DEPC)按照反转录体系配制反应体系,按照37 ℃反转录60 min,90 ℃灭活反转录酶5 min的反应程序进行反转录合成cDNA。将2×QuantiNova SYBR Green PCR Master Mix,10×miScript Nucleics Mix通用引物,模板cDNA和RNase-Free water置于冰上,并轻轻混匀,配制反应体系,按照95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火、延伸10 s,40个循环设置Bio-Rad荧光定量PCR仪,记录IL-2 mRNA与IL-6 mRNA相对表达水平。
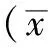
2 结果
2.1SH和WKY大鼠收缩压比较SH大鼠收缩压为(211±15)mmHg(1mmHg=0.133kPa),高于WKY大鼠的(122±5)mmHg,差异有统计学意义(t=25.22,P<0.01)。
2.2SH和WKY大鼠炎性因子表达水平比较SH大鼠IL-2表达水平为(152.40±29.62)pg/ml,高于WKY大鼠的(73.41±20.16)pg/ml,差异有统计学意义(t=7.24,P<0.05);SH大鼠IL-6表达水平为(29.74±1.90)pg/ml,高于WKY大鼠的(22.58±1.06)pg/ml,差异有统计学意义(t=14.72,P<0.05)。
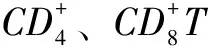
2.4 各组淋巴细胞IL-2mRNA、IL-6mRNA相对表达水平比较SH大鼠各组淋巴细胞IL-2mRNA、IL-6mRNA表达水平比较,差异均有统计学意义(P<0.05),其中ConA组IL-2mRNA、IL-6mRNA表达水平均高于空白对照组和Gap27+ConA组,Gap27+ConA组IL-6mRNA表达水平低于空白对照组,差异有统计学意义(P<0.05)。WKY大鼠各组淋巴细胞IL-6mRNA表达水平比较,差异无统计学意义(P>0.05)。WKY大鼠各组淋巴细胞IL-2mRNA表达水平比较,差异有统计学意义(P<0.05),其中ConA组IL-2mRNA表达水平高于空白对照组和Gap27+ConA组,差异有统计学意义(P<0.05,见表1)。
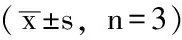
Table 1 Comparison of the expression levels of IL-2 and IL-6 mRNA among different groups of SH rats and WKY rats
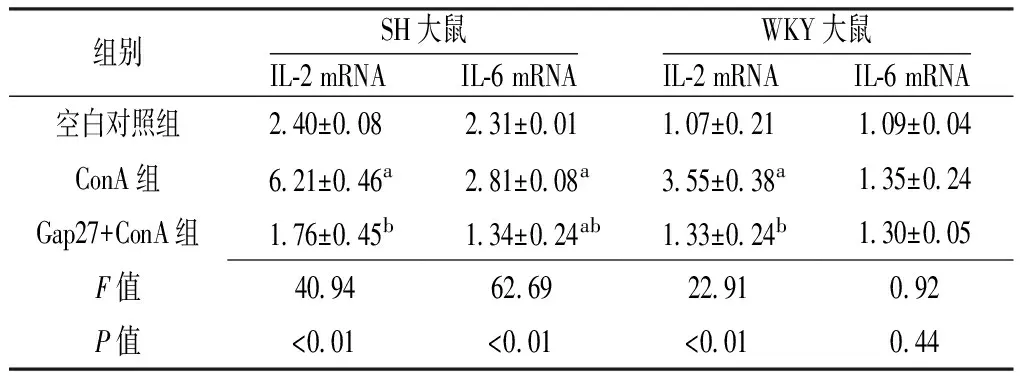
组别SH大鼠IL⁃2mRNA IL⁃6mRNAWKY大鼠IL⁃2mRNA IL⁃6mRNA空白对照组240±008231±001107±021109±004ConA组621±046a281±008a355±038a135±024Gap27+ConA组176±045b134±024ab133±024b130±005F值409462692291092P值<001<001<001044
注:SH=自发性高血压,WKY大鼠=Wistar京都大鼠,IL-2=白介素2,IL-6=白介素6,ConA=刀豆蛋白A;与空白对照组比较,aP<0.05;与ConA组比较,bP<0.05
3 讨论
WAKI等[8]研究发现,高血压模型动物脑干中细胞因子表达上调,炎性细胞可影响其血压的调节。血管紧张素Ⅱ可刺激大鼠神经中枢,活化T淋巴细胞,加重高血压进展[9]。炎性因子主要由免疫细胞释放,参与调节机体免疫反应,在细胞增殖、分化、免疫修复等过程中发挥主要作用[10]。MADHUR等[11]研究表明,原发性高血压病患者血清C反应蛋白、肿瘤坏死因子α和IL-6等炎性因子水平与血压升高呈正相关。本实验结果显示,SH大鼠炎性因子IL-2和IL-6表达水平均高于WKY大鼠,与既往研究[12]一致,提示SH与炎性反应关系密切。
Gap27作为特异性缝隙连接阻断剂,可能作用于Cx细胞膜第二胞外环,阻断三磷腺苷(ATP)释放和钙离子内流,发挥阻断作用[17]。OVIEDO-ORTA等[18]研究发现,缝隙连接参与调节淋巴细胞与巨噬细胞间信号传递,并且在炎性因子刺激下,单核细胞Cx43表达上调[4]。本研究发现,Gap27可使T淋巴细胞炎性因子IL-2 mRNA和IL-6 mRNA表达下调。NIGER等[19]研究发现,缝隙连接影响炎性因子和免疫球蛋白的分泌,本研究结果与其相符,提示缝隙连接阻断剂可能通过改变Cx43通道结构或抑制细胞内钙离子浓度进而改变通道通透性[20],从而影响炎性因子的释放。
综上所述,SH大鼠伴随炎性反应,炎性因子释放增加,同时构成T淋巴细胞间缝隙连接通道的Cx43表达显著上调,应用缝隙连接阻断剂阻断T淋巴细胞间信息通讯后炎性因子的释放显著下降,提示缝隙连接参与高血压炎性反应,具体机制有待进一步研究。
作者贡献:王爱、李丽、司军强、马克涛进行课题设计与实施、资料收集整理、成文并对文章负责;潘立君、于秀石、李新芝进行课题设计与实施、评估、资料收集整理;马克涛进行质量控制及审校。
本文无利益冲突。
[1]ARIMA H,MURAKAMI Y,LAM T H,et al.Effects of prehypertension and hypertension subtype on cardiovascular disease in the Asia-Pacific Region[J].Hypertension,2012,59(6):1118-1123.
[2]SCHECKENBACH K E,CRESPIN S,KWAK B R,et al.Connexin channel-dependent signaling pathways in inflammation [J].J Vasc Res,2011,48(2):91-103.
[3]TITTARELLI A,MENDOZA-NARANJO A,FARAS M,et al.Gap junction intercellular communication regulate NK cell activation and modulate NK cytotoxic capacity[J].J Immunol,2014,192(3):1313-1319.
[4]MATSUE H,YAO J,MATSUE K,et al.Gap junction-mediated intercellular communication between dendritic cells(DCs) is required for effective activation of DCs[J].J Immunol,2006,176(1):181-190.
[5]GLASS A M,SNYDER E G,TAFFET S M.Connexins and pannexins in the immune system and lymphatic organs[J].Cell Mol Life Sci,2015,72(15):2899-2910.
[8]WAKI H,GOURAUD S S,MAEDA M,et al.Evidence of specific inflammatory condition in nucleus tractus solitarii of spontaneously hypertensive rats[J].Exp Physiol,2010,95(5):595-600.
[9]MARVAR P J,HARRISON D G.Stress-dependent hypertension and the role of T lymphocytes[J].Exp Physiol,2012,97(11):1161-1167.
[10]SAADOUN D,GARRIDO M,COMARMOND C,et al.Th1 and Th17 cytokines drive inflammation in Takayasu arteritis[J].Arthitis Rheumatol,2015,67(5):1353-1360.
[11]MADHUR M S,HARRISON D G.Synapses,signals,CDs,and cytokines:interactions of the autonomic nervous system and immunity in hypertension[J].Circ Res,2012,111(9):1113-1116.
[12]YU H T,PARK S,SHIN E C,et al.T cell senescence and cariovascular diseases[J].Clin Exp Med,2016,16(3):257-263.
[13]TAKEUCHI H,SUZUMURA A.Gap junction and hemichannels composed of connexins:potential therapeutic targets for neurodegenerative diseases[J].Front Cell Neurosci,2014,8:189.
[14]PONCE A,LARRE I,CASTILLO A,et al.Ouabain increases gap junctional communication in epithelial cells[J].Cell Physiol Biochem,2014,34(6):2081-2090.
[15]RAJNAI H,TELEKI L,KISZNER G,et al.Connexin 43 communication channels in follicular dendritic cell development and in follicular lymphomas[J].J Immunol Res,2015,2015:528098.
[16]KUCZMA M,LEE J R,KRAJ P.Connexin 43 signaling enhances the generation of Foxp3+regulatoty T cells[J].J Immunol,2011,187(1):248-257.
[17]CHEN G,PARK C K,XIE R G,et al.Connexin-43 induces chemokine release from spinal cord astrocytes to maintain late-phase neuropathic pain in mice[J].Brain,2014,137(Pt 8):2193-2209.
[19]NIGER C,HOWELL F D,STAINS J P.Interleukin-1 beta increases gap junctional communication among synovial fibroblasts via extracellular-signal-regulated kinase pathway[J].Biol Cell,2009,102(1):37-49.
[20]MENDOZA-NARANJO A,SAÉZ P J,JOHANSSON C C,et al.Functional gap junctions facilitate melanoma antigen transfer and cross-presentation between human dendritic cells[J].J Immunol,2007,178(11):6949-6957.
本文链接:
——连接蛋白43
细胞连接通讯是动物体内细胞通讯的主要方式之一,其发挥细胞之间信息传递功能的结构基础是细胞间隙连接,而细胞间隙连接的主要结构成分是连接蛋白。对于细胞间信息传递、细胞的生长、分化、维持心肌节律性同步收缩具有重要的意义。连接蛋白家族是一组高度相关的蛋白质家族,每一个蛋白均是一种基因的产物。目前已发现十几种连接蛋白,其中连接蛋白43是由总跨度为2768碱基对的三条互补脱氧核苷酸所编码的含有387氨基酸的单肽。连接蛋白43在维持正常心律的电生理中起重要作用,连接蛋白43是主要的间隙连接蛋白也是心室肌细胞主要连接蛋白。连接蛋白43与心律失常、分娩、肿瘤等的发生密切相关,随着研究的进一步深入,从分子水平、基因转录等着手,更进一步阐述其致病机制,可能为临床的诊断和治疗提供新的理论依据。
(本文编辑:吴立波)
Correlation between Connexin 43 in Peripheral Blood Lymphocytes and Expression Level of Inflammatory Factors among Spontaneously Hypertensive Rats
WANGAi1,2,PANLi-jun3,YUXiu-shi1,2,LILi1,2,SIJun-qiang1,2,MAKe-tao1,2*,LIXin-zhi1,4
1.KeyLaboratoryforXinjiangEndemicandEthnicDiseasesoftheEducationMinistryofChina,MedicalCollegeofShiheziUniversity,Shihezi832002,China2.DepartmentofPhysiology,MedicalCollegeofShiheziUniversity,Shihezi832002,China3.UrumqiPetrochemicalCompanyofChinaWorkerHospital,Urumqi830019,China4.DepartmentofPhysiologyandPathology,MedicalCollegeofShiheziUniversity,Shihezi832002,China
*Correspondingauthor:MAKe-tao,Professor;E-mail:maketao@hotmail.com
Hypertension; Connexin 43; Inflammation; Lymphocytes
国家自然科学基金资助项目(31260247,81460098,81560081,81660271);石河子大学杰出青年人才培育计划项目(2012ZRKXJQ01);石河子大学高层次人才科研启动计划(RCZX201449)
R 544.1
A
10.3969/j.issn.1007-9572.2017.02.011
2016-03-08;
2016-10-09)
1.832002新疆石河子市,石河子大学医学院新疆地方与民族高发病教育部重点实验室
2.832002新疆石河子市,石河子大学医学院生理学教研室
3.830019新疆乌鲁木齐市,中国石油乌鲁木齐石化公司职工医院
4.832002新疆石河子市,石河子大学医学院病理生理学教研室
*通信作者:马克涛,教授;E-mail:maketao@hotmail.com

