血红素加氧酶1在斑马鱼低氧应激中的保护作用研究
李艳丽徐功玉肖金文李 志赵浩斌周青春桂建芳钟雪萍
(1. 华中师范大学生命科学学院, 湖北省遗传调控与整合生物学重点实验室, 武汉 430079;
2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
血红素加氧酶1在斑马鱼低氧应激中的保护作用研究
李艳丽1徐功玉1肖金文1李 志2赵浩斌1周青春1桂建芳2钟雪萍1
(1. 华中师范大学生命科学学院, 湖北省遗传调控与整合生物学重点实验室, 武汉 430079;
2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
实验探讨了低氧条件下血红素加氧酶1(Ho1)对斑马鱼的保护作用。Real-time PCR结果显示, 低氧条件下斑马鱼ho1 mRNA水平在斑马鱼胚胎和离体培养细胞ZF4中显著增加, 而在成鱼的不同组织中呈现不同的反应。低氧处理24h后, 斑马鱼脑、鳃和肝脏中ho1 mRNA表达量明显上升, 而在心脏和肾脏中ho1 mRNA表达量显著降低。用锌原卟啉IX(ZnPPIX)抑制ZF4细胞ho1的表达, 采用CCK8试剂盒检测细胞存活率, 结果显示抑制ho1表达可导致低氧条件下ZF4细胞存活率明显降低。利用Hoechst染色和caspase 3活性检测发现, 在低氧条件下抑制ho1表达后ZF4细胞的凋亡率较对照组显著增加, 而Ho1的诱导剂可显著降低低氧条件下抑制组的细胞凋亡率。这些结果表明斑马鱼Ho1可能通过抗细胞凋亡发挥低氧保护作用。
斑马鱼; 血红素加氧酶1; 低氧; 细胞活力; 细胞凋亡
血红素加氧酶1(Ho1)是催化血红素降解形成胆绿素、一氧化碳(CO)和游离铁(Fe2+)的起始酶和限速酶, 其催化产物胆绿素又可被胆绿素还原酶还原生成胆红素。Ho1亦称热休克蛋白32(Hsp32), 可被血红素、重金属、氧化应激、紫外照射、炎症介质和某些生长因子等诱导表达[1,2]。人和脊椎动物的血红素加氧酶1及其催化产物可通过抗氧化、抗炎、抗细胞凋亡等方式对组织细胞起保护作用。有研究表明, 敲除血红素加氧酶1基因的人胚胎纤维原细胞对高铁血红素和过氧化氢暴露导致的氧化损伤高度敏感, 细胞存活率显著降低[3]。在人肺上皮细胞中超表达小鼠血红素加氧酶1, 人肺上皮细胞细胞生长停滞, 抗氧化损伤能力明显增强[4]。血红素加氧酶1转基因小鼠在肺部特异性超表达血红素加氧酶1, 可保护肺器官免于低氧暴露导致的高血压和炎性反应[5]。近年来, 研究发现血红素加氧酶1参与多种生理和病理过程中细胞对低氧的适应性调节作用。在人类多种肿瘤细胞中血红素加氧酶1表达量较高, 且其表达量与实体肿瘤的生长密切相关。此外, 血红素加氧酶1的诱导表达可显著降低低氧/复氧、低氧缺血、缺血/再灌注对人和小鼠脑、肾、肝、肺和心脏等器官造成的损伤[6—8]。但是, 目前血红素加氧酶1在鱼类低氧应激中的生物学功能尚不清楚。
水体低氧是指在池塘、水库、湖泊、河口及近海季节性发生的、水中溶解氧低于2 mg/L的一种自然现象。水体富营养化可导致低氧现象频繁发生。低氧环境影响鱼类的生存、生长和繁殖[9,10]。某些耐低氧鱼类在长期的进化中获得了一些低氧适应机制, 可通过低氧诱导因子(Hypoxia inducible factor, HIF)信号途径调节大量低氧应答基因的转录, 从而调节机体对低氧的生理反应, 增强细胞或组织对于缺氧的耐受性[11,12]。有研究表明斑马鱼胚胎在缺氧状态下能够存活24h[13]。斑马鱼成鱼在极端低氧长时间处理后出现鳃片数目减少、表面积增加以利于氧的摄取[14]。斑马鱼的胚胎和成鱼在低氧状态下基因和蛋白质的表达都会发生变化,以调整体内代谢适应低氧环境[14,15]。因此, 利用斑马鱼这一理想的发育、遗传和毒理研究模型, 可系统地分析ho1基因在鱼类低氧应激中的生物学功能。在本文中我们研究了斑马鱼ho1基因在低氧条件下的表达特征, 然后初步探讨了Ho1在斑马鱼低氧应激中的功能。
1 材料与方法
1.1 实验材料
斑马鱼由本实验室饲养。取健康、性成熟的斑马鱼, 于饲养系统关灯前将雌雄按1∶2的比例放入产卵缸内。次日给光后拿掉挡板, 让其完成交配和产卵。收集、挑选正常发育的胚胎进行培养, 培养温度为28℃, 光周期为明14h∶暗10h。斑马鱼胚胎成纤维细胞(Zebrafish embryonic fibroblasts, ZF4)由中国科学院水生生物研究所崔宗斌研究员惠赠, 用辅加10%胎牛血清的DMEM/F12(1∶1)培养基于28℃细胞培养箱中培养, 每3—4天按1∶1.5的比例传代一次。
1.2 实验方法
低氧处理将斑马鱼ZF4细胞或处于不同发育阶段的胚胎置于低氧培养箱中用1%或5% O2处理不同的时间。向装有曝气水的广口瓶中冲入高纯氮气, 至水中溶解氧浓度为1.5 mg/L, 然后将斑马鱼成鱼置于瓶中培养。在完成低氧处理后, 收取样品, 液氮速冻, 储存于-80℃冰箱备用。
Real-time PCR检测ho1基因的表达收集经低氧处理的ZF4细胞、斑马鱼胚胎或各组织, 用Trizol法提取总RNA, 具体步骤按照试剂盒说明书进行。用DNaseⅠ酶解可能残余的基因组DNA。用1%琼脂糖凝胶电泳鉴定所提取的RNA的完整性。紫外分光光度法测定RNA样品的浓度和纯度。取各种RNA用逆转录酶Powerscrit和oligo (dT)合成第一链模板cDNA, 然后以cDNA作为模板进行Realtime PCR。以斑马鱼β-actin基因作为参照。ho1基因Real-time RCR反应体系为: SYBR Green Mix 10 μL, DEPC H2O 1 μL, 上、下游引物(F、R)(10 mol/L)各0.5 μL, 模板cDNA 8 μL, 总体积为20 μL。PCR反应条件为: 95℃预变性3min; 95℃ 10s, 58℃ 30s, 72℃30s, 35个循环。在每一个循环最后要设一个读板温度, 这一般根据目的基因情况而定。每一个样品重复3次, 每个基因的表达量以β-actin为参照用2-∆∆Ct方法[16,17]进行数据处理及分析。
细胞活力检测将ZF4细胞以1×104cells/well的浓度接种在96孔板上, 待细胞长到一定密度, 换用无血清培养基培养。实验共设置了10组, 其中5组用于锌原卟啉IX (ZnPPIX)抑制实验: 在无血清培养基中加入Ho1的抑制剂ZnPPIX使其终浓度为0、5、10、15、20 μmol/L, 每组设定4个重复。待细胞在无血清培养基中培养2h后用1% O2低氧处理36h, 然后利用CCK8试剂盒测定其细胞活力。另外5组用于Hemin回复实验: 各组细胞先用10 μmol/L的ZnPPIX溶液预处理1h, 然后在无血清培养基中加入Ho1的诱导剂血红素(Hemin)使其终浓度为0、5、10、20 μmol/L, 每组设定4个重复。待细胞在无血清培养基中培养1h后用1% O2低氧处理36h, 然后利用CCK8试剂盒测定各组细胞的细胞活力。
Hochest染色实验共设置了4组, 常氧组、低氧组、ZnPPIX+低氧组、ZnPPIX+Hemin+低氧组。ZnPPIX和Hemin的浓度均为10 μmol/L。在六孔板中铺上无菌盖玻片, 然后种入细胞, 待细胞贴壁后换用无血清培养基并加药。药物处理2h后, 除常氧组外, 其余各组均低氧处理48h。吸去培养基,然后加入500 μL固定液, 室温固定15min。缓慢吸尽固定液, 加入1 mL PBS轻轻摇晃洗涤2次, 每次3min。加入500 μL Hoechst33258染色液染色5min。吸去染色液, 用PBS洗涤2次。在洁净的载玻片中央滴一滴抗荧光淬灭封片液, 从六孔板中取出贴有细胞的盖玻片, 盖在封片液上, 尽量避免气泡, 在荧光显微镜下(激发光波长350 nm, 发射光波长460 nm)观察细胞的形态特征。
Caspase3活性检测用试剂盒提供的pNA配制标准品稀释液, 制定pNA标准曲线。胰酶消化贴壁细胞, 离心(12000 r/min, 4℃, 5min)、收集细胞沉淀。细胞沉淀用PBS洗涤2次。加入适量细胞裂解液, 震荡混匀, 于冰浴中裂解15min。取10 μL细胞裂解液, 采用Bradford法检测细胞裂解液中的总蛋白浓度。取50 μL检测缓冲液, 加入40 μL细胞裂解液, 约30 μg蛋白, 适当混匀, 随后加入10 μL人工合成的caspase 3特异底物Ac-DEVD-pNA (2 mmol/L),总体积为100 μL。充分混匀后, 37℃培养箱中孵育60—120min。发现颜色变化较明显时迅速用酶标仪测定A405。颜色变化不明显时, 孵育时间可适当延长。样品中caspase 3催化生成的pNA产生的吸光度为待测样品A405减去空白对照A405。一个酶活力单位定义为当底物饱和时, 在37℃一个小时内可以剪切1 nmol Ac-DEVD-pNA产生1 nmol pNA的caspase 3的酶量。计算出样品中所含有的caspase 3酶活力单位。
统计分析 Real-time PCR数据用Origin6.1软件中T-test方法来分析差异显著性。当P<0.05时认为差异性显著, 当P<0.01时认为差异性极显著。
2 结果
2.1 低氧对斑马鱼ZF4细胞ho1基因表达的影响
用低氧(1% O2)处理ZF4细胞24h、48h和72h,然后利用Real-time PCR检测ZF4细胞ho1 mRNA的表达水平。结果如图 1所示, 低氧可显著诱导ho1基因的转录, ho1 mRNA的相对表达量在低氧处理24h后显著升高。
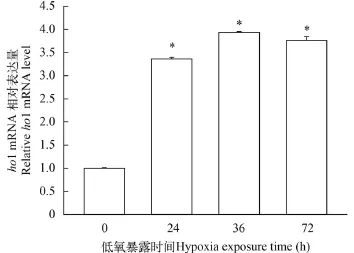
图 1 Real-time PCR检测低氧条件下斑马鱼ZF4细胞ho1基因的表达(*代表P<0.05)Fig. 1 The effect of hypoxia on ho1 gene expression in ZF4 cells
2.2 低氧对斑马鱼胚胎和成鱼ho1基因表达的影响
用低氧(5% O2)处理斑马鱼胚胎, 在低氧处理不同时间后进行取样, 然后Real-time PCR的方法检测低氧处理前后斑马鱼胚胎ho1 mRNA的表达水平。结果如图 2a所示, 低氧处理后斑马鱼胚胎ho1基因的表达量均有不同程度的增加, 从低氧处理24h开始常氧组和低氧组差异显著。用低氧处理斑马鱼成鱼, 检测低氧处理前后ho1 mRNA在组织中的表达变化。结果表明(图 2b), 经低氧处理后,斑马鱼ho1基因在脑、肝、鳃、肠、肌肉等组织中表达量显著增加, 而在心脏和肾脏中表达量显著降低, 在性腺中表达量的变化不显著。
2.3 低氧条件下抑制ho1表达对斑马鱼ZF4细胞活力的影响
用不同浓度的ho1抑制剂ZnPPIX抑制ZF4细胞ho1的表达, 然后检测低氧条件下ZF4细胞的活力。结果如图 3所示, ZnPPIX处理可显著降低低氧条件下ZF4细胞的生存活力, 并且这种作用具有浓度依赖性, 随着ZnPPIX浓度的升高, ZF4细胞的生存活力逐渐下降。与对照组(0 ZnPPIX)比较, 5、10、15、20 μmol/L ZnPPIX处理组ZF4细胞的细胞活力依次为对照组的93.75%、77.92%、62.5%和45.83%。
用不同浓度的Ho1诱导剂血红素(Hemin)诱导抑制组ZF4细胞ho1的表达, 然后检测低氧条件下ZF4细胞的活力。结果如图 4所示, 10和20 μmol/L的Hemin可以部分回复10 μmol/L ZnPPIX抑制ho1表达后低氧对ZF4造成的活力损伤。Hemin的这种回复作用存在明显的剂量效应关系。在低氧条件下, 当10 μmol/L ZnPPIX单独作用时, ZF4细胞的细胞活力仅为对照组的79.59%。当Hemin浓度为5 μmol/L时, ZF4细胞的细胞活力为对照组的82.28%, 并未观察到明显的回复作用。当Hemin浓度达到10 μmol/L时, 细胞活力上升到对照组的96.94%, 与ZnPPIX单独处理组相比具有显著差异。当Hemin浓度为20 μmol/L时, 细胞活力回复到对照组水平。
2.4 低氧条件下抑制ho1表达对斑马鱼ZF4细胞凋亡的影响
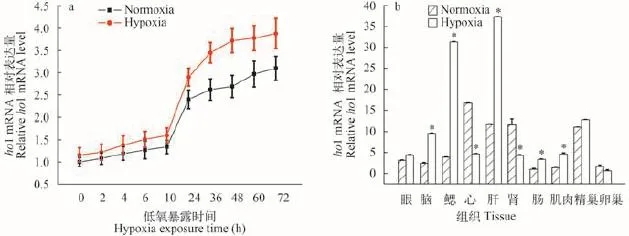
图 2 ho1 mRNA在低氧处理斑马鱼胚胎(a)和成鱼组织(b)中的表达图式(*代表P<0.05)Fig. 2 Effects of hypoxia on ho1 mRNA level in zebrafish embryos (a) and various tissues of zebrafish adult (b)
将ZF4细胞随机分成4组, 常氧组、低氧组、ZnPPIX+低氧组、ZnPPIX+Hemin+低氧组。除常氧组外, 其余3组均用低氧处理48h, 然后利用光学显微镜观察各组的细胞形态。结果如图 5a所示, 常氧组ZF4细胞生长状态良好, 细胞大小形态一致, 密度均一, 呈长梭形, 贴壁紧密。低氧组细胞逐渐变圆, 密度明显下降, 少数细胞漂浮死亡。ZnPPIX+低氧组在低氧处理后, 细胞密度急剧下降, 大片脱落, 结团、破碎。而ZnPPIX+Hemin+低氧组, 无论是在细胞数目还是在细胞形态上都得到了显著回复。结果表明, 在低氧条件下抑制ho1的表达会诱导ZF4细胞的大量死亡, Ho1对低氧条件下的ZF4细胞具有保护作用。
用Hoechst染色法检测各组的细胞凋亡情况,结果如图 5a所示, 常氧组细胞核形态完整, 呈椭圆形, 颜色均一, 为深蓝色。低氧处理组部分细胞出现凋亡特征。而ZnPPIX+低氧处理组, 大部分细胞都呈现凋亡状态, 细胞核致密浓染, 或者破碎呈凋亡小体。ZnPPIX+Hemin+低氧处理组细胞出现凋亡特征的数量较ZnPPIX+低氧处理组显著减少。用试剂盒检测caspase 3活性, 结果如图 5b所示, ZnPPIX+低氧组的caspase 3活性显著高于其他各组, 在添加Hemin之后, caspase 3活性得到一定程度的回复。这些结果表明Ho1可通过抗细胞凋亡来增强ZF4细胞的低氧耐受力。
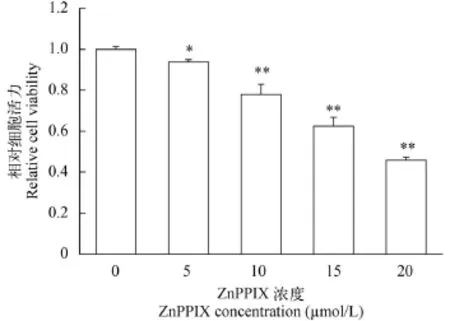
图 3 不同浓度ZnPPIX诱导下ZF4细胞在低氧处理后的细胞活力(*代表P<0.05, **代表P<0.01)Fig. 3 Viability of ZF4 cells after exposure to hypoxia with different doses of ZnPPIX
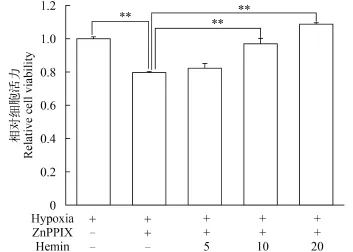
图 4 ZnPPIX和Hemin共同作用对低氧条件下ZF4细胞活力的影响(**代表P<0.01)Fig. 4 Coeffect of ZnPPIX and Hemin on the viability of ZF4 cells under hypoxia
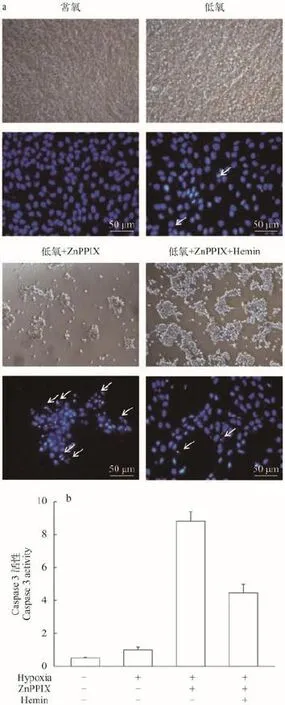
图 5 低氧条件下抑制ho1表达后斑马鱼ZF4细胞的凋亡情况Fig. 5 Detection of apoptosis in ZF4 cells treated with Ho1 inhibitor under hypoxiaA. Hoechst染色; B. Caspase 3 活性检测A. Hoechst staining; B. Detection of caspase 3 activity
3 讨论
已有的研究表明, 斑马鱼Ho1可参与一系列氧化应激反应。多种重金属和持续有机污染物存在的情况下成年斑马鱼Ho1的活性明显增强[18,19]。斑马鱼早期胚胎ho1基因也对多种化合物表现出高度的敏感性[19,20]。用乙酰氨基酚诱导斑马鱼肝损伤后, ho1的表达量会急剧上升[21]。因此Ho1被认为可以作为指示水体污染程度的生物标志物。但目前尚未见到斑马鱼Ho1参与低氧应答的研究。本研究首先采用Real-time PCR技术分析了ho1基因在斑马鱼低氧应答中的表达特征, 然后探讨了ho1基因在斑马鱼低氧应答中的保护作用。研究发现, 斑马鱼ho1在低氧条件下表达量显著上升, 可通过抗细胞凋亡发挥低氧保护作用。
3.1 斑马鱼ho1在低氧条件下的表达特征分析
人和脊椎动物的血红素加氧酶1对低氧的应答具有细胞特异性和种间差异。研究发现, 低氧处理后人脐静脉上皮细胞、人星形胶质细胞和人冠状动脉上皮细胞血红素加氧酶1 mRNA的表达水平显著降低, 而人肺A549细胞、人真皮纤维原细胞血红素加氧酶1 mRNA的表达水平显著升高[22,23]。用低氧处理离体培养的人滋养细胞, 细胞滋养层细胞的血红素加氧酶1蛋白表达较常氧无显著变化, 而合体滋养层细胞的血红素加氧酶1蛋白水平在处理12h后较常氧组显著降低[24]。而在小鼠中, 无论是活体的心脏、肝脏, 还是离体培养细胞, 低氧处理均可诱导其血红素加氧酶1的表达[25]。而且小鼠心脏和肝脏中的血红素加氧酶1 mRNA含量在低氧处理期间呈现动态的变化。小鼠心脏中的血红素加氧酶1 mRNA含量在低氧处理5d后显著增加, 在28d达到最高水平。小鼠肝中的血红素加氧酶1 mRNA水平在低氧处理1d后显著增加, 在第5天的时候回复到正常水平, 在21d的时候达到最大值[26]。在本研究中, 低氧处理后斑马鱼离体培养细胞和胚胎中ho1 mRNA的水平显著增加, 并且随着暴露时间的延长也呈现动态的变化。而斑马鱼成鱼中ho1 mRNA表达的变化与器官类型有关。在低氧处理24h后, 斑马鱼脑、鳃和肝脏中ho1 mRNA表达量明显上升, 而在心脏和肾脏中ho1 mRNA表达量显著降低。这些结果表明, 低氧可能通过不同的方式影响不同类型的细胞, 斑马鱼Ho1对低氧的应答依赖于细胞/器官类型和暴露时间。
3.2 斑马鱼ho1在低氧应答过程中的功能分析
进一步对斑马鱼Ho1在低氧应答中的功能进行分析, 发现抑制ho1表达使在低氧条件下培养的斑马鱼细胞生活力显著降低, 而ho1的诱导剂则可以回复低氧条件下因ho1表达抑制所增强的细胞损伤,这一结果表明斑马鱼Ho1可发挥低氧保护作用。这与相关的研究结果相一致。在低温低氧条件下, 金鱼Ho1在鳃化学感应神经上皮细胞(NECs)中的表达量增加、酶活性增强, 从而调节金鱼在低氧条件下的呼吸频率[27]。低氧可诱导鲫鱼囊胚细胞ho1 mRNA的大量表达, 稳定转染ho1的鲫囊胚细胞对低氧的耐受力显著增加[28,29]。高温低氧和低温低氧均可诱导人肝细胞中血红素加氧酶1的表达, 从而保护细胞, 避免产生炎性反应[30]。人血红素加氧酶1通过PI3K/Akt/Nrf2信号途径保护H9c2心肌细胞、C6神经胶质细胞免受缺氧/复氧诱导的细胞凋亡[31—33]。小鼠恶性肿瘤T细胞血红素加氧酶1大量表达, 保护细胞免受低氧诱导的细胞压力[34]。小鼠血红素加氧酶1也可以通过抗氧化和抗凋亡作用减轻小鼠缺血/再灌注造成的肾损伤, 增加超氧化物歧化酶的水平, 降低细胞凋亡率[35]。
关于低氧条件下血红素加氧酶1的作用机制,目前研究发现血红素加氧酶1可以通过降解血红素所获得的产物发挥细胞保护作用。低氧处理后人肝细胞的血红素加氧酶1蛋白水平和酶活性上升,胆红素含量增加[30], 而胆红素可作为抗氧化剂有效清除缺氧条件下产生的氧自由基, 防止细胞脂质层过氧化。此外, 低氧处理的小鼠, 无论是活体还是离体培养的心肌细胞, 其一氧化碳(CO)的含量均较对照组显著增加。机体内源性CO主要由血红素加氧酶降解血红素生成。低氧处理期间小鼠动脉血中CO的含量变化与血红素加氧酶1在肝中含量的变化相吻合[28,29]。而血红素降解产生的CO可通过环鸟苷酸(cGMP)发挥信号传导、舒张血管、抗炎和抗细胞凋亡作用。另有研究发现, 小鼠血红素加氧酶1在低氧条件下还可发生核转位现象, 激活AP-2、Brn3和CBF等转录因子的表达, 继而增强细胞的抗氧化能力[36]。在本研究中, 抑制ho1表达使斑马鱼在低氧条件下离体培养细胞的凋亡率显著升高, 表明斑马鱼Ho1也可以通过抑制细胞凋亡来增强细胞的低氧耐受力, 其具体作用机制还有待进一步研究。
总之, 斑马鱼ho1是一个低氧诱导基因, 可通过抑制细胞凋亡来增强细胞的低氧耐受能力。但目前ho1在斑马鱼低氧适应中的作用机制尚不清楚。本研究为进一步探讨ho1影响斑马鱼低氧耐受能力的分子机制奠定了基础。
[1]Sun J L, Xia Z W, Zhang X H, et al. The advances on the protective action and mechanism of heme oxygenase gene in tissues and cells [J]. Chinese Bulletin of Life Science, 2003, 15(4): 220—223 [孙健乐, 夏振炜, 张雪洪, 等. 保护基因HO在组织细胞中的作用及其机制研究进展. 生命科学, 2003, 15(4): 220—223]
[2]Ryter S W, Alam J, Choi A M K. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications [J]. Physiological Reviews, 2006, 86(2): 583—650
[3]Poss K D, Tonegawa S. Reduced stress defense in heme oxygenase 1-deficient cells [J]. Proceedings of the National Academy of Sciences USA, 1997, 94(20): 10925—10930
[4]Lee P J, Alam J, Wiegand G W, et al. Overexpression of heme oxygenase-1 in human pulmonary epithelial cells results in cell growth arrest and increased resistance to hyperoxia [J]. Proceedings of the National Academy of Sciences USA, 1996, 93(19): 10393—10398
[5]Minamino T, Christou H, Hsieh C M, et al. Targeted expression of heme oxygenase-1 prevents the pulmonary inflammatory and vascular responses to hypoxia [J]. Proceedings of the National Academy of Sciences USA, 2001, 98(15): 8798—8803
[6]He X H, Tang J J, Wang Y L, et al. Transduced heme oxygenase-1 fusion protein reduces renal ischemia/reperfusion injury through its antioxidant and antiapoptotic roles in rats [J]. Transplantation Proceedings, 2015, 47(6): 1627—1632
[7]Issan Y, Kornowski R, Aravot D. Heme oxygenase-1 induction improves cardiac function following myocardial ischemia by reducing oxidative stress [J]. PLoS One, 2014, 9(3): e92246
[8]Yun N, Cho H I, Lee S M. Impaired autophagy contributes to hepatocellular damage during ischemia/reperfusion: heme oxygenase-1 as a possible regulator [J]. Free Radical Biology and Medicine, 2014, 68(2): 168—177
[9]Cheung C H Y, Chiu J M Y, Wu R S S. Hypoxia turns genotypic female medaka fish into phenotypic males [J]. Ecotoxicology, 2014, 23(7): 1260—1269
[10]Shang E H H, Yu R K, Wu R S S. Hypoxia affects sex differentiation and development, leading to a male-dominated population in zebrafish (Danio rerio) [J]. Environmental Science and Technology, 2006, 40(9): 3118—3122
[11]Xiao W H. The hypoxia signaling pathway and hypoxic adaptation in fishes [J]. Science China Life Sciences, 2015, 58(2): 148—155 [肖武汉. 低氧信号传导途径与鱼类低氧适应. 中国科学: 生命科学, 2014, 44(12): 1227—1235]
[12]Zhu C D, Wang Z H, Yan B. Strategies for hypoxia adaptation in fish species: a review [J]. Journal of Comparative Physiology B, 2013, 183(8):1005—1013
[13]Padilla P A, Roth M B. Oxygen deprivation causes suspended animation in the zebrafish embryo [J]. Proceedings of the National Academy of Sciences USA, 2001, 98(13): 7331—7335
[14]van der Meer D L, van den Thillart G E, Witte F, et al. Gene expression profiling of the long-term adaptive response to hypoxia in the gills of adult zebrafish [J]. American Journal of Physiology Regulatory Integrative Comparative Physiology, 2005, 289(5): R1512—R1519
[15]Chen K, Cole R B, Rees B B. Hypoxia-induced changes in the zebrafish (Danio rerio) skeletal muscle proteome [J]. Journal of Proteomics, 2013, 78(1): 477—485
[16]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-∆∆Ct)method [J]. Methods, 2001, 25(4): 402—408
[17]Tao W T, Wang L L, Hou S F, et al. Study on expression pattern and function of zebrafish HO1 [J]. Acta Hydrobiologica Sinica, 2014, 38(2): 209—215 [陶文庭, 王琳琳,侯少丰, 等. 斑马鱼HO1基因的表达特征及功能研究.水生生物学报, 2014, 38(2): 209—215]
[18]Voelker D, Vess C, Tillmann M, et al. Differential gene expression as a toxicant-sensitive endpoint in zebrafish embryos and larvae [J]. Aquatic Toxicology, 2007, 81(4): 355—364
[19]Knecht A L, Goodale B C, Truong L, et al. Comparative developmental toxicity of environmentally relevant oxygenated PAHs [J]. Toxicology Applied Pharmacology, 2013, 271(2): 266—275
[20]Weil M, Scholz S, Zimmer M, et al. Gene expression analysis in zebrafish embryos: a potential approach to predict effect concentrations in the fish early life stage test [J]. Environmental Toxicology and Chemistry, 2009, 28(9): 1970—1978
[21]Cox A G, Saunders D C, Kelsey P B, et al. S-nitrosothiol signaling regulates liver development and improves outcome following toxic liver injury [J]. Cell Reports, 2014, 6(1): 56—69
[22]Nakayama M, Takahashi K, Kitamuro T, et al. Repression of heme oxygenase-1 by hypoxia in vascular endothelial cells [J]. Biochemical and Biophysical Research Communication, 2000, 271(3): 665—671
[23]Panchenko M V, Farber H W, Korn J H. Induction of heme oxygenase-1 by hypoxia and free radicals in human dermal fibroblasts [J]. American Journal of Physiology Cell Physiology, 2000, 278(1): C92—C101
[24]Newby D, Cousins F, Myatt L, et al. Heme oxygenase expression in cultured human trophoblast cells during in vitro differentiation: effects of hypoxia [J]. Placenta, 2005, 26(2—3): 201—209
[25]Long X, Wu G, Rozanski D J, et al. Hypoxia-inducedHaem Oxygenase-1 gene expression in neonatal rat cardiac myocytes [J]. Heart Lung and Circulation, 2001, 10(3): 121—129
[26]Han F, Takeda K, Yokoyama S, et al. Dynamic changes in expression of heme oxygenases in mouse heart and liver during hypoxia [J]. Biochemical and Biophysical Research Communication, 2005, 338(1): 653—659
[27]Tzaneva V, Perry S F. Heme oxygenase-1 (HO-1) mediated respiratory responsesto hypoxia in the goldfish, Carassius auratus [J]. Respiratory Physiology and Neurobiology, 2014, 199: 1—8
[28]Zhong X P, Wang D, Zhang Y B, et al. Identification and characterization of hypoxia-induced genes in Carassius auratus blastulae embryonic cells using suppression subtractive hybridization [J]. Comparative Biochemistry and Physiology Part B, 2009, 152(2): 161—170
[29]Wang D, Zhong X P, Qiao Z X, et al. Inductive transcription and protective role of fish heme oxygenase-1 under hypoxic stress [J]. The Journal of Experimental Biology, 2008, 211(16): 2700—2706
[30]Tüzüner E, Liu L, Shimada M, et al. Heme oxygenase-1 protects human hepatocytes in vitro against warm and cold hypoxia [J]. Journal of Hepatology, 2004, 41(5): 764—772
[31]Pachori A S, Anthony S, Patricia N, et al. Heme-oxygenase-1-induced protection against hypoxia/reoxygenation is dependent on biliverdin reductase and its interaction with PI3K/Akt pathway [J]. Journal of Molecular and Cellular Cardiology, 2007, 43(5): 580—592
[32]Liu S X, Zhang Y, Wang Y F, et al. Upregulation of heme oxygenase-1 expression by hydroxysafflor yellow A conferring protection from anoxia/reoxygenation-induced apoptosis in H9c2 cardiomyocytes [J]. International Journal of Cardiology, 2012, 160(2): 95—101
[33]Min K P, Chang H K, Kim Y M, et al. Akt-dependent heme oxygenase-1 induction by NS-398 in C6 glial cells: a potential role for CO in prevention of oxidative damage from hypoxia [J]. Neuropharmacology, 2007, 53(4): 542—551
[34]Dey M, Chang A L, Wainwright D A, et al. Heme oxygenase-1 protects regulatory T cells from hypoxia-induced cellular stress in an experimental mouse brain tumor model [J]. Journal of Neuroimmunology, 2014, 266(1—2): 33—42
[35]He X H, Tang J J, Wang Y L, et al. Transduced heme oxygenase-1 fusion protein reduces renal ischemia/reperfusion injury through its antioxidant and antiapoptotic roles in rats [J]. Transplantation Proceedings, 2015, 47(6): 1627—1632
[36]Lin Q, Weis S, Yang G, et al. Heme Oxygenase-1 protein localizes to the nucleus and activates transcription factors important in oxidative stress [J]. The Journal of Biological Chemistry, 2007, 282(28): 20621—20633
STUDIES ON THE PROTECTIVE ROLE OF ZEBRAFISH HO1 IN RESPONSE TO HYPOXIA
LI Yan-Li1, XU Gong-Yu1, XIAO Jin-Wen1, LI Zhi2, ZHAO Hao-Bin1, ZHOU Qin-Chun1, GUI Jian-Fang2and ZHONG Xue-Ping1
(1. Hubei Key Laboratory of Genetic Regulation and Integrative Biology, School of Life Sciences, Huazhong Normal University, Wuhan 430079, China; 2. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Heme oxygenase 1 (Ho1) is the rate-limiting enzyme in the degradation of heme into biliverdin, carbon monoxide and free divalent iron. Abnormal expression of ho1 gene is associated with the development and progression of various human diseases, while functions of zebrafish Ho1 under hypoxia stress remain largely unknown. This study explored the protection role of zebrafish Ho1 during hypoxia exposure. The results showed that hypoxia significantly induced zebrafish ho1 mRNA in ZF4 cells, embryos, brain, gill, and liver but significantly decreased it in heart and kidney after 24h hypoxic exposure. Ho1 inhibition by ZnPPIX decreased ZF4 cell viability under hypoxia stress, enhanced Ho1 activity protected ZF4 cell from hypoxia stress-induced cell death. These results showed that Ho1 may protect zebrafish from hypoxia-induced cell apoptosis.
Zebrafish; Heme oxygenase 1; Hypoxia; Cell viability; Cell apoptosis
Q344+.1
A
1000-3207(2017)01-0043-07
10.7541/2017.6
2016-01-16;
2016-04-21
国家自然科学基金项目(30972254); 淡水生态与生物技术国家重点实验室开放课题(2013FB03)资助 [Supported by the National Natural Science Foundation of China (30972254); the State Key Laboratory of Freshwater Ecology and Biotechnology (2013FB03)]
李艳丽(1987—), 女, 湖北宜昌人; 硕士研究生; 研究方向为遗传学。E-mail: lylccnu@163.com
钟雪萍, E-mail: zhongxueping@mail.ccnu.edu.cn

