中国局部进展期直肠癌诊疗专家共识
中国局部进展期直肠癌诊疗专家共识
中国抗癌协会大肠癌专业委员会
局部进展期直肠癌;诊断;治疗;共识
1 局部进展期直肠癌的定义(p42)
2 局部进展期直肠癌的诊断及临床分期(p43)
2.1 病理诊断
2.2 局部进展期直肠癌的临床分期
2.2.1 治疗前临床分期
2.2.2 放化疗后的临床分期
3 局部进展期直肠癌的多学科综合治疗讨论(p44)
3.1 建立多学科协作组及定期多学科讨论的优点
3.2 局部进展期直肠癌多学科综合治疗的组成及讨论模式
3.3 局部进展期直肠癌多学科综合治疗讨论
3.3.1 多学科综合治疗讨论前准备
3.3.2 局部进展期直肠癌多学科综合治疗讨论内容
4 局部进展期直肠癌的新辅助治疗(p46)
4.1 术前新辅助放疗的方式
4.1.1 术前短程放疗
4.1.2 术前长程放化疗
4.1.3 术前短程放疗和长程化放疗的比较
4.2 术前放化疗中同期化疗方案的选择
4.2.1 氟尿嘧啶单药
4.2.2 奥沙利铂联合氟尿嘧啶
4.2.3 伊立替康的应用
4.3 新辅助放化疗或放疗与手术的间隔时间
4.4 直肠癌的术后辅助放化疗
5 直肠癌的非手术治疗(p50)
6 局部进展期直肠癌的手术治疗(p51)
6.1 局部进展期直肠癌的手术切除
6.1.1 全系膜切除的原则
6.1.2 切缘与根治
6.2 局部进展期直肠癌的手术方式
6.2.1 经腹会阴直肠癌根治术
6.2.2 直肠前切除术
6.2.3 柱状经腹会阴直肠癌根治术
6.2.4 经括约肌间切除术
6.2.5 局部切除
6.3 局部进展期直肠癌的淋巴结清扫
6.3.1 侧方淋巴结清扫
6.3.2 根部淋巴结清扫
6.4 局部进展期直肠癌的微创治疗
6.4.1 腹腔镜直肠癌根治术
6.4.2 机器人直肠癌根治术
7 局部进展期直肠癌的术后病理评估(p55)
7.1 标本的处理
7.1.1 系膜完整性评价和标本的预处理及固定
7.1.2 标本的大体描述
7.1.3 标本的取材
7.2 病理报告
7.2.1 病理报告内容及规范
7.2.2 组织学分型
7.2.3 组织学分级
7.2.4 直肠癌TNM分期
7.2.5 新辅助放化疗后肿瘤退缩分级的病理学评估
7.3 直肠癌常用分子病理检测
7.3.1 微卫星不稳定与错配修复蛋白检测
7.3.2 ras基因突变检测
7.3.3 BRAF基因突变检测
8 局部进展期直肠癌术后的辅助化疗(p59)
8.1 新辅助放化疗后的局部进展期直肠癌术后辅助化疗的争议
8.2 辅助化疗方案及药物的选择
9 局部进展期直肠癌的预后(p61)
9.1 新辅助放化疗后术后降期
9.2 新辅助放化疗后肿瘤退缩分级
9.3 新辅助放化疗后病理学完全缓解
9.4 生物标志物预测新辅助放化疗
9.4.1 微卫星不稳定
9.4.2 K-ras或ras突变状态
9.4.3 循环肿瘤DNA
9.4.4 循环肿瘤细胞
10 局部进展期直肠癌治疗后的随访(p63)
10.1 随访项目及其价值
10.1.1 体格检查
10.1.2 CEA等肿瘤标志物
10.1.3 肠镜检查
10.1.4 影像学检查
10.2 规范的随访计划
11 展望和总结(p65)
附 录(p72)
大肠癌作为中国最常见的恶性肿瘤之一,在中国受到广泛的关注。在2012年确诊的全球136万例大肠癌中,中国大肠癌的新发病例数达到25.3万,占全球大肠癌新发病例的18.6%。中国作为全球大肠癌每年新发病例最多的国家,开展积极的肿瘤防治对策,对降低中国大肠癌的发病率和死亡率具有重要的意义。随着人们生活水平的提高和生活方式的改变,结肠癌的发病率正逐年上升,但目前在中国直肠癌发病人数仍然占大肠癌的多数。
直肠癌的诊治具有非常大的挑战性,由于解剖结构的关系,直肠癌手术难度大、并发症发生率高、局部复发率高,同时对生活质量影响较大;特别对于局部进展期直肠癌(locally advanced rectal cancer,LARC),长期以来治疗效果较差。然而随着多学科综合治疗(multidisciplinary team,MDT)理念在直肠癌中的应用,特别是新辅助放化疗在局部进展期直肠癌中的广泛开展,使得这类患者的治疗效果有了显著的提高。中国抗癌协会大肠癌专业委员会一直致力于大肠癌多学科综合治疗的推广,使得目前中国主流的大肠癌治疗已经从原先由个别外科医师或肿瘤内科医师独立制定治疗策略的模式向多学科协作、综合治疗的模式转变,使中国大肠癌的治疗水平与国际相接轨,治疗疗效也得到不断地提升。
然而目前在局部进展期直肠癌领域仍然存在相当多的争议之处,难以用现有的临床证据进行直接套用。该领域是目前研究的重点和热点之一,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也只是定一个大的方向,具体到细节方面操作性差异很大,很难形成固定的指南模式以指导中国局部进展期直肠癌的临床诊治工作。 因此本专业委员会拟以共识的方式对直肠癌的诊断、分期、治疗、评估及随访进行汇总,综合现有的临床数据、中国国情及专家委员会的建议,在局部进展期直肠癌的各个方面提供目前的共识,为临床医师的诊治提供参考。
本共识撰写的主要框架紧贴临床,按照患者就诊的流程进行撰写,为临床医师在患者诊疗的各个流程中提供可信赖的参考依据。以一个局部进展期直肠癌患者就诊为例,参照目前患者最常用的术前新辅助放化疗后手术的流程进行撰写。具体顺序如下:诊断及临床分期(病理诊断、影像学术前分期及评估)、多学科综合治疗组讨论、术前新辅助放化疗、放化疗与手术间期处理、外科手术治疗、术后病理评估、术后辅助治疗、随访和预后判断。
本共识希望在局部进展期直肠癌的诊治各个方面尽量细化,在各个细节方面为临床医师实际操作提供参考及帮助。在目前无巨大争议之处提出清晰的推荐方案,在存在很大争议的地方,本共识既列出不同方案的参考及来源,亦提出个别或数个适合中国患者的治疗方案。
1 局部进展期直肠癌的定义
在讨论局部进展期直肠癌的共识或争议之前,首先必须明确局部进展期直肠癌的定义。局部进展期直肠癌不是一个固定不变的定义,同样存在争议及与时俱进的更新。在无良好的影像学检查技术之前,局部进展期直肠癌的概念更加模糊,指依靠肛指检查肿瘤较固定难以推动而无远处转移的直肠癌;随着影像学技术的发展,局部进展期直肠癌患者数量出现增加的趋势。局部进展期直肠癌是一个相对的概念,是相对于早期直肠癌(单纯依靠外科全系膜切除甚至局部切除就能获得很低的局部复发率和很好的5年生存率)和晚期直肠癌(合并全身远处器官转移)而言的。
目前对于局部进展期直肠癌的定义既需要参考影像学检查中原发肿瘤局部侵犯深度或肠系膜淋巴结肿大情况,又需要参考患者局部或远处复发风险进行综合考虑[1-2]。本共识中定义的局部进展期直肠癌,为经影像学或病理检查发现的原发肿瘤侵出肠壁肌层直至周围有名结构(c/pT3-4b)或系膜内及真骨盆范围内出现淋巴结转移(c/pN1-2)而无远处转移(M0)的距肛门12 cm以内的直肠癌。随着各种术前分期及术前治疗技术的发展,局部进展期直肠癌的定义必然会进一步更新。
共识1:局部进展期直肠癌的定义为经影像学或病理检查发现的原发肿瘤侵出肠壁肌层直至周围有名结构(c/pT3-4b)或系膜内及真骨盆范围内出现淋巴结转移(c/pN1-2)而无远处转移(M0)的距肛门12 cm以内的直肠癌。
2 局部进展期直肠癌的诊断及临床分期
2.1 病理诊断
直肠癌可通过术前活检获得病理诊断,常用方法包括肠镜活检、硬管直肠肛门镜活检或扩肛活检等。虽然有部分来自腺瘤恶变的早期直肠癌通过活检获得恶性证据会比较困难,但对于局部进展期直肠癌而言,通过活检获得明确病理诊断的概率非常大;同时局部进展期直肠癌患者通常需要接受术前新辅助放化疗,明确的病理诊断(包括病理类型)有利于制定最合适的治疗策略。因此推荐对每一例局部进展期直肠癌患者获得明确的病理诊断后再进行治疗。
此外,本共识认为,对于以下几种情况,获得明确的恶性证据是必须的:
⑴ 由于永久性造口对患者是重大的创伤,对于可能手术需要永久性造口的病例必须在所有治疗开始前获得明确的病理诊断。
⑵ 新辅助放化疗后出现的肿瘤退缩可能导致后期无法在手术前获得明确的病理诊断,因此对于接受新辅助放化疗的患者必须在治疗开始前获得明确的病理诊断。
⑶ 发生于直肠的恶性肿瘤病理类型多样,除本共识主要讨论的原发性直肠腺癌外,还包含少见的原发性直肠神经内分泌肿瘤、恶性黑色素瘤、淋巴瘤、软组织肉瘤、其他特殊类型的原发恶性肿瘤及转移性肿瘤等。本共识主要针对原发于直肠的腺癌进行讨论。在临床诊疗中,由于治疗方案的不同,当有依据需要与原发性腺癌以外的其他类型恶性肿瘤进行鉴别诊断时,首先需要进一步进行相关检测以明确病理诊断。
共识2:推荐对每一例局部进展期直肠癌患者获得明确病理诊断后再进行治疗。对可能需要永久性造瘘的患者、接受新辅助放化疗的患者及需要与原发性腺癌以外的其他类型恶性肿瘤进行鉴别时,必须明确病理诊断。
2.2 局部进展期直肠癌的临床分期
2.2.1 治疗前临床分期
⑴ T分期:对于局部进展期直肠癌而言,治疗开始前准确的影像学评估及分期是开展后续治疗的最关键因素之一。目前最常用的分期方法是直肠MRI和直肠内镜超声(endoscopic ultrasonography,EUS)。多项Meta分析或综述分析了不同影像学技术在直肠癌T分期和N分期中的准确性。有文献报道,在T分期方面,对于T1-2的肿瘤,EUS分期的准确性较传统低分辨率MRI更高,与现代高分辨率MRI准确性相当[3-5];而对于T3-4的肿瘤,由于MRI图像上直肠的解剖结构清晰,对肿瘤肠壁外侵犯、系膜浸润深度判断的灵敏度高,对肿瘤侵犯盆底周围器官、结构和骨骼显示较佳,使其具有EUS或螺旋CT无法比拟的优势[3,6-7]。
环切缘的判断在局部进展期直肠癌的治疗前分期及选择治疗策略上具有重要价值。无论是EUS或者CT目前都无法清楚显示直肠的系膜边缘,而采用专门扫描方案的直肠MRI能够清楚地显示直肠的系膜边缘、肿瘤外侵程度及其与环切缘的关系。欧洲的MERCURY研究证明,高分辨率MRI采用特定的直肠MRI扫描方案界定了肿瘤边缘距离系膜边缘1 mm作为环切缘阳性的判断标准,而且其判断直肠环切缘侵犯情况的准确率达到94%;后期的随访再次证实了MRI判断的环切缘阳性具有显著的预后预测价值[8]。
⑵ N分期:对于周围淋巴结转移的判断,目前没有一个最佳的阈值来作为判断淋巴结转移的标准。无论是直肠MRI、螺旋CT还是EUS均不具备令人满意的灵敏度(55% ~69%),尤其是对小于等于5 mm的淋巴结准确性更低。但与CT或EUS相比较,MRI在判断淋巴结转移时具有以下优势:MRI除可发现系膜内淋巴结外,尚可发现系膜外的盆腔淋巴结转移,而后者是预后不良的重要因素之一;此外,MRI不仅可以明确淋巴结的形态和大小,同时结合内部信号及特定造影剂等有助于进一步区分转移淋巴结与非转移性淋巴结[9-11]。
⑶ M分期:对于所有的直肠癌而言,在临床分期时都必须进行全身相关检查以排除盆腔外的远处器官的转移,除直肠癌特定的盆腔相关影像学检查外,胸部X线检查、腹部CT或MRI是最基本的检查手段。由于直肠癌患者较结肠癌患者具有更高的肺转移发生率,推荐对直肠癌患者行胸部CT检查以替代胸部X线检查;作为排除远处转移的检查手段,腹部CT或MRI具有同等的准确性,但对已发现的肝转移病灶的评估,MRI优于CT检查。尽管目前报道PET/CT在发现远处转移灶的敏感性优于MRI或CT,但目前不推荐临床常规应用。而骨扫描、头颅影像学检查等只在具有临床症状时推荐应用。
直肠癌治疗前分期的直肠MRI推荐扫描方案及直肠MRI分期推荐报告内容见附录1。
共识3:局部进展期直肠癌治疗前临床分期具有重要的指导意义。① 对直肠局部的临床分期,直肠MRI在判断肿瘤侵犯深度、与盆腔结构关系及环切缘状况等具有显著的优势,推荐对每例局部进展期直肠癌患者常规采用。② 直肠周围淋巴结转移的判断是目前的难点,尚无可靠的影像学判断方法,目前仍以直肠MRI检查最常用。③ 推荐对每例局部进展期直肠癌患者至少行胸部CT、腹部CT或MRI检查排除远处转移。
2.2.2 放化疗后的临床分期
对于接受新辅助放化疗后的直肠癌患者的临床分期,关注焦点主要在放化疗的疗效评估上。EUS、CT和MRI均可应用于放化疗后的评估,目前最常用的方法仍然是直肠MRI。直肠MRI在区分ypT0-2、ypT3或ypT4上具有目前最高的准确性,能够帮助外科医师选择是否需要更大范围的手术[12]。然而目前各种影像学方法在判断放化疗后少量肿瘤细胞的残留及影像学完全缓解方面均无良好的准确性,同时由于在准确鉴别放化疗后系膜内纤维组织增生和肿瘤残留存在缺陷,导致放化疗的分期通常表现为分期过度。尽管有研究报道PET/CT在放化疗有效的患者中出现显著的SUV值得下降,但PET/ CT在判断放化疗疗效方面的作用尚不肯定。
局部进展期直肠癌新辅助放化疗后的MRI再分期的推荐分期标准及报告内容见附录2。
共识4:局部进展期直肠癌新辅助放化疗后对放化疗疗效的判断目前尚无最佳的影像学手段,特别对于少量肿瘤细胞残留及影像学完全缓解方面有较大缺陷。直肠MRI仍然是目前推荐度最高、准确性相对最好、最常应用的影像学技术。
3 局部进展期直肠癌的多学科综合治疗讨论
3.1 建立多学科协作组及定期多学科讨论的优点
局部进展期直肠癌的处理是大肠癌领域治疗的重点和难点之一,不同治疗方法在局部进展期直肠癌中的应用使得不同方法组合而成的治疗策略也越来越多。传统的对局部进展期直肠癌的治疗以外科手术结合手术后的放化疗为主,外科医师在患者的诊断、治疗及随访中占据主导地位。随着多种治疗方法在直肠癌中的广泛应用,尽管目前外科医师仍然在直肠癌的治疗中占主导地位,但其他专科医师在其中发挥了越来越大的作用,最终影响甚至改变了外科医师主导的治疗决策。因此建立一个多学科团队对局部进展期直肠癌进行定期多学科讨论是目前不断提高其治疗疗效、延长生存期和改善生活质量最有效的策略之一。
建立多学科协作组并进行多学科讨论最直接的优点是对每个进展期直肠癌患者提供多方面的观点,从而更好地改善直肠癌的评估、疗效及预后判断。越来越多的证据证明,在大肠癌治疗中心经过专科培训及积极参与到多学科协作中的外科医师其治疗直肠癌后,患者的死亡率更低、保肛率更高[1-2,13-16]。通过多学科讨论,听取不同专业背景的人员的观点及评论能够促进治疗局部进展期直肠癌的外科医师进行自我评估及自我改进,而病理科医师对术后样本的大体评估及组织学评估既对外科医师改进手术方式有帮助,也对开展术前放化疗的放疗科医师和化疗科医师改进放化疗技术有帮助[1-2]。
共识5:局部进展期直肠癌是多学科综合治疗在大肠癌治疗领域应用的最佳模式之一,通过多学科团队协作,改善了局部进展期直肠癌的治疗效果及生活质量,值得广泛推荐。
3.2 局部进展期直肠癌多学科综合治疗的组成及讨论模式
在大肠癌的多学科综合治疗领域,英国走在了世界前列。早在2004年英国就出版了名为Improving Outcomes in Colorectal Cancer: Manual Update一书,系统阐述并指导多学科综合治疗的组成及建立模式[1]。结合欧美国家对多学科综合治疗讨论模式的推荐及国内在大肠癌多学科综合治疗讨论应用实践,对局部进展期直肠癌多学科综合治疗的组成成员分成两部分:基本组成成员(核心成员)和扩展组成成员(表1)。基本组成成员是能够顺利开展局部进展期直肠癌多学科综合治疗讨论的基本保证,广泛适用于不同级别、不同治疗水平及不同治疗量的医院,以建立基本的多学科综合治疗讨论团队;而对于病例高度汇集、医疗及科研水平领先的肿瘤中心,扩展组成成员的加入是建立目前最佳的多学科综合治疗讨论团队所必须的。

表 1 局部进展期直肠癌推荐的多学科综合治疗协作组成员
共识6:在国内二甲以上的医院基本均能够实现建立最基本的多学科团队对局部进展期直肠癌进行个体化多学科讨论,在有条件的三甲医院提倡建立更全面、覆盖面更广的多学科协作模式。
3.3 局部进展期直肠癌多学科综合治疗讨论
3.3.1 多学科综合治疗讨论前准备
推荐每周由多学科秘书组织进行多学科讨论。在讨论之前需要对讨论病例的资料进行充分准备,以帮助多学科综合治疗成员做出最准确全面的判断。
需要准备的材料包括:
⑴ 患者临床病史、既往治疗病史等。
⑵ 讨论前所有可获得的客观检查资料,可由1名临床医师对资料进行初步筛选以提交多学科讨论展示。
⑶ 必需的资料:① 术前分期相关影像学资料,建议直肠癌患者均行术前MRI或EUS以准确判断分期;② 直肠癌内镜检查报告,对于直肠肿块的大小、位置、距肛门距离等情况的描述,有条件的提供超声内镜报告,推荐对直肠癌行硬管直肠镜检查准确测量肿瘤距肛门距离;③ 未手术患者需要准备术前活检病理或会诊病理,已手术患者提供术后病理报告,特殊病理类型的报告及对诊断治疗有价值的免疫组织化学检测、基因检测报告等。
3.3.2 局部进展期直肠癌多学科综合治疗讨论内容
在条件许可的情况下,推荐对每一例直肠癌患者均进行多学科综合治疗讨论。局部进展期直肠癌的诊治是目前的难点之一,在术前分期、术前新辅助放化疗、手术切除及术后化疗等领域均存在单纯依靠现有临床证据无法直接给予肯定答案的情况。因此,委员会推荐存在以下情况的患者需要进行多学科综合治疗讨论:
⑴ 结合术前分期影像学检查(直肠MRI或EUS)的优缺点,对于术前分期准确性存在疑问、环切缘可疑累及和合并盆腔淋巴结可疑转移的病例推荐提交多学科综合治疗。
⑵ 对于术前临床分期为cT3aN0的直肠癌患者推荐提交多学科综合治疗讨论以进一步明确分期,判断选择是否需要接受术前放疗、放化疗或直接行根治性手术。
⑶ 在部分直肠癌患者考虑常规分割放化疗和短程放疗之间进行优缺点评估选择时,建议提交多学科综合治疗讨论。
⑷ 在新辅助放化疗后达到临床完全缓解(clinic complete response,cCR)或根治术后病理学完全缓解(pathological complete response,pCR)的患者需要提交多学科综合治疗讨论以选择后续治疗方案。
⑸ 特殊病例(如同时多原发癌、家族性肠癌等)、特殊病理类型(如印戒细胞癌、神经内分泌肿瘤等)及病理诊断不明确(如多次活检阴性等)推荐提交多学科综合治疗讨论以选择合适的治疗方案。
⑹ 部分疑难复杂手术推荐提交多学科综合治疗讨论。
⑺ 开展临床研究的病例、有临床科研价值的病例推荐多学科综合治疗讨论以促进临床研究的开展。
⑻ 其他直肠癌多学科综合治疗成员认为需要推荐进行多学科综合治疗讨论的病例。
共识7:对于局部进展期直肠癌进行多学科讨论前必须对患者的临床病理信息进行全面收集,特别是影像学及病理学资料;在条件许可时推荐对每例局部进展期直肠癌进行多学科讨论;特别对分期、治疗方案选择和疗效评估等缺乏足够证据的病例及少见病例积极进行多学科讨论;鼓励在有争议领域开展各种类型的临床研究或临床试验。
4 局部进展期直肠癌的新辅助治疗
近年来,多学科综合治疗的理念在直肠癌的治疗中越来越受到重视。在根治性手术的基础上,放化疗已成为局部晚期直肠癌不可或缺的治疗部分。而随着多项大型临床Ⅲ期直肠癌术前放疗研究结果的报道,局部进展期直肠癌的规范化治疗指南已由术前新辅助放疗或放化疗取代术后辅助放化疗。2004年德国CAO/ ARO/AIO-94临床研究和英国MRC CR07两个关键的临床试验奠定了局部晚期直肠癌术前新辅助放化疗的基础,新辅助治疗是目前的局部进展期直肠癌治疗的规范。相对于术后放化疗,术前放化疗有其临床和生物学上的优点。主要包括:放疗后肿瘤降期退缩,可提高切除率;对低位直肠肿瘤,肿瘤的退缩可能增加保留肛门括约肌的机会;降低术中播散的概率;肿瘤乏氧细胞少,对放疗较术后放疗敏感;小肠的蠕动度较术后大,未坠入盆腔,治疗的不良反应较低。目前欧洲较多的肿瘤中心对T3N1-2M0或T4N0-2M0的患者采取术前新辅助放疗或放化疗[17-20]。
共识8:对于局部进展期直肠癌,术前新辅助放疗或放化疗是目前最常用的标准治疗策略,其肿瘤学疗效及生活质量上均优于术后辅助放化疗。建议对每例局部进展期直肠癌评估新辅助放疗或放化疗的可行性。
4.1 术前新辅助放疗的方式
新辅助放疗的方式主要有两种,一种为短程快速大分割放疗,多采用每次5.0 Gy,共25.0 Gy(5次),通常放疗结束后1周内手术。另一种为常规分割,45.0 ~50.4 Gy,每次1.8 Gy,通常手术在放疗结束后6 ~8周进行。
4.1.1 术前短程放疗
术前短程大分割放疗在北欧国家开展较多,北欧进行的多项随机临床研究,多数采用短程快速放疗。在广泛采用标准全系膜切除术(total mesorectal excision,TME)之前,瑞典开展了两项短程放疗的前瞻性随机对照研究(瑞典研究Ⅰ[21]和瑞典研究Ⅱ[22-23]),比较单纯手术与25.0 Gy/5次术前放疗+手术的价值。两项研究均证实了术前放疗明显提高了无复发生存率和局部控制率,瑞典研究Ⅱ甚至显示了总生存期(overall survival,OS)的延长。在TME成为直肠癌手术的标准治疗原则后,荷兰研究和MRC CR07研究均比较了术前放疗+TME与TME或TME手术+术后选择性放疗的疗效差异,均证实了术前放疗联合TME较单纯TME进一步改善局部复发率。研究也发现对侵犯肠壁外、合并淋巴结转移或环切缘阳性的患者疗效最好,但对生存获益的证据尚不肯定。
直肠癌术前短程放疗研究结果见附录3。
4.1.2 术前长程放化疗
只有少量研究比较了单纯术前长程放疗和手术之间的疗效差异,研究已经证实,术前联合5-FU为主的放化疗较单纯放疗能显著改善局部控制率。目前术前单纯应用长程放疗极少,而多数以长程放化疗为主。其中里程碑式的研究是德国CAO/ARO/AIO-94研究[24]。研究证实术前放化疗提高了保肛率、5年局部控制率,并具有更低的3 ~4度毒性反应(含急性和后期反应)及吻合口狭窄。另外术前组还获得了8%的pCR率。在长期生存方面,2组生存情况差异无统计学意义。局部控制率的获益一直延续到11年的长期随访,而无疾病生存期(disease free survival,DFS)和OS差异无统计学意义[25]。
术前长程放化疗的放疗相关技术见附录4。
4.1.3 术前短程放疗和长程化放疗的比较
2006年波兰开展了术前采用不同分割剂量的临床Ⅲ期随机对照研究[26],共T3-4Nx可切除直肠癌,随机分为短程快速放疗组和常规术前化放疗组。结果发现,阳性环切缘率、肿瘤退缩率在长程放化疗组明显较低,但两组具有相同的保肛率。与短程放疗相比,长程放化疗也没有提高局部控制率和生存率,也没有降低后期不良反应[27]。另一项头对头比较术前短程放疗和长程化放疗的头对头临床Ⅲ期研究,澳大利亚的一项临床研究报道,3年局部复发率、5年远处转移率、OS及不良反应在短程放疗组和长程放化疗组中差异均无统计学意义[28]。
总体而言,短程放疗和长程化放疗在局部控制、长期生存方面差异无统计学意义。但长程放疗由于放疗与化疗联合,并且放疗与手术的间隔时间较长,肿瘤可获得足够的退缩时间,近期疗效相对更好。短程放疗和长程放化疗的比较见表2。对低位直肠,初始不可切除,推荐常规分割放化疗,可有更多的肿瘤降期,提高R0切除率,降低局部复发,提高保肛率。而短程大分割放疗由于其放疗费用低、治疗时间短,能够较好的节省卫生资源,因此,对于患者年龄较大,期望寿命较短或初始病灶切除满意度高时可考虑。
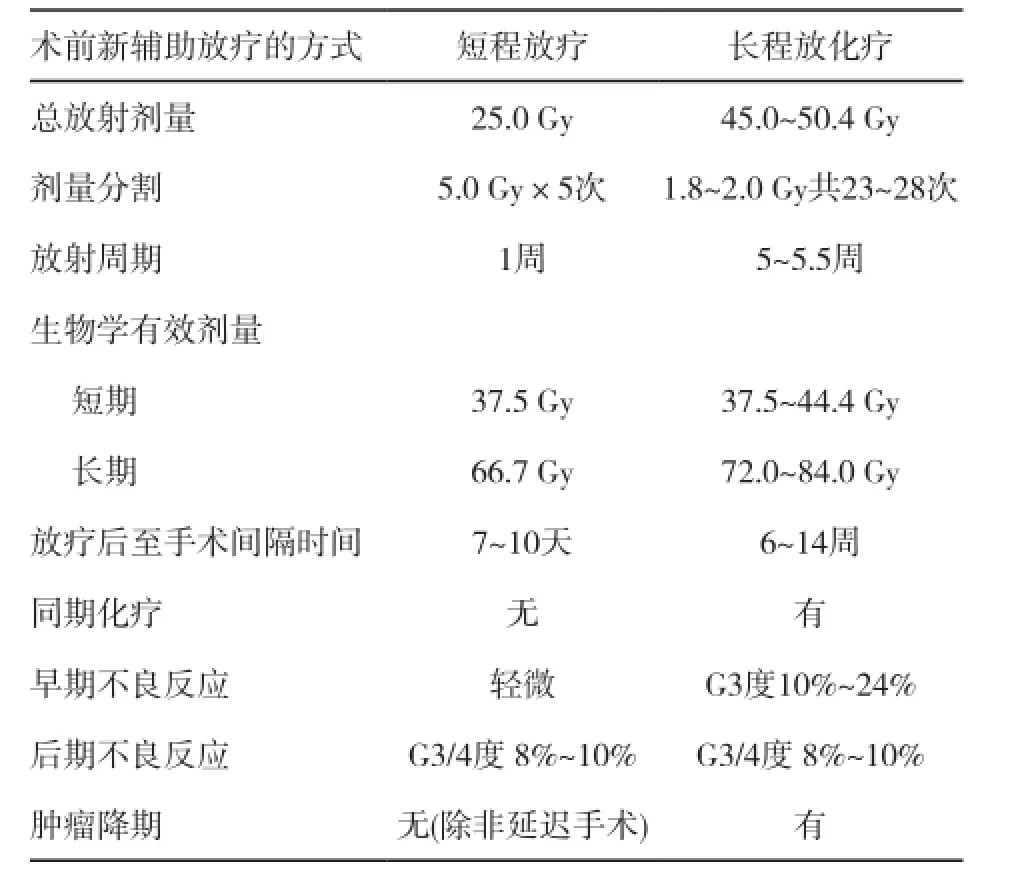
表 2 短程放疗和长程放化疗的比较
共识9:对于局部进展期直肠癌选择术前治疗策略时,短程放疗及长程放化疗均是可选择的标准治疗策略,现有研究比较发现两者在局部控制率及长期生存方面差异无统计学意义。在选择放疗方式时,更多的需要依据治疗目标进行选择,对初始肿瘤负荷较大、肿瘤外侵较明显时,长程放化疗降期效果更好,能够提供更高的肿瘤退缩及更高环切缘的阴性率;对于放化疗耐受性较差的患者或肿瘤局部外侵较不明显时,短程放疗费用低、时间短、耐受性更好,能够提高治疗的依从性。另外,考虑到长程放化疗肿瘤退缩程度更高,将获得更高的pCR率,因此如果在获得pCR的治疗目标下可更多的考虑长程放化疗治疗。
4.2 术前放化疗中同期化疗方案的选择
随着术前放化疗作为局部进展期直肠癌标准治疗策略的确立,对于不同的化疗药物在放疗同期的应用开展了一系列的临床研究,包括氟尿嘧啶(5-FU)类单药、联合奥沙利铂或伊利替康的化疗方案。
4.2.1 氟尿嘧啶单药
术前长程放疗结合同期化疗的早期临床Ⅲ期随机对照研究主要有以下2项:EORTC22921和FFCD9203研究,对比术前放疗加或不加5-FU是否能提高疗效。EORTC22921研究是一项2×2设计的临床Ⅲ期研究,对局部进展期直肠癌患者根据术前接受单纯放疗还是联合化放疗,术后是否接受辅助化疗分为4组:术前放疗+手术;术前放化疗+手术;术前放疗+手术+术后化疗;术前放化疗+手术+术后化疗。结果显示,单纯放疗未加用任何化疗组复发率为17.1%,而只要加用了化疗,无论术前化疗还是术后化疗,复发率都下降至8%,差异有统计学意义。对于DFS和OS,4组之间差异均无统计学意义[29-30]。FFCD9203研究将局部进展期直肠癌患者随机分为术前单纯放疗组和术前联合放化疗组。放化疗剂量选择与EORTC22921相同,结果显示联合放化疗组pCR显著升高,5年局部复发率显著降低;而在DFS和OS方面,差异无统计学意义[31]。
这两项临床研究证实了与单纯术前放疗相比,联合5-FU的术前放化疗能够进一步降低局部复发率。
4.2.2 奥沙利铂联合氟尿嘧啶
奥沙利铂曾被寄予厚望来提高新辅助放化疗疗效,在早期的临床Ⅱ期研究中,奥沙利铂+5-FU用于新辅助放化疗取得了理想的pCR率。为了进一步证实奥沙利铂的新辅助治疗价值,目前共有5项临床Ⅲ期研究对新辅助治疗中加用奥沙利铂是否提高疗效进行了分析。
法国的ACCORD12/0405研究[32]:对比了盆腔放疗45 Gy联合卡培他滨增敏和盆腔放疗50 Gy联合卡培他滨+奥沙利铂的直肠癌术前放化疗方案。结果显示,剂量强度的增加造成了3度以上不良反应明显增加,但主要研究指标pCR却未能获益。意大利STAR-01研究[33]:局部进展期直肠癌患者随机分入5-FU单药增敏组和奥沙利铂+5-FU联合增敏组。但研究结果同样令人失望,2组pCR率相同,而不良反应尤其是腹泻却明显的增加。美国NSABP R-04研究[34]:局部进展期直肠癌患者被随机分为5-FU或卡培他滨联合或不联合奥沙利铂。结果显示联合奥沙利铂组在pCR率、手术降期率、保肛率和手术淋巴结阳性率方面差异均无统计学意义,但有更多的3 ~4度腹泻反应。德国CAO/ARO/AIO-04研究[35]:局部进展期直肠癌患者随机分入5-FU组或奥沙利铂+5-FU组 。结果显示,加用奥沙利铂总的3 ~4度不良反应并未增加;手术R0切除率、环切缘方面,2组也类似;而在pCR方面,加用奥沙利铂组明显优于5-FU单药组。荷兰PETACC-6研究[36]:Ⅱ/Ⅲ期直肠癌患者随机分入放疗联合卡培他滨单药或卡培他滨+奥沙利铂组,结果也令人失望,在加入奥沙利铂后,pCR未能得到提升,但不良反应显著增加 。
综合这5项研究,奥沙利铂在新辅助治疗中的价值令人遗憾,除了德国CAO/ARO/AIO-04研究外,其余4项研究均认为奥沙利铂显著增加了不良反应尤其是腹泻的发生,而近期疗效pCR没有明显提高。而远期疗效上,目前有4项研究报道了3年局部控制率、DFS和OS的结果,从数据上看,长期的随访结果也难以令人满意。因此,在目前的证据基础上,奥沙利铂并不被推荐用于局部晚期直肠癌新辅助放化疗中。但考虑到中国人群直肠癌发病中位年龄比欧美国家年轻约10岁,中国直肠癌患者因年纪较轻,对放化疗的耐受性也相对更好,因此有必要设计符合中国人群的临床试验来验证奥沙利铂在新辅助治疗中的价值。中山大学肿瘤防治中心的汪建平教授领导的团队设计了FORWARC临床研究。对接受了新辅助治疗的局部进展期直肠癌患者随机分组,分别予以5-FU单药化疗联合放疗(A组)、mFOLFOX6化疗联合放疗(B组)及单纯mFOLFOX6化疗(C组)。初步结果显示,3组pCR率依次为14.3%、28.0%和6.1%,A、B两组术后并发症(吻合口瘘和切口感染)均高于C组。需要指出的是,该研究未采用国内外标准的同步放化疗方案,而是全身化疗与单纯局部放疗的简单叠加,所得到的预后结果和不良反应与其他研究不可比;另外,该研究随访期尚短,pCR结果不能代表最终的无瘤生存期。该研究对局部晚期直肠癌术前放化疗模式以及化疗方案进行了探讨,我们期待最终的疗效分析结果。
4.2.3 伊立替康的应用
作为大肠癌化疗的三种有效药物之一,伊立替康和放疗的结合也受到关注。然而,伊立替康在局部晚期直肠癌的术前化放疗研究中却并不顺利,欧美早期进行了一系列的临床I、Ⅱ期研究,但是较高的腹泻发生率是限制其应用的重要原因之一。目前对联合伊利替康的同期放疗增敏的研究尚集中于小样本的临床研究中。
同期放化疗中化疗药物的给药方式及主要研究列举见附录5。
共识10:对局部进展期直肠癌,以5-FU为主的化疗药物与放疗的联合能够进一步改善局部控制率;相比术后放化疗而言,不良反应更小,耐受性好。然而,目前的证据主要支持5-FU单药与放疗的联合以改善局部控制率及提高肿瘤退缩率;对于奥沙利铂+5-FU与放疗的联合多数研究均未得出肯定的临床获益,同时合并了显著增高的不良反应,因此目前不推荐临床应用。
4.3 新辅助放化疗或放疗与手术的间隔时间
对于接受新辅助放化疗或放疗局部进展期直肠癌患者而言,新辅助治疗结束后与实施手术的时间间隔一直存在争议。国际上推荐对于常规分割新辅助放化疗的患者间隔时间为6 ~8周(European Society for Medical Oncology推荐)或5 ~12周(NCCN指南推荐),对于短程放疗的患者间隔时间为放疗结束后7 ~10 d[37-38],采用该时间间隔的主要依据来源于几个证明新辅助放化疗价值的前瞻性随机对照临床试验[24,39]。近年来由于局部进展期直肠癌患者放化疗后的非手术治疗和局部切除的应用,使得术前治疗与手术的间隔时间这个问题显得尤为重要。在欧洲和美国的几个来源于癌症数据库大样本的回顾性研究发现,新辅助治疗结束后10 ~12周进行手术的患者有更高的机会在术后达到pCR,同时也发现10 ~12周之后再延长等待时间pCR率不再提高,甚至对切除满意度及OS有负面影响[40-42]。但是这些结果仍然需要在前瞻性临床研究中进一步证实,因此对于常规分割放化疗的患者,目前新辅助治疗与手术的间隔仍然以6 ~8周为主,在部分有获得pCR希望或期望肿瘤进一步退缩以提高保肛机会的患者中至多可以延长至12 ~14周。
对于采用短程放疗的直肠癌患者而言,大部分仍然采用放疗结束后7 ~10 d内进行手术切除的时间间隔,尽管目前有部分研究(StockholmⅢ研究)发现,短程放疗后延长手术时间间隔亦进一步改善肿瘤退缩、提高pCR率[43-44],但仍然缺乏更多的数据。
共识11:新辅助放疗或放化疗后与手术的时间间隔仍然是有争议的一个问题,对常规分割的新辅助放化疗患者,新辅助治疗与手术的间隔目前仍然以6 ~8周为主,在部分有获得pCR希望或期望进一步退缩以提高保肛机会的患者中可以至多延长至12 ~14周;对采用短程放疗的患者,大部分仍然采用放疗结束后7 ~10 d内进行手术切除的时间间隔。
4.4 直肠癌的术后辅助放化疗
术后辅助放化疗的最大的优势在于其对病例的选择基于术后病理分期,能够更准确的选择合适的病例,其作为局部进展期直肠癌的主流策略之一应用近20余年,但2004年以后在欧美等发达国家逐步被术前新辅助治疗所代替。较早期欧美国家的多个前瞻性临床试验证实,对局部进展期直肠癌而言,与单纯手术组相比,术后辅助放化疗显著降低了局部复发率,但对DFS和OS的改善仍然存在争议[18,20,45-47]。辅助放化疗的主要缺点是放疗对小肠和盆腔组织存在毒性反应,放射敏感性相对较差,以及会阴伤口的严重疤痕等。然而,目前在我国由于医疗技术水平和患者认识水平的差异,未能进行新辅助放化疗而直接手术的直肠癌患者仍然占多数,其中许多患者接受了术后的辅助放化疗。
目前,由于术前分期的准确性仍然有待进一步改善,因此部分术前分期过低的直肠癌患者可能直接接受了TME手术,而术后病例证实其为局部进展期直肠癌,这部分患者亦可能为辅助放化疗的适应证患者,而在这部分患者中,pT3N0的患者是否需要辅助放化疗目前仍然存在争议。研究发现,对于pT3N0的直肠癌患者可以分成若干的危险度组,对于上段pT3N0的直肠癌,取样淋巴结在12个以上同时能够施行较好的TME手术时,其单纯手术的10年累积局部复发率低于10%,对这部分患者可考虑不给予辅助放疗或放化疗。
直肠癌辅助放化疗的放疗技术参数及化疗给药方式见附录6。
共识12:在局部进展期直肠癌中,术后辅助放化疗较单纯手术治疗能显著降低局部复发率,对生存时间的改善不明确;但由于辅助放化疗疗效及患者生活质量均不如术前放化疗,目前正逐步被术前新辅助放化疗所代替。由于分期不准或其他因素未能接受术前新辅助放化疗的pT3-4N0-1局部进展期直肠癌可考虑接受辅助放化疗,但是对相对高位的pT3N0直肠癌辅助放化疗可选择性应用。
5 直肠癌的非手术治疗
长期以来,对于局部进展期直肠癌患者,术前新辅助放化疗联合根治性全系膜切除手术联合或不联合术后辅助化疗是最常用的标准治疗策略之一。新辅助放化疗的价值不仅在于进一步降低了局部复发率,还在于新辅助放化疗后的肿瘤标本的病理缓解率的评估为预测患者预后提供了一个很好的预后因子,体现了个体化治疗的重要理念。多项研究证实通过新辅助放化疗后达到pCR的患者,5年的局部复发率、无复发生存率及OS较未达到pCR的患者均有显著的改善[48-49],因此pCR的实现是新辅助放化疗的重要优势之一。 尽管新辅助放化疗结合TME手术能够获得较佳的根治效果,但是放化疗后TME手术具有较高的并发症、长期的生活质量的影响及部分患者需要永久性造口等缺陷。因此越来越多的研究关注于对新辅助放化疗后的局部进展期直肠癌患者进行分层,对pCR的患者探索非手术治疗的价值。然而目前最准确的pCR的判断需要对TME手术的标本评估才能获得,而在TME手术切除之前的各种临床判断方法,包括肛指检查、内镜检查、活检及影像学检查(CT、MRI、EUS及PET/CT),均难以准确预测pCR。然而,即使存在不能准确预测pCR的缺点,放化疗后的临床评估仍然具有重要价值,在临床评估达到cCR的患者是目前研究中最接近pCR的预测指标,从而建立了局部进展期直肠癌新辅助放化疗后的非手术治疗(non-operative modality,又名watch-and-wait approach)这一创新性的治疗策略。在实践中亦发现cCR的患者采用非手术治疗,部分患者能够达到与传统标准根治术相当的治疗效果且显著改善患者的生活质量。巴西的Habr-Gama于2004年和2006年报道了99例新辅助放化疗后达到cCR并持续超过12个月的患者,采用非手术治疗的策略,5年总的复发率仅为13%;其中局部复发率为5%,全身转移率为8%,且能对5%的局部复发患者行挽救治疗;5年OS和无复发生存率分别达到93%和85%[50]。其他来自荷兰和美国的研究也进一步证实了新辅助放化疗后cCR患者行非手术治疗的良好效果[51-52]。
需要指出的是,cCR患者非手术治疗取得的成功依赖3个要素:① 严苛的cCR判断标准;② 非常密切的随访方案;③ 及时的挽救性手术。目前对cCR的判断尚无统一的判断标准,国际上主要参考巴西研究的判断标准:① 直肠MRI评估直肠内无可见肿瘤病灶;② 直肠MRI评估直肠系膜及周围无明显肿大淋巴结;③ 内镜检查直肠黏膜未见明显肿瘤;④ 内镜在直肠腔内原发灶部位及其他任何可疑部位多点活检未见肿瘤;⑤ 肛指检查直肠腔内黏膜完整无明显肿瘤。必须同时满足以上5点才能判断为cCR,持续的cCR要求达到12个月以上。采用非手术治疗的cCR患者的随访较常规根治性手术的随访要更加密切,要求随访的手段于非手术治疗方案开始前的评估手段一致,包括临床肛指检查、直肠MRI检查、全身CT检查、内镜检查及可疑部位的活检;而随访间隔要求前两年内每2 ~3个月进行一次盆腔相关检查,每3 ~6个月进行胸部及腹部CT检查,两年后可根据情况适当延长随访间隔;以期通过以上手段的重复检查保证患者达到持续的cCR,并早期发现复发病灶及其行挽救性治疗。文献报道采用非手术治疗开始的1 ~2年内的局部复发85% ~90%能够行挽救性治疗,仍能获得80%以上的持续无复发生存[50,53]。
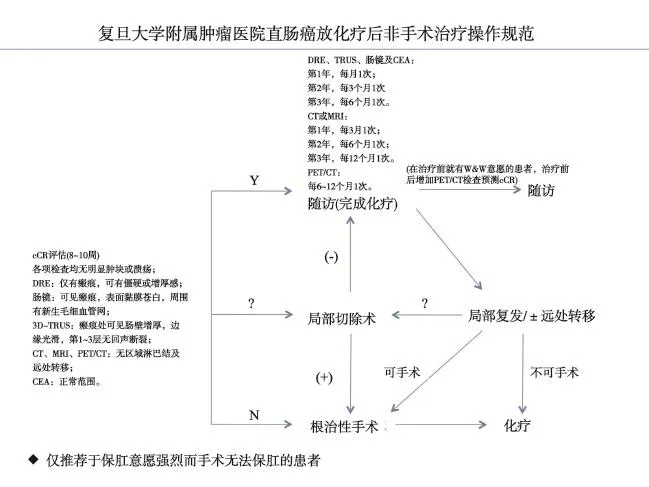
复旦大学附属肿瘤医院直肠癌放化疗后非手术治疗操作规范见附录7。
共识13:局部进展期直肠癌新辅助放化疗后达到持续cCR(12个月以上)的患者,采用watch-and-wait approach的非手术治疗策略是可选择的一个方案,肿瘤学效果与传统治疗策略相当,同时使患者获得更好的生活质量。但是必须严格判断达到持续cCR的病例,进行持续而密切的随访,必要时及时进行挽救性治疗;对不能同时满足以上辑点的医院或患者不推荐采用非手术治疗策略。然而目前在cCR的判断、随访的间隔及随访项目、挽救性治疗的时机方面均未获得公认的方案,需要深入研究。
6 局部进展期直肠癌的手术治疗
直肠癌的手术最早开展于18世纪,随着医疗技术水平的不断进步,直肠癌术式不断发展,现如今不再停留在肛门和括约肌功能的保留上。进入 20 世纪 90 年代后,研究者们又开始致力于扩大保留功能范围的研究,即保留盆腔自主神经的直肠癌手术[54]。性功能和排尿功能的保留也越来越多地受到医师的重视。21世纪以来,微创外科手术在越来越多的传统手术领域都获得了巨大的成功[55]。技术与理念的进步,也使得直肠癌手术的方法不断创新。
6.1 局部进展期直肠癌的手术切除
6.1.1 全系膜切除的原则
1982 年英国的Heald等[56]在中低位的直肠癌手术中引入了全直肠系膜切除的概念(即TME):在中低位的直肠癌手术中,强调在骶前间隙中直视下利用锐性手段,将直肠及其完整的系膜游离至盆底肌水平,按此原则切除的中低位直肠癌标本包括了病变所在的肠段及其完整的直肠系膜。Heald等[56]认为直肠癌的外周浸润和周围的微转移病灶主要局限于直肠固有筋膜之内,除非肿瘤已经突破固有筋膜或者盆底肌。只有全系膜切除,才能最大程度地降低系膜中散在肿瘤组织在骶前间隙残留的可能性,降低局部复发率。如今,TME概念已经受到广泛的认可,成为直肠癌根治术中依循的经典原则。
6.1.2 切缘与根治
直肠癌手术肿瘤根治的一个关键点在于远端切缘是否有足够的长度,是否能保证切缘阴性。一系列研究显示,2 cm远端切缘足以使肿瘤切除完全并使患者获得良好的长期生存,因而这一标准得到了广泛认可,成为目前保肛手术下切缘标准的主流。NCCN指南指出对于实施TME手术的患者1 ~2 cm的远端切缘距离是可以接受的,但必须进行术中冰冻病理检查以明确切缘阴性。
20世纪80年代,英国利兹大学的病理学医生Quirke等[57]系统地研究了直肠癌环周浸润与术后局部复发的关系,并提出了“环周切缘”(circumferential resection margin,CRM)的概念,即肿瘤浸润最深处与直肠系膜切除边界间的最短距离,当该距离小于1 mm 时被认为存在环周切缘阳性。研究发现,环周切缘阳性(小于等于1 mm)是导致直肠癌术后局部复发的主要因素[58],同时也适用于接受新辅助治疗的患者,是术后作治疗决策时的重要指标之一。目前环周切缘也成为评价TME手术效果及手术满意度的重要指标。
6.2 局部进展期直肠癌的手术方式
局部进展期直肠癌的手术方式多样,但基本在经腹会阴直肠癌根治术(abdomenoperineal resection,APR)与直肠前切除这两个基本手术方式的基础上演变而来,如柱状切除术、经括约肌间切除术、翻出术、拉出术等手术方式。而由于新辅助放化疗的应用,部分直肠癌患者肿瘤退缩显著,使得原先仅用于早期直肠癌的局部切除成为进展期直肠癌患者控制肿瘤并获得良好生活质量的一种新的选择。
6.2.1 经腹会阴直肠癌根治术
APR手术自1908年提出之后,一直作为治疗低位直肠癌的标准手术方式。 Miles认为,根治性手术的范围应当包括全部盆腔结肠、髂总动脉以下全部结肠系膜和淋巴结、肛周皮肤、脂肪组织和肛提肌群。这在当时具有划时代的意义,因为他引进了癌细胞经淋巴管转移的概念,并变为了R0的切除,显著降低了患者的局部复发率,提高了患者的长期生存率。目前在国内外各级医院,对于距肛8 cm以内,尤其是距肛5 cm以的低位直肠癌,APR手术目前仍作为标准术式开展,但随着保肛手术技术的发展,距肛距离已经不再是一个独立的评估指标,需结合患者多方面因素。
6.2.2 直肠前切除术
研究显示,低位直肠癌的引流方向是向上、向侧方的,肿瘤下方的肠段存在保留的可能,这为保肛手术的根治效果提供了重要依据。随着管型吻合器的发明,低位肠段吻合的难度显著降低,对于肿瘤根治性切除后,肛提肌上方残余直肠大于2 cm的患者,采用吻合器的直肠前切除手术目前仍为首选,其长期生存和无病存活率均不亚于APR手术[59]。近年临床实践证明,在齿状线上方如保留 l cm 的直肠壁,术后排便功能可基本保持正常。
目前直肠前切除术主要应用于肿瘤距齿状线5 cm以上,远端切缘距肿瘤下缘1 ~2 cm或以上的直肠癌患者。随着超低位前切除术的开展,肿瘤下缘距齿状线3 cm或距肛缘5 cm左右的直肠癌,在确保游离后肿瘤下切缘阴性的前提下,也可以行前切除术获得根治的效果。
6.2.3 柱状经腹会阴直肠癌根治术
传统APR 按照TME游离直肠,随着远端直肠系膜的缩小,手术平面靠近直肠肌管,进而使手术标本形成狭窄的“腰部”。如肿瘤位于该狭窄部位,则此处环周切缘阳性率及术中肠管穿孔发生率较高[60]。2007年,Holm等[61]提出了柱状APR的手术方式,在俯卧位下行广泛的会阴部切除,使标本成为无狭窄腰部的圆柱状,以增加远端直肠癌周组织的切除量,柱状APR更强调切除全部的肛提肌,最大限度减少藏匿在其中的残留肿瘤。
柱状APR较传统APR相比,通过改变体位扩大手术切除范围来降低环切缘阳性率,减少局部复发率,并且由于会阴手术视野开阔,减少了术中肠管穿孔的发生,同时降低了手术难度。研究表明,柱状APR可降低环周切缘阳性率,改善患者预后,而不会增加患者的死亡率[62]。
然而柱状APR术后盆底留有较大缺损。如果采用直接缝合的方法,术后有较高可能发生会阴口撕开、 感染、血肿及盆底疝,其并发症高达62.5%[63],尤其对于术前放化疗者更增加了上述危险性[64]。Bullard等于2006年报道直肠癌特别是行术前新辅助放化疗者,APR术后一期缝合会阴部伤口愈合更为困难,建议对难愈性会阴伤口采用其他替代方法,如转移肌皮瓣以及生物材料修补重建盆底。
目前柱状APR手术主要适用于术前接受了新辅助治疗,分期为T3、T4期低位直肠癌,尤其是肿瘤侵犯肛提肌的患者。
6.2.4 经括约肌间切除术
1994 年,Schiessel等[65]提出了直肠内括约肌切除保留肛门的术式,即经括约肌间切除(intersphincteric resection,ISR),对于肿瘤浸润深度在内括约肌以内的患者,在保证 TME 的前提下部分或全部切除肛门内括约肌。通过牺牲一部分内括约肌使肿瘤远端肠管切缘达到1 cm,从而避免切除肛门。
ISR与APR术的适应证并不一致,所以行ISR 与 APR 术的患者存在一定异质性。故尚无法理想比较 ISR 与 APR 术的优劣。但大多观点认为,ISR手术肿瘤学效果与 APR手术比较差异无统计学意义,甚至更好。一项系统综述显示[66]:ISR 手术 R0 切除率为 97.0%,围手术期病死率为 0.8%,总并发症发生率为 25.8%,局部复发率为 6.7%(中位随访时间 56 个月),5年中存活率为 86.3%,无病存活率为 78.6%。其根治效果和长期预后不亚于 APR术[67]。值得注意的是一般情况下行ISR的患者分期较早。
ISR术后排便功能的影响与手术的切除范围以及是否行术前放疗密切相关[68]。术中切除肛门内括约肌越多,术后肛门功能恢复越差。术前放疗不利术后肛门功能恢复。其他包括肿瘤远端与肛门直肠环的距离、吻合口与肛缘的距离、高龄或本身肛门括约肌松弛等因素都会影响ISR术后排便功能。
关于进展期直肠癌在新辅助治疗后行ISR的可行性及肿瘤学疗效尚有待多中心、大样本的前瞻性研究结果。
6.2.5 局部切除
直肠癌的局部切除可通过多种入路完成,如经肛门、经肛门括约肌、经骶尾等。其中以经肛门切除最常用,主要术式有经肛门直视下局部切除术(transanal excision,TAE),经肛门内镜下微创切除术 (transanal endoscopic microsurgery,TEM)和经肛门微创手术(transanal minimally invasive surgery,TAMIS)等,手术仅切除肿瘤原发病灶,不行区域淋巴结清除。标本完整切除,组织学特征良好,切缘阴性的T0和T1期直肠癌被认为是局部切除的最佳适应证。局部切除术后的标本必须进行详细的病理检查,特别是基底切缘。一旦出现切缘阳性[69],肿瘤低分化或脉管浸润,患者的术后复发率将显著升高,必须进行挽救性手术 。
新辅助治疗可能使更多患者从局部切除手术中获益,尤其是对于新辅助治疗后达到cCR的患者。Bhangu等[70]指出,T1~T2期直肠癌患者或可在新辅助治疗后予以安全局部切除。经新辅助治疗的T2~T3期患者明显降期,局部切除后随访的结果也较满意。Kim等[71]对26例 cCR患者进行局部切除,平均随访时间24个月,未见局部复发者,其中仅1例发生远处转移,5 年生存率达到了96.15% ,认为对部分T2~T3期患者经新辅助治疗后肿瘤缩小、降期达到cCR后可以采用局部切除治疗。
我们认为,进展期直肠癌行新辅助治疗后如评估为cCR,可考虑行局部切除。进一步明确退缩情况,如无残留,可进入等待观察临床试验;如有残留则仍进一步行根治性手术。对于局部切除治疗新辅助治疗后的进展期直肠癌,尚待长期随访以及大规模的临床数据来验证其安全性。
6.3 局部进展期直肠癌的淋巴结清扫
6.3.1 侧方淋巴结清扫
直肠淋巴结引流途径包括上方、侧方及下方途径,淋巴结转移是直肠癌复发转移的重要原因。20世纪50年代以来,日本学者发现直肠癌的淋巴结转移规律也遵循直肠正常的淋巴引流规律。由此提出了侧方淋巴结清扫的直肠癌扩大根治术。
日本学者早在20世纪70年代就致力于开展侧方淋巴结清扫的扩大根治术,且认为侧方淋巴结清扫可减少盆腔复发,并提高长期生存率[72]。日本临床肿瘤学组开展了大规模临床试验JCOG0212,对701例临床Ⅱ期、Ⅲ期低位直肠癌患者,随机分配接受TME或TME联合侧方淋巴结清扫,5年无复发生存率在联合侧清组和单纯TME组分别为73.4%和73.3%。局部复发患者的数量分别为25(7.1%)和44(12.6%) (P=0.02)。单纯TME组的非劣效性未被证实(P=0.055),而联合侧方淋巴结清扫可以显著降低术后局部复发。但值得注意的是目前大部分相关日本学者的研究中,都未纳入新辅助治疗以比较其与侧方淋巴结清扫对于进展期直肠癌的疗效。
欧美学者认为侧方淋巴结是第3站淋巴结,其受累已属晚期,是全身转移的一部分,局部的扩大清扫无法提高生存率。与此同时,全直肠系膜切除联合新辅助治疗对根治直肠癌已足够,而扩大的侧方淋巴结清扫几乎必然伴随手术时间的延长和并发症的增加。Nagawa 等[73]的研究显示,术前放疗联合TME及侧方淋巴结清扫组与术前放疗组联合单纯TME组比较,患者局部复发及远期生存率差异均无统计学意义,而侧方淋巴结清扫造成了更多的术后并发症。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)和NCCN指南不推荐常规开展盆壁侧方淋巴结的清扫,除非临床怀疑有转移。有Meta分析显示[74],侧方淋巴结清扫在局部复发和长期生存方面并无显著获益,却会提高术后并发症发生率,并引发排尿功能障碍和性功能障碍。
因此目前对于是否应当扩大清扫盆壁的侧方淋巴结还没有统一的定论。在新辅助治疗的大背景下,是否行侧方淋巴结清扫应根据患者治疗后的淋巴结反应情况进行有选择性的手术治疗。
6.3.2 根部淋巴结清扫
肠系膜下动脉(inferior mesenteric artery,IMA)根部淋巴结指从IMA起始部至左结肠动脉起始处之间的淋巴结,是直肠癌淋巴引流的第3站淋巴结,也是进展期直肠癌淋巴结转移的重要途径[75]。文献报道IMA根部淋巴结转移率为0.7% ~11.6%[76]。IMA根部淋巴结阳性患者,其术后肿瘤复发率可达67.4%[77]。因此对于进展期直肠癌患者,行IMA根部区域淋巴结清扫尤为重要,可最大限度地清除病灶,有利于提高手术后综合治疗效果。
有学者主张高位结扎,即于IMA根部离断不保留左结肠动脉,认为由于采取高位结扎时同时对IMA根部淋巴结进行了清扫,清扫范围更彻底,提供了更多的淋巴结,因此对于疾病术后的分期和判断预后提供了更多信息。然而,Pezim等[78]回顾性的分析了1 370 例直肠癌病例,其中 784 例行高位结扎,另外 586 例行低位结扎,发现二者5年生存率差异无统计学意义。Dworkin 等[79]的研究指出,IMA根部结扎后,乙状结肠浆膜的血运显著下降,可能导致吻合口供血不足。主张低位结扎的学者认为低位结扎时保留了左结肠动脉,对吻合口近的血供影响不大,因此有助于预防术后吻合口瘘的发生。因此在彻底清扫IMA根部淋巴结,在保证彻底根治程度的基础上保留左半结肠血管,可改善吻合口区的血供,降低吻合口漏发生的风险,这对老年患者尤其有意义。
共识14:手术切除是局部进展期直肠癌患者获得根治的最重要的治疗手段之一。传统的各种手术方式均必须在全系膜切除的原则下进行操作,肿瘤患者的肿瘤部位、身体条件、外侵程度、术前治疗疗效等多个因素选择合适的手术方式,在保证肿瘤根治性切除的基础上,尽量提高患者的生活质量。
对于新辅助放化疗后肿瘤显著退缩达到cCR的患者,局部切除可作为一个可选择的方案,但应用必须非常慎重并密切随访。
侧方淋巴结清扫的意义仍然未得到公认,尤其在新辅助放化疗的背景下,对治疗前无肯定侧方淋巴结转移的患者可不常规行侧方清扫,对治疗前怀疑侧方淋巴结转移的患者可根据患者新辅助放化疗后的影像学评估选择性地实施。局部进展期直肠癌手术的总体原则以肿瘤的根治性为第一要务,保证根治性的前提下兼顾患者的生活质量。
6.4 局部进展期直肠癌的微创治疗
6.4.1 腹腔镜直肠癌根治术
目前在国内外,腹腔镜手术在大肠癌中已经广泛开展。结肠癌腹腔镜手术已经成为标准手术方式之一。但是目前直肠癌的腹腔镜手术是否能够作为标准手术方式之一仍然存在一定争议。
1993 年,西班牙的研究者率先开展腹腔镜与开腹结肠癌手术的随机对照试验,此后美国的COST、欧洲的COLOR Ⅱ研究、英国的CLASICC及韩国的COREAN等随机对照试验研究陆续开展。其中CLASICC 研究[80]纳入了部分低位直肠(5 ~8 cm) 保肛手术。该研究的结果显示,在接受前切除手术的患者中,腹腔镜技术导致了潜在较高的环周切缘阳性率(12% vs 6%,P=0.19),而在手术死亡率、并发症发生率、术后生活质量方面差异无统计学意义。COLORⅡ研究[81]于2013年报告了初步结果。结果显示,腹腔镜手术中转率为17%。与开腹手术相比,腹腔镜手术时间较长,但失血量少,术后肠功能恢复更快,术后住院时间较短。腹腔镜组和开腹组的肿瘤分期、肿瘤大小和病理类型差异均无统计学意义,下切缘距离、切缘阳性率和淋巴结清除数差异亦无统计学意义。而针对新辅助化疗后直肠癌手术,韩国的COREAN研究[82]得出了相似的结论,研究者认为对于有经验的医生,直肠癌腹腔镜手术,完全可以达到与开腹手术同样的治疗效果,同时术后康复更快。
NCCN指南尚未对腹腔镜应用于直肠癌手术给予最高等级的推荐。对于环切缘阳性风险高的局部进展期直肠癌以及肠梗阻或穿孔的患者,腹腔镜直肠癌手术仍不作推荐。目前,全世界许多肿瘤治疗中心均开展了直肠癌腹腔镜手术的临床试验。
6.4.2 机器人直肠癌根治术
中国机器人手术尚处于起步阶段,国内一些肿瘤治疗中心已经开始开展机器人直肠癌手术。
达芬奇系统是目前主流的机器人手术平台,与传统腹腔镜手术相比,达芬奇系统学习曲线较短,相对简便易学[83]。机器人手术也存在以下缺点:使用费用较高,术者操控时无法获得牵拉组织时产生的力反馈,配套操作器械的种类较局限,机械臂较大,拆卸时间长,在人体内的自由活动空间小难以胜任多个部位或解剖范围大的手术等。
机器人直肠癌手术的适应证与禁忌证与传统腹腔镜手术类似。2009 年 Patriti等[84]报道了机器人辅助直肠癌根治术的中期结局(平均随访 20.2 个月),3 年OS及DFS分别为 92.6%和 73.7%;随后的多中心研究[85]提示(平均随访 17.4 个月),中转开腹率为4.9%,3年OS 为97%,3年DFS为77.6%,局部复发率为0。系统综述分析[86-87]提示,机器人与腹腔镜术式治疗直肠癌,在淋巴结检出率、局部复发率、远处转移率和总复发率方面比较差异均无统计学意义。
共识15:直肠癌的微创手术技术主要包括腹腔镜手术及机器人手术,腹腔镜直肠癌根治术能否作为常规开展的标准手术方式之一存在一定争议,主要集中于术后样本对环切缘的完整性方面,而是多个临床研究尚未获得肿瘤学效果的结果。建议对有经验的腹腔镜外科医生可开展直肠癌的腹腔镜根治术,并严格掌握适应证;对于既往手术引起严重腹腔粘连,局部晚期疾病或急性肠梗阻或穿孔的患者,则不适宜行腹腔镜直肠癌手术。而达芬奇手术应根据各医院的实际情况进行开展,推荐在临床研究的基础上逐步累积治疗经验,同时亦要考虑患者经济支出的增加。
7 局部进展期直肠癌的术后病理评估
在多学科综合治疗的广泛应用下,病理科正发挥着越来越大的作用。对于局部进展期直肠癌,完整规范的病理诊断能够协助临床医生更准确地预测患者的预后,协助外科医生评判手术的根治性,协助放疗科医生评估放化疗治疗的敏感性,协助化疗科医生制定术后化疗方案;此外,详尽的病理诊断有助于临床医生了解肿瘤的个体生物学特征并以此预测患者治疗的敏感性。因此,局部进展期直肠癌,特别是接受新辅助放化疗后的直肠癌,根治术后的样本评估对判断预后及指导后续治疗具有至关重要的作用。
7.1 标本的处理
7.1.1 系膜完整性评价和标本的预处理及固定
收到标本后应仔细核对标本基本信息,如姓名、送检科室、标本类型和送检份数等。
观察并记录标本的基本情况,包括是否有穿孔、组织缺损和系膜完整性。完整的TME术可有效降低局部复发率和显著增加5年生存率。病理检查是评价直肠系膜完整性最直观的方法,包括环周切缘、肿瘤距环周切缘的距离。直肠系膜完整性的判断标准见表3。
用墨汁标记直肠系膜切缘(图1)。通常沿肿瘤对侧剪开肠管,将肠管铺平固定于木板或石蜡板上,标本完全浸没于4%甲醛溶液中,以确保标本的充分暴露和固定。建议标本在离体后30 ~60 min内进行标记、切开、固定等初步处理;建议固定液的量应为组织的10倍;标本的固定时间为8 ~48 h。
7.1.2 标本的大体描述
描述肠管,记录肿瘤的特征,包括大体类型(蕈伞型、溃疡型及浸润型)、部位、大小(新辅助治疗后标本若无肉眼明确肿块,描述肠黏膜的改变(如溃疡、水肿、疤痕等)及范围)、数目、浸润深度、肿瘤与两侧切缘以及环周切缘的距离。环周切缘用于完全无腹膜覆盖肠段的切缘描述(图2)。
切除标本若包含肛管、肛周皮肤,应描述肿瘤有无累犯,皮肤有无改变(如湿疹样改变)。淋巴结取材应按淋巴引流方向进行分组,一般分为肿块旁淋巴结,肠系膜淋巴结,尖淋巴结。记录淋巴结的数目、大小。

表 3 直肠系膜完整性的判定标准
图 1 墨汁染色的直肠癌经腹会阴根治术标本(固定前和固定后)
图 2 固定后切开肠壁的直肠癌标本
7.1.3 标本的取材
⑴ 肿块:沿肠壁长轴、垂直于肠壁切取肿瘤组织,视肿瘤大小、浸润深度、不同质地、颜色等分别取材4 ~6块,取材应包括肿瘤浸润最深处(注意浆膜面或环状切缘)、肿瘤与肿瘤周围交界处的组织;若病变不明显或新辅助治疗后根治术标本,根据肠镜和影像描述的原肿瘤区域或可疑区域(瘢痕或纤维化区)需全部取材。如见其他异常病灶(如息肉、憩室等),应取材。推荐取材组织大小不大于2.0 cm×1.5 cm×0.3 cm。
⑵ 切缘:取远侧、近侧手术切缘。肿瘤位于腹膜返折以下时,需取环周切缘。
⑶ 切除标本若包含肛管、肛周皮肤且有肿瘤累犯或有异常,均需取材。
⑷ 包埋所有检出的淋巴结,较大淋巴结应剖开包埋。未经新辅助治疗的根治术标本应至少检出12枚淋巴结。
共识16:对于接受根治性TME手术的局部进展期直肠癌,术后标本的病理评估至关重要。采用标准化的预处理、固定及取材程序,有助于准确评价手术切除的完整性、肿瘤浸润深度、环周切缘及淋巴结检出情况。特别对于接受新辅助放化疗的样本,需要结合病史对原肿瘤部位进行充分而广泛的取材,以全面评估肿瘤的退缩程度及残留肿瘤的范围、深度、周围组织反应等。建议对每例患者均进行环切缘的评估。
7.2 病理报告
7.2.1 病理报告内容及规范
病理报告内容应包括以下内容:标本类型、肿瘤部位、肉眼分型、肿瘤大小、组织学分型、组织学分级、浸润深度、有无脉管和神经束浸润、切缘情况(包括近切缘、远切缘、环周切缘)、淋巴结转移情况(包括具体分组)、癌结节情况、新辅助治疗后肿瘤退缩分级(tumor regression grading,TRG)。建议报告病理TNM分级(pTNM)。建议报告微卫星不稳定(microsatellite instability,MSI)、错配修复基因表达情况(MLH1、MSH2、MSH6和PMS2)和分子病理检测K-ras、N-ras及BRAF基因状态。可选择的组织病理学报告模式见图3。
7.2.2 组织学分型
直肠恶性肿瘤的组织学分型见附录8。
7.2.3 组织学分级
直肠癌的组织学分级建议采用高、中、低分化和未分化。
直肠癌组织学分级与分型的相关性见表4。
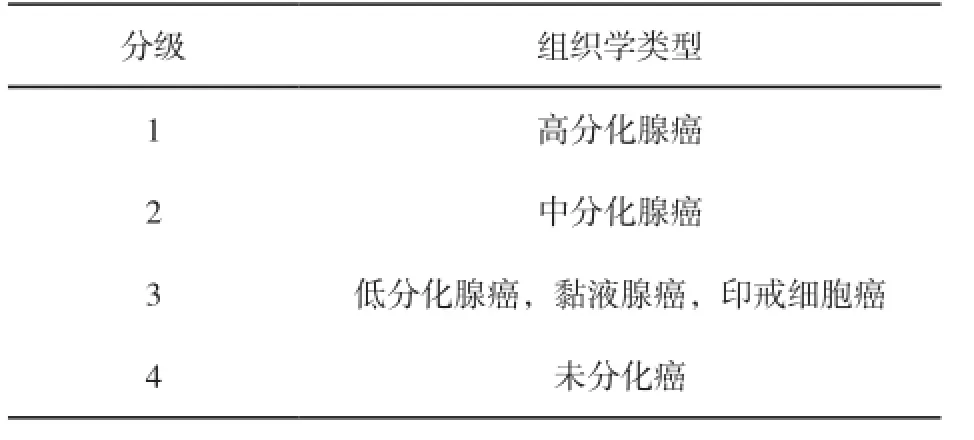
表 4 直肠癌分级与组织学分型的关系
7.2.4 直肠癌TNM分期

图 3 直肠癌术后样本组织病理学报告样例
需要在病理报告中注明患者的TNM分期,目前可采用的分期主要为国际抗癌联盟(Union for International Cancer Control,UICC)和美国癌症协会(American Joint Committee on Cancer,AJCC)的TNM分期方法[88]。对于新辅助放化疗后的患者亦可使用此分期标准,但必须在分期前添加yp,使用ypTxNxMx的分期表述。
美国癌症协会(AJCC 第七版)推荐的TNM分期方法见附录9。
7.2.5 新辅助放化疗后肿瘤退缩分级的病理学评估
目前研究已经证实局部进展期直肠癌新辅助放化疗后样本的肿瘤退缩与患者的预后相关,而对放化疗后样本的评估主要依据残留肿瘤成分以及纤维化的成分来进行病理学退缩的分级[89]。目前针对新辅助放化疗后TRG评分有4种方法[88,90-92],目前尚无公认的最佳TRG评分方法,但均对pCR的评估是一致的。推荐使用AJCC 第七版的TRG评分系统。
4种新辅助放化疗后肿瘤退缩的TRG评估方法见附录10。
7.3 直肠癌常用分子病理检测
7.3.1 MSI与错配修复(mismatch repair,MMR)蛋白检测
MSI存在于约15%的散发性大肠癌以及几乎所有的遗传性非息肉病性大肠癌(Lynch综合征),其发生机制与MMR系统有关。MSI的分类是基于不同单核或双核苷酸重复序列的改变(如:BAT25、BAT26、D5S346、D2S123和D17S250,即Bethesda标准微卫星位点)。根据WHO消化系统肿瘤组织学分类(2010版),高频MSI (high frequency MSI,MSI-H)定义为至少2个微卫星标志物(40%)发生改变。若肿瘤在这5个标准微卫星位点中有一个异常的标志(或多于1个但在更多的标记中少于40%),则被命名为低频MSI (low frequency MSI,MSI-L)。而微卫星稳定(microsatellite stable,MSS)的肿瘤在Bethesda标准微卫星位点上不存在以上改变。MSI也可通过免疫组织化学方法检测错配修复蛋白(MSH2、MLH1、MSH6或PMS2)的缺失进行初筛。有研究显示MSI-H散发性大肠癌与锯齿状病变途径相关,经常伴有BRAF V600E基因突变;而MMR基因突变所致的MSI-H大肠癌(如Lynch 综合征)却没有BRAF基因突变,因此临床上可通过MMR联合BRAF基因检测筛查Lynch综合征患者。MSI或MMR的检测除了可以用于筛选Lynch综合征外,还可以指导临床治疗,如:MSI-H大肠癌可能对特定的化疗方案反应较差(如5-FU),但对伊立替康反应较好。
7.3.2 ras基因突变检测
ras基因是否突变不仅有一定的预后意义,更是抗EGFR治疗有效性的重要生物学标志物。其最常见的方式为点突变,可采用直接测序法或ARMS法进行检测。对于有条件的单位可以对进展期直肠癌的患者进行K-ras第2、3、4外显子以及N-ras第2、3、4外显子的检测。检测样本可来源于治疗前活检标本或治疗后手术标本。
7.3.3 BRAF基因突变检测
BRAF基因突变位点为第15外显子的1799位核苷酸,发生胸腺嘧啶-腺嘌呤转换,导致氨基酸残基V600E的缬氨酸被谷氨酸替代,进而激活MAPK信号通路。推荐检测进展期直肠癌的BRAF V600E突变。研究显示BRAF V600E突变与不良预后有关,尤其对MSI-L/S直肠癌。在有条件的单位亦可作为选择性检测项目之一。
共识17:局部进展期直肠癌推荐建立标准化模块化的病理报告模式,包含对标本的大体描述、镜下分级及分型、切缘情况(上下切缘及环切缘)、淋巴结情况等;并报告病理学分期。对接受新辅助放化疗的病例,除报告病理学分期外,需要对肿瘤退缩情况进行TRG分级。对有条件的单位可以选择性报告MSI、错配修复基因表达情况(MLH1、MSH2、MSH6及PMS2)和分子病理检测K-ras,N-ras及BRAF基因状态。
8 局部进展期直肠癌术后的辅助化疗
局部进展期直肠癌目前推荐接受标准的术前新辅助放化疗,然而对于接受了R0手术切除后的患者是否仍要进一步接受辅助治疗,目前并无定论[93-96]。新辅助治疗和TME术后患者恢复时间较长,辅助治疗能否进一步带来获益、患者又能否耐受足量的化疗剂量存在争议。
8.1 新辅助放化疗后的局部进展期直肠癌术后辅助化疗的争议
在美国,根据NCCN指南大多推荐术后接受4个月以5-FU为主的化疗[97]。这一观点主要是基于在术前新辅助放化疗模式之前,术后辅助放疗和化疗已被证实的有效性。Petersen等[98]认为,5-FU为基础的辅助化疗能显著降低术后直肠癌患者的死亡风险(HR=0.83,95%CI:0.76 ~0.91)和复发风险(HR=0.75,95%CI:0.68 ~0.83),然而该综述纳入的20项随机研究中仅有1项是接受了术前新辅助放化疗[29]。
有4项随机研究探讨了术前新辅助放化疗后直肠癌患者接受术后辅助化疗的价值。
EORTC 22921研究:入组患者接受了术前新辅助放疗(45 Gy/25次)+化疗[5-FU 350 mg/m²,每天,静脉滴注,亚叶酸钙(LV)×5 d,放疗第1周和第5周给药),二次随机接受术后4个疗程5-FU/LV辅助化疗或术后不接受化疗[29]。结论:无论术前或术后,接受化疗均能提高局部控制率。然而,最新随访数据结果显示,是否接受辅助化疗对10年OS(51.8% vs 48.4%,HR=0.91,95%CI:0.77 ~1.09)和DFS(47.0% vs 43.7%,HR=0.91,95%CI:0.77 ~1.08)差异无统计学意义[99]。
该项研究ITT人群中,27%的患者未能接受辅助治疗,完成规定4个周期辅助化疗的比例也不高(57%),采用的化疗方案也仅是静脉推注的5-FU,这几点可能也是导致未能获得阳性结果的硬伤。
非预期的亚组分析数据[30]显示,785例患者接受了R0切除且术中未发现淋巴结转移或远处转移,术后辅助化疗能显著提高新辅助治疗后降期为ypT0-2患者的OS,但对ypT3-4患者无差异。有回顾性研究提出新辅助放化疗的降期作用可能可以预测术后化疗疗效[95],然而,该研究在后续随访中未能再次证实这一相关性[99];其他几项研究中,也未能在新辅助放化疗后显著获得降期患者中发现术后化疗能带来更多获益[97,100]。因此,新辅助治疗带来的病理分期下降可能更多的是一个预后因素而非预测指标[101],但没有前瞻性数据支持足够的统计效能来回答这一问题。
一项前瞻性的意大利协作研究[102]纳入1993年—2003年655例术前新辅助放化疗后的患者。患者术后随机接受了静脉推注5-FU/LV治疗6个疗程或观察随访。研究发现,术后辅助化疗在复发率和OS(5年生存率69% vs 70%)方面都未带来益处,术后病理淋巴结阳性患者ypN+人群中,OS也未能因辅助化疗带来获益(5年生存率:52% vs 51%)。
荷兰的多中心前瞻性结肠癌及直肠癌PROCTOR-SCRIPT研究[103]纳入了437例Ⅱ期或Ⅲ期直肠癌患者,在新辅助放化疗(5×5 Gy放疗+以5-FU为基础)后接受了全系膜切除术,随机接受术后观察(221例)或辅助化疗(216例)。辅助化疗包括5-FU/LV或8个疗程卡培他滨。该研究未能发现术后5-FU单药辅助化疗对5年生存率(79.2% vs 80.4%)、无疾病生存期(HR=0.8,95%CI:0.6-1.07,P=0.13)和复发率(38.5% vs 34.7%)带来获益。
英国ChronicleⅢ期临床研究中[104],新辅助放化疗(以5-FU为主)后手术切除患者术后随机接受18周XELOX(卡培他滨联合奥沙利铂)化疗或不接受辅助治疗。预期入组800例患者,但由于入组困难一共纳入113例患者后提前终止研究。XELOX组3年DFS高于观察组,但差异无统计学意义(78% vs 71%,HR=0.80,95%CI:0.38 ~1.69;P>0.05)。两组OS差异无统计学意义(P>0.05)。
基于以上研究的Meta分析[105]结果显示,5-FU为主的术后化疗不能延长新辅助放化疗患者的OS、DFS和远期复发时间[106]。然而部分研究的亚组分析发现,对新辅助放疗有效后显著降期的患者(cT3-4降期为ypT0-2)及肿瘤位置较高(距肛门10 ~15 cm)的直肠癌患者能够从5-FU的辅助化疗中获得3% ~4%的生存获益,QUASAR的研究也证实了该结果[30,107]。
8.2 辅助化疗方案及药物的选择
很少有Ⅲ期随机研究探讨新辅助放化疗后术后辅助化疗方案的选择,因此具体用哪种化疗方案尚无定论。
化疗方案包括4个月的5-FU/LV(RPMI方案:5-FU 500 mg/m2qw×6,q8w,4个周期;de Gramont方案)、5-FU类单药(卡培他滨)和含奥沙利铂的化疗方案(FOLFOX或XEOX)。与结肠癌一样,伊立替康不推荐用于辅助化疗[108]。有些机构推荐对高危患者接受奥沙利铂为主的化疗,如术前放化疗降期程度较差、ypT3-4或淋巴结阳性[109]。除此之外,是否加用奥沙利铂方案也需要考虑患者的PS状况和伴随疾病情况。
有五项研究探讨了奥沙利铂在术前新辅助放化疗中的价值[32-33,35,110-111]。虽然OS差异无统计学意义,但PETACC[110]和CAO/ARO[35]研究结果都倾向于术前或术后加用奥沙利铂,CAO/ARO研究中加用奥沙利铂组在3年DFS上获得显著性提高。而Ⅱ期ADORE研究[112]则显示,直肠癌切除术后采用与新辅助放化疗相同的含奥沙利铂的方案进行辅助化疗能带来获益。该研究纳入了321例新辅助放化疗(5-FU类药物为主)后接受根治性手术的直肠癌患者,术后病理为ypⅡ或ypⅢ期,随机接受4个月5-FU/ LV静脉化疗(5-FU 380 mg/m2+ LV 20 mg/m2,第1 ~5天,每28 d 1个周期)或FOLFOX方案化疗。该研究在术后进行随机研究,降低了脱落率。随访38.2个月后,采用FOLFOX辅助化疗显著提高了3年DFS(71.6 vs 62.9%,HR=0.66,95%CI:0.43 ~0.99)。FOLFOX组出现恶心呕吐、乏力和感觉神经毒性的患者数更多,但3 ~4度毒性反应发生率差异无统计学意义(P>0.05)。探索性亚组分析中,观察到ypN1b/N2的Ⅲ期患者及肿瘤退缩不明显患者能从FOLFOX化疗中获益。
NCCN指南中,5-FU/LV、FOLFOX或XELOX方案都可用于新辅助放化疗后辅助化疗方案的选择,推荐使用含奥沙利铂的方案。
共识18:目前对于接受新辅助放化疗的局部进展期直肠癌TME根治术后是否需要进行辅助化疗意见并不统一。多数临床研究发现,术后以5-FU为主的辅助化疗并未使患者获得显著的生活获益和降低远期复发率,但是在亚组分析中发现肿瘤降期明显、高位直肠癌的患者能够获得3% ~4%的生存获益。在这方面美国NCCN指南与欧洲ESMO指南均存在不统一的意见。因此目前难以对新辅助放化疗后的直肠癌术后辅助化疗提供统一的共识,需要结合患者治疗后的身体耐受性、术前分期的严重程度、放化疗的敏感性、术后病理分期及其他分子特征对患者的药物敏感性和预后预测综合判断,选择是否需要接受术后辅助化疗。对于化疗方案,5-FU/LV、卡培他滨单药、FOLFOX或XELOX方案都可作为新辅助放化疗后辅助化疗方案,并进行个体化选择。
直肠癌术后辅助化疗参考方案见附录11。
9 局部进展期直肠癌的预后
局部进展期直肠癌采用术前同步放化疗后,大部分患者能够带来实质性肿瘤降期,但是降期患者是否能从中得到无复发生存、OS的获益存在不少争议,特别是术后未能获得pCR的患者。患者术前放化疗后的pCR似乎受到多种因素影响,例如术前放化疗方式(长程还是短程放疗)、术前放化疗和手术的时间间隔、同步放化疗联合的化疗方案及术前全身化疗的周期数等[35,113-115]。
9.1 新辅助放化疗后术后降期
多项回顾性研究[116-118]显示,通过术前放化疗降期患者,降低术后局部复发率、改善术后无复发生存时间及OS,但是这些研究多是回顾性研究,且入选患者异质性强,因此证据强度不足,难以得出肯定性结论。有研究者于2002年报告了一项165例经过术前放化疗的局部晚期直肠癌患者队列研究[116]。研究者经过长期随访,发现放化疗后降期患者的局部控制、无远处转移率和OS都有改善的趋势,但是该研究入选患者时期较早,同步化疗方案陈旧,且术前分期主要采用盆腔CT和直肠EUS,因此在分期的准确性上存在争议。另一项回顾性研究[117]分析了292例接受术前放化疗患者,多因素分析结果显示,新辅助治疗后降期是5年DFS和OS的独立预后因素,但此研究主要由病理学家完成,研究中并未清楚交待分期方法和具体细节,因此其结论准确性值得质疑。而一项Ⅲ期随机对照比较直肠癌患者术前和术后放化疗的经典德国CAO/AIO/ARO-94研究[118]发现,在术前放化疗组,无论是T、N分期还是UICC分期,降期效应都非常明显;例如按照UICC分期ypT0N0、Ⅰ、Ⅱ、Ⅲ和Ⅳ期患者,术前放化疗组分别为9%、28%、29%、26%和9%,对照术后放化疗组分别为 0%、19%、29%、43%和8%(P<0.001),但是11年随访数据显示,两组患者中10年远处转移率和无病生存率差异无统计学意义,特别是在yp分期为Ⅱ期患者,因此新辅助治疗后的降期未必是一个可靠的评价术前放化疗长期疗效的观察终点。
9.2 新辅助放化疗后肿瘤退缩分级
毫无疑问,局部晚期直肠癌患者中存在对新辅助治疗敏感和不敏感的患者,退缩良好患者其预后比缓解差的患者好,但是有无替代的终点指标可以预测长期生存一直存在争论。TRG是病理学上对存活肿瘤细胞和治疗后纤维化比例来进行定义。目前得到较一致认可的主要是Dworak分级及基于Dworak改良的Rodel分级,两种分级皆为5分类(见病理部分TRG评分)。
Losi等[119]研究发现,基于Dworak分级可以判断局部晚期直肠癌患者术前放化疗患者预后,3年DFS在TRG 4、3、2、1和0级患者分别为100%、85%、82%、66%和33%(P=0.01),而在术后pTNM分期为Ⅱ和Ⅲ期患者TRG 3级患者和TRG 0 ~2级患者相比具有更佳DFS趋势。CAO/AIO/ARO-94研究[120]同样发现,TRG 4级患者10年累计远处转移率和DFS分为10.5%和89.5%,而在TRG 2和3级(中度退缩)患者,分别为29.3%和73.6%,在TRG 1和0级(退缩不良)患者,分别为39.6%和63.0%(P=0.005和P=0.008);并且多因素分析显示,TRG分级是预示前述两参数的独立预后因素。因此TRG反映了肿瘤组织对术前放化疗的敏感性,和ypTNM分期相比,对预后的判断准确性更高。
9.3 新辅助放化疗后病理完全缓解
在25% ~38%的术前新辅助治疗患者,经过手术切除原发灶后发现肿瘤细胞无残留,即pCR[49,115],按照TNM分期一般视为ypT0N0M0。早在1995年Chari等[121]报告放化疗后获得pCR的直肠癌患者,比没有得到明显缓解或不缓解的患者有更长的远期疗效,这一结论也得到了后续的临床研究证实[122]。Capirci等[123]报告566例获得pCR的患者经过长期随访显示出良好的预后,5年DFS和OS率分别为85%和92%。但是这些研究的缺陷在于没有和放化疗后疾病残留的患者进行对照,可能与大部分研究中获得pCR的患者数量较少有关[49]。此外,还有研究发现获得pCR的患者和无pCR的患者相比,两者的远处转移率、生存率相似,差异无统计学意义[124-125]。
Maas等[49]于2010年报道的一项研究,汇集了17项不同的研究,纳入了3 105例经过术前放化疗的直肠癌患者,484例患者获得了pCR的疗效,经过中位随访时间为48个月的随访,发现pCR的患者和非pCR患者相比,有更好的5年粗DFS率(83.3% vs 65.6%),经过调整的pCR患者进展风险降低46%(HR=0.54),表明这类患者获得长期无病生存的可能性更大。但是该研究的缺陷在于大部分患者是非临床研究,治疗方案和策略的异质性较强,并且在评价TRG的方法上缺乏一致性[120]。尽管存在一些不同意见,但是目前对于术前放化疗后获得pCR的患者,基本认为这类患者对术前治疗敏感、肿瘤生物学行为对良好预后有利,因此术后局部复发和远处转移率低,能够得到长期生存。
9.4 生物标志物预测新辅助放化疗
9.4.1 微卫星不稳定
MSI占到整个大肠癌患者的15%左右,在直肠癌中占2% ~8%[126-127]。MSI-H的Ⅱ期结肠癌患者预后较好。但是MSI-H在判断直肠癌放化疗后的疗效上存在争议,有些研究证实,MSI和治疗后缓解良好相关,而有些研究则没有证实[128-130]。一项研究发现,基线MLH1阳性患者经过放化疗后pCR高于对应阴性患者(24.3% vs 9.4%,P=0.055)[130],另一项采用伊立替康联合5-FU的术前放化疗治疗57例患者的研究发现,MSI-H的患者长期生存更佳[128]。而相悖的研究结果发现,直肠癌活检组织中MSI-H的患者接近8%,但是对放化疗无明显疗效[131]。
9.4.2 K-ras或ras突变状态
K-ras突变状态是否能预测直肠癌术前放化疗的预后仍不明确,Luna-Pérez等[132]2000年报道的研究发现,特异性K-ras突变位点(12、13和61密码子突变)患者对新辅助治疗疗效好,但该研究中携带有K-ras突变的患者分期较早,而对照组患者相对分期更晚。而在其他的研究中,并没有发现ras突变状态和预后的关系,但发现特异性位点突变的患者,如G12V和G13D突变的患者较无突变患者的肿瘤退缩有明显差别,携带有G13D突变的患者TRG评分在3 ~4比例更高,而G12V突变的患者退缩并不显著[133]。
9.4.3 循环肿瘤DNA
可作为预测局部晚期直肠癌术前放化疗疗效的候选循环肿瘤DNA(circulating tumor DNA,ctDNA),一般认为是来源于直肠肿瘤细胞并且具有预测转移潜能的标志物。Zitt等[134]采用实时荧光定量聚合酶链反应(realtime fluorescent quantitative polymerase chain reaction,RTFQ-PCR)方法检测直肠癌患者术前放化疗不同时相的ctDNA含量预测放化疗疗效,发现在放化疗前中位ctDNA含量为4.2 ng/mL,在放化疗结束时为1.0 ng/mL,而术后检测为4.1 ng/mL,还发现术后病理分期为ypT0-1的患者和ypT3-4的患者ctDNA含量有明显差异,分别为2.2 ng/mL和5.1 ng/mL,因此,该研究显示,ctDNA可能是预测局部进展期直肠癌患者的潜在标志物,而这点在结肠癌术后患者中已经观察到ctDNA能够预测结肠癌的复发风险[135]。
9.4.4 循环肿瘤细胞
循环肿瘤细胞 (circulating tumor cells,CTC)可能是来源于原发肿瘤且被释放入外周循环中,被认为是导致远处器官转移的初始“种子”。既往大多数研究没有将结肠癌和直肠癌截然分开,因此难以将CTC在直肠癌之中的预后意义阐明清楚。Galizia等[136]研究CTC在大肠患者术后复发风险的评价,包含了12例接受术前放化疗的直肠癌患者,结果并没有发现CTC计数和结肠癌或者直肠癌术后复发风险之间的差别,也没有发现术前放化疗对CTC计数的影响,尽管其检测方法被认为并不一定可靠[137]。
共识19:局部进展期直肠癌治疗后的预后判断在后期的随访模式及复发病灶的及时处理至关重要。对于接受新辅助放化疗的直肠癌患者而言,除了传统的TNM分期对患者的预后判断之外,放化疗后肿瘤的降期及病理学的TRG评分均对预后预测有重要帮助。而且目前只有pCR的患者能够获得一致而肯定的预后预测价值,其他临床指标的预后价值尚需进一步研究。对于肿瘤分子标志物对直肠癌放化疗敏感性预测及预后预测的研究方兴未艾,但未获得临床广泛认可的依据,需要在后续研究中积极探索。
10 局部进展期直肠癌治疗后的随访
局部进展期直肠癌治疗后进行随访的主要目的是通过对局部复发、远处转移及第二原发肿瘤的早期发现并积极处理,从而延长患者的OS。其他随访的目的还包括处理后期并发症、改善医患交流和沟通以及改善生活质量等。
尽管随访具有重要价值,但是选择合适的随访方案是有争议的,如随访的间隔、随访时所用的检查手段以及随访的经济成本效益均有需要讨论之处。两篇系统的综述及Meta分析汇总了5项前瞻性随机对照临床研究的随访方案,得出了一致的结论:与随意或不密切的随访相比,按照特定随访方案进行一定密度的随访能够显著降低结肠癌和直肠癌的死亡率[138-139]。
10.1 随访项目及其价值
10.1.1 体格检查
目前没有足够的数据支持或反对定期的体格检查在随访中的价值。但是对直肠癌而言,肛门指检非常重要,能够对吻合口的狭窄程度进行评估,同时亦能提示肿瘤复发的可能。通常建议前3年每3 ~6个月进行相关体格检查,然后每年1次[140]。
10.1.2 CEA等肿瘤标志物
尽管有30%左右的直肠癌复发不伴有CEA的升高,CEA检查仍然是重要的推荐之一,CEA的升高并不一定意味着存在复发或转移,但CEA的升高提示了进行全身检查的必要性。其他如CA19-9等指标由于缺乏足够的证据并不作为常规随访的必需项目,可选择性地参考应用[140]。
10.1.3 肠镜检查
对于直肠癌患者随访采用肠镜检查包含两个目的:发现第二原发肿瘤和对吻合口的评估。通常有3% ~7%的患者在随访过程中发现第二原发癌,另发现有25%的患者为腺瘤并能够在肠镜下给予及时处理。而肠镜下能够仔细评估吻合口的狭窄程度、亚临床瘘的发生及早期发现吻合口复发并进行活检。因此对于局部进展期直肠癌术后建议2 ~3年内利用肠镜进行吻合口评估的频率应该略增加,而对于全肠道的评估可参照结肠癌的随访频率。
10.1.4 影像学检查
⑴ 胸部X线检查:胸部X线检查对早期肺转移的检出率较低(3% ~20%),尽管胸部X线价格便宜,目前并不支持将胸部X线作为胸部随访的常规手段。
⑵ CT检查:尽管目前没有足够的证据支持CT能够在其他病状等出现之前更早地发现复发转移病灶,但是CT扫描对于出现症状或者CEA升高时的全身评估具有重要作用。多排螺旋CT能够为发现肝、肺、后腹膜及盆腔的可疑复发病灶提供足够的信息,以支持针对性的进一步检查。
⑶ MRI检查:MRI检查具有更佳的组织对比度,从准确性而言较CT能够更好地诊断盆腔复发及对肝转移进行详细评估。但MRI由于费用高,可推荐用于CT发现可疑病灶后的进一步评估。
一项Meta分析比较了超声、CT、MRI和PET/CT在早期发现胃肠道肿瘤转移中的价值,PET和螺旋CT在转移的诊断中具有最好的敏感度,但由于PET/CT的昂贵费用,目前并不支持将PET/CT作为常规随访项目之一[141-142]。
10.2 规范的随访计划
目前没有公认的规范的随访计划,依据于美国NCCN指南的推荐随访方案如下:
⑴ 临床评估及体格检查术后前2年每3 ~6个月1次,然后每6个月1次直至5年。
⑵ CEA检查前两年每3 ~6个月1次,然后每6个月1次直至5年(特别对T2以上的肿瘤)。
⑶ 胸部、腹部及盆腔CT每年1次,持续3年(特别对复发高危患者)。
⑷ 术后1年内应完成1次肠镜检查,如果有异常1年后再次复查肠镜,如果有大的腺瘤,处理后第3年复查肠镜,然后5年1次。若术前因梗阻未行肠镜检查的,术后3 ~6个月内应行肠镜检查。
⑸ 对于行直肠前切除的患者,建议术后每6个月行直肠镜检查直至5年(该直肠镜检查在国内可用肠镜仅检查直肠部位而替代)。
特别对于新辅助放化疗的直肠癌患者而言,术后5年以后仍然有部分患者会出现局部复发和远处转移[30,143],因此对新辅助放化疗的患者术后5年仍然需要一定频度的定期随访。
除定期随访监测肿瘤复发转移之外,对于治疗相关的后期反应,特别是对患者日常生活的影像,也应在随访中密切注视。除术前放化疗和术后化疗给患者带来生活质量影响之外,手术对患者的影响仍然是最显著的[144-146]。
与直肠癌自身及治疗相关的远期反应包括:慢性腹泻或大便失禁(造瘘患者),术后或放疗后引起的泌尿生殖功能障碍,例如性功能障碍、勃起功能障碍、阴道干燥、性交疼痛和尿失禁等,如果这些症状持续不缓解,应建议患者去泌尿科或妇科就诊[147-148]。其他比较常见的直肠癌患者术后长期困扰还包括外周神经病变、乏力、失眠、认知功能障碍、情感障碍和社交障碍[149-151]。
共识20:局部进展期直肠癌术后的定期随访至关重要,尽管目前没有公认的随访方案,但是采用规范的随访方案进行定期随访比无序而随意的随访更有助于延长患者的OS。在随访方案的选择上比较多样,NCCN指南、ESMO指南以及前瞻性临床试验的随访方案均可作为选择之一,对随访方案的依从性较选择某一种方案更重要。与结肠癌随访不同的是,肛指检查、肠镜或直肠镜对吻合口的定期检查在直肠癌的随访中具有特殊的地位;特别对于接受新辅助放化疗的直肠癌患者,除按照常规随访方案进行随访外,术后5年及以后的复发亦是需要关注的方面之一。
同时,由于直肠特殊的解剖部位,直肠癌术后或放化疗后均盆腔局部的功能损伤较大,对患者肛门功能、泌尿生殖系统功能及造口的随访亦是重要内容之一。
目前常用的直肠癌随访方案见附录12。
11 展望和总结
对于局部进展期直肠癌,术前新辅助放化疗联合TME手术仍然是目前最标准最常用的治疗方式。在多学科综合治疗模式下,局部进展期直肠癌的治疗效果得到显著的提升、生活质量亦得到显著的改善。但是在该领域,目前还存在许多有争议与亟待改善之处,如进一步提高术前分期的准确性,提高新辅助治疗的pCR率,更加个体化的选择新辅助放化疗的患者,进一步降低术后远处转移的发生等。希望在中国的医生学者们能够更加深入的参与到局部进展期直肠癌的研究中去,在这些争议之处多提供中国直肠癌的治疗成果。
[1] VALENTINI V, ARISTEI C, GLIMELIUS B, et al. Multidisciplinary Rectal Cancer Management: 2ndEuropean Rectal Cancer Consensus Conference (EURECA-CC2)[J]. Radiother Oncol, 2009, 92(2): 148-163.
[2] VALENTINI V, GLIMELIUS B. Rectal cancer radiotherapy: towards European consensus[J]. Acta Oncol, 2010, 49(8): 1206-1216.
[3] BIPAT S, GLAS A S, SLORS F J, et al. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging--a meta-analysis[J]. Radiology, 2004, 232(3): 773-783.
[4] AL-SUKHNI E, MILOT L, FRUITMAN M, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and metaanalysis[J]. Ann Surg Oncol, 2012, 19(7): 2212-2223.
[5] PULI S R, BECHTOLD M L, REDDY J B, et al. how good is endoscopic ultrasound in differentiating various T stages of rectal cancer? Meta-analysis and systematic review[J]. Ann Surg Oncol, 2009, 16(2): 254-265.
[6] TAYLOR F G, QUIRKE P, HEALD R J, et al. One millimetre is the safe cut-off for magnetic resonance imaging prediction of surgical margin status in rectal cancer[J]. Br J Surg, 2011, 98(6): 872-879.
[7] SMITH N J, BARBACHANO Y, NORMAN A R, et al. Prognostic significance of magnetic resonance imagingdetected extramural vascular invasion in rectal cancer[J]. Br J Surg, 2008, 95(2): 229-236.
[8] PATEL U B, TAYLOR F, BLOMQVIST L, et al. Magnetic resonance imaging-detected tumor response for locally advanced rectal cancer predicts survival outcomes: MERCURY experience[J]. J Clin Oncol, 2011, 29(28): 3753-3760.
[9] BROWN G, RICHARDS C J, BOURNE M W, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison[J]. Radiology, 2003, 227(2): 371-377.
[10] BROWN G. Local radiological staging of rectal cancer[J]. Clin Radiol, 2004, 59(3): 213-214.
[11] KIM J H, BEETS G L, KIM M J, et al. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? [J]. Eur J Radiol, 2004, 52(1): 78-83.
[12] BARBARO B, FIORUCCI C, TEBALA C, et al. Locally advanced rectal cancer: MR imaging in prediction of response after preoperative chemotherapy and radiation therapy[J]. Radiology, 2009, 250(3): 730-739.
[13] MCARDLE C S, HOLE D J. Influence of volume and specialization on survival following surgery for colorectal cancer[J]. Br J Surg, 2004, 91(5): 610-617.
[14] MCGRATH D R, LEONG D C, GIBBERD R, et al. Surgeon and hospital volume and the management of colorectal cancer patients in Australia[J]. ANZ J Surg, 2005, 75(10): 901-910.
[15] PURVES H, PIETROBON R, HERVEY S, et al. Relationshipbetween surgeon caseload and sphincter preservation in patients with rectal cancer[J]. Dis Colon Rectum, 2005, 48(2): 195-202; discussion 202-204.
[16] ROGERS SO J R, WOLF R E, ZASLAVSKY A M, et al. Relation of surgeon and hospital volume to processes and outcomes of colorectal cancer surgery[J]. Ann Surg, 2006, 244(6): 1003-1011.
[17] Prolongation of the disease-free interval in surgically treated rectal carcinoma. Gastrointestinal Tumor Study Group[J]. N Engl J Med, 1985, 312(23): 1465-1472.
[18] FISHER B, WOLMARK N, ROCKETTE H, et al. Postoperative adjuvant chemotherapy or radiation therapy for rectal cancer: results from NSABP protocol R-01[J]. J Natl Cancer Inst, 1988, 80(1): 21-29.
[19] KROOK J E, MOERTEL C G, GUNDERSON L L, et al. Effective surgical adjuvant therapy for high-risk rectal carcinoma[J]. N Engl J Med, 1991, 324(11): 709-715.
[20] WOLMARK N, WIEAND H S, HYAMS D M, et al. Randomized trial of postoperative adjuvant chemotherapy with or without radiotherapy for carcinoma of the rectum: National Surgical Adjuvant Breast and Bowel Project Protocol R-02[J]. J Natl Cancer Inst, 2000, 92(5): 388-396.
[21] Preoperative short-term radiation therapy in operable rectal carcinoma. A prospective randomized trial. Stockholm Rectal Cancer Study Group[J]. Cancer, 1990, 66(1): 49-55.
[22] Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish rectal cancer trial[J]. N Engl J Med, 1997, 336(14): 980-987.
[23] FOLKESSON J, BIRGISSON H, PAHLMAN L, et al. Swedish rectal cancer trial: long lasting benefits from radiotherapy on survival and local recurrence rate[J]. J Clin Oncol, 2005, 23(24): 5644-5650.
[24] SAUER R, BECKER H, HOHENBERGER W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351(17): 1731-1740.
[25] SAUER R, LIERSCH T, MERKEL S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase Ⅲ trial after a median follow-up of 11 years[J]. J Clin Oncol, 2012, 30(16): 1926-1933.
[26] BUJKO K, NOWACKI M P, NASIEROWSKA-GUTTMEJER A, et al. Sphincter preservation following preoperative radiotherapy for rectal cancer: report of a randomised trial comparing short-term radiotherapy vs conventionally fractionated radiochemotherapy[J]. Radiother Oncol, 2004, 72(1): 15-24.
[27] BUJKO K, NOWACKI M P, NASIEROWSKA-GUTTMEJER A, et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer[J]. Br J Surg, 2006, 93(10): 1215-1223.
[28] NGAN S Y, BURMEISTER B, FISHER R J, et al. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04[J]. J Clin Oncol, 2012, 30(31): 3827-3833.
[29] BOSSET J F, COLLETTE L, CALAIS G, et al. Chemotherapy with preoperative radiotherapy in rectal cancer[J]. N Engl J Med, 2006, 355(11): 1114-1123.
[30] COLLETTE L, BOSSET J F, DEN DULK M, et al. Patients with curative resection of cT3-4rectal cancer after preoperative radiotherapy or radiochemotherapy: does anybody benefit from adjuvant fluorouracil-based chemotherapy? A trial of the European Organisation for Research and Treatment of Cancer Radiation Oncology Group[J]. J Clin Oncol, 2007, 25(28): 4379-4386.
[31] GÉRARD J P, CONROY T, BONNETAIN F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4rectal cancers: results of FFCD 9203[J]. J Clin Oncol, 2006, 24(28): 4620-4625.
[32] GÉRARD J P, AZRIA D, GOURGOU-BOURGADE S, et al. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer[J]. J Clin Oncol, 2012, 30(36): 4558-4565.
[33] ASCHELE C, CIONINI L, LONARDI S, et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase Ⅲ trial[J]. J Clin Oncol, 2011, 29(20): 2773-2780.
[34] O’CONNELL M J, COLANGELO L H, BEART R W, et al. Capecitabine and oxaliplatin in the preoperative multimodality treatment of rectal cancer: surgical end points from national surgical adjuvant breast and bowel project trial R-04[J]. J Clin Oncol, 2014, 32(18): 1927-1934.
[35] RÖDEL C, LIERSCH T, BECKER H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ ARO/AIO-04 randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(7): 679-687.
[36] SCHMOLL H J, HAUSTERMANS K, PRICE T J, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine and oxaliplatin versus capecitabine alone in locally advanced rectal cancer: Diseasefree survival results at interim analysis[J]. J Clin Oncol, 2014, 32 (suppl): abstr 3501.
[37] GLIMELIUS B, TIRET E, CERVANTES A, et al, Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013(suppl 6): vi81-88.
[38] BENSON A B 3rd, VENOOK A P, BEKAII-SAAB T, et al. Rectal cancer, version 2. 2015[J]. J Natl Compr Canc Netw, 2015, 13(6): 719-728.
[39] KAPITEIJN E, MARIJNEN C A, NAGTEGAAL I D, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer[J]. N Engl J Med, 2001, 345(9): 638-646.
[40] SLOOTHAAK D A, GEIJSEN D E, VAN LEERSUM N J, et al. Optimal time interval between neoadjuvant chemoradiotherapy and surgery for rectal cancer[J]. Br J Surg, 2013, 100(7): 933-939.
[41] PROBST C P, BECERRA A Z, AQUINA C T, et al. Extended intervals after neoadjuvant therapy in locally advanced rectal cancer: The key to improved tumor response and potential organ preservation[J]. J Am Coll Surg, 2015, 221(2): 430-440.
[42] HUNTINGTON C R, BOSELLI D, SYMANOWSKI J, et al. Optimal timing of surgical resection after radiation in locally advanced rectal adenocarcinoma: An analysis of the national cancer database[J]. Ann Surg Oncol, 2016, 23(3): 877-887.
[43] PETTERSSON D, CEDERMARK B, HOLM T, et al. Interim analysis of the Stockholm Ⅲ trial of preoperative radiotherapy regimens for rectal cancer[J]. Br J Surg, 2010, 97(4): 580-587.
[44] PETTERSSON D, LÖRINC E, HOLM T, et al. Tumour regression in the randomized Stockholm Ⅲ trial of radiotherapy regimens for rectal cancer[J]. Br J Surg, 2015, 102(8): 972-978; discussion 978.
[45] TEPPER J E, O’CONNELL M, NIEDZWIECKI D, et al. Adjuvant therapy in rectal cancer: analysis of stage, sex, and local control--final report of intergroup 0114[J]. J Clin Oncol, 2002, 20(7): 1744-1750.
[46] O’CONNELL M J, MARTENSON J A, WIEAND H S, et al. Improving adjuvant therapy for rectal cancer by combining protracted-infusion fluorouracil with radiation therapy after curative surgery[J]. N Engl J Med, 1994, 331(8): 502-507.
[47] SMALLEY S R, BENEDETTI J K, WILLIAMSON S K, et al. Phase Ⅲ trial of fluorouracil-based chemotherapy regimens plus radiotherapy in postoperative adjuvant rectal cancer: GI INT 0144[J]. J Clin Oncol, 2006, 24(22): 3542-3547.
[48] RÖDEL C, MARTUS P, PAPADOUPOLOS T, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer[J]. J Clin Oncol, 2005, 23(34): 8688-8696.
[49] MAAS M, NELEMANS P J, VALENTINI V, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data[J]. Lancet Oncol, 2010, 11(9): 835-844.
[50] HABR-GAMA A, PEREZ R O, PROSCURSHIM I, et al. Patterns of failure and survival for nonoperative treatment of stage c0 distal rectal cancer following neoadjuvant chemoradiation therapy[J]. J Gastrointest Surg, 2006, 10(10): 1319-1328; discussion 1328-1329.
[51] MAAS M, BEETS-TAN R G, LAMBREGTS D M, et al. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer[J]. J Clin Oncol, 2011, 29(35): 4633-4640.
[52] SMITH J D, RUBY J A, GOODMAN K A , et al. Nonoperative management of rectal cancer with complete clinical response after neoadjuvant therapy[J]. Ann Surg, 2012, 256(6): 965-972.
[53] HABR-GAMA A, PEREZ R O, NADALIN W, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results[J]. Ann Surg, 2004, 240(4): 711-717; discussion 717-718.
[54] HOJO K, VERNAVA A M 3rd, SUGIHARA K, et al. Preservation of urine voiding and sexual function after rectal cancer surgery[J]. Dis Colon Rectum, 1991, 34(7): 532-539.
[55] JACOBS M, VERDEJA J C, GOLDSTEIN H S. Minimally invasive colon resection (laparoscopic colectomy) [J]. Surg Laparosc Endosc, 1991, 1(3): 144-150.
[56] HEALD R J, HUSBAND E M, RYALL R D. The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? [J]. Br J Surg, 1982, 69(10): 613-616.
[57] QUIRKE P, DURDEY P, DIXON M F, et al. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumour spread and surgical excision[J]. Lancet, 1986, 2(8514): 996-999.
[58] QUIRKE P, DIXON M F. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination[J]. Int J Colorectal Dis, 1988, 3(2): 127-131.
[59] KNIGHT C D, GRIFFEN F D. An improved technique for low anterior resection of the rectum using the EEA stapler[J]. Surgery, 1980, 88(5): 710-714.
[60] MARR R, BIRBECK K, GARVICAN J, et al. The modern abdominoperineal excision: the next challenge after total mesorectal excision[J]. Ann Surg, 2005, 242(1): 74-82.
[61] HOLM T, LJUNG A, HÄGGMARK T, et al. Extended abdominoperineal resection with gluteus maximus flap reconstruction of the pelvic floor for rectal cancer[J]. Br J Surg, 2007, 94(2): 232-238.
[62] WEST N P, FINAN P J, ANDERIN C, et al. Evidence of the oncologic superiority of cylindrical abdominoperineal excision for low rectal cancer[J]. J Clin Oncol, 2008, 26(21): 3517-3522.
[63] TEI T M, STOLZENBURG T, BUNTZEN S, et al. Use of transpelvic rectus abdominis musculocutaneous flap for anal cancer salvage surgery[J]. Br J Surg, 2003, 90(5): 575-580.
[64] JIMENEZ R E, SHOUP M, COHEN A M, et al. Contemporary outcomes of total pelvic exenteration in the treatment of colorectal cancer[J]. Dis Colon Rectum, 2003, 46(12): 1619-1625.
[65] SCHIESSEL R, KARNER-HANUSCH J, HERBST F, et al.Intersphincteric resection for low rectal tumours[J]. Br J Surg, 1994, 81(9): 1376-1378.
[66] MARTIN S T, HENEGHAN H M, WINTER D C. Systematic review of outcomes after intersphincteric resection for low rectal cancer[J]. Br J Surg, 2012, 99(5): 603-612.
[67] KUO L J, HUNG C S, WU C H, et al. Oncological and functional outcomes of intersphincteric resection for low rectal cancer[J]. J Surg Res, 2011, 170(1): e93-98.
[68] ITO M, SAITO N, SUGITO M, et al. Analysis of clinical factors associated with anal function after intersphincteric resection for very low rectal cancer[J]. Dis Colon Rectum, 2009, 52(1): 64-70.
[69] SGOURAKIS G, LANITIS S, GOCKEL I, et al. Transanal endoscopic microsurgery for T1and T2rectal cancers: a metaanalysis and meta-regression analysis of outcomes[J]. Am Surg, 2011, 77(6): 761-772.
[70] BHANGU A, BROWN G, NICHOLLS R J, et al. Survival outcome of local excision versus radical resection of colon or rectal carcinoma: a surveillance, epidemiology, and end results (SEER) population-based study[J]. Ann Surg, 2013, 258(4): 563-569; discussion 569-571.
[71] KIM C J, YEATMAN T J, COPPOLA D, et al. Local excision of T2and T3rectal cancers after downstaging chemoradiation[J]. Ann Surg, 2001, 234(3): 352-358; discussion 358-359.
[72] YAMAGUCHI T, MORI T, TAKAHASHI K, et al. Controversy about treatment of colorectal cancer in view of surgeon--lymph node dissection for colorectal surgery (lateral lymph node dissection and TME)[J]. Gan To Kagaku Ryoho, 2003, 30(9): 1256-1259.
[73] NAGAWA H, MUTO T, SUNOUCHI K, et al. Randomized, controlled trial of lateral node dissection vs nerve-preserving resection in patients with rectal cancer after preoperative radiotherapy[J]. Dis Colon Rectum, 2001, 44(9): 1274-1280.
[74] TAKAHASHI T, UENO M, AZEKURA K, et al. Lateral node dissection and total mesorectal excision for rectal cancer[J]. Dis Colon Rectum, 2000, 43(10 Suppl): 59-68.
[75] SURTEES P, RITCHIE J K, PHILLIPS R K. High versus low ligation of the inferior mesenteric artery in rectal cancer[J]. Br J Surg, 1990, 77(6): 618-621.
[76] HIDA J, YASUTOMI M, MARUYAMA T, et al. Indication for using high ligation of the inferior mesenteric artery in rectal cancer surgery. Examination of nodal metastases by the clearing method[J]. Dis Colon Rectum, 1998, 41(8): 984-987; discussion 987-991.
[77] PANDEY D. Survival benefit of high ligation of the inferior mesenteric artery in sigmoid colon or rectal cancer surgery (Br J Surg, 2006, 93: 609-615) [J]. Br J Surg, 2006, 93(8): 1023; author reply 1023.
[78] PEZIM M E, NICHOLLS R J. Survival after high or low ligation of the inferior mesenteric artery during curative surgery for rectal cancer[J]. Ann Surg, 1984, 200(6): 729-733.
[79] DWORKIN M J, ALLEN-MERSH T G. Effect of inferior mesenteric artery ligation on blood flow in the marginal arterydependent sigmoid colon[J]. J Am Coll Surg, 1996, 183(4): 357-360.
[80] GUILLOU P J, QUIRKE P, THORPE H, et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial[J]. Lancet, 2005, 365(9472): 1718-1726.
[81] VAN DER PAS M H, HAGLIND E, CUESTA M A, et al. Laparoscopic versus open surgery for rectal cancer (COLORⅡ): short-term outcomes of a randomised, phase 3 trial[J]. Lancet Oncol, 2013, 14(3): 210-218.
[82] JEONG S Y, PARK J W, NAM B H, et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial[J]. Lancet Oncol, 2014, 15(7): 767-774.
[83] MAESO S, REZA M, MAYOL J A, et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis[J]. Ann Surg, 2010, 252(2): 254-262.
[84] PATRITI A, CECCARELLI G, BARTOLI A, et al. Shortand medium-term outcome of robot-assisted and traditional laparoscopic rectal resection[J]. JSLS, 2009, 13(2): 176-183.
[85] PIGAZZI A, LUCA F, PATRITI A, et al. Multicentric study on robotic tumor-specific mesorectal excision for the treatment of rectal cancer[J]. Ann Surg Oncol, 2010, 17(6): 1614-1620.[86] D’ANNIBALE A, PERNAZZA G, MORPURGO E, et al. Robotic right colon resection: evaluation of first 50 consecutive cases for malignant disease[J]. Ann Surg Oncol, 2010, 17(11): 2856-2862.
[87] LIM D R, MIN B S, KIM M S, et al. Robotic versus laparoscopic anterior resection of sigmoid colon cancer: comparative study of long-term oncologic outcomes[J]. Surg Endosc, 2013, 27(4): 1379-1385.
[88] EDGE S B, COMPTON C. AJCC Cancer Staging Manual[M]. 7thedition. New York, NY: Springer-Verlag, 2010.
[89] ZLOBEC I. Assessing downgrading of locally advanced rectal cancer after chemo-radiotherapy[J]. Eur J Cancer, 2011, 47(8): 1125-1126.
[90] DWORAK O, KEILHOLZ L, HOFFMANN A. Pathological features of rectal cancer after preoperative radiochemotherapy[J]. Int J Colorectal Dis, 1997, 12(1): 19-23.
[91] MANDARD A M, DALIBARD F, MANDARD J C, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations[J]. Cancer, 1994, 73(11): 2680-2686.
[92] RYAN R, GIBBONS D, HYLAND J M, et al.Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J]. Histopathology, 2005, 47(2): 141-146.
[93] BUJKO K, GLYNNE-JONES R, BUJKO M. Does adjuvant fluoropyrimidine-based chemotherapy provide a benefit for patients with resected rectal cancer who have already received neoadjuvant radiochemotherapy? A systematic review of randomised trials[J]. Ann Oncol, 2010, 21(9): 1743-1750.
[94] FIETKAU R, BARTEN M, KLAUTKE G, et al. Postoperative chemotherapy may not be necessary for patients with ypN0-category after neoadjuvant chemoradiotherapy of rectal cancer[J]. Dis Colon Rectum, 2006, 49(9): 1284-1292.
[95] JANJAN N A, CRANE C, FEIG B W, et al. Improved overall survival among responders to preoperative chemoradiation for locally advanced rectal cancer[J]. Am J Clin Oncol, 2001, 24(2): 107-112.
[96] KIRAN R P, KIRAT H T, BURGESS A N, et al. Is adjuvant chemotherapy really needed after curative surgery for rectal cancer patients who are node-negative after neoadjuvant chemoradiotherapy? [J]. Ann Surg Oncol, 2012, 19(4): 1206-1212.
[97] KHRIZMAN P, NILAND J C, VEER A, et al. Postoperative adjuvant chemotherapy use in patients with stage Ⅱ/Ⅲrectal cancer treated with neoadjuvant therapy: a national comprehensive cancer network analysis[J]. J Clin Oncol, 2013, 31(1): 30-38.
[98] PETERSEN S H, HARLING H, KIRKEBY L T, et al. Postoperative adjuvant chemotherapy in rectal cancer operated for cure[J]. Cochrane Database Syst Rev, 2012, 14(3): CD004078.
[99] BOSSET J F, CALAIS G, MINEUR L, et al. Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: long-term results of the EORTC 22921 randomised study[J]. Lancet Oncol, 2014, 15(2): 184-190.[100] PARK I J, KIM D Y, KIM H C, et al. Role of adjuvant chemotherapy in ypT0-2N0patients treated with preoperative chemoradiation therapy and radical resection for rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2015, 92(3): 540-547.
[101] CHAN A K, WONG A, JENKEN D, et al. Post-treatment TNM staging is a prognostic indicator of survival and recurrence in tethered or fixed rectal carcinoma after preoperative chemotherapy and radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 61(3): 665-677.
[102] SAINATO A, CERNUSCO LUNA NUNZIA V, VALENTINI V, et al. No benefit of adjuvant fluorouracil leucovorin chemotherapy after neoadjuvant chemoradiotherapy in locally advanced cancer of the rectum (LARC): Long term results of a randomized trial (I-CNR-RT) [J]. Radiother Oncol, 2014, 113(2): 223-229.
[103] BREUGOM A J, VAN GIJN W, MULLER E W, et al. Adjuvant chemotherapy for rectal cancer patients treated with preoperative (chemo)radiotherapy and total mesorectal excision: a Dutch Colorectal Cancer Group (DCCG) randomized phase Ⅲ trial[J]. Ann Oncol, 2015, 26(4): 696-701.
[104] GLYNNE-JONES R, COUNSELL N, QUIRKE P, et al. Chronicle: results of a randomised phase Ⅲ trial in locally advanced rectal cancer after neoadjuvant chemoradiation randomising postoperative adjuvant capecitabine plus oxaliplatin (XELOX) versus control[J]. Ann Oncol, 2014, 25(7): 1356-1362.
[105] NELSON V M, BENSON A B 3rd. Pathological complete response after neoadjuvant therapy for rectal cancer and the role of adjuvant therapy[J]. Curr Oncol Rep, 2013, 15(2): 152-161.
[106] BREUGOM A J, SWETS M, BOSSET J F, et al. Adjuvant chemotherapy after preoperative (chemo) radiotherapy and surgery for patients with rectal cancer: a systematic review and meta-analysis of individual patient data[J]. Lancet Oncol, 2015, 16(2): 200-207.
[107] QUASAR COLLABORATIVE GROUP, GRAY R, BARNWELL J, et al. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study[J]. Lancet, 2007, 370(9604): 2020-2029.
[108] DELBALDO C, YCHOU M, ZAWADI A, et al. Postoperative irinotecan in resected stage Ⅱ-Ⅲ rectal cancer: final analysis of the French R98 intergroup trial dagger[J]. Ann Oncol, 2015, 26(6): 1208-1215.
[109] SASTRE J, CUSTODIO A, SANCHEZ J C, et al. Risk-adapted adjuvant chemotherapy after concomitant fluoropyrimidineradiotherapy neoadjuvant treatment for patients with resectable cT3-4or N+rectal cancer[J]. Anticancer Drugs, 2011, 22(2): 185-190.
[110] SCHMOLL H J, HAUSTERMANS K, PRICE T J. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine +/- oxaliplatin in locally advanced rectal cancer: Interim analysis[J]. Ann Oncol, 2014, 2014(25): iv 167.
[111] ALLEGRA C J, YOTHERS G, O’CONNELL M J. Neoadjuvant therapy for rectal cancer. Mature results from NSABP protocol R-04 (abstract) [J]. J Clin Oncol, 2014, 32(Suppl 3): Abstr390.
[112] HONG Y S, NAM B H, KIM K P, et al. Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancer after preoperative chemoradiotherapy (ADORE): an openlabel, multicentre, phase 2, randomised controlled trial[J]. Lancet Oncol, 2014, 15(11): 1245-1253.
[113] MOHIUDDIN M, REGINE W F, JOHN W J, et al. Preoperative chemoradiation in fixed distal rectal cancer: dose time factors for pathological complete response[J]. Int J Radiat Oncol Biol Phys, 2000, 46(4): 883-888.
[114] WOLTHUIS A M, PENNINCKX F, HAUSTERMANS K, et al. Impact of interval between neoadjuvant chemoradiotherapy and TME for locally advanced rectal cancer on pathologicresponse and oncologic outcome[J]. Ann Surg Oncol, 2012, 19(9): 2833-2841.
[115] GARCIA-AGUILAR J, CHOW O S, SMITH D D, et al. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer: a multicentre, phase 2 trial[J]. Lancet Oncol, 2015, 16(8): 957-966.
[116] GARCIA-AGUILAR J, CHOW O S, SMITH D D, et al. Does downstaging predict improved outcome after preoperative chemoradiation for extraperitoneal locally advanced rectal cancer? A long-term analysis of 165 patients[J]. Int J Radiat Oncol Biol Phys, 2002, 53(3): 664-674.
[117] RULLIER A, LAURENT C, CAPDEPONT M, et al. Impact of tumor response on survival after radiochemotherapy in locally advanced rectal carcinoma[J]. Am J Surg Pathol, 2010, 34(4): 562-568.
[118] FOKAS E, LIERSCH T, FIETKAU R, et al. Downstage migration after neoadjuvant chemoradiotherapy for rectal cancer: the reverse of the Will Rogers phenomenon? [J]. Cancer, 2015, 121(11): 1724-1727.
[119] LOSI L, LUPPI G, GAVIOLI M, et al. Prognostic value of Dworak grade of regression (GR) in patients with rectal carcinoma treated with preoperative radiochemotherapy[J]. Int J Colorectal Dis, 2006, 21(7): 645-651.
[120] FOKAS E, LIERSCH T, FIETKAU R, et al. Tumor regression grading after preoperative chemoradiotherapy for locally advanced rectal carcinoma revisited: updated results of the CAO/ARO/AIO-94 trial[J]. J Clin Oncol, 2014, 32(15): 1554-1562.
[121] CHARI R S, TYLER D S, ANSCHER M S, et al. Preoperative radiation and chemotherapy in the treatment of adenocarcinoma of the rectum[J]. Ann Surg, 1995, 221(6): 778-86; discussion 786-787.
[122] KUO L J, LIU M C, JIAN J J, et al. Is final TNM staging a predictor for survival in locally advanced rectal cancer after preoperative chemoradiation therapy? [J]. Ann Surg Oncol, 2007, 14(10): 2766-2772.
[123] CAPIRCI C, VALENTINI V, CIONINI L, et al. Prognostic value of pathologic complete response after neoadjuvant therapy in locally advanced rectal cancer: long-term analysis of 566 ypCR patients[J]. Int J Radiat Oncol Biol Phys, 2008, 72(1): 99-107.
[124] ONAITIS M W, NOONE R B, FIELDS R, et al. Complete response to neoadjuvant chemoradiation for rectal cancer does not influence survival[J]. Ann Surg Oncol, 2001, 8(10): 801-806.
[125] BONNETAIN F, BOSSET J F, GERARD J P, et al. What is the clinical benefit of preoperative chemoradiotherapy with 5-FU/leucovorin for T3-4rectal cancer in a pooled analysis of EORTC 22921 and FFCD 9203 trials: surrogacy in question?[J]. Eur J Cancer, 2012, 48(12): 1781-1790.
[126] ISHIKUBO T, NISHIMURA Y, YAMAGUCH I, et al. The clinical features of rectal cancers with high-frequency microsatellite instability (MSI-H) in Japanese males[J]. Cancer Lett, 2004, 216(1): 55-62.
[127] SHIN J S, TUT T G, LEE C S, et al. Radiotherapy response in microsatellite instability related rectal cancer[J]. Korean J Pathol, 2013, 47(1): 1-8.
[128] CHARARA M, EDMONSTON T B, BURKHOLDER S, et al. Microsatellite status and cell cycle associated markers in rectal cancer patients undergoing a combined regimen of 5-FU and CPT-11 chemotherapy and radiotherapy[J]. Anticancer Res, 2004, 24(5B): 3161-3167.
[129] SPOLVERATO G, PUCCIARELLI S, BERTORELLE R, et al. Predictive factors of the response of rectal cancer to neoadjuvant radiochemotherapy[J]. Cancers (Basel), 2011, 3(2): 2176-2194.
[130] BERTOLINI F, BENGALA C, LOSI L, et al. Prognostic and predictive value of baseline and posttreatment molecular marker expression in locally advanced rectal cancer treated with neoadjuvant chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2007, 68(5): 1455-1461.
[131] DEMES M, SCHEIBERTRAM S, BARTSCH S, et al. Signature of microsatellite instability, K-ras and BRAF gene mutations in German patients with locally advanced rectal adenocarcinoma before and after neoadjuvant 5-FU radiochemotherapy[J]. J Gastrointest Oncol, 2013, 4(2): 182-192.
[132] LUNA-PÉREZ P, SEGURA J, ALVARADO I, et al. Specific c-K-ras gene mutations as a tumor-response marker in locally advanced rectal cancer treated with preoperative chemoradiotherapy[J]. Ann Surg Oncol, 2000, 7(10): 727-731.
[133] GAEDCKE J, GRADE M, JUNG K, et al. K-ras and BRAF mutations in patients with rectal cancer treated with preoperative chemoradiotherapy[J]. Radiother Oncol, 2010, 94(1): 76-81.
[134] ZITT M, MÜLLER H M, ROCHEL M, et al. Circulating cellfree DNA in plasma of locally advanced rectal cancer patients undergoing preoperative chemoradiation: a potential diagnostic tool for therapy monitoring[J]. Dis Markers, 2008, 25(3): 159-165.
[135] TIE J, WANG Y, TOMASETTI C, et al. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage Ⅱ colon cancer[J]. Sci Transl Med, 2016, 8(346): 346ra92.
[136] GALIZIA G, GEMEI M, ORDITURA M, et al. Postoperative detection of circulating tumor cells predicts tumor recurrence in colorectal cancer patients[J]. J Gastrointest Surg, 2013, 17(10): 1809-1818.
[137] LIM S H, CHUA W, HENDERSON C, et al. Predictive and prognostic biomarkers for neoadjuvant chemoradiotherapy in locally advanced rectal cancer[J]. Crit Rev Oncol hematol, 2015, 96(1): 67-80.
[138] JEFFERY M, HICKEY B E, HIDER P N. Follow-up strategies for patients treated for non-metastatic colorectalcancer (Cochrane Review) [M]. The Cochrane Library, Issue 4, Oxford: Update Software; 2002.
[139] RENEHAN A G, EGGER M, SAUNDERS M, et al. Impact on survival of intensive follow up after curative resection for colorectal cancer: systematic review and meta-analysis of randomised trials[J]. BMJ, 2002, 324(7341): 813.
[140] DESCH C E, BENSON A B 3rd, SOMERFIELD M R, et al. Colorectal cancer surveillance: 2005 update of an American Society of Clinical Oncology Practice Guideline[J]. J Clin Oncol, 2005, 23(33): 8512-8519.
[141] SCHAEFER O, LANGER M. Detection of recurrent rectal cancer with CT, MRI and PET/CT[J]. Eur Radiol, 2007, 17(8): 2044-2054.
[142] KINKEL K, LU Y, BOTH M, WARREN R S, et al. Detection of hepatic metastases from cancers of the gastrointestinal tract by using noninvasive imaging methods (US, CT, MR imaging, PET): a meta-analysis[J]. Radiology, 2002, 224(3): 748-756.
[143] PEETERS K C, MARIJNEN C A, NAGTEGAAL I D, et al. The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma[J]. Ann Surg, 2007, 246(5): 693-701.
[144] DESNOO L, FAITHFULL S. A qualitative study of anterior resection syndrome: the experiences of cancer survivors who have undergone resection surgery[J]. Eur J Cancer Care (Engl), 2006, 15(3): 244-251.
[145] SCHNEIDER E C, MALIN J L, KAHN K L, et al. Surviving colorectal cancer : patient-reported symptoms 4 years after diagnosis[J]. Cancer, 2007, 110(9): 2075-2082.
[146] DOWNING A, MORRIS E J, RICHARDS M, et al. Healthrelated quality of life after colorectal cancer in England: a patient-reported outcomes study of individuals 12 to 36 months after diagnosis[J]. J Clin Oncol, 2015, 33(6): 616-624.
[147] DOWNING A, MORRIS E J, RICHARDS M, et al. Urinary dysfunction after rectal cancer treatment is mainly caused by surgery[J]. Br J Surg, 2008, 95(8): 1020-1028.
[148] LANGE M M, MARIJNEN C A, MAAS C P, et al. Risk factors for sexual dysfunction after rectal cancer treatment[J]. Eur J Cancer, 2009, 45(9): 1578-1588.
[149] JANSEN L, HERRMANN A, STEGMAIER C, et al. Healthrelated quality of life during the 10 years after diagnosis of colorectal cancer: a population-based study[J]. J Clin Oncol, 2011, 29(24): 3263-3269.
[150] MOLS F, BEIJERS T, LEMMENS V, et al. Chemotherapyinduced neuropathy and its association with quality of life among 2- to 11-year colorectal cancer survivors: results from the population-based PROFILES registry[J]. J Clin Oncol, 2013, 31(21): 2699-2707.
[151] WRIGHT P, DOWNING A, MORRIS E J, et al. Identifying social distress: A cross-sectional survey of social outcomes 12 to 36 months after colorectal cancer diagnosis[J]. J Clin Oncol, 2015, 33(30): 3423-3430.
附 录
附录 1 直肠癌治疗前分期的直肠MRI推荐扫描方案及直肠MRI分期推荐报告内容
1 直肠癌MRI检查建议
⑴ 成像技术:局部进展期直肠癌分期和新辅助放化疗后再分期首选的检查技术是MRI,应使用1.5T或者3.0T MRI。建议使用体外线圈,不建议使用直肠内线圈。不建议常规用直肠内充填或灌肠[7]。
⑵ MRI扫描序列:① 应包括矢状位,轴位和冠状位2D T2加权序列,建议层厚范围在1 ~3 mm(最大4 mm)。② 轴位和冠状位序列应该与矢状位图像上肿瘤最长轴垂直和平行。对于低位肿瘤,冠状位应该与肛管平行以评估肿瘤下极和肛门括约肌的复杂关系。③ CRT后再分期建议使用DWI序列并且有益于评估yT分期。目前,DWI用于最初分期,评估淋巴结及直肠系膜筋膜(MRF)的证据尚不足。④ 不建议使用抑脂和对比增强序列。⑤ 不建议常规使用直肠内充填剂。⑥ 除非预扫描图像可见明显的肠道运动伪影的情况下才可能会使用解痉药。
2 直肠MRI报告建议
MRI分期报告应包括:肿瘤下极距肛门的距离、肿瘤长径、T分期、N分期和MRF受侵情况。
T分期MR评估见表5。
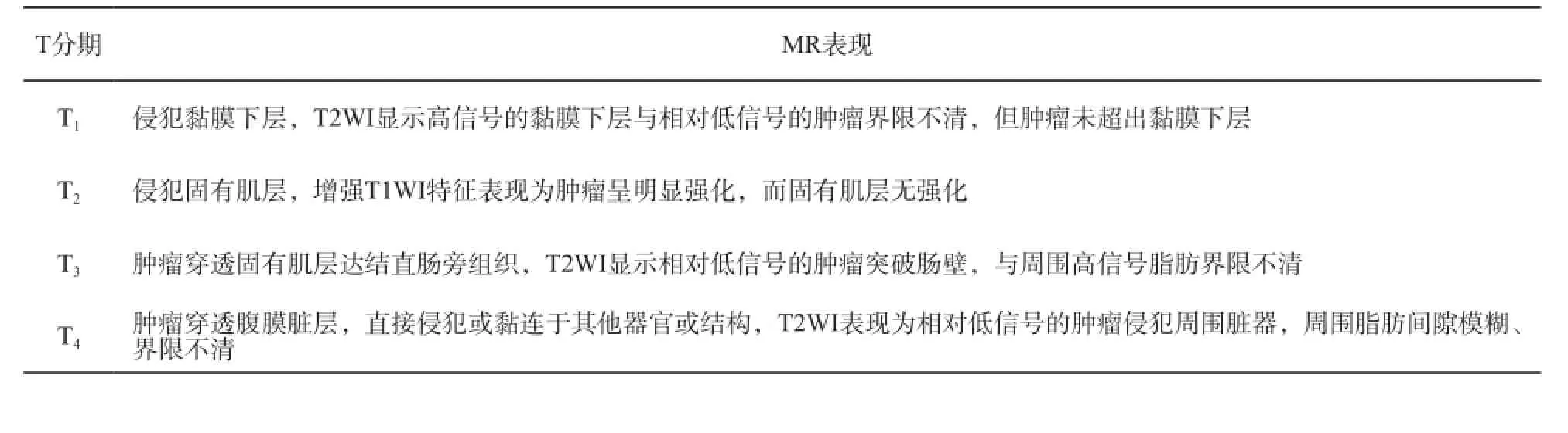
表 5 T分期MR评估
N分期应包括可疑的直肠系膜外淋巴结,预测淋巴结转移的标准是圆形,边界不规则及信号不均匀。大小也可以预测,但是并没有一个最佳的阈值作为判断淋巴结转移的标准。
MRF受侵情况包括肿瘤与MRF的最短距离(mm)及其位置(几点钟方向)。如果直肠系膜筋膜与肿瘤的距离小于等于1 mm,则表示MRF“受侵”。当肿瘤与直肠系膜筋膜间的距离为1 ~2 mm,则预示MRF“可疑受侵”。
以下几项不是必须的,但是建议报告:
⑴ 肿瘤在肠周的位置(例如:侧方、前方、后方)。
⑵ T3期肿瘤肠壁外侵的最远距离(mm):未列入TNM分期中,但却有很重要的临床意义。ESMO指南中原发性直肠T3期肿瘤细分为4类:① T3a,即肌层外肿瘤侵犯小于1 mm;② T3b,即肌层外肿瘤侵犯在1 ~5 mm之间;③ T3c,即肌层外肿瘤侵犯5 ~15 mm之间;④ T4d,即肌层外肿瘤侵犯大于15 mm。北美放射学会放射诊断模板中把原发性直肠T3期肿瘤细分为3类:① T3a,即肌层外肿瘤侵犯小于5 mm;② T3b,即肌层外肿瘤侵犯在5 ~10 mm之间;③ T3c,即肌层外肿瘤侵犯大于10 mm[12]。
⑶ 可疑淋巴结转移的数量。
⑷ 直肠周围血管(EMVI)受侵情况。
⑸ 肿瘤生长的形态学方式(环形、息肉状、黏液性、溃疡型及穿孔)。
附录 2 局部进展期直肠癌新辅助放化疗后的MRI再分期的推荐分期标准及报告内容
新辅助放化疗后MRI再分期报告应包括:
⑴ 肿瘤残留和(或)纤维灶是否存在:CRT后一个正常双层的直肠壁表现为完全缓解,然而任何的纤维残留都是可疑征象,既可能预示着肿瘤残留也可能是完全缓解。
⑵ MRI TRG (mrTRG)是评价局部进展期直肠癌neoCRT效果的影像指标,与患者预后关系密切。MRI根据影像判读残存肿瘤与纤维量的比例关系,建立与pTRG相似的mrTRG系统:①mrTRG1,肿瘤组织完全退缩,各层存在少量纤维组织;② mrTRG2,肿瘤大部分为大块纤维组织所替代;③ mrTRG3,部分肿瘤为纤维所替代(约50%);④ mrTRG4,仅少部分肿瘤为纤维组织所代替;⑤ mrTRG5,肿瘤完全未见变化。
⑶ 肿瘤下极距齿状线的距离。
⑷ 肿瘤长径。
⑸ yT分期(表6)。

表 6 yT分期MR评估
⑹ yN分期:CRT后淋巴结大小(短径)更可靠。大小退缩并且淋巴结信号均匀预示着为非转移性淋巴结。形状和边界正常化是否能预测非转移性淋巴结尚不明确。
⑺ MRF受侵犯情况:肿瘤和MRF的最短距离(mm)及其位置(几点钟方向),CRT后如果肿瘤和MRF间脂肪间隙恢复,则应该考虑MRF未受侵。侵犯MRF的条索影应考虑为是一个可疑的征象,可能预示着MRF持续受侵,也可能不是。
以下几项不是必须的,但是建议报告:
① 肿瘤于肠周的位置(侧方、前方和后方);② T3期肿瘤,肠壁外侵的最远距离(mm);③ 肿瘤生长的形态学方式(环形、息肉状、黏液性、溃疡型和穿孔)。
附录 3 直肠癌术前短程放疗研究汇总
直肠癌术前短程放疗研究汇总见表7。
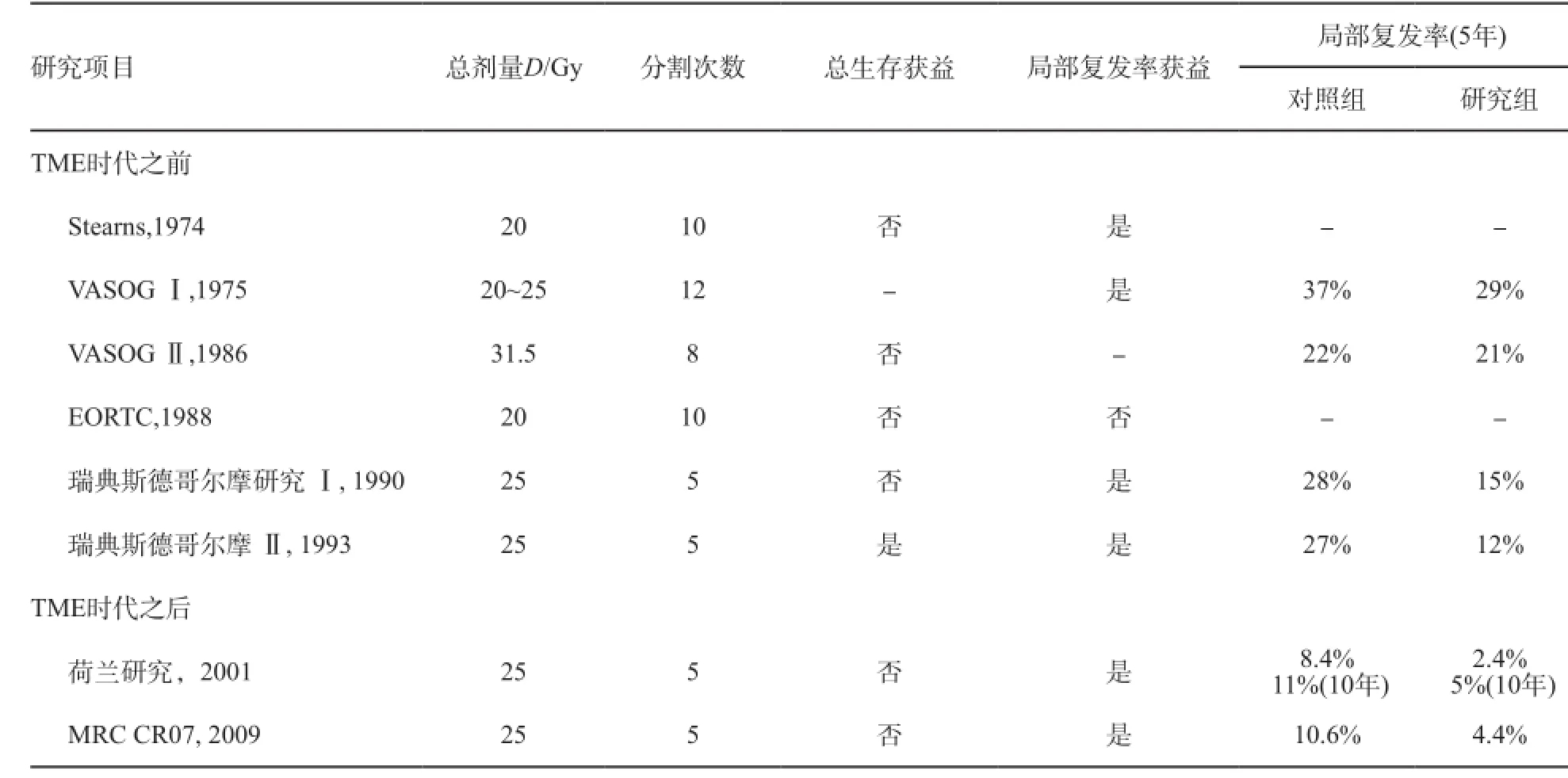
表 7 直肠癌术前短程放疗研究汇总
附录 4 术前长程放化疗的放疗相关技术
1 靶区定义
必须进行原发肿瘤高危复发区域和区域淋巴引流区照射。
⑴ 原发肿瘤高危复发区域包括肿瘤或瘤床、直肠系膜区和骶前区,中低位直肠癌靶区应包括坐骨直肠窝。
⑵ 区域淋巴引流区包括真骨盆内髂总血管淋巴引流区、直肠系膜区、髂内血管淋巴引流区和闭孔淋巴结区。
⑶ 有肿瘤和(或)残留者,全盆腔照射后局部缩野加量照射。
⑷ 盆腔复发病灶的放疗:① 既往无放疗病史,建议行原发肿瘤高危复发区域、区域淋巴结引流区(真骨盆区)照射和肿瘤局部加量放疗。② 既往有放疗史,根据情况决定是否放疗。
2 照射技术
根据医院具有的放疗设备选择不同的放射治疗技术,如常规放疗、三维适形放疗、调强放疗、图像引导放疗等。
⑴ 推荐CT模拟定位,如无CT模拟定位,必须行常规模拟定位。建议俯卧位或仰卧位,充盈膀胱。
⑵ 必须三野及以上的多野照射。
⑶ 如果调强放疗,必须进行计划验证。
⑷ 局部加量可采用术中放疗或外照射技术。
⑸ 放射性粒子植入治疗不推荐常规应用。
3 照射剂量
无论使用常规照射技术还是三维适形放疗或调强放疗等新技术,都必须有明确的照射剂量定义方式。三维适形照射和调强放疗必须应用体积剂量定义方式,常规照射应用等中心点的剂量定义模式。
⑴ 原发肿瘤高危复发区域和区域淋巴引流区推荐DT 45.0 ~50.4 Gy,每次1.8 ~2.0 Gy,共25或28次。术前放疗如采用5 Gy/次,共5次,1周,或其他剂量分割方式,有效生物剂量必须大于等于30 Gy。
⑵ 有肿瘤和(或)残留者,全盆腔照射后局部缩野加量照射DT 10 ~20 Gy。
附录 5 同期放化疗中化疗药物的给药方式及主要研究列举
目前同期放化疗的给药方式主要为口服给药及静脉给药,当患者同期使用5-FU单药化疗时,可以选择口服卡培他滨给药方式,825 mg/m2,每日2次,口服,若患者既往有胃溃疡病史或者口服卡培他滨药物出现严重的消化道反应如腹痛、腹泻,可以采取静脉化疗泵5-FU持续输注,5-FU 120 h持续静脉滴注,1 000 mg/m2,每天,放疗第1周和第5周给药,代表性的临床试验是德国的CAO/ARO/AIO-94研究。同步化疗也可选用EORTC 22921试验中的化疗方案,患者耐受性均较好。
术前放化疗的同步方案及主要研究列举:
1 EORTC 22921和EORTC 22921试验,随机,Ⅲ期研究[3]
入组病例:T3或可切除T4,M0;1993年4月—2003年3月完成入组。
分组:N=1 011。① 术前放疗组(n=505):术前放疗总剂量45 Gy,分次剂量180 cGy,每天1次,每周5次;② 术前放化疗(n=506):放疗同前,同步化疗(5-FU 350 mg/m2,每天,亚叶酸20 mg/m2,每天,放疗第1周和第5周给药;③ 术前放疗+术后化疗(n=505):④ 术前放疗+化疗+术后化疗(n=506)。
术后化疗4个疗程。
2 FFCD9203试验
入组病例:T3或可切除T4,Nx,M0;1993年4月—2003年11月完成入组。
分组:N=733。① 术前放疗组(n=367):术前放疗总剂量45 Gy/25次,共5周,分次剂量180 cGy,每天1次,每周5次;② 术前放化疗(n=375):放疗同前,同步化疗(每天给予5-FU 350 mg/m2,每天给予亚叶酸20 mg/m2,放疗第1周和第5周给药;放疗结束后3 ~10周手术。
3 NSABP R-04美国研究
入组:Ⅱ或Ⅲ期直肠癌,N=1608。
分组:放疗45 Gy/25次,共5周,加量5.4 ~ 10.8 Gy。同步化疗分为:① 5-FU持续静脉滴注,225 mg/m2,每周5次;② 5-FU持续静脉滴注,225 mg/m2,每周5次,联合奥沙利铂,50 mg/m2,qw×5;③ 口服卡培他滨825 mg/m2,每日2次,1周5次;④ 口服卡培他滨825 mg/m2,每日2次,1周5次,联合奥沙利铂,50 mg/m2, qw×5。
4 德国多中心,随机,开放,非劣效,Ⅲ期研究
入组:Ⅱ ~Ⅲ期局部进展期直肠癌。
分组:
① 卡培他滨组:卡培他滨2 500 mg/m2,第1 ~14天,共2个疗程,后同步放化疗,50.4 Gy+卡培他滨1 650 mg/m2,第1 ~38天,术后5个疗程卡培他滨,2 500 mg/m2,第1 ~14天。② 5-FU组:2个疗程。5-FU 500 mg/m2,快速静脉注射,第1 ~5天,第29天重复,后同步放化疗,50.4 Gy+5-FU 225 mg/m2,每天,之后手术,术后行4个疗程5-FU,500 mg/m2,快速静脉注射,第1 ~5天。
5 ACCORD12/0405,法国研究,随机对照
入组:T3-4NxM0,N=598。
分组:① 术前卡培他滨放疗45 Gy,5周,每次1.8 Gy,同步卡培他滨(800 mg/m2,每日2次,放疗日口服);② 术前卡培他滨+奥沙利铂放疗组,50 Gy,5周,每次2 Gy,同步卡培他滨(800 mg/m2,每日2次,放疗日口服)+奥沙利铂(50 mg/m2,qw)。放化疗结束后6周行TME手术。
6 STAR-01,意大利研究,随机对照Ⅲ期[19]
入组:747例,可切除T3-4/N1-2,中低位直肠癌。
分组:① 5-FU/放疗组(n=379),50.4 Gy/28次,每天同步5-FU 225 mg/m2;② 5-FU/奥沙利铂/放疗组(n=368):奥沙利铂 60 mg/m2,每周1次,共6个疗程。
7 CAO/ARO/AIO-04 研究,德国,多中心随机Ⅲ期研究
入组:T3-4,N+;2006年7月—2010年2月。
分组:对照组(5-FU/放疗组,n=623),50.4 Gy,5-FU 1 000 mg/m2,第1 ~5天,第29 ~33天,放化疗后手术,术后给予4个疗程5-FU,快速静脉注射,500 mg/m2,第1 ~5、29天;试验组(5-FU/奥沙利铂/放疗组,n=613)50.4 Gy,5-FU 250 mg/m2,第1 ~14天,第22 ~35天,奥沙利铂50 mg/m2,第1、8、22、29天,放化疗后手术,术后行8个疗程FOLFOX(奥沙利铂100 mg/m2,第1、15天;5-FU 2 400 mg/m2,第1 ~2天,第15 ~16天;LV 400 mg/m2,第1、15天)。
附录 6 直肠癌辅助放化疗的放疗技术参数及化疗给药方式
1 辅助放疗靶区定义
照射野临床靶体积(clinical target volume,CTV):包括瘤床、骶前软组织、骶3上缘以上的髂外血管和部分髂总血管、骶3上缘以下的髂内血管周围淋巴引流区和会阴手术疤痕(Mile’s手术)。具体范围:上界为L5锥体下缘,下界为闭孔下缘(Dixon手术)或会阴疤痕(Mile’s手术)。侧界为真骨盆内缘,前界包括充盈膀胱后壁1/4 ~1/3,后界包括骶骨皮质一半(骶3上缘以上)和骶骨皮质后缘(骶3上缘以下),计划靶体积(planning target volume,PTV):在CTV的范围上扩大1.0 cm。 正常组织和器官的勾画:包括双侧股骨头、膀胱、照射范围内的小肠(需勾画到PTV 最上层的上两层)和睾丸。
2 照射技术
根据医院具有的放疗设备选择不同的放射治疗技术,如常规放疗、三维适形放疗、调强放疗、图像引导放疗等。
⑴ 推荐CT模拟定位,如无CT模拟定位,必须行常规模拟定位。建议俯卧位或仰卧位,充盈膀胱。
⑵ 必须三野及以上的多野照射。
⑶ 如果调强放疗,必须进行计划验证。
3 照射剂量
瘤床、高危复发区域和区域淋巴引流区推荐DT 45 ~50.4 Gy,每次1.8 ~2.0 Gy,共25或28次。
4 同步化疗
常规治疗患者根据身体情况选用单药卡培他滨 825 mg/m2,每日2次口服,从放射治疗第1 ~5天,星期六、日休息, 7 天为1个周期,放射治疗期间用 5 个周期;也可使用XELOX方案,奥沙利铂每周42.5 mg/m2,卡培他滨625 mg/m2,每日2次口服,从放射治疗第1~5天,星期六、日休息,7天为1个周期,放射治疗期间用 5 个周期。
附录 7 直肠癌放化疗后非手术治疗操作常规(参考)
附录 8 结直肠恶性肿瘤组织学分型
结直肠恶性肿瘤组织学分型包括:
⑴ 普通管状腺癌。
⑵ 特殊类型腺癌:① 筛状粉刺型腺癌;②髓样癌;③ 微乳头状癌;④ 黏液腺癌;⑤ 锯齿状腺癌;⑥ 印戒细胞癌。
⑶ 少见类型癌:① 腺鳞癌;② 梭形细胞癌;③ 鳞状细胞癌;④ 未分化癌。
⑷ 神经内分泌肿瘤:① 神经内分泌肿瘤,G1和G2;② 神经内分泌癌;③ 大细胞神经内分泌癌;④ 小细胞神经内分泌癌;⑤ 混合性腺神经内分泌癌。
⑸ 其他。
附录 9美国癌症协会 (2010年AJCC 第七版)推荐的TNM分期方法
1 原发肿瘤(T)
Tx:原发肿瘤无法评价。
T0:无原发肿瘤证据。
Tis:原位癌,局限于上皮内或侵犯黏膜固有层。
T1:肿瘤侵犯黏膜下层。
T2:肿瘤侵犯固有肌层。
T3:肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖的结肠及直肠旁组织。
T4a:肿瘤穿透腹膜脏层。
T4b:肿瘤直接侵犯或黏连于其他器官或结构。
2 区域淋巴结(N)
Nx:区域淋巴结无法评价。N0:无区域淋巴结转移。
N1:有1 ~3枚区域淋巴结转移。N1a:有1枚区域淋巴结转移。N1b:有2 ~3枚区域淋巴结转移。
N1c:浆膜下、肠系膜、无腹膜覆盖结肠/直肠周围组织内有肿瘤种植(tumor deposit,TD),无区域淋巴结转移。
N2:有4枚以上区域淋巴结转移。N2a:4 ~6枚区域淋巴结转移。
N2b:7枚及更多区域淋巴结转移。
3 远处转移(M)
M0: 无远处转移。M1:有远处转移。M1a:远处转移局限于单个器官或部位(如肝、肺、卵巢、非区域淋巴结)。
M1b:远处转移分布于1个以上的器官、部位或腹膜转移。
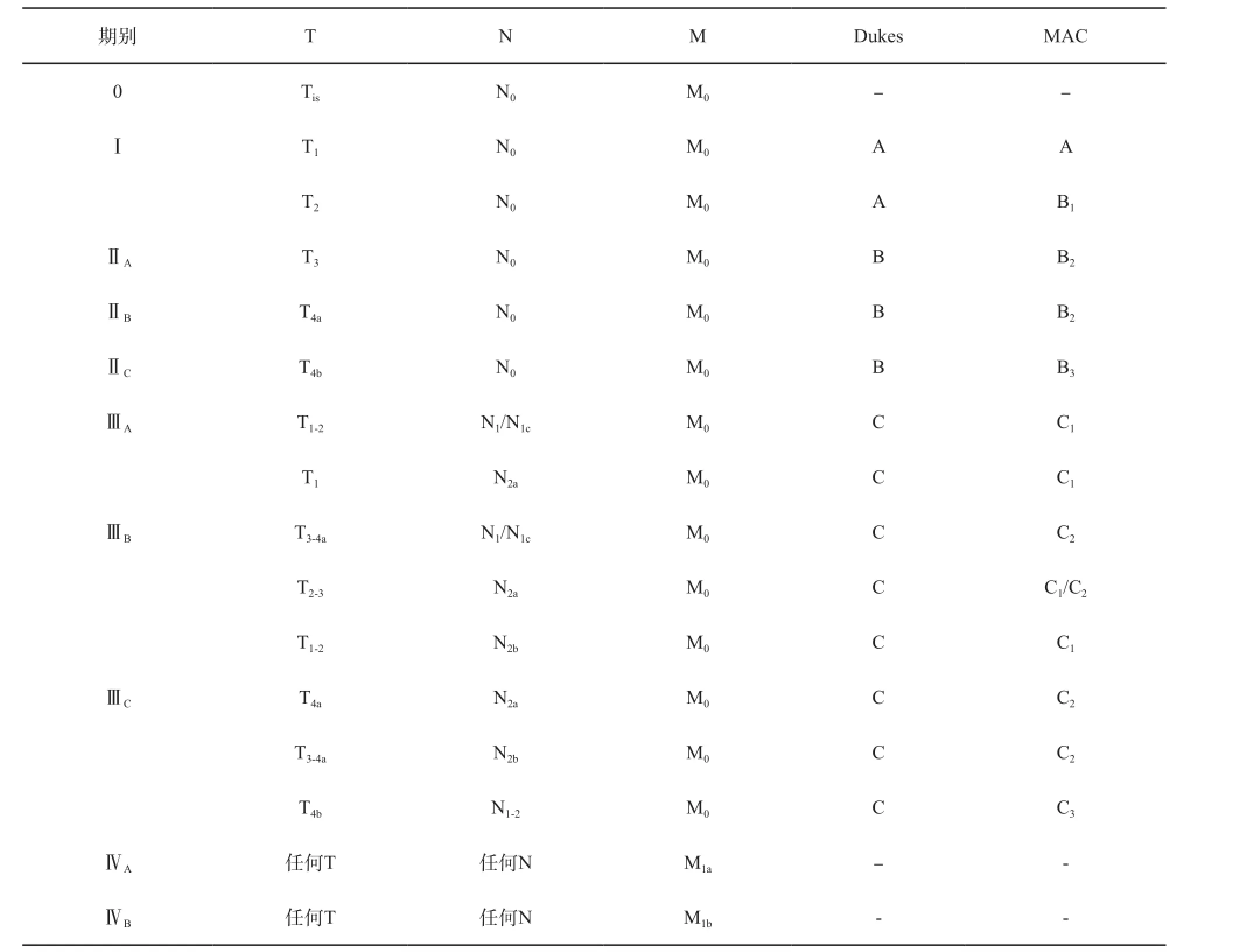
表 8 解剖分期/预后组别
附录 10 4种新辅助放化疗后肿瘤退缩的TRG评估方法(表9 ~12)
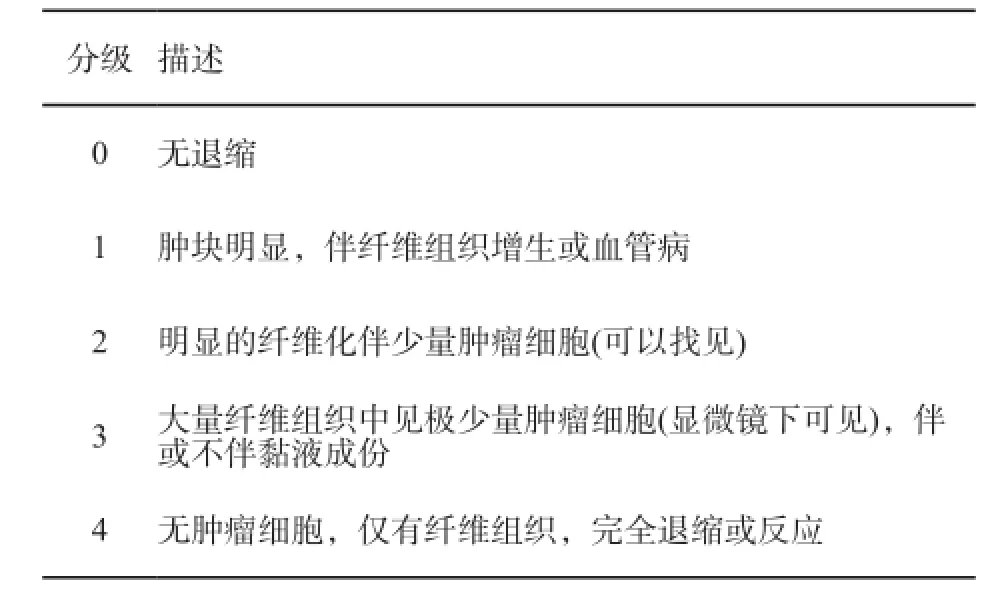
表 9 1997年Dworak等提出的TRG评估方法

表 10 1994年Mandard等提出TRG评估方法

表 11 2005年Mandard等提出的修改版本

表 12 2010年AJCC第七版推荐TRG评估方法(Ryan等提出并修改)
附录 11 直肠癌术后辅助化疗参考化疗方案
5 -FU/LV
LV 200 mg/m2, 静脉滴注2 h,第1天
5-FU 400 mg/m2静脉推注,600 mg/m2civ 22 h,第1 ~2天
每2周重复
或
De Gramont方案
LV 400 mg/m2,静脉滴注2 h,第1天
5-FU 400 mg/m2静脉推注,2 400 mg/m2civ 46 h
每2周重复
单药卡培他滨
卡培他滨 1 000 ~1 250 mg/m²,口服,每日2次,连续14 d
每3周重复
FOLFOX方案
奥沙利铂 85 mg/m²,静脉滴注2 h,第1天
LV 400 mg/m²,静脉滴注2 h,第1天
5-FU 400 mg/m²,静脉推注,第1天;然后2 400 mg/m²,civ 46 h
每2周重复
XELOX方案
奥沙利铂 130 mg/m²,静脉滴注2 h,第1天
卡培他滨 1 000 mg/m²,口服,每日2次,连续14 d
每3周重复
附录 12 目前常用的直肠癌随访方案
1 NCCN指南(2016年第2版)
⑴ 病史和体检:2年内每3 ~6个月1次,然后每6个月1次,共5年。
⑵ 对于T2及以上的肿瘤,2年内每3 ~6个月检查CEA,然后每6个月1次,共5年。
⑶ 转移复发高危患者每年需进行胸部、腹部、盆腔CT检查,共5年。
⑷ 术后1年内行肠镜检查,如果术前因肿瘤梗阻无法行全结肠镜检查,术后3 ~6个月检查:① 如果有异常,1年内复查;② 如果未发现高风险腺瘤(绒毛状腺瘤,直径大于1 cm,或有高级别不典型增生),则3年内复查,以后每5年复查1次。
⑸ 低位前切除术后的患者建议每半年行直肠镜检查,评估吻合口,直至5年。
⑹ PET/CT检查不作为常规推荐。
2 ESMO指南(2013版)
⑴ 如有可能,每6个月复查至术后2年。
⑵ 如果在疾病确诊过程中,没有进行全结肠镜检查(例如因肠梗阻起病),术后1年内应完善此检查。每5年,进行病史询问,结肠镜检查,如有息肉应进行切除,直至75岁。
⑶ 临床、实验室和影像学检查未能证实获益,仅限于有可疑症状的患者。
3 中国卫生部结直肠癌诊疗规范(2015年版)
结直肠癌治疗后一律推荐规律随访。
⑴ 病史和体检,每3 ~6个月1次,共2年,然后每6个月1次,总共5年,5年后每年1次。
⑵ 监测CEA、CA19-9,每3 ~6个月1次,共2年,然后每6个月1次,共5年,5年后每年1次。
⑶ 腹腔、盆腔超声检查每3 ~6个月1次,共2年,然后每6个月1次,共5年,5年后每年1次。胸片每6个月1次,共2年,2年后每年1次。
⑷ 胸腔、腹腔及盆腔CT或MRI检查每年1次。
⑸ 术后1年内行肠镜检查,如有异常,1年内复查;如未见息肉,3年内复查;然后5年1次,随访检查出现的大肠腺瘤均推荐切除。如术前肠镜未完成全结肠检查,建议术后3 ~6个月行肠镜检查。
⑹ PET/CT不是常规推荐的检查项目。
10.19401/j.cnki.1007-3639.2017.01.008
R735.3+7
:B
:1007-3639(2017)01-0041-40
2016-11-20)

