初治结核病患者自噬相关基因表达水平的研究
吕子征 王伟 刘京铭 李传友 高孟秋
·论著·
初治结核病患者自噬相关基因表达水平的研究
吕子征 王伟 刘京铭 李传友 高孟秋
目的 研究初治结核病患者自噬相关基因表达水平。方法 选取2013年12月至2016年3月在首都医科大学附属北京胸科医院就诊的12例初治肺结核病患者作为病例组;选取首都医科大学附属北京胸科医院体检健康的新入职职工和在读学生12名作为对照组。收集研究对象外周血,提取RNA,将RNA逆转录为cDNA,进行实时定量PCR。使用H37Rv标准株感染人外周血单核细胞(THP-1细胞)作为感染组,而未感染H37Rv标准株的THP-1细胞作为未感染组,分别在感染4 h和6 h使用Trizol法提取RNA,将RNA逆转录为cDNA,进行实时定量PCR检测。实时定量PCR检测使用β-肌动蛋白(β-actin)作为内参基因,测量各个基因的循环阈值(cycle threshold,Ct),并计算各个基因的ΔCt值。不同样品同一基因的检测通过计算两者之间的ΔCt值差值,使用2-ΔΔCt比较基因之间的表达水平。结果 病例组Ras蛋白脑组织同源类似物(Rheb)基因ΔCt值为8.71±0.58,对照组ΔCt值为7.83±0.58,两组相比差异有统计学意义(t=3.74,P=0.001);病例组Rheb基因表达下调。病例组哺乳动物雷帕霉素靶蛋白(mTOR)基因ΔCt值为11.88±0.97,对照组ΔCt值为10.81±1.04,两组相比差异有统计学意义(t=2.60,P=0.016);病例组mTOR基因表达下调。使用2-ΔΔCt法比较两组间自噬相关基因表达倍数关系,对照组Rheb基因表达水平是病例组的(1.85±0.91)倍;对照组mTOR基因表达水平是病例组的(2.76±1.56)倍。H37Rv标准株感染THP-1细胞6 h后,感染组自噬相关蛋白LC3B基因ΔCt值为6.41±0.15,未感染组ΔCt值为7.04±0.05,两组相比差异有统计学意义(t=4.50,P=0.046);感染组表达上调。感染组mTOR基因ΔCt值为8.73±0.16,对照组ΔCt值为10.10±0.20,两组相比差异有统计学意义(t=4.79,P=0.041),感染组表达上调。结论 初治结核病患者患病后Rheb和mTOR基因表达下调,调节细胞的自噬;而H37Rv标准株感染THP-1细胞6 h后LC3B和mTOR基因表达上调,调节细胞自噬水平。
分枝杆菌,结核; 自噬; 基因表达; 免疫
结核分枝杆菌(Mycobacteriumtuberculosis, MTB)是一种胞内感染菌,以巨噬细胞为主的固有免疫在抵抗其感染时发挥着重要作用[1]。当MTB感染宿主细胞时,巨噬细胞等吞噬细胞可以通过Toll模式识别受体(Toll like receptor,TLR)识别MTB,并启动细胞自噬将胞内的MTB杀灭[2-3]。参与自噬相关的蛋白质大约有30多种,自噬相关的基因表达情况在一定程度上影响细胞内的自噬水平[4]。本研究通过研究Ras蛋白脑组织同源类似物(Rheb)基因、哺乳动物雷帕霉素靶蛋白(mTOR)基因、自噬相关蛋白5(ATG5)基因、自噬相关蛋白12(ATG12)基因和自噬相关蛋白LC3B基因表达水平,分析自噬相关基因的表达水平在结核病的发生发展过程中产生的影响。同时,对比H37Rv标准株感染人外周血单核细胞(THP-1细胞)时自噬相关基因的表达水平,分析体内和体外(细胞和人体)在MTB感染后自噬相关基因的变化趋势。
材料和方法
一、研究对象
1.对象:选取2013年12月至2016年3月在首都医科大学附属北京胸科医院就诊的12例初治肺结核病患者作为病例组,收集其临床资料。选取首都医科大学附属北京胸科医院体检健康的新入职员工和在读学生12名作为对照组。本研究经首都医科大学附属北京胸科医院伦理委员会批准,研究对象均签署知情同意书。
2.纳入排除标准:(1)病例组纳入标准:①痰涂片或痰培养MTB呈阳性;②规范化抗结核化疗时间小于1个月;③无糖尿病史;同时满足上述3个条件即可纳入。排除标准:有感染性疾病、肿瘤、免疫缺陷性疾病和自身免疫性疾病者。(2)对照组纳入标准:近1年内X线胸部摄影或CT扫描检查正常,结核菌素纯蛋白衍化物(PPD)或结核感染T细胞斑点试验(T-SPOT.TB)检查阴性,既往无结核病患者密切接触史,并且无任何结核病临床症状和体征。
二、试剂和耗材
PAXgene RNA管和PAXgene Blood RNA试剂盒购自美国BD公司。反转录试剂盒(RT2First Strand Kit)购自德国凯杰公司。cDNA合成试剂盒(cDNA Synthesis SuperMix for qPCR)和实时定量PCR(Top Green qPCRSuperMix)试剂盒购自北京全式金生物技术有限公司。实时定量PCR 96孔板购买于美国ABI公司。H37Rv标准株和THP-1细胞保存于北京胸科医院细菌免疫室。其他试剂还包括佛波酯(PMA)、RNA提取试剂(Trizol)、胎牛血清(Hyclone)、RPMI1640培养基等。
三、方法
1.血液标本处理:采集研究对象外周血约2 ml,并按照PAXgene Blood RNA试剂盒的操作步骤提取受试者白细胞RNA[5],测量RNA的纯度和浓度,用反转录试剂盒将其逆转录为cDNA。
2.THP-1细胞的培养和诱导分化:将THP-1细胞从冻存管内复苏,使用RPMI1640培养基(内含体积分数10%的胎牛血清)传代培养。细胞计数时使用质量分数为0.4%台盼蓝和THP-1细胞悬液按照1∶1的比例混合均匀,取15 μl放在血球计数板后使用倒置显微镜计数。将计数好的THP-1细胞悬液的浓度配置为1×106个/ml,并加入PMA(终浓度为100 nmol/L)刺激诱导分化[6-7];转移到细胞培养6孔板中铺板(每孔2 ml),24 h后使用显微镜观察细胞分化情况。
3.THP-1细胞感染处理:使用1×磷酸盐缓冲液将培养好的H37Rv标准株洗涤3次,同时8000×g离心10 min,并测量吸光度(A)值。按照感染强度(multiplicity of infection,MOI)为10∶1的比例感染THP-1细胞[8],分别在感染4 h和6 h后,使用Trizol试剂处理细胞(H37Rv标准株感染THP-1细胞试验进行3次独立重复)。提取细胞内的RNA,并将RNA逆转录为cDNA。
4.引物设计和循环阈值(Ct值)检测:使用引物设计软件(Primer 5.0)设计PCR引物,选取最佳引物序列。引物由美国Invitrogen公司合成,序列见表1。使用β-肌动蛋白(β-actin)作为内参基因,测量各个基因的Ct值,并计算各个基因的ΔCt值,ΔCt=Ct基因-Ctβ-actin。不同样品同一基因的检测可以通过计算两者之间的ΔCt值差值,使用2-ΔΔCt比较基因之间的表达水平。在细胞水平试验中其自噬基因的ΔCt值为3次独立重复试验测得的均值。ΔCt值在一定程度上反映了基因的表达水平,ΔCt值越低,其基因表达水平越高[9]。

表1 自噬相关基因的引物设计
5.统计学分析:应用SPSS 22.0软件进行统计分析,采用两独立样本t检验检测病例组和对照组年龄差异,以及病例组与对照组自噬相关基因表达水平的差异;采用Fisher确切概率法检验病例组和对照组的性别差异;采用配对样本t检验检测THP-1细胞感染H37Rv标准株不同时间自噬相关基因表达水平的差异,以P<0.05为差异有统计学意义。
结 果
1.一般情况:病例组12例,包括男7例,女5例;平均年龄为(36.17±15.91)岁。对照组12名,包括男5名,女7名;平均年龄为(27.92±3.37)岁。病例组与对照组比较,年龄及性别差异均无统计学意义(t=1.76,P=0.093;Fisher确切概率法,P=0.684),两组均衡可比。
2.自噬相关基因表达分析:病例组Rheb基因ΔCt值为8.71±0.58,对照组ΔCt值为7.83±0.58,两组相比差异有统计学意义(t=3.74,P=0.001),病例组Rheb基因表达下调。病例组mTOR基因ΔCt值为11.88±0.97,对照组ΔCt值为10.81±1.04,两组相比差异有统计学意义(t=2.60,P=0.016),病例组mTOR基因表达下调。而自噬相关基因ATG5、ATG12和LC3B两组间差异均无统计学意义,具体见表2。使用2-ΔΔCt法比较两组间自噬相关基因表达倍数关系,对照组Rheb基因表达水平是病例组的(1.85±0.91)倍;mTOR基因表达水平是病例组的(2.76±1.56)倍。
3.THP-1细胞感染H37Rv标准株后自噬相关基因表达情况:使用H37Rv标准株感染THP-1细胞4 h后,自噬相关基因ATG5、ATG12、LC3B、Rheb和mTOR在感染组与未感染组之间表达差异均无统计学意义。H37Rv标准株感染THP-1细胞6 h后,LC3B基因的ΔCt值为6.41±0.15,未感染组ΔCt值为7.04±0.05,两组相比差异有统计学意义(t=4.50,P=0.046),感染组表达上调。感染组mTOR基因ΔCt值为8.73±0.16,对照组ΔCt值为10.10±0.20,两组相比差异有统计学意义(t=4.79,P=0.041),感染组表达上调。自噬相关基因ATG5、ATG12和Rheb表达水平感染组与未感染组相比差异均无统计学意义(表3)。
讨 论
MTB是一种胞内感染菌,体液免疫应答中产生的抗体对其免疫效果比较局限,而天然免疫和细胞免疫对MTB应答起主要作用[2]。巨噬细胞通过细胞表面的TLR识别吞噬MTB后,启动自噬消化分解MTB,并将MTB的抗原表位通过人类白细胞抗原(human leukocyte antigen,HLA-Ι)提呈给CD4+的Th1淋巴细胞,从而启动细胞免疫应答[10-11]。自噬是机体免疫非常重要的环节,它既可以直接杀灭MTB,又可以为抗原提呈启动细胞免疫作准备。
本研究发现,初治结核病患者中Rheb和mTOR基因表达下调,可在一定程度上促进自噬水平,抵抗MTB感染。mTOR蛋白是一种蛋白酶,当mTOR蛋白激活后将抑制细胞的自噬水平,而mTOR蛋白被雷帕霉素抑制后,使细胞内的自噬水平升高[12]。Rheb属于Ras家族的成员,研究发现,Rheb蛋白可以激活mTOR蛋白,从而抑制细胞的自噬[13]。有研究报道,使用MicroRNA155干扰Rheb基因后可以促进细胞自噬杀灭MTB[14]。Rheb和mTOR蛋白都属于PI3K-Akt-mTOR信号通路,并且Rheb和mTOR蛋白都可以抑制细胞内的自噬[15]。尽管发现在初治结核病患者和健康者之间调节自噬的基因存在表达差异(Rheb和mTOR),但是参与自噬过程的蛋白基因ATG5、ATG12和LC3B在健康者和初治结核病患者之间并没有发现明显的表达差异。究其原因,可能为:(1)无论在健康者还是初治结核病患者中细胞自噬总是处在一个稳态中,所以这些自噬蛋白基因表达水平无明显差异;(2)测量的基因未覆盖到表达有明显差异的基因;(3)可能由于本研究的样本量较小,未检测到存在的基因表达差异。

表2 自噬相关基因在病例组和对照组中表达水平的比较
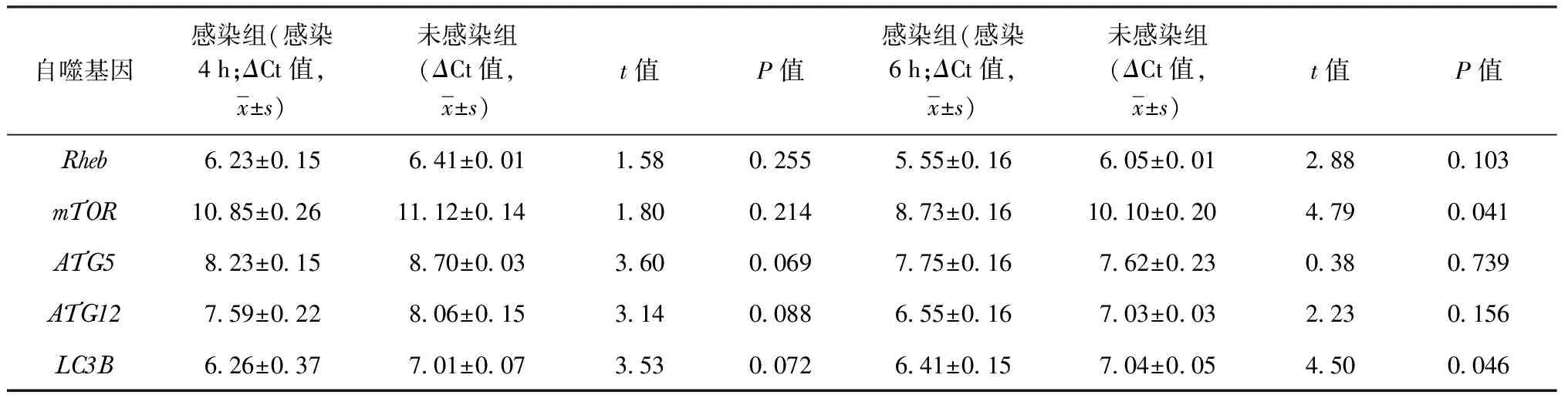
表3 自噬相关基因对THP-1细胞感染H37Rv标准株不同时间表达水平的影响
在细胞实验结果中,使用H37Rv标准株感染THP-1细胞4 h后自噬相关基因未见明显变化,而在感染6 h后测量自噬相关基因LC3B和mTOR较健康者表达上调,ATG5、ATG12和Rheb基因表达水平与健康者比较差异均无统计学意义。研究结果表明,THP-1细胞感染H37Rv标准株早期并不能明显改变自噬相关基因ATG5、ATG12和Rheb在细胞内的表达水平;H37Rv标准株感染6 h后,发现LC3B和mTOR基因表达上调。这揭示了MTB作为一种胞内感染菌可能改变被感染细胞的一些自噬相关基因的表达,并且使自噬蛋白基因LC3B和抑制自噬的基因mTOR表达同时上调。
综上,MTB感染并不能直接使调节自噬的基因Rheb和mTOR表达下调,而是通过一系列复杂的调控影响自噬水平。同时,本研究也证实H37Rv标准株在感染THP-1细胞的相互作用过程中,基因水平上同时存在促进和抑制自噬水平的双向调节。
[1] Xu G, Wang J, Gao GF, et al. Insights into battles betweenMycobacteriumtuberculosisand macrophages. Protein Cell, 2014, 5(10): 728-736.
[2] Iwasaki A, Medzhitov R. Toll-like receptor control of the adaptive immune responses. Nature Immunol, 2004, 5(10): 987-995.
[3] Janeway CA Jr, Medzhitov R. Innate immune recognition. Annu Rev Immunol, 2002, 20: 197-216.
[4] Bernard A, Jin M, Xu Z, et al. A large-scale analysis of autophagy-related gene expression identifies new regulators of autophagy. Autophagy, 2015, 11(11): 2114-2122.
[5] Morton CO, de Luca A, Romani L, et al. RT-qPCR detection of Aspergillus fumigatus RNA in vitro and in a murine model of invasive aspergillosis utilizing the PAXgene®and TempusTMRNA stabilization systems. Med Mycol, 2012, 50(6): 661-666.
[6] Park EK, Jung HS, Yang HI, et al. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res, 2007, 56(1): 45-50.
[7] 陈亮, 孙毅凡, 陈涛, 等. 佛波酯诱导THP-1细胞分化条件的优化及自噬模型的建立. 中国防痨杂志, 2013, 35(12)997-1002.
[8] Fontán P, Aris V, Ghanny S, et al. Global transcriptional profile ofMycobacteriumtuberculosisduring THP-1 human macrophage infection. Infect Immun, 2008, 76(2): 717-725.
[9] Yuan JS, Reed A, Chen F, et al. Statistical analysis of real-time PCR data. BMC Bioinformatics, 2006, 7: 85.
[10] Harris J, De Haro SA, Master SS, et al. T helper 2 cytokines inhibit autophagic control of intracellularMycobacteriumtuberculosis. Immunity, 2007, 27(3): 505-517.
[11] Bradfute SB, Castillo EF, Arko-Mensah J, et al. Autophagy as an immune effector against tuberculosis. Curr Opin Microbiol, 2013, 16(3): 355-365.
[12] Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature, 2011, 469(7330): 323-335.
[13] Sanjuan MA, Milasta S, Green DR. Toll-like receptor signaling in the lysosomal pathways. Immunol Rev, 2009, 227(1): 203-220.
[14] Wang J, Yang K, Zhou L, et al. MicroRNA-155 promotes autophagy to eliminate intracellular mycobacteria by targeting Rheb. PLoS Pathog, 2013, 9(10): e1003697.
[15] He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy. Annu Rev Genet, 2009, 43: 67-93.
(本文编辑:李敬文)
A study on expression of autophagy related gene in tuberculosis patients undergoing initial treatment
LYÜZi-zheng,WANGWei,LIUJing-ming,LIChuan-you,GAOMeng-qiu.
BacteriaImmunologyLaboratory,BeijingChestHospital,CapitalMedicalUniversity,Beijing101149,ChinaCorrespondingauthor:GAOMeng-qiu,Email:gaomqwdm@aliyun.com
Objective To explore expression of autophagy related gene in tuberculosis patients undergoing initial treatment. Methods Twelve first-treated tuberculosis patients from Beijing Chest Hospital were selected as case group and 12 newly recruited employees and students of Beijing Chest Hospital were in control group. The RNA was extracted from the peripheral blood and reversed to cDNA and then tested using qPCR. THP-1 cells infected by H37Rv were defined as infectious group and those without H37Rv were defined as the control group, then, using Trizol, RNA was extracted 4 and 6 hours after being infected with THP-1, and then reversed to cDNA and tested using qPCR. The gene of β-actin was defined as reference gene. After cycle threshold (Ct) values being tested by qPCR, we calculated theΔCt by subtracted Ct values of reference gene from autophagy genes. In addition, we used 2-ΔΔCt method to compare levels of the same genes from difference groups. Results TheΔCt values ofRhebgene in case group and control group were 8.71±0.58 versus 7.83±0.58 (t=3.74,P=0.001). TheΔCt values ofmTORgene were 11.88±0.97 versus 10.81±1.04 (t=2.60,P=0.016) in case group and control group. BothRhebgene andmTORgene were lowly expressed in case group. However, after infected for 6 hours,ΔCt values ofLC3Bgene in infected group and control group were 6.41±0.15 versus 7.04±0.05 (t=4.50,P=0.046);ΔCts ofmTORwere 8.73±0.16 versus 10.10±0.20 (t=4.79,P=0.041). TheLC3Bgene and themTORgene were highly expressed in infectious group. All the differences were statistically significant. Conclusion TheRhebandmTORgenes were lowly expressed in first-treated tuberculosis patients, which could regulate and increase the autophagy in defendingMycobacteriumtuberculosisinfection. In contrast, the gene expressions ofLC3BandmTORwere upgrading after infected by H37Rv for 6 hours.
Mycobacteriumtuberculosis; Autophagy; Gene expression; Immunity
10.3969/j.issn.1000-6621.2017.01.018
北京市医院管理局临床医学发展专项基金资助项目(ZYLX201304)
101149,首都医科大学附属北京胸科医院细菌免疫室(吕子征、王伟、刘京铭、李传友),结核科(高孟秋)
高孟秋,Email: gaomqwdm@aliyun.com
2016-06-27)

