GeneXpert MTB/RIF技术在结核病早诊断中的应用
路丽苹 陆斌 刘梅 洪建军 郭晓芹 高谦
·论著·
GeneXpert MTB/RIF技术在结核病早诊断中的应用
路丽苹 陆斌 刘梅 洪建军 郭晓芹 高谦
目的 评估GeneXpert MTB/RIF技术(简称Xpert MTB/RIF)检测结核分枝杆菌(MTB)及其利福平耐药的可行性。方法 选取2015年1—6月上海市松江区结核病定点医院结核科门诊连续纳入、初次就诊的疑似结核病患者,共556例。收集患者痰液标本,分别进行涂片抗酸染色镜检法(简称“涂片法”)、液体分枝杆菌培养管 (MGIT)培养法(简称“液体培养法”)、传统比例法药物敏感性试验(简称“药敏试验”)和Xpert MTB/RIF检测,比较Xpert MTB/RIF法和传统方法检测痰标本中MTB及其耐药性的效能。结果 537例患者经涂片法、液体培养法和Xpert MTB/RIF检测,阳性率分别为17.32%(93/537)、28.31%(152/537)和28.12%(151/537)。以液体培养为金标准,Xpert MTB/RIF检测的敏感度和特异度分别为90.60%(135/149)和95.84%(369/385),且敏感度高于涂片法[涂片法的敏感度为60.53%(92/152)],差异有统计学意义(χ2=36.71,P<0.01);Xpert MTB/RIF检测涂阳标本的敏感度为96.63%(86/89),明显高于检测涂阴标本的敏感度[81.67%(49/60)],差异有统计学意义(χ2=9.43,P<0.01)。以比例法药敏试验结果为金标准,Xpert MTB/RIF检测利福平耐药的敏感度为90.00%(9/10),特异度为99.07%(106/107),一致率为98.29%(115/117)。结论 Xpert MTB/RIF技术操作简便、快速、安全,敏感度和特异度较高,对基层实验室早期检测MTB及判定利福平耐药具有重要价值。
分枝杆菌,结核; 痰; 核酸扩增技术; 早期诊断; 利福平; 抗药性
目前,国内结核病实验室检测结核分枝杆菌(MTB)的常用方法仍然是痰涂片抗酸染色镜检、罗氏固体培养和比例法药物敏感性试验(简称“药敏试验”)。涂片镜检法的阳性检出率低,传统固体培养和药敏试验耗时较长,均难以实现对结核病患者的早期正确诊断和治疗[1]。随着分子生物学诊断技术的不断发展,GeneXpert MTB/RIF技术(简称Xpert MTB/RIF)作为一种利福平耐药实时荧光定量核酸扩增检测技术,受到了国内外的广泛关注。该检测方法针对MTBropB基因81 bp利福平耐药区间设计引物和探针,检测其是否发生突变。其完全整合传统核酸扩增所需的3个主要步骤(核酸提取、扩增和检测),仅需将处理后的待检样品放入反应盒后,系统就会自动进行核酸提取、被提取物核酸扩增和产物检测,反应结束后会自动给出实验结果。Xpert MTB/RIF检测技术操作简单、方便,2.5 h之内即可诊断患者是否感染MTB及其是否对利福平耐药[2-4],而传统方法检测利福平耐药则需要8周。
依托“十二五”国家科技重大专项支持,上海市松江区对2015年1—6月在该区唯一的结核病定点医院(上海市松江区中心医院)结核科门诊就诊的疑似肺结核患者进行连续6个月监测,对痰液样本同时进行涂片抗酸染色镜检法(简称“涂片法”)、液体分枝杆菌培养管 (MGIT)培养法(简称“液体培养法”)、传统比例法药敏试验和Xpert MTB/RIF检测,以评估Xpert MTB/RIF在检测MTB及其是否对利福平耐药方面的应用效能,现报告如下。
对象和方法
一、研究对象
选取2015年1—6月上海市松江区中心医院结核科门诊连续纳入的初次就诊的疑似结核病患者,共556例,收集其痰液标本。
二、试验方法
1.仪器与试剂:GeneXpert 检测系统及其配套试剂盒(Cartrige反应盒)购自美国Cepheid公司;痰标本处理液购自美国Cepheid公司;BACTEC MGIT 960系统及其配套试剂(MGIT生长指示管、分枝杆菌培养添加剂试剂盒、分枝杆菌联合药敏试剂盒系列)购自美国BD公司;改良罗氏培养基及噻吩-2-羧酸酰肼、对硝基苯甲酸鉴别培养基由上海市疾病预防控制中心培养基室配制;萋-尼抗酸染液购自珠海贝索生物技术有限公司;其他部分试剂为国产分析纯。
2.痰涂片检查:按照《痰涂片镜检标准化操作及质量保证手册》[5]中的标准化操作程序执行。
3.液体培养:采用BACTEC MGIT 960培养系统进行液体培养,参照《结核病诊断实验室检验规程》[6]操作及美国BD医疗器械(上海)有限公司提供的《MGIT液体培养操作手册》进行标准化操作。取处理好的痰液标本0.5 ml,加入MGIT液体培养管中,放入BACTEC MGIT 960液体培养系统中进行培养;培养阳性的标本进一步行药敏试验。
4.传统生化法菌种鉴别:参照《结核病诊断实验室检验规程》[6]操作。根据阳性生长对照孔、噻吩-2-羧酸酰肼药物孔、对硝基苯甲酸药物孔生长快慢,以及阳性和阴性情况判定鉴定结果。生长缓慢,噻吩-2-羧酸酰肼药物孔阳性,对硝基苯甲酸药物孔阴性者鉴定为MTB。
5.药敏试验:参照《结核病诊断实验室检验规程》[6]操作,采用文献[7]推荐的比例法,应用罗-琴(L-J)培养基,利福平40.0 μg/ml。耐药判定:根据菌落在培养基上生长情况,若含药培养基上生长的菌落数与对照培养基上生长菌落数的百分比大于1%,则认为受试菌对该抗结核药物耐药。
6.Xpert MTB/RIF检测:按照Xpert MTB/RIF操作说明书进行。移取1.0 ml痰液至螺旋盖试管中并加入2.0 ml痰标本处理液,在涡旋振荡器上振荡10 s,室温放置15 min,用专用吸管转移样本至专用的样本反应盒,将样本反应盒放入Xpert MTB/RIF Dx仪器的样本舱中,进行DNA提取、PCR扩增和结果的检测,通过专用软件判读结果。
7.质量控制:结核病痰检实验室操作人员均参加了国家Xpert MTB/RIF检测方法和仪器操作的专门培训,同时均参加每年国家结核病实验室药敏检测熟练度测试。
三、统计学分析
采用Excel 2007软件收集试验数据,应用SPSS 17.0软件进行统计学分析。不同检测方法间敏感度、特异度、一致率的比较采用χ2检验,以P<0.05为差异有统计学意义。敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;一致率=(真阳性例数+真阴性例数)/总例数×100%。
结 果
一、基本情况
对纳入的556例患者痰标本分别进行了痰涂片、液体培养及Xpert MTB/RIF检测,其中13例患者的标本培养污染,4例Xpert MTB/RIF检测MTB失败,2例Xpert MTB/RIF 利福平耐药检测结果无法判读,最终纳入分析537例。
二、各方法检测MTB的比较
1.细菌学检测结果:537例患者痰标本中,涂片法检查阳性93例(17.32%),阴性444例(82.68%);液体培养阳性152例(28.31%),阴性385例(71.69%);Xpert MTB/RIF检测阳性151例(28.12%),阴性386例(71.88%)。152例液体培养阳性的患者经菌种鉴定为MTB感染者149例,非结核分枝杆菌感染者3例。
2.涂片法与Xpert MTB/RIF检测结果的比较:93例涂片检查阳性患者经Xpert MTB/RIF检测有86例阳性;444例涂片检查阴性患者经Xpert MTB/RIF检测有379例阴性。相对于涂片检查,Xpert MTB/RIF检测的敏感度为92.47%(86/93),特异度为85.36%(379/444)。
3.液体培养法与Xpert MTB/RIF检测结果的比较:149例液体培养阳性的患者中(不包括鉴定为非结核分枝杆菌3例),经Xpert MTB/RIF检测有135例阳性;液体培养阴性的385例患者中,Xpert MTB/RIF检测有369例阴性。相对于液体培养,Xpert MTB/RIF检测敏感度为90.60%(135/149),特异度为95.84%(369/385)。
4.以液体培养为金标准比较涂片法和Xpert MTB/RIF检测的效能:涂片法和Xpert MTB/RIF检测MTB的敏感度分别为60.53%和90.60%,Xpert MTB/RIF检测敏感度高于涂片法,差异有统计学意义(χ2=36.71,P<0.01)。涂片法和Xpert MTB/RIF检测的一致率分别为88.64%和93.85%,Xpert MTB/RIF检测高于涂片法,差异有统计学意义(χ2=11.35,P=0.010)。具体见表1。
5. Xpert MTB/RIF检测涂阳及涂阴痰标本的效能:涂片检查阴性的444例患者,液体培养阳性者60例,Xpert MTB/RIF检测阳性49例,均为MTB。以液体培养结果为金标准,Xpert MTB/RIF检测涂阴患者的敏感度为81.67%(49/60),特异度为95.83%(368/384)。涂片检查阳性的93例患者,液体培养阳性92例,其中3例经鉴定是非结核分枝杆菌,这3例Xpert MTB/RIF结果为MTB(未检测出)。除去3例非结核分枝杆菌,其余90例结果见表2。以液体培养结果为金标准,Xpert MTB/RIF检测涂阳患者的敏感度和特异度分别为96.63%(86/89)和1/1。Xpert MTB/RIF检测涂阳标本的敏感度高于涂阴标本,差异有统计学意义(χ2=9.43,P<0.01)。

表1 以液体培养为金标准比较涂片法和Xpert MTB/RIF检测痰液标本的效能
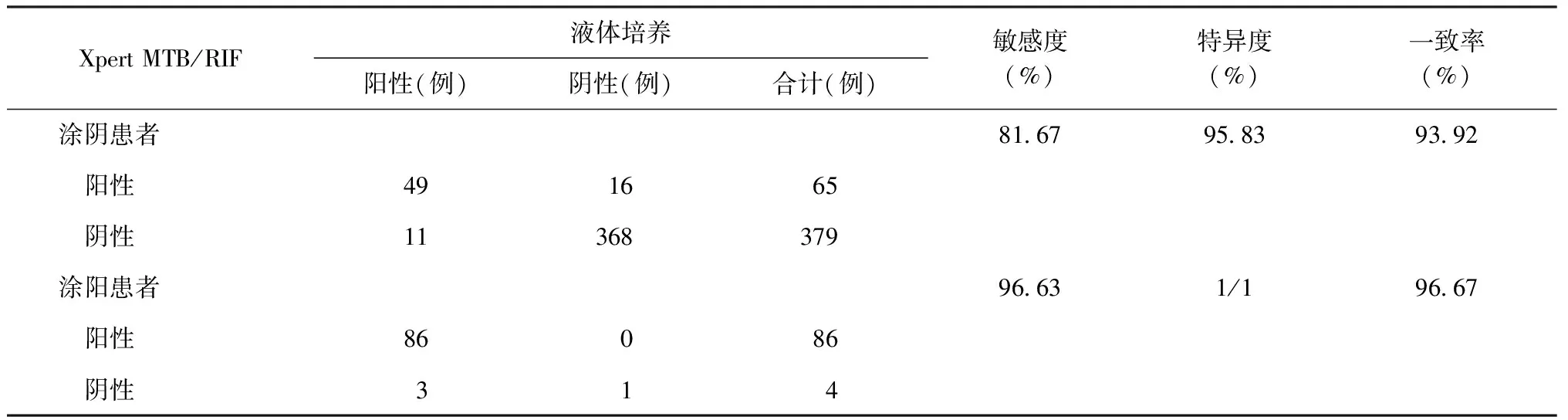
表2 以液体培养结果为金标准比较Xpert MTB/RIF检测涂片阳性与阴性痰标本的效能
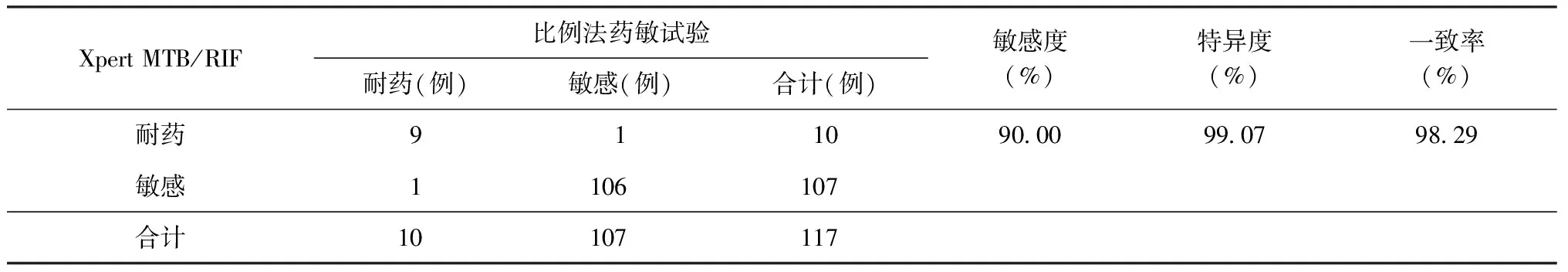
表3 Xpert MTB/RIF与比例法药敏试验检测培阳患者对利福平耐药性的结果比较
三、Xpert MTB/RIF与比例法药敏试验检测利福平耐药性的比较
液体培养与Xpert MTB/RIF检测结果均为阳性的135例患者中,18例未做传统药敏试验,同时应用Xpert MTB/RIF与比例法药敏试验进行利福平耐药检测的患者共117例,检测结果见表3。以比例法药敏试验检测结果为金标准,Xpert MTB/RIF检测MTB对利福平耐药的敏感度为90.00%(9/10),特异度为99.07%(106/107)。
讨 论
实验室检查是结核病确诊尤其是耐多药结核病确诊的重要依据。目前,我国基层结核病实验室诊断菌阳肺结核仍主要依赖于痰涂片和痰培养等传统方法。但是,这两种方法因其检出率较低,致使部分菌阳肺结核不能被及时发现。因而,探索一种MTB高检出率的方法,快速、准确诊断肺结核及其耐药性,对控制结核病疫情具有重要意义。
近年来,Xpert MTB/RIF检测技术已在多个国家和地区进行了验证评估[8-11],Xpert MTB/RIF检测可自动完成从MTB的DNA提取、扩增、产物检测到结果报告[15],且除标本前处理外整个检测均在封闭的反应盒内进行,全部检测过程仅需要2.5 h,能够实现结核病和利福平耐药的快速检测。同时,由于其敏感度和特异度较高,为WHO所推荐[12]。
目前,国内报道的对Xpert MTB/RIF检测的评估研究均以固体培养为金标准,液体培养为金标准者少见。上海市松江区结核病实验室2012年以来配置了BACTEC MGIT 960仪,对患者的痰标本检查全面实施液体培养,取代固体培养。本研究即以液体培养为金标准评估Xpert MTB/RIF技术,对国内的相关研究提供了参考价值。
本研究显示,Xpert MTB/RIF检测与涂片、液体培养法比较,其敏感度分别为92.47%和90.60%,同其他研究报道的结果相近[3,13]。以液体培养法结果为金标准,涂片法和Xpert MTB/RIF检测MTB的敏感度分别为60.53%和90.60%,Xpert MTB/RIF检测的敏感度明显高于涂片法检查,结果与其他研究相符[14]。相比液体培养法,Xpert MTB/RIF检测的报告时间大大缩短,提示Xpert MTB/RIF检测的临床应用价值高于传统涂片和液体培养法。目前,结核门诊就诊的具有典型症状或体征的肺结核患者明显减少,影像学表现不典型者亦较多,给临床医生的诊断带来的难度越来越大。Xpert MTB/RIF检测技术的应用则能更好地辅助临床医生进行诊断,尤其对于菌阴肺结核患者进行早期诊断和治疗。
本研究结果显示,以液体培养法结果为金标准,Xpert MTB/RIF检测涂阳患者和涂阴患者MTB的敏感度分别为96.63%和81.67%,与国内报道的Xpert MTB/RIF检测涂阳患者敏感度结果相近[4,17]。西班牙[18]、法国[19]和美国[20]分别开展的3项试验显示,Xpert MTB/RIF对痰涂片阳性标本的检测敏感度为98%~100%,对痰涂片阴性标本的检测敏感度为57%~83%,与本研究结果相近。由此,提示该方法检测痰涂片阳性标本时的敏感度较高,而检测痰涂片阴性标本时的敏感度相对较低[20-22]。
本研究中,Xpert MTB/RIF检测MTB对利福平耐药的敏感度为90.00%,特异度为99.07%。与国内外报道的敏感度相近[4,13-14]。但由于本研究的对象为初诊的疑似肺结核患者,检测到对利福平耐药的患者例数较少,下一步将扩大样本量进行进一步评估。
综上,Xpert MTB/RIF是一种快速、简便、自动化的分子诊断方法,敏感度和特异度较高,相对涂片、液体培养法及传统药敏试验等检测技术,其对实验室生物安全要求较低,且对操作人员危害轻,适用于基层实验室早期诊断结核病及是否对利福平耐药。WHO建议加快Xpert MTB/RIF检测技术的推广,作为一种全新的结核病快速诊断工具在临床上使用[12,23]。本研究也在某种程度上证明,该方法在我国基层实验室对于结核病诊断及是否对利福平耐药的患者筛査具有一定的意义和应用前景。但Xpert MTB/RIF检测技术需要相应的仪器及配套试剂,价格昂贵,且该方法仅能检测利福平是否耐药,而不能够对异烟肼是否耐药进行检测,不能诊断耐多药结核病,这些都限制了其在我国实验室诊断中的广泛应用。
[1] 王怡心, 陈雄豪, 林惠玲, 等. XpertMTB/RIF技术在基层实验室结核病诊断中的应用研究.分子诊断与治疗杂志, 2015, 7(3):176-179,192.
[2] Blakemore R, Story E, Helb D, et al. Evolution of the analytical performance of the Xpert MTB/RIF assay.J Clin Microbiol,2010,48(7):2495-2501.
[3] Boehme CC, Nabeta P, Hillemann D, et al. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med, 2010, 363(11): 1005-1015.
[4] 刘亚芹, 杨振斌, 冯冬霞, 等. GeneXpert法检测结核分枝杆菌及其对利福平耐药性的研究.中华实验和临床感染病杂志, 2015, 9(4):524-527.
[5] 赵雁林,姜广路. 痰涂片镜检标准化操作及质量保证手册. 北京:中国协和医科大学出版社,2009.
[6] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程. 北京:中国教育文化出版社,2006:34-58.
[7] World Health Organization. WHO/IUATLD global working group on anti-tuberculosis drug resistance surveillance. Guidelines for surveillance of drug resistance in tuberculosis. Geneva: World Health Organizationg,1997:216.
[8] Kurbatova EV, Kaminski DA, Erokhin VV, et al. Performance of Cepheid®Xpert MTB/RIF®and TB-Biochip®MDR in two regions of Russia with a high prevalence of drug-resistant tuberculosis. Eur J Clin Microbiol Infect Dis, 2013, 32(6):735-743.
[9] Myneedu VP, Behera D, Verma AK, et al. Xpert(®) MTB/RIF assay for tuberculosis diagnosis: evaluation in an Indian setting. Int J tuberc Lung Dis, 2014, 18(8): 958-960.
[10] Ou X, Xia H, Li Q, et al. A feasibility study of the Xpert MTB/RIF test at the peripheral level laboratory in China. Int J Infect Dis, 2015, 31: 41-46.
[11] Mokaddas E, Ahmad S, Eldeen HS, et al. Discordance between Xpert MTB/RIF assay and Bactec MGIT 960 Culture System for detection of rifampin-resistantMycobacteriumtuberculosisisolates in a country with a low tuberculosis (TB) incidence. J Clin Microbiol, 2015, 53(4): 1351-1354.
[12] World Health Organization. Rapid implementation of the Xpert MTB/RIF diagnostic test: technical and operational ‘HOW to’; practical considerations. Geneva: World Health Organization, 2011.
[13] 李辉,谭耀驹,李洪敏,等.利福平耐药实时荧光定量核酸扩增检测技术的诊断效果对比研究. 中国防痨杂志,2014,36(6):472-476.
[14] 赵冰,欧喜超,夏辉,等. Xpert Mtb/RIF检测技术在结核病诊断中的应用评价. 中国防痨杂志, 2014, 36(6): 462-466.
[15] Lawn SD, Nicol MP. Xpert®MTB/RIF assay: development, evaluation and implementation of a new rapid molecular diagnostic for tuberculosis and rifampicin resistance. Future Microbiol, 2011, 6(9):1067-1082.
[16] 胡忠义. 结核病耐药性检测技术进展及存在的问题和对策.中国防痨杂志, 2013, 35(11):865-867.
[17] 张治国, 欧喜超, 孙倩, 等. 利福平耐药实时荧光定量核酸扩增技术检测痰标本中结核分枝杆菌及其耐药性的研究. 中国防痨杂志,2013,35(1):13-16.
[18] Moure R, Muoz L, Torres M, et al. Rapid detection ofMycobacteriumtuberculosiscomplex and rifampin resistance in smear-negative clinical samples by use of an integrated real-time PCR method. J Clin Microbiol, 2011, 49(3):1137-1139.
[19] Armand S, Vanhuls P, Delcroix G, et al. Comparison of the Xpert MTB/RIF test with an IS6l10-TaqMan real-time PCR assay for direct detection ofMycobacteriumtuberculosisin respiratory and nonrespiratory specimens. J Clin Microbiol, 2011, 49(5):1772-1776.
[20] Marlowe EM, Novak-Weekley SM, Cumpio J, et al. Evaluation of the Cepheid Xpert MTB/RIF assay for direct detection ofMycobacteriumtuberculosiscomplex in respiratory specimens. J Clin Microbiol, 2011, 49(4):1621-1623.
[21] Rachow A, Zumla A, Heinrich N, et al. Rapid and accurate detection ofMycobacteriumtuberculosisin sputum samples by Cepheid Xpert MTB/RIF assay-a clinical validation study. PLoS One, 2011, 6(6): e20458.
[22] Theron G, Peter J, van Zyl-Smit R, et al. Evaluation of the Xpert MTB/RIF assay for the diagnosis of pulmonary tuberculosis in a high HIV prevalence setting. Am J Respir Crit Care Med, 201l, 184(1): 132-140.
[23] World Health Organization. WHO endorses new rapid tuberculosis test[EB/OL]. (2010-12-08)[2016-06-20]. http://www.who.int/mediacentre/news/releases/2010/tb_test_20101208/en/.
(本文编辑:李敬文)
Application of GeneXpert MTB/RIF test for early diagnosis of tuberculosis
LULi-ping*,LUBin,LIUMei,HONGJian-jun,GUOXiao-qin,GAOQian.
*DepartmentofTuberculosisControl,SongjiangDistrictCenterforDiseaseControlandPrevention,Shanghai201620,ChinaCorrespondingauthor:LULi-ping,Email:luluyer-1194@163.com
Objective To evaluate the application of GeneXpert MTB/RIF in detecting tuberculosis and resistance to rifampin. Methods Sputum samples from of 556 continuous patients with suspected tuberculosis from Clinics in Songjiang Central Hospital between January, 2015 and June in, 2015 were collected. The sensitivity and specificity of differentwere detected by smear test, liquid culture, traditional proportion method drug susceptibility test, and GeneXpert MTB/RIF test, the detection rates ofMycobacteriumtuberculosis(MTB) and rifampin resis-tances of traditional methods and GeneXpert MTB/RIF were analyzed. Results The positive rates of bacteria smear, liquid culture, and GeneXpert MTB/RIF method used for 537 sputum samples were 17.32% (93/537), 28.31% (152/537) and 28.12% (151/537). Compared to the liquid culture result (the golden standard), the sensitivity and specificity of the GeneXpert MTB/RIF for MTB were 90.60% (135/149) and 95.84% (369/385), the sensitivity was significantly higher than that of smear microscopy (60.53% (92/152);χ2=36.71,P<0.01). The sensitivities of GeneXpert MTB/RIF test for sputum smear-positive and smear-negative were significantly different (96.63% (86/89) vs. 81.67% (49/60),χ2=9.43,P<0.01). According to the result of conventional drug susceptibility with proportion method, the sensitivity, specificity and consistent rates of GeneXpert MTB/RIF test in detecting rifampin resistance were 90.00% (9/10), 99.07% (106/107) and 98.29% (115/117), respectively. Conclusion GeneXpert MTB/RIF method is simple, rapid,and with high safety, sensitivity and specificity, therefore, it has great value in the early diagnosis of tuberculosis and determination of rifampin resistance in primary laboratories.
Mycobacteriumtuberculosis; Sputum; Nucleic acid amplification techniques; Early diagnosis; Rifampin; Drug resistance
10.3969/j.issn.1000-6621.2017.01.016
“十二五”国家科技重大专项(2013ZX10004903)
201620 上海市松江区疾病预防控制中心结核病防治科(路丽苹、洪建军、郭晓芹);上海市松江区中心医院检验科(陆斌);复旦大学上海医学院 教育部、卫生部医学分子病毒学重点实验室(刘梅、高谦)
路丽苹,Email:luluyer-1194@163.com
2016-06-02)

