外周血CD5+B淋巴细胞与不明原因自然流产的关系性研究
王强强,奚士航,王际铭,王 萍
(皖南医学院 1.临床医学院;2.微生物学与免疫学教研室,安徽 芜湖 241002)
外周血CD5+B淋巴细胞与不明原因自然流产的关系性研究
王强强1,奚士航1,王际铭1,王 萍2
(皖南医学院 1.临床医学院;2.微生物学与免疫学教研室,安徽 芜湖 241002)
目的:通过检测不明原因自然流产患者和正常育龄妇女外周血CD5+B淋巴细胞的含量,探讨CD5+B淋巴细胞与不明原因自然流产的关系。方法:选择自然流产患者5例,正常育龄妇女5例。运用免疫磁珠法分离外周血中B淋巴细胞,采用流式细胞术检测CD5+B淋巴细胞的含量。结果:正常育龄组外周血中CD5+B淋巴细胞的比例为(0.78±0.40)%;自然流产组为(6.64±4.34)%。自然流产组明显高于正常育龄组,差异有统计学意义(P<0.05)。结论:CD5+B淋巴细胞可能参与不明原因自然流产的发病过程。
CD5+B淋巴细胞;自然流产;免疫磁珠法;流式细胞术
【DOI】10.3969/j.issn.1002-0217.2017.01.003
CD5+B细胞是B淋巴细胞一个亚群,是由胚胎或出生后早期的前体细胞发育而来,主要分布在腹膜、胸膜、肠系膜、大网膜及扁桃体等处。现已发现CD5+B细胞参与多种自身免疫性疾病的发病机制,如干燥综合征、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)等[1-3],这可能与CD5+B细胞分泌多种自身抗体有关。研究发现抗心磷脂抗体、抗单链DNA抗体[4]与自然流产有着密切的关系,自然流产患者血清中自身抗体可与相应抗原结合形成免疫复合物,沉淀于器官和血管,造成多器官损害,并可引起胎盘功能不全、胚胎发育障碍而引起妊娠丢失[5]。CD5+B细胞可产生相应抗体,故推测CD5+B细胞与自然流产的发病有关。
1 资料和方法
1.1 一般资料 收集2016年3~6月皖南医学院生育专科门诊部不明原因自然流产患者 5例,平均年龄(28.4±4.6)岁,平均孕周(8.3±3.0)周。所有患者经检查,夫妻双方染色体正常,内分泌检查无异常,排除全身感染性疾病,排除遗传疾病,在临床治疗前采集患者血样。另设体检健康的无自然流产史的育龄妇女5名作为对照组,平均年龄(24.3±3.2)岁。
1.2 主要试剂与仪器 CD19 McroBeads,human(Miltenyi公司);MACS Buffer(Miltenyi公司);CD19-PE human(Miltenyi公司);Anti-Human CD5 APC(eBioscience公司);Phosphate Buffered Saline(PBS,HyClone公司);人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);2%多聚甲醛(paraformaldehyde,PFA):取2g PFA加入100 mL磷酸缓冲液(phosphate buffer saline,PBS)中,置于60℃水浴锅中水浴溶解,调pH为7.2,4℃冰箱贮存。超净工作台(型号:Class Ⅱ BSC,新加坡ESCO公司);磁性细胞分离架(型号:MACS,Miltenyi公司);冷冻离心机(型号:4K1S,sigma公司);流式细胞仪(型号:FACS Verse,BD公司)。
1.3 方法
1.3.1 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的分离,采用密度梯度离心法 ①取新鲜抗凝静脉血10 mL与等量PBS充分混匀,将混匀后的液体缓慢滴加于10 mL淋巴细胞分离液液面上(抗凝静脉血∶PBS∶淋巴细胞分离液=1∶1∶1),2000 r/min×20 min。 ②吸取单个核细胞,加5倍容积的PBS洗涤两次,1500 r/min×5 min,用PBS调整细胞浓度为1×107/mL。
1.3.2 免疫磁珠分选[6]①用40 μm筛网过滤上述细胞悬液中较大团块,1500 r/min×5 min,100 μL MACS Buffer定容,取80 μL细胞悬液(余下20 μL作为分选前细胞)加入20 μL CD19 McroBeads,human,4℃放置15 min,加入400 μL缓冲液定容细胞悬液到500 μL,混匀。②组装美天旎磁珠分选系统,以500 μL MACS Buffer润洗美天旎分选柱(MS柱)待流空后将分选的细胞上柱,待流空后取500 μL MACS Buffer冲洗分选柱,重复3次。③将MS柱移出磁场,加入1 mL MACS Buffer,迅速推动活塞,使磁性标记的细胞流入收集管中,标记为CD19+细胞。
1.3.3 流式细胞仪检测 ①用PBS洗涤细胞悬液,将分选前细胞分成四管,空白管1个,补偿管2个和检测管1个。分选后细胞分为两管,空白管和检测管。分别用CD19-PE human 和Anti-Human CD5 APC进行细胞表面抗原的荧光染色,放置于4℃冰箱中避光30 min。注意取荧光抗体的移液器头只能一次性使用,避免荧光抗体交叉污染。要将细胞悬液和荧光抗体加在流式管底部,不应加到管壁上,防止细胞悬液和荧光抗体不能充分接触。注意避光,以免光亮造成荧光猝灭。②PBS 1 mL洗涤两遍,加2%PFA 400 μL/管,震荡混匀待上机检测。③ FCM分析,上机检测前应使用BD公司提供的质控微球来设置和调节各种参数使仪器处于最佳状态。分别作FSC/SSC,CD19/CD5二维点图;上空白管,调节FSC/SSC散点图电压,使出现的细胞点位于散点图的适当位置。在FSC/SSC散点图上圈出淋巴细胞区域设门,设门要注意把分析的细胞设置在门内,尽量减少其他细胞和细胞碎片掺入,获取的细胞数应足够。上补偿管,观察散点图上阳性细胞位置,依次调节各荧光补偿。上检测管,分别统计正常育龄妇女和自然流产患者免疫磁珠分选前后CD19+CD5+细胞所占百分比。见图1、2。
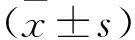
2 结果
2.1 CD19分选结果 通过流式细胞仪检测发现CD19单克隆抗体磁珠用于外周血淋巴细胞分选,分选后的CD19阳性细胞可以达到(78.80±14.57)%,而分选前CD19阳性细胞只占(2.27±2.06)%。
2.2 分选后CD5+B淋巴细胞检测结果 外周血中CD5+B细胞亚群水平的FCM检测结果显示,自然流产组患者外周血CD19+CD5+细胞含量为(6.64±4.34)%,对照组为(0.78±0.40)%,与对照组比较,自然流产组患者CD19+CD5+细胞比例升高,差异有统计学意义(t′=3.005,P<0.05)。
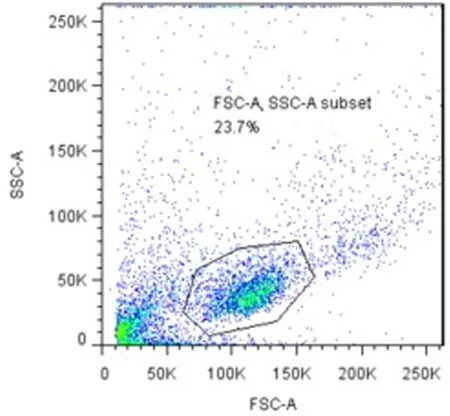
图1 1例自然流产患者单个核细胞设门

图2 1例自然流产患者免疫磁珠分选后CD19+CD5+细胞比例
3 讨论
近年研究表明CD5+B细胞能产生多种针对自身抗原的抗体,与自身免疫病的发生有关。Seidi等[7]在多发性硬化症中观察到CD5+B细胞与髓鞘蛋白抗体产生有关,并且也与多发性硬化症的活动期有关。李正发等[8]研究发现免疫相关性全血细胞减少症(IRP)患者外周血CD5+B细胞比率显著高于恶性血液病患者及正常对照组。付蓉等[9]提出IRP患者自身抗体的产生与B淋巴细胞及其亚群数量异常、功能亢进及凋亡受抑有关,利用流式细胞术检测骨髓造血细胞自身抗体及B淋巴细胞数可以为IRP的诊断提供科学可靠的依据。本实验结果显示自然流产患者外周血CD5+B细胞含量较正常育龄者升高(P<0.05),故推测CD5+B细胞数量的增多,导致其产生的抗体含量增多,如抗心磷脂抗体、抗单链DNA抗体等,导致母体免疫平衡失调,排斥作用增强引起流产。
免疫磁珠分选方法是近几年发展起来的一种细胞分选技术,尤其以德国Miltenyi Biotech公司的MACs和MiniMACS应用最多,它的基本原理是通过与磁性颗粒交联的特异性单抗结合靶细胞表面标志性抗原,借助磁力的作用,细胞被吸附而滞留在磁场中,将细胞进行分离。流式细胞分选技术(FACS)基本原理是利用流式细胞分选仪,以高能量激光照射高速流动状态下被荧光色素染色的单细胞或微粒,测量其产生的散射光和发射荧光的强度以达到分选的目的。相比FACS而言,MACS对细胞的刺激较小,操作简单,稳定性高、重复性强,所获得的细胞活性较高,不会出现像FACS那样由于机器运行时间长导致参数漂移故而实际获取的靶细胞阳性率大大下降的情况,更适用于临床大批量的细胞分选和大多数实验室的细胞分选工作。据文献报道,免疫磁珠技术可以用于分离人体各种细胞,如B淋巴细胞、T淋巴细胞、内皮细胞、造血干细胞、单核吞噬细胞、胰岛细胞和多种肿瘤细胞等。如今免疫磁珠技术已广泛应用于临床,尤其在肿瘤的诊断、分期方面发挥着重要作用。Ogura等[10]使用免疫磁珠,从外周血中提取出来的CD34+干细胞,将之用于Ⅰ、Ⅱ期临床试验研究,结果显示这种技术纯化出来的干细胞是安全有效的。本实验运用免疫磁珠联合流式细胞仪分选后的CD19+B淋巴细胞可达到(79.48±10.99)%,远远大于分选前细胞比例,分离步骤简便易行,在获得高纯度细胞的同时,对细胞损伤少,细胞丢失少,对临床大样本分离较安全、准确。
本实验表明自然流产患者外周血CD5+B细胞水平升高,但其具体的调节机制及 病理过程还未明确,今后我们将测定流产患者外周血中特定抗体的含量,探讨自身抗体与CD5+B细胞的关系。通过测定CD5+B细胞的基因表达水平进一步探讨CD5+B细胞与自然流产的关系,为不明原因自然流产的产前诊断提供一定的参考价值,也为其治疗提供思路。
[1] 肖睿璟,李莉,刘婧依,等.干燥综合征患者外周血CD5+B细胞、CD5 mRNA变化的研究[J].武汉大学学报,2010,31(1):13-15.
[2] 杨金华,介绍亮,吴萌,等.CD19+CD5+B细胞和白细胞介素-10在系统性红斑狼疮患者外周血中的变化及意义[J].中华风湿病学杂志,2015(7):447-450.
[3] 饶莉,何世东,于乐,等.类风湿关节炎患者外周血CD5+B细胞及其亚群变化和意义[J].中国综合临床,2009,25(5):502-504.
[4] 任兴斌,高春海.自然流产病人抗ACA与抗DNA抗体分析[J].中华男科学,2000,6(1):36-37.
[5] 黄神姣,陈敦金,罗太珍,等.a-β2GP1、ACA 在早期先兆流产患者妊娠丢失中的临床意义[J].临床医学工程,2012,19(10):1684-1685.
[6] 罗欣,杜颖颖,张进,等.密度梯度离心和免疫磁珠分选相结合分离脐血中胎儿有核红细胞[J].中国产前诊断杂志,2010,2(3):4-7.
[7] SEIDI OA,SEMRA YK,SHARIEF MK.Expression of CD5 on B lymphocytes correlates with disease activity in patients with multiple sclerosis[J].Journal Neuroimmunol,2002,133(1-2):205-210.
[8] 李正发,董婷,欧阳红梅,等.骨髓单个核细胞抗体及外周血B淋巴细胞与IRP的相关性研究[J].生命科学研究,2014,18(5):418-422.
[9] 付蓉,邵宗鸿,刘鸿,等.免疫相关性全血细胞减少症患者骨髓B淋巴细胞数量、功能及凋亡[J].医学研究通讯,2003,32(11):9-12.
[10] OQURA M,KAQAMI Y,SUZUKI R,etal.Phase I/II trial of cure-oriented high-dose chemoradiotherapy with transplantation of CD34+ peripheral blood stem cells purified by the immunomagnetic bead method for refractory hematological malignancies[J].Cancer Chemother Pharmacol,1997,40(Suppl):S51-57.
Peripheral blood CD5+B lymphocytes and spontaneous abortion of unknown origin
WANG Qiangqiang,XI Shihang,WANG Jiming,WANG Ping
School of Clinical Medicine,Wannan Medical College,Wuhu 241002,China
Objective:To investigate the correlation of spontaneous abortion of unknown causes and CD5+B lymphocytes through determination of the CD5 positive B lymphocyte level in the peripheral blood in women with unestablished miscarriage and normal pregnancy.Methods:Five patients with spontaneous abortion were included in the experimental group,and five women of normal pregnancy were recruited as control group.Magnetic activated cell sorting technique was used to(MACS)to isolate the peripheral blood CD5+B lymphocytes for which the level was measured with flow cytometry(FCM).Results:Women of normal pregnancy had higher level of peripheral blood CD5+B lymphocytes than the patients with miscarriage[(6.64±4.34)%vs.(0.78±0.40)%].The difference was significant(P<0.05).Conclusion:CD5+B lymphocytes might be involved in the pathogenesis of the spontaneous abortion of unknown origin.
CD5+B lymphocytes;spontaneous abortion;magnetic activated cell sorting;flow cytometry
1002-0217(2017)01-0008-03
国家级大学生创新训练项目(201410368033)
2016-09-01
王强强(1995-),男,2012级临床医学专业本科生,(电话)15755383969,(电子信箱)1441551658@qq.com; 王 萍,女,副教授,硕士生导师,(电子信箱)418187325@qq.com,通信作者。
R 392.3;R 714.21
A

