AAVC-1诱导A549细胞凋亡的线粒体机制研究
徐 成,张根葆,周淑艳,桑金凤
(皖南医学院 1.临床医学院;2.病理生理学教研室;3.蛇毒研究所,安徽 芜湖 241002)
AAVC-1诱导A549细胞凋亡的线粒体机制研究
徐 成1,张根葆2,3,周淑艳2,桑金凤2
(皖南医学院 1.临床医学院;2.病理生理学教研室;3.蛇毒研究所,安徽 芜湖 241002)
目的:探讨皖南五步蛇蛇毒抑瘤组分Ⅰ(AAVC-1)诱导人非小细胞型肺癌A549细胞凋亡的作用,并分析其可能的线粒体机制。方法:以不同作用浓度的AAVC-1处理A549细胞,采用Annexin V /PI双染流式细胞仪分析法检测A549细胞凋亡百分率;JC-1检测细胞线粒体的膜电位变化,免疫组化检测细胞色素C在线粒体内的分布。结果:不同浓度梯度AAVC-1 1.0、3.0、9.0、20.0 μg/mL处理24 h后,与对照组相比,A549细胞早期凋亡率明显增加(P<0.05);线粒体膜电位绿色荧光百分比由(23.01±6.07)%上升至(87.26±9.54)%(P<0.01),荧光显微镜观察到绿色荧光增强;免疫组化显示,随着AAVC-1浓度增加,胞质内细胞色素C平均光密度值明显增加(P<0.05)。结论:AAVC-1可以通过降低线粒体膜电位和促进细胞色素C的释放,激活线粒体通路诱导人非小细胞型肺癌A549的凋亡。
五步蛇毒抑瘤组分Ⅰ;非小细胞型肺癌;线粒体;细胞凋亡
【DOI】10.3969/j.issn.1002-0217.2017.01.002
肺癌是威胁人类健康和生命的最常见的恶性肿瘤之一,有报道指出我国肺癌的发病率和病死率有明显增高的趋势,其中非小细胞型肺癌的恶性程度最高,对放化疗均不敏感,预后最差[1]。因此,寻找有效安全的抗肿瘤药物是当前研究的一个热点问题。蛇毒生物学活性广泛,是一种天然的药用资源,富含多种酶类、蛋白质和多肽,具有镇痛、抗凝、抗血栓、抗肿瘤等功效[2-3],其中抗肿瘤效应已越来越受到重视[4]。本实验室前期从皖南地区五步蛇粗毒中分离纯化了一种抑瘤组分Ⅰ(Agkistrodonacutusvenom-1,AAVC-1),研究表明,AAVC-1可以剂量依赖性抑制人非小细胞肺癌细胞A549的体外增殖和诱导其凋亡,但其确切的机制尚不清楚[5]。本实验进一步探讨AAVC-1诱导A549细胞凋亡的线粒体机制,为AAVC-1可能的临床应用提供一定的理论依据。
1 材料与方法
1.1 试剂、药品和仪器 五步蛇蛇毒抑瘤组分Ⅰ(AAVC-1)冻干粉由皖南医学院蛇毒研究所提供。无支原体胎牛血清购自杭州四季青生物工程材料有限公司;RPMI 1640(Hyclone)、胰蛋白酶(Gibcobrl)、JC-1检测试剂盒、细胞色素C单克隆抗体、Annexin V- FITC/PI 细胞凋亡检测试剂均购自浙江碧云天生物技术研究所(进口分装产品);免疫组化试剂盒为武汉博士德公司产品;MUSE智能触控细胞分析仪(德国,Milipore公司),倒置荧光显微镜(日本,OLYMPUS IX51),二氧化碳培养箱(美国,Thermo公司),超净工作台(上海三发科学仪器有限公司)。
1.2 细胞培养和分组 人肺癌细胞A549由皖南医学院蛇毒研究所留存,细胞接种于含10%胎牛血清、1%青霉素-链霉素溶液的RPMI1640中,置于5%CO2,恒温37℃细胞培养箱中常规培养。设置对照组(加入等体积的细胞培养液),实验组(分别加入1.0、3.0、9.0、20.0 μg/mL AAVC-1),以及CCCP组(CCCP,作为一种质子载体,强效的线粒体氧化磷酸化解偶联剂,可使线粒体内膜两侧的膜电位彻底丧失[6])。
1.3 方法
1.3.1 Annexin V-FITC/PI流式细胞仪检测A549细胞凋亡 各组细胞培养24 h后,细胞样本均分3份。处理细胞及加入试剂的具体操作参照凋亡检测试剂盒说明。细胞消化、离心,收集悬浮细胞,弃培养基。用冷PBS洗涤细胞两次。用400 μL 1X Binding Buffer悬浮细胞,浓度大约为1 × 106/mL。在细胞悬浮液中加入5 μL Annexin V-FITC,轻轻混匀后于2~8°C避光条件下孵育15 min。 加入10 μL PI后轻轻混匀于2~8°C避光条件下孵育5 min。使用MUSE智能触控细胞分析仪分析样本。样本最少细胞数为1×105个。以上检测重复3遍。
1.3.2 JC-1检测线粒体膜电位变化 依据JC-1检测试剂盒使用说明进行操作。JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针,取对数增殖期细胞,将细胞接种于6孔板,分别设置对照组(加入等量的培养基),CCCP(1 μg/mL CCCP处理20 min)以及不同浓度的AAVC-1(1.0、3.0、9.0、20.0 μg/mL)实验组,37℃孵育24 h,重复3次,荧光显微镜下观察线粒体膜电位改变,用Image pro plus 6.0 软件的Color Histogram模板计算出5个视野绿色荧光强度的平均值,以平均荧光强度做统计分析,定量线粒体膜电位水平。
1.3.3 免疫组化检测胞质细胞色素C(cyto.c)含量 制备细胞爬片,待铺满60%~80%后弃原培养液,PBS洗3次,加入4%多聚甲醛室温固定20 min,PBS洗3次,再加0.5%Triton X-100,室温下封闭15 min,PBS洗3次,加入抗细胞色素C兔单克隆抗体1∶200(阴性对照组加PBS),37℃过夜,PBS洗3次,再加生物素标记的羊抗兔IgG,37℃孵育30 min,PBS洗3次,加 DAB显色液,显微镜下控制显色,苏木精复染,水洗,1%盐酸酒精分化,酒精梯度脱水,最后中性树胶封片,倒置显微镜观察拍照,用Image pro plus 6.0 软件的Color Histogram模板计算出5个视野平均光密度值,以平均光密度值来定量细胞色素C表达水平。
2 结果
2.1 AAVC-1诱导A549细胞的凋亡 AAVC-1作用于A549 细胞24 h后,利用Annexin V/PI双染流式细胞术检测,左下限为正常细胞群,右下限为早期凋亡细胞群,右上限为晚期凋亡细胞和坏死细胞群[7]。结果如图1所示,随着药物浓度的增加,细胞凋亡率也相应增加。当AAVC-1在1.0 ~ 20.0 μg/mL范围时,A549细胞早期凋亡率分别为0.99%、2.60%、5.69%、7.88%、16.74%,而对照组细胞凋亡无明显改变。

A:对照组;B~E:AAVC-1 1.0、3.0、9.0、20.0 μg/mL处理组。
图1 AAVC-1诱导A549细胞早期凋亡的百分率
2.2 AAVC-1对A549细胞线粒体膜电位的影响 JC-1是一种用于检测线粒体膜电位的荧光探针,可以检测细胞组织或纯化的线粒体膜电位[6]。当线粒体膜电位水平较高时,JC-1聚集在线粒体基质中,形成聚合物,呈高红低绿;当膜电位水平较低时,JC-1主要以单体形式存在于胞质中,呈高绿低红。各组A549细胞绿色荧光百分比见表1,随着AAVC-1浓度的增加,绿色荧光逐渐增强(P<0.05和P<0.01),提示AAVC-1处理的A549细胞的线粒体膜电位水平明显下降(图2)。
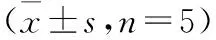

组别绿色荧光百分比/%Control11.00±4.06AAVC-11.0μg/mL23.01±6.07*AAVC-13.0μg/mL51.61±6.99**AAVC-19.0μg/mL64.05±6.20**△AAVC-120.0μg/mL87.26±9.54**△CCCP92.62±12.26**F值86.513P值0.000
注:与对照组比较,*P<0.05,**P<0.01;与AAVC-1 1.0 μg/mL 组比较,△P<0.05。

A:对照组;B~E:AAVC-1 1.0、3.0、9.0、20.0 μg/mL处理组;F:CCCP组。
图2 AAVC-1对A549细胞线粒体膜电位的影响(200×)
2.3 AAVC-1增加A549细胞线粒体细胞色素C的释放 免疫组化检测结果显示,在实验组AAVC-1孵育A549细胞24 h后,细胞胞质内出现明显的黄染颗粒,镜下细胞体积缩小,细胞间隙增大,胞质染色加深,随AAVC-1浓度的增加,细胞色素C平均光密度值也逐渐升高,与对照组比较差异有统计学意义(P<0.05),见表2。对照组细胞呈长梭形,边界清晰,胞质内黄染颗粒不明显。
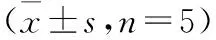

组别平均光密度值Control0.05±0.02AAVC-11.0μg/mL0.37±0.10*AAVC-13.0μg/mL0.44±0.43**AAVC-19.0μg/mL0.54±0.84**AAVC-120.0μg/mL0.79±0.10**F值8.587P值0.000
注:与对照组比较,*P<0.05,**P<0.01。
3 讨论
细胞线粒体是细胞能量供应的场所,氧化磷酸化、电子传递、三羧酸循环等均依赖线粒体,当线粒体膜结构或功能受到破坏时,能量代谢异常,可引起细胞凋亡。有文献报道指出,线粒体死亡途径是细胞凋亡发生的主要机制之一[8],当Bax蛋白和线粒体膜上的电位依赖性离子通道相结合,膜通透性改变,线粒体的膜电位Δψm降低,细胞色素C和凋亡诱导因子AIF从线粒体释放入胞质,在dATP或ATP的作用下,和凋亡蛋白酶激活因子Apaf-1结合,激活下游的casapase-9,三者形成凋亡复合体,再进一步激活关键的凋亡蛋白casapase-3,继而引发细胞凋亡[9-10]。AAVC-1是从皖南五步蛇粗毒中分离纯化的一种抑瘤组分,具有明显的抑制肿瘤细胞增殖和促进凋亡的效应[5]。本实验结果进一步证实了AAVC-1的促细胞凋亡作用,20.0 μg/mL AAVC-1可使人非小细胞肺癌A549细胞早期凋亡百分率达16.97%。JC-1荧光探针用来检测细胞膜电位改变,当线粒体的膜电位较高时,JC-1主要以聚合物的形式聚集在胞质中,呈红色荧光;当膜电位浓度降低时,JC-1以单体的形式,散在分布于胞质中,呈绿色荧光[6]。实验发现,不同浓度AAVC-1处理24h均会引起A549细胞线粒体膜电位Δψm降低,绿色荧光百分比高于对照组(P<0.05和P<0.01);实验还观察到AAVC-1各浓度组(1.0~20.0 μg/mL)引起线粒体膜电位降低的程度小于CCCP组(P<0.05),提示AAVC-1可以诱导线粒体膜电位的降低,但未使线粒体膜电位彻底崩溃。同时,免疫组化结果也显示实验组AAVC-1孵育A549细胞24 h后胞质内出现明显的黄染颗粒,细胞色素C平均光密度值也明显升高,与对照组相比差异有统计学意义(P<0.05)。结果表明,AAVC-1可以通过降低A549细胞线粒体膜电位Δψm,诱导细胞色素C从细胞线粒体释放至胞质,从而导致细胞凋亡。
[1] WAKELEE H,RAMALINGAM S,BELANI CP,etal.Docetaxel in advanced non-small cell lung cancer[J].Expert Rev Anticancer Ther,2005,5(1):13-24.
[2] ZHANG L,CUI L.A cytotoxin isolated from Agkistodon acutus snake venom induces apoptosis via Fas pathway in A549 cells[J].Toxicol In Vitro,2007,21(6):1095-1103.
[3] 陈念,付晓燕,江伟健,等.蛇毒蛋白的分类和应用[J].中国新药杂志,2009,18(13):1204-1011.
[4] JANEYUTH CHAISAKUL,WAYNE C HODGSON,SANJAYA KURUPPU,etal.Effects of Animal Venoms and Toxins on Hallmarks of Cancer[J].Journal of Cancer,2016,7(11):1571-1578.
[5] 徐平,张根葆,王斐,等.尖吻蝮蛇毒抑瘤组分Ⅰ对人肺癌A549 细胞增殖抑制作用.[J].中国临床药理学与治疗学,2014,19(5):493-496.
[6] ANTOINE T,FISHER N,AMEWU R,etal.Rapid kill of malaria parasites by artemisinin and semi-synthetic endoperoxides involves ROS-dependent depolarization of the membrane potential[J].J Antimicrob Chemother,2014,69(4):1005-1016.
[7] KHAN A,GILLIS K,CLOR J,etal.Simplified evaluation of apoptosis using the Muse cell analyze[J].Postepy Biochem,2012,58(4):492-498.
[8] ESTAQUIER J,VALLETTE F,VAYSSIERE JL,etal.The mitochondrial pathways of apoptosis[J].Med Biol,2012,942:157-183.
[10] HOU LL,ZHOU LY,LUO KQ,etal.Smac/DIABLO and cytochrome c are released from mitochondria through a similar mechanism during UV-induced apoptosis[J].Apoptosis,2005,10(2):289-299.
Mitochondrial mechanism of AAVC-1 induced apoptosis in A549 cells
XU Cheng,ZHANG Genbao,ZHOU Shuyan,SANG Jinfeng
School of Clinical Medicine,Wanan Medical College,Wuhu 241002,China
Objective:To investigate the apoptosis pathway and mechanisms of human non-small cell lung cancer A549 cells induced by anticoagulant fraction fromAgkistrodonacutusvenom(AAVC-1).Methods:Different dose of AAVC-1 was used to treat A549 cells,and the apoptosis percentage of A549 cells was assessed by flow cytometry with annexin V/PI double staining.Mitochondrial trans-membrane potential(Δψm)of A549 cells was measured by JC-1 fluorescence probe and microscopy,and distribution of cytochrome C in the mitochondria was detected by immunohistochemistry after AAVC-1 treatment.Results:The early apoptosis rate of A549 cells was significantly increased after treatment with different dose of AAVC-1 for 24 h as compared with the control group(P<0.05).The fluorescence green intensity was increased from(20.13±1.6)% to(89.12±1.2)%(P<0.01),and fluorescence spectroscopy indicated intensified intracellular green fluorescence.Immunohistochemical test revealed markedly increased average light density of cytochrome C with added dose of AAVC-1 treatment(P<0.05).Conclusion:AAVC-1 can induce the apoptosis of human non-small cell lung cancer A549 cells by reducing the mitochondrial membrane potential and promoting the release of cytochrome C.
Agkistrodonacutusvenomantitumor component 1;non-small cell lung cancer;mitochondria;apoptosis
1002-0217(2017)01-0005-04
皖南医学院大学生科研资助项目(RG20151204);安徽高校省级自然科学研究重点项目(KJ2011A266)
2016-09-23
徐 成(1993-),女,2012级临床医学专业本科生,(电话)18356976912,(电子信箱)1165911631@qq.com; 张根葆,男,教授,硕士生导师,(电子信箱)zgb858@163.com,通信作者。
R 734.2
A

