重编程人成纤维细胞为诱导型类小脑颗粒样细胞的体外实验研究
沈刚,苏作鹏,全勇,徐福林,徐锋
·论著·
重编程人成纤维细胞为诱导型类小脑颗粒样细胞的体外实验研究
沈刚,苏作鹏,全勇,徐福林,徐锋
目的 在体外直接诱导重编程获取患者成纤维细胞来源的诱导型类小脑颗粒样细胞(hiCGCs),并研究这些细胞的生物学特征。方法 筛选与小脑神经细胞发育、分化相关的诱导因子;构建携带有转录因子的表达载体;以标准皮肤细胞培养流程培养出人头皮成纤维细胞,使用慢病毒载体介导Ascl1、Sox2和OCT4三个转录因子在胞内表达,并在培养过程中加入神经营养因子:BMP4,FGF8b和Wnt3a;诱导获得具有小脑颗粒神经元特征的hiCGCs。结果 经细胞免疫组织化学和电生理检测,证实该hiCGCs具有类似正常小脑颗粒神经元的生物学和生理学特征。使用Ascl1、Sox2和OCT4三个转录因子及BMP4、FGF8b和Wnt3a三种营养因子可将成人成纤维细胞直接转变成为具有小脑颗粒神经元特征的hiCGCs。结论 HiCGCs在形态上与小脑颗粒神经元非常相似,能够表达小脑颗粒神经元的特异性蛋白,并具有类似正常小脑颗粒神经元的电生理特性。
人诱导型类小脑颗粒样神经细胞;再生医学;谱系重编程
小脑是脑组织中相对独立和特殊的区域,在运动控制和认知功能领域发挥着重要的作用。颗粒细胞是谷氨酸能的兴奋性神经元,也是小脑数量最多的神经元[1-2]。临床上常见的小脑疾病包括小脑萎缩和小脑发育不良[3-6],该类疾病目前无有效的治疗方法。通过外源性细胞、组织移植的方式可以促进神经组织及其功能修复,并重建神经信号网络,有望成为攻克该类疾病的重要途径[7]。但小脑特异性功能神经细胞的来源途径有限,采用细胞谱系重编程技术将人头皮成纤维细胞直接转化为小脑特异性的神经细胞,可以提供大量、稳定的小脑特异性细胞,解决移植细胞来源局限的问题。在此基础上,本研究采用神经外科手术患者的成纤维细胞(头皮组织来源),使用慢病毒载体介导Ascl1、Sox2和OCT4三个因子在细胞内表达,并在培养过程中加入体外诱导胚胎干细胞向小脑神经元分化的重要神经营养因子——BMP4、FGF8b和Wnt3a,诱导获得了具有小脑颗粒神经元特征的人诱导型小脑颗粒样神经细胞(hiCGCs)。现报告如下。
1 材料与方法
1.1 标本 收集神经外科手术患者的健康头皮标本。在知情同意的前提下,所有标本均在手术切除后立刻剪碎并用于培养原代的成纤维细胞。
1.2 成纤维细胞培养及病毒感染 (1)收集接受外科手术患者术中脱落的头皮组织,在70%乙醇中浸泡消毒5 min,PBS清洗2遍;用无菌小剪刀剪成1 mm3的碎片,加入含双抗的PBS清洗2遍;加入胶原酶Ⅳ(1 mg/ml),离心5 min后弃上清。向沉淀物中加入适量0.25%胰蛋白酶。收集离心的细胞悬液2~3次,在成纤维细胞培养液内重悬细胞,调整至一定细胞密度后接种到培养瓶。用第5代细胞进行诱导重编程。将慢病毒加入到靶细胞,测定病毒滴度后,用足量含病毒的培养液感染靶细胞。第二轮病毒感染后,用N3培养液进一步诱导培养。
1.3 体细胞重编程为hiCGCs 每天给细胞进行换液直到颗粒样神经元样细胞(granular-like cells)出现。经过大约1周的慢病毒感染能看到颗粒神经元样细胞,14 d左右能进行细胞克隆挑选并换用N2培养液。稳定传代生长3~5代。其中,根据形态特征剔除掉非神经元样细胞,同时也将处于转染体系中转变的神经元样细胞挑取补充进培养体系中。
1.4 鉴定hiCGCs的生物学特征 将成纤维细胞接种至6孔板,使用前述因子表达来诱导hiCGCs的产生,观察在诱导细胞中GFP阳性并具有典型神经元细胞形态:在三维成像的层面上有一条≥3倍胞体长度的细长突触的完整细胞。用细胞计数器计数Tuj1+/GFP+并具有典型神经元形态的细胞数,计算病毒转染后不同时间点的hiCGCs细胞诱导效率,同时计数Tuj1+/Ath1+双阳性的细胞数;诱导效率=hiCGCs细胞数/接种的成纤维细胞数。使用蛋白免疫印迹(Western blot)、RT-PCR分析小脑颗粒样细胞相关蛋白及RNA的表达水平。膜片钳技术检测hiCGCs的电生理特性,记录兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)。EPSCs在电压钳模式下记录,给予刺激,电压钳制在-80 mV和+40 mV。所采集的数据经数模转换器及pClamp 9.2软件处理。
2 结 果
2.1 人头皮成纤维细胞的原代培养及鉴定 采用组织块培养法进行人头皮成纤维细胞培养。接种后约2~3d,在倒置显微镜下可观察到组织块周围有细胞爬出,呈辐射状生长,表现出典型的成纤维细胞样。在原代培养初期,细胞增殖较慢,传3~5代之后,细胞增殖速度加快。波形蛋白(viementin)和胶原蛋白(collagen)是在成纤维细胞中最经常被检测到的蛋白,是可靠的成纤维细胞标志。在原代培养的人头皮成纤维细胞上广泛检测到viementin和collagen的表达(图1),证明用于重编程的头皮细胞主要是成纤维细胞。
为排除起始细胞群可能有来自于本身就具有一定多向分化潜能的神经嵴及其衍生物。分别使用神经干/祖细胞标志Nestin、小脑颗粒神经元标志Ath1、神经上皮标志Pax6、Sox10和多能干细胞标志Nanog等来鉴定人成纤维细胞。经过免疫化学实验检测,起始细胞并不表达神经干/祖细胞、小脑颗粒神经元等的标志蛋白。

图1 人头皮成纤维细胞viementin和collagen蛋白的表达(scale bar=400 μm)
2.2 体细胞重编程产生诱导型颗粒神经元样细胞
显微镜下观察,在病毒感染后7 d出现部分神经元样细胞,形态主要为:胞体变小,有单级或双极突触出现。其后继续变化,14 d左右形成肉眼可见的较典型神经元样细胞,形态更为复杂,有明显的突触延伸出胞体。到第21 d,部分培养的细胞表现出典型神经元的细胞形态,呈三角形或椭圆形,胞体变小、折光性强,边界清楚,向外延伸出一根或多根轴突样突起。进一步培养28 d后,部分细胞表现出更为成熟的神经元的细胞形态,部分细胞突触出现典型的小脑颗粒神经元样的T形分叉。经过稳定传代筛选培养,hiCGCs在形态上与小脑颗粒神经元非常相似。
2.3 hiCGCs诱导效率分析 Tuj1抗体已经被广泛证实仅识别神经细胞的neuronal class Ⅲβ-tubulin,是比较公认的神经元标志。小脑颗粒神经元缺乏特异性标识,需要结合多种标志物进行鉴定。Ath1是小脑颗粒神经元产生所必需的物质,是第一个在活体内获得的能够产生颗粒细胞的基因,其表达提示小脑颗粒神经元的可能。通过计数:(1)具有典型神经元的细胞形态;(2)表达Tuj1+/GFP+双阳性的细胞,来计算诱导为神经细胞的效率。同时计算转分化为Tuj1+/Ath1+神经元的效率。结果显示,随着转染后时间的增加,Tuj1+/GFP+双阳性细胞出现的比例逐渐增高;到转染后的第21d后,Tuj1+/GFP+细胞的数量陡然增多(P<0.01),见图2。
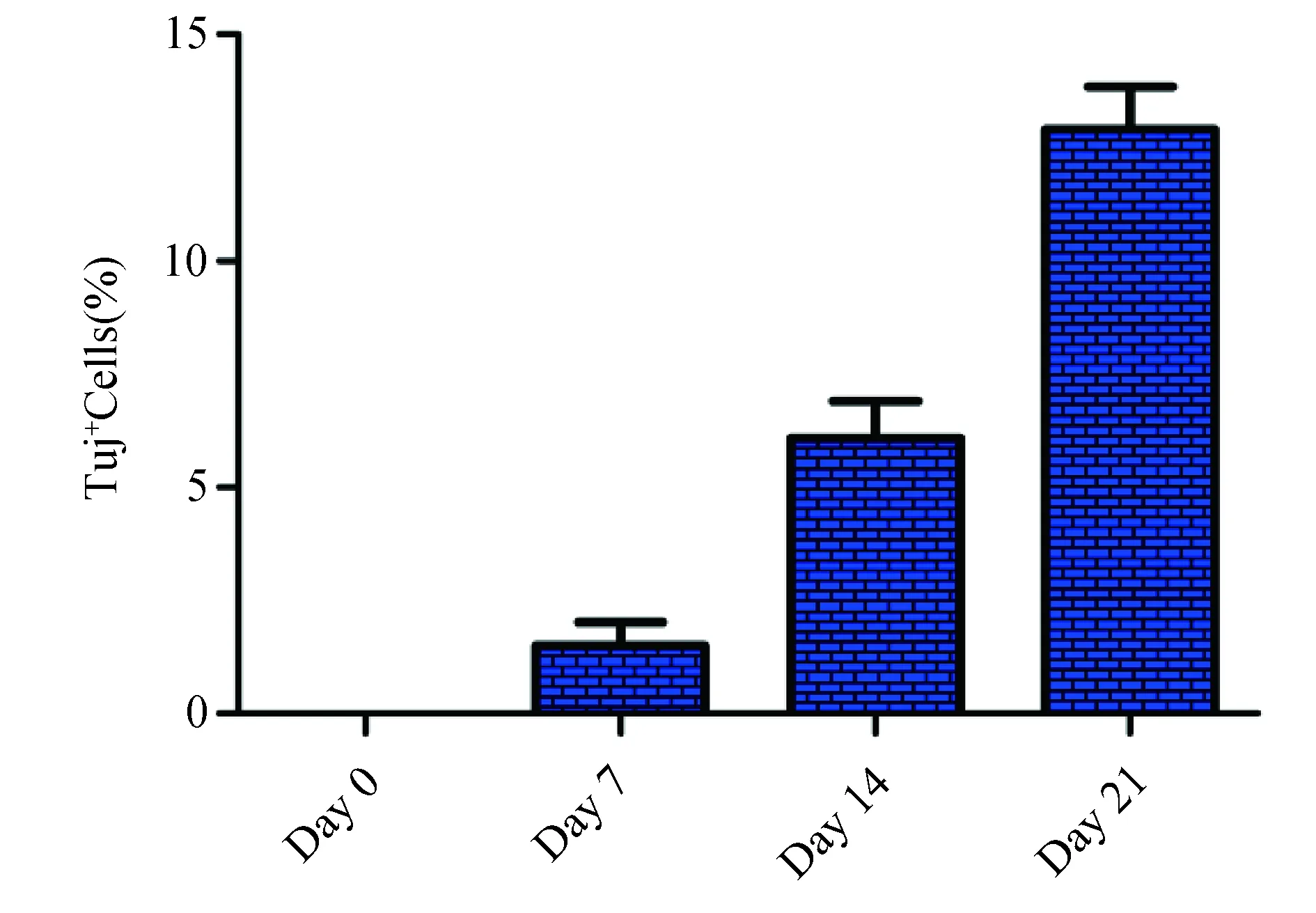
图2 体细胞重编程产生Tuj1+/GFP+的诱导效率
病毒转染后第28 d,Tuj1+/GFP+双阳性细胞占被转染细胞总数的比例,使用Ascl1、Sox2和OCT4 3个外源基因诱导为神经元的效率可达(11.90±0.85)%;Tuj1+/Ath1+双阳性细胞的数量呈现同样的趋势,在加入BMP4、FGF8b和Wnt3a因子的情况下,最高可达(5.35±0.80)%;而在没有添加3种因子的情况下,只有(2.20±0.42)%(图3)。不同诱导方案的诱导效率比较,差异有统计学意义(P<0.01)。
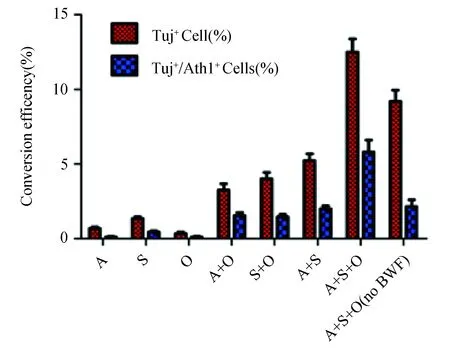
图3 不同诱导方案产生hiCGCs的效率
2.4 诱导产生hiCGCs的对照实验 作为对照,将人头皮成纤维细胞置于不含外源转录因子的N3培养体系中,只在培养液及BMP4、FGF8b、Wnt3a营养因子的作用下,结果显示有部分细胞在形态上表现出了向神经元样细胞转变的趋势,但形态不典型;且这部分形态变化的细胞不表达神经元特异蛋白Tuj1及Ath1。这表明,在没有外源诱导因子存在的情况下,成纤维细胞不能够转变为神经元或小脑颗粒样细胞。同时,将只介导表达GFP的慢病毒载体导入成纤维细胞内,结果显示被病毒感染的细胞表达绿色荧光,但形态上并没有发生变化,也不表达Tuj1;表明仅靠GFP蛋白不能诱导重编程。
2.5 hiCGCs表达小脑颗粒神经元特异性蛋白 除了使用Tuj1检测诱导神经元的产生,还使用免疫细胞化学的方法来检测MAP2和突触素蛋白(synapsin)等神经元标识(图4、5),以进一步确认所获得的重编程细胞是神经元。小脑颗粒神经元缺乏特异性标识,使用Ath1、Zic1、En1等小脑颗粒神经元相对特异的标志物结合Tuj1的表达来确认获得的神经元主要为小脑颗粒样神经元。此外,还检测到某些细胞表达部分神经元亚型的特征性蛋白,如谷氨酸能神经元(vGluT1)和GABA能神经元。在GFP+细胞上使用星形胶质细胞标志蛋白GFAP和少突胶质细胞标志蛋白MBP进行免疫细胞化学检测,结果显示,GFP+细胞无明显表达GFAP和MBP;表明本课题所采用的诱导体系主要将成纤维细胞诱导转变成为神经元。
蛋白免疫印迹法检测结果显示,Ascl1和Sox2表达水平从7 d~28 d呈现明显上升,而OCT4则维持在一个相对较低的表达水平。Ath1、NeuN和Pax6表达水平随时间的变化反映出由成纤维细胞向小脑颗粒神经元转化的过程。p53蛋白表达水平在整个过程中一直呈低水平表达,表明转化的过程及所获得的hiCGCs均具有一定的安全性。用qPCR检测Ascl1、Sox2和OCT4在进入细胞后的表达变化,发现其与western blot检测的结果基本一致,Ascl1和Sox2表达水平呈现比较明显的上升趋势,而OCT4的表达量则缓慢升高(图6),差异有统计学意义(P<0.05)。

图4 hiCGCs表达神经元标志物MAP2(Scale bar=200 μm)
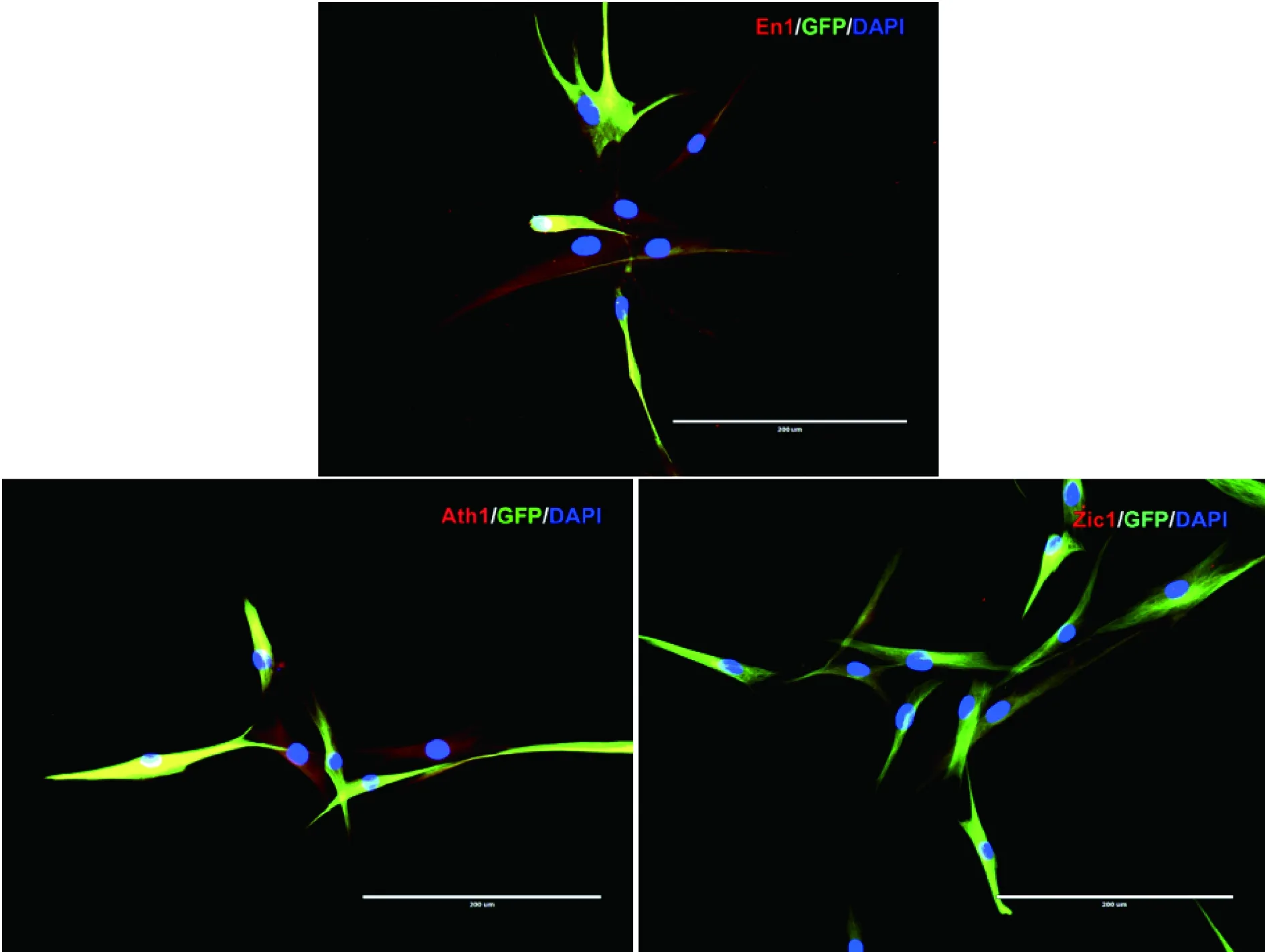
图5 hiCGCs表达小脑颗粒神经元标志物(Scale bar=200 μm)
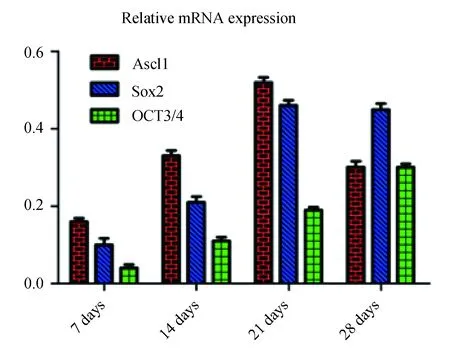
图6 外源诱导因子在hiCGCs内的表达水平动态变化
2.6 hiCGCs的神经电生理特性 在诱导重编程后28 d左右,在电流钳模式下显示,在150 pA下暴发第1次动作电位。动作电位保持在比较稳定的电压增量和波幅范围内。在电压钳模式下,保持钳制电压为-70 mV,观察到分化所得的hiCGCs具有活跃的电生理特性,表现出类似成熟神经元的动作电位特征。在电压钳模式下,给予刺激可以记录到NMDA/AMPA受体介导兴奋性突触后电流(EPSC),电压分别钳制在-80 mV和+40 mV。给予NMDA/AMPA受体拮抗剂(50 μM APV和5 μM NBQX),会被特异性阻断。这显示,诱导小脑颗粒样神经元具有谷氨酸能神经元的电生理特点,并在培养中与周围细胞形成了功能性突触联系,从而参与神经电信号的传导。实验结果表明,hiCGCs表达有电压门控离子通道,能发放兴奋性突触后电流,具有类似正常小脑颗粒神经元的电生理特性。
3 讨 论
首先使用脑发育(主要后脑)的主要转录因子构建一个诱导因子筛选的基因池[8-10]。通过多次筛选,选择了Ascl1、Sox2和OCT4三个因子。使用qPCR及western blot检测Ascl1、Sox2和OCT4三个外源诱导因子在进入细胞后的表达情况,Ascl1和Sox2表达随时间推移呈现比较明显的上调趋势,而OCT4的表达量则表现为持续缓慢升高。这表明,在成纤维细胞向小脑颗粒样神经元转变的过程中,Ascl1和Sox2可能起到主要的作用,而OCT4则可能是一个重要的辅助因子。故推测,Ascl1和Sox2首先形成了一个具有重要功能的同源结构域,这个蛋白质的二级结构对于启动重编程进程、打开染色体致密结构,在细胞水平上开启谱系转变具有决定性作用,进而召唤OCT4等转录因子结合到各自特定的目标位点上,从而打开小脑颗粒样细胞重编程所涉及的多个激活位点,在重编程过程中主要发挥启动/开关的作用,在整个基因组水平上推动了重编程事件的发生和发展。
神经营养因子BMP4、FGF8b和Wnt3a在整个诱导过程中起着重要的作用,在神经前体细胞向小脑颗粒神经元分化的过程中起着导向性的作用。在没有这三种营养因子的情况下,Tuj1+/Ath1+双阳性细胞的数量只有添加三种营养因子下的一半,而对Tuj1+的细胞数量则没有明显的影响。在Ascl1、Sox2和OCT4三个转录因子和BMP4、FGF8b和Wnt3a三个营养因子的共同作用下,神经元的转化效率及Tuj1+/Ath1+双阳性细胞达到最高。
神经元特异性蛋白的表达对于确认诱导细胞的属性十分重要,包括Tuj1、MAP-2、synapsin等[11-13]。Tuj1抗体是比较公认的神经元标志,已经被证实仅识别神经细胞的neuronal class Ⅲβ-tubulin。微管相关蛋白(microtubule-associated protein-2,MAP-2)在神经系统发育、形成和再生过程的不同时期发挥重要的作用,是神经元细胞骨架的重要组成成分。Synapsin是与突触囊泡相关的有代表性的磷酸蛋白,在神经递质释放和神经的早期发育分化的过程中扮演着重要的角色。说明诱导的hiCGCs表达神经元特异性标志物。通过监测hiCGCs的部分电生理特性,表明hiCGCs具有类似神经元的电活动,并具有一定功能。通过对GFAP及MBP的检测,显示诱导的hiCGCs不表达胶质细胞的特异性标志物。
小脑颗粒神经元缺乏特异性标识,Ath1、Zic1、En1是小脑颗粒神经元特异性相对较高的标志物。在Tuj1+/GFP+双阳性细胞中,可以检测到Ath1、Zic1、En1分别在不同的亚群中表达,Tuj1+/Ath1+细胞在Tuj1+/GFP+双阳性细胞中更有近一半的表达量。因此结合Tuj1及Ath1、Zic1、En1的表达,可确定Tuj1+/GFP+双阳性细胞主要为小脑颗粒样神经元,即hiCGCs。Ath1是小脑颗粒神经元产生所必需的物质,是第一个在活体内获得的能够产生颗粒细胞的基因,其表达提示小脑颗粒神经元的可能[9-10,14]。Zic1、En1、Pax6等也是特异性较高小脑颗粒神经元的标志物[9-10]。小脑颗粒神经元为谷氨酸能神经元[15],部分诱导细胞给予刺激可以记录到NMDA/AMPA受体介导兴奋性突触后电流,在谷氨酸受体拮抗剂(APV和NBQX)存在时,会被特异性阻断。通过多种小脑颗粒神经元特异性标志物的检测以及谷氨酸能神经元细胞电生理的检测,可以说明诱导的细胞为小脑颗粒样神经细胞。
为了证明诱导产生hiCGCs的体系具有特异性,作为对照,本实验将人头皮成纤维细胞置于不含外源转录因子的N3培养体系中(含神经营养因子BMP4、FGF8b和Wnt3a),检测是否也可能发生重编程。结果显示,只在含营养因子培养液的作用下,成纤维细胞不能够转变为小脑颗粒样神经元。还将只介导表达GFP的慢病毒载体导入人头皮成纤维细胞内,结果表明仅靠GFP不能诱导成纤维细胞发生重编程。
此外,转分化获取细胞的质量还受到一些目前尚不能确定的因素的影响。虽然本研究中转分化过程是在统一规范的条件下完成的,但获取细胞的质量并不完全一致,转化效率和细胞形态上存在一定的差异。现尚无法明确造成这些差异的因素,可能与头皮成纤维细胞的个体差异以及操作中的细微差别有关。如果可以明确此类因素的影响,有望进一步提高细胞转化的质量。
[1] Mikio H.Neuronal subtype specification in the cerebellum and dorsal hindbrain[J].Dev Growth Differ,2012,54:317.
[2] Aird C.Phenotypic heterogeneity of the endothelium:II.Representative vascular beds[J].Circ Res,2007,100:174.
[3] Bhavesh T,Parampreet S,Shrikant M.Spinocerebellar ataxia-10 with paranoid schizophrenia[J].Ann Indian Acad Neurol,2015,18:93.
[4] Hu T,Zhao B,Wei Q,etal.Unusual cerebral white matter change in a Chinese family with Spinocerebellar ataxia type 12[J].J Neurol Sci,2015,349:243.
[5] Rozenfeld N,Nemeth J,Walker T,etal.An investigation of diffusion imaging techniques in the evaluation of spinocerebellar ataxia and multisystem atrophy[J].J Clin Neurosci,2015,22:166.
[6] Francesco S,Giorgia P,Arturo B,etal.A randomized controlled pilot trial of Lithium in spinocerebellar ataxia type 2[J].J Neurol,2015,262:149.
[7] Erceg S,Moreno-Manzano V,Garita-Hernandez M,etal.Concise review:stem cells for the treatment of cerebellar-related disorders[J].Stem Cells,2011,29:564.
[8] Hirai H.Basic research on cerebellar gene therapy using lentiviral vectors[J].Cerebellum,2012,11:443.
[9] Hatten E,Alder J,Zimmerman K,etal.Genes involved in cerebellar cell specification and differentiation[J].Curr Opin Neurobiol,1997,7:40.
[10] Wang VY,Zoghbi HY.Genetic regulation of cerebellar development[J].Nat Rev Neurosci,2001,2:484.
[11] Bélanger C,Auclair F,Bertrand L,etal.The disposition of early-generated neurons in the rat embryo predicts the pattern of major axonal tracts[J].Brain Res Bull,1993,30:273.
[12] Berninger B,Costa MR,Koch U,etal.Functional properties of neurons derived from in vitro reprogrammed postnatal astroglia[J].J Neurosci,2007,27:8654.
[13] Su P,Zhang JB,Zhao F,etal.The interaction between microglia and neural stem/precursor cells[J].Brain Res Bull,2014,109:32.
[14] Srivastava R,Kumar M,Peineau S,etal.Conditional induction of Math1 specifies embryonic stem cells to cerebellar granule neuron lineage and promotes differentiation into mature granule neurons[J].Stem Cells,2013,31:652.
[15] Sillitoe RV,Morphology JA,Codes M.And circuitry produce the three-dimensional complexity of the cerebellum[J].Annu Rev Cell Dev Biol,2007,23:549.
(收稿2016-09-11 修回2016-10-23)
In vitro experimental study of reprogramming human fibroblasts into induced cerebellar granule cells
SHENGang,SUZuo-peng,QUANYong,etal.
DepartmentofNeurosurgery,CentralHospitalofMinhangDistrict,Shanghai,Shanghai201100,China
Correspondingauthor:QUANYong
Objectives Directly reprogram patients’ fibroblasts into human induced cerebellar granule cells (hiCGCs) and study the biological characteristics of these cells in vitro.Methods Screening inducing factors associated with cerebellar cell development and differentiation;build expression vector with transcription factors;collect and culture patients’ skin fibroblasts;use slow virus carrier mediated Ascl1,OCT4 and Sox2 transcription factors in intracellular expression,and add neurotrophic factor:BMP4,FGF8b and Wnt3a in the process of culture,get human induced cerebellar granule neurons (hiCGCs) with characteristics of cerebellar granule neurons).Results Confirm the hiCGCs with similar normal biology and physiology characteristics of cerebellar granule neurons via cell immunohistochemical and electrophysiological examination.By using three transcription factors Ascl1,OCT4 and Sox2 and three nutrition factors BMP4,FGF8b and Wnt3a,adult fibroblasts can be directly transformed into hiCGCs with the characteristics of cerebellar granule neurons.Conclusions HiCGCs are very similar with cerebellar granule neurons in morphology,can express granular specific proteins and similar normal electrophysiological characteristics of cerebellar granule neurons.
human induced cerebellar granular-like cells; regenerative medicine; lineage reprogramming
10.3969/j.issn.1672-7770.2017.01.008
国家自然科学基金(81471242)
201100 上海市闵行区中心医院神经外科(沈刚,苏作鹏,全勇,徐福林);复旦大学附属华山医院神经外科(徐锋)
全勇
R394.2,Q421
A
1672-7770(2017)01-0030-05

