腺苷预处理星形胶质细胞氧糖剥夺复氧糖后CX3CL1、GLT-1表达的变化
王 洁 韩艳艳 李 娟 毛向雷 牛草原 李艳艳 兰春伟 谭 军
(新乡医学院第三附属医院,河南 新乡 453000)
腺苷预处理星形胶质细胞氧糖剥夺复氧糖后CX3CL1、GLT-1表达的变化
王 洁 韩艳艳 李 娟 毛向雷 牛草原 李艳艳 兰春伟 谭 军
(新乡医学院第三附属医院,河南 新乡 453000)
目的 探讨在缺氧复氧情况下腺苷预处理诱导星形胶质细胞谷氨酸转运体蛋白(GLT-1)和趋化因子(CX3CL1)的表达变化。方法 原代培养的大鼠星形胶质细胞分为正常组、模型组和腺苷预处理组。模型组:细胞接受5 h氧糖剥夺/复氧糖24 h处理;腺苷预处理组:细胞在氧糖剥夺前24 h加入100 μmol/L腺苷后接受5 h氧糖剥夺/复氧糖24 h。在5 h氧糖剥夺/复氧糖24 h后观察各组的细胞形态、MTT法检测各组细胞活力,ELISA检测各组CX3CL1的相对表达情况,免疫荧光法及Western印迹法检测各组GLT-1的相对表达情况。结果 ①正常组、模型组和腺苷预处理组在氧糖剥夺5 h复氧糖24 h后细胞活力(OD值)分别是(0.763±0.065),(0.217±0.052)和(0.404±0.013),腺苷可以减少缺氧复氧引起的损伤(P<0.05)。②与正常组相比,星形胶质细胞在缺氧复氧后,其释放的趋化因子CX3CL1明显升高(P<0.05),GLT-1的表达明显降低(P<0.05)。与模型组相比,腺苷预处理组可明显降低缺氧复氧组CX3CL1的释放(P<0.05),以及增加缺氧复氧GLT-1的表达水平(P<0.05)。结论 腺苷预处理可使氧糖剥夺/复氧糖后CX3CL1的释放减少,GLT-1表达量升高,从而增强脑对缺血再灌注损伤的耐受。
CX3CL1;谷氨酸转运体蛋白;星形胶质细胞;氧糖剥夺/复氧糖
脑组织过度的炎症反应是造成脑缺血再灌注损伤的重要机制之一,脑缺血再灌注损伤炎症反应发生的关键是白细胞聚集并迁移至脑实质中。CX3CL1作为脑中主要的趋化因子,具有黏附、趋化、调节小神经胶质细胞、星形胶质细胞功能及神经保护等多重作用,参与脑缺血再灌注损伤的发生和发展〔1〕。谷氨酸积聚所致的兴奋性毒性被认为是脑缺血再灌注损伤的另一重要机制〔2〕。脑内清除谷氨酸的主要机制是谷氨酸转运体蛋白(GLT)-1将胞外谷氨酸重摄取至胞内,以终止谷氨酸的神经兴奋作用。星形胶质细胞膜上表达大量GLT-1,参与了大部分胞外谷氨酸的清除,但在缺血缺氧等条件下其功能表达会发生显著变化,从而导致谷氨酸兴奋性毒性。腺苷作为一种神经递质与G蛋白耦联受体(主要是受体A1)相结合后,激活ATP依赖的钾离子通道,抑制兴奋性氨基酸释放,阻止兴奋性氨基酸诱导的神经元除极效应,降低细胞膜对钙离子的通透性,扩张血管,抑制炎性细胞黏附和浸润,抑制血小板聚集以及减轻炎性细胞、自由基导致的血管内皮损伤。本研究探讨腺苷是否通过调节CX3CL1及GLT-1发挥抗脑缺血再灌注损伤作用。
1 材料与方法
1.1 材料 出生24 h内的SD大鼠,雌雄不限,体重10~12 g。由新乡医学院实验动物中心提供。高糖DMEM培养基,无糖DMEM(Gibco),胎牛血清,青链霉素,0.25%胰蛋白酶,MTT试剂盒,ELISA试剂盒,胶质纤维酸性蛋白(GFAP)抗体、GLT-1抗体均购自武汉博士德生物有限公司。
1.2 实验分组和OGD模型的建立〔3〕大鼠星形胶质细胞的原代培养参照参考文献〔4〕。将第三代融合80%以上的星形胶质细胞传代至24孔板内,随机分为正常组,模型组和腺苷预处理组。细胞经24 h基本贴壁并伸出突触,待细胞贴壁后腺苷预处理组给予腺苷预处理,即细胞换含100 μmol/L腺苷的DMEM预处理,24 h后进行氧糖剥夺。正常组不进行氧糖剥夺,模型组和腺苷预处理组在糖氧剥夺期分别更换为预热的无糖DMEM培养基,去培养板盖,放入95%氮气、5%CO2的培养箱中孵育。缺氧5 h后,模型组及腺苷预处理组均更换为预热的复糖DMEM培养基,转移到细胞培养箱内培养24 h。正常组在37℃、5%CO2培养箱中孵育。
1.3 星形胶质细胞形态学观察 用光学显微镜(德国Leica)直接观察各组细胞在氧糖剥夺复氧后形态变化。
1.4 细胞活性检测 取第3代星形胶质细胞以1×105个/ml的密度接种于96孔板,每孔细胞数为104个,待24 h后细胞基本融合后,氧糖剥夺处理过程如同上述,各孔加入相应的培养基100 μl,在再复氧复糖24 h时,每孔加入MTT50 μl,充分混匀,在细胞培养箱内继续孵育4 h后平板离心机1 000 r/min离心5 min,小心去除培养液,每孔加入150 μl DMSO,37℃摇晃10 min,用450 nm波长测定OD值,各实验组设5个复孔,独立重复3次。
1.5 ELISA检测CX3CL1表达 将对数生长期的星形胶质细胞以5×104个/ml的密度接种于24孔板中继续培养,待细胞基本融合后,吸弃培养液,进行随机分组,每组设3个复孔,重复3次,各组氧糖剥夺处理过程如同上述,各孔加入相应的培养基1 000 μl,在再复氧复糖24 h时,收集各组细胞上清液,按大鼠试剂盒进行CX3CL1测定。
1.6 免疫荧光测GLT-1的表达〔4〕取第3代星形胶质细胞传代至24孔板内,随机分为正常组、模型组、腺苷预处理组(ADO/R),氧糖剥夺过程如上述。24 h细胞贴壁后,用PBS漂洗3次,4%多聚甲醛固定10 min,弃去,PBS洗3次,0.1%Triton-X 100作用10 min,PBS液漂洗3次,5%BSA封闭1 h,弃封闭液,加入兔抗GLT-1抗体(1∶200稀释),孵育过夜,弃一抗,PBS液漂洗3次,加FITC标记的羊抗兔IgG抗体(1∶200稀释),室温孵育1 h,弃二抗,荧光显微镜下观察拍照。观察照相后以Image Pro-Plus 6.0软件分析得出平均吸光度值及荧光强度。
1.7 Western印迹测GLT-1表达量 分别消化各组缺氧复氧后的细胞,加上蛋白裂解液,冰上裂解20 min,测定蛋白浓度,加入上样缓冲液,沸水变性5 min,每孔加入40 μg蛋白样品电泳,用NC膜转膜,封闭后加一抗(1∶500稀释),4℃孵育过夜,加入HRP标记的二抗,37℃孵育1 h,ECL显影,GAPDH作为内参对照,用ImageJ软件分析荧光条带吸光度值。以目的蛋白GLT-1与内参的比值进行统计分析。
1.8 统计学方法 采用SPSS17.0统计软件进行单因素方差分析,两两比较均采用Turkey法。
2 结 果
2.1 星形胶质细胞的原代培养及鉴定结果 分离培养的星形胶质细胞接种2 h 开始贴壁生长,3 d后胞体增大,7 d时基本成熟,胞体较大、扁平、形状多样,从胞体发出许多长而分支的突起,形成密集的细胞网络。原代培养星形胶质细胞传到第3 代后,用兔抗GFAP 多克隆抗体进行免疫荧光染色,可见细胞阳性率达95%以上;荧光显微镜下显示清晰的星形胶质细胞,轮廓清晰,胞质中呈绿色荧光,胞核处荧光浅淡,胞体宽大而扁平,发出多个短而粗大的突起,形态不规则,相互连接成片。见图1。
2.2 各组星形胶质细胞形态观察及活力检测结果 糖氧剥夺复糖氧后正常组星形胶质细胞生长状态良好,折光性强,相连的细胞之间形成大量的突触联系,与氧糖剥夺复氧糖前相比无明显形态学变化。模型组星形胶质细胞胞体水肿变圆,细胞形态由不规则变成梭形,突起明显变短或消失;腺苷预处理组细胞水肿较轻。见图2。
2.3 MTT 与细胞的形态变化相一致。正常组、模型组、腺苷预处理组在氧糖剥夺5 h复氧24 h后细胞活力(OD值)分别是(0.763±0.065),(0.217±0.052),(0.404±0.013)。模型组星形胶质细胞活力下降,明显低于正常组(P<0.05)。腺苷预处理组细胞活力显著高于模型组,表明腺苷与处理组能明显改善细胞活力(P<0.05)。三组间两两比较差异显著(P<0.05)。
2.4 糖氧剥夺复糖氧24 h后细胞培养液中CX3CL1浓度 模型组星形胶质细胞CX3CL1浓度明显高于正常组(P<0.05),表明细胞受到缺氧缺糖损伤,细胞损伤严重,释放大量CX3CL1;与模型组比较,腺苷预处理组细胞损伤轻,CX3CL1释放减少(P<0.05)。
2.5 GLT-1免疫荧光结果 正常组胞膜及胞质中荧光信号最强;糖氧剥夺复糖氧后,胞膜荧光信号减弱;而胞质中荧光表达弱且无明显变化。与模型组相比,腺苷预处理组胞膜荧光强度降低但高于正常组。见图3。
2.6 Western印迹检测氧糖剥夺/复糖后GLT-1的表达 如图4所示,正常组星形胶质细胞在氧糖剥夺5 h复氧糖24 h后蛋白表达相对最高,腺苷预处理组次之,模型组最低(P<0.05)。
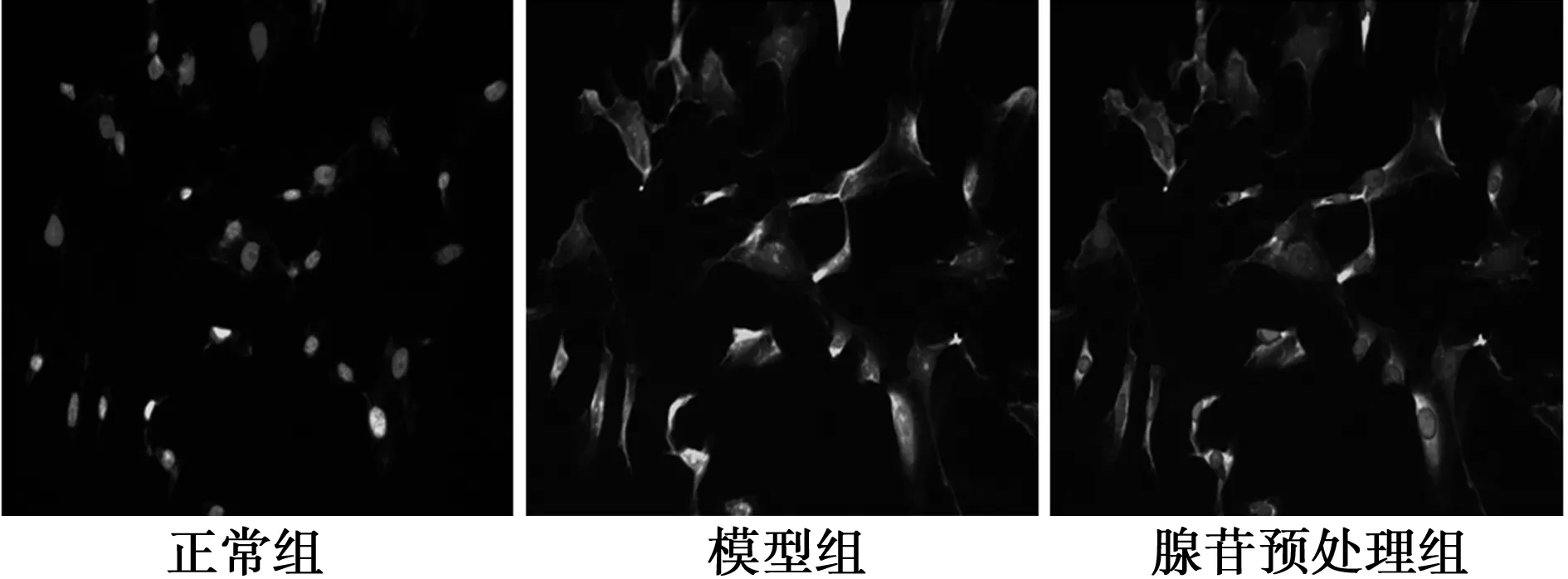
图1 免疫荧光染色鉴定星形胶质细胞(×200)
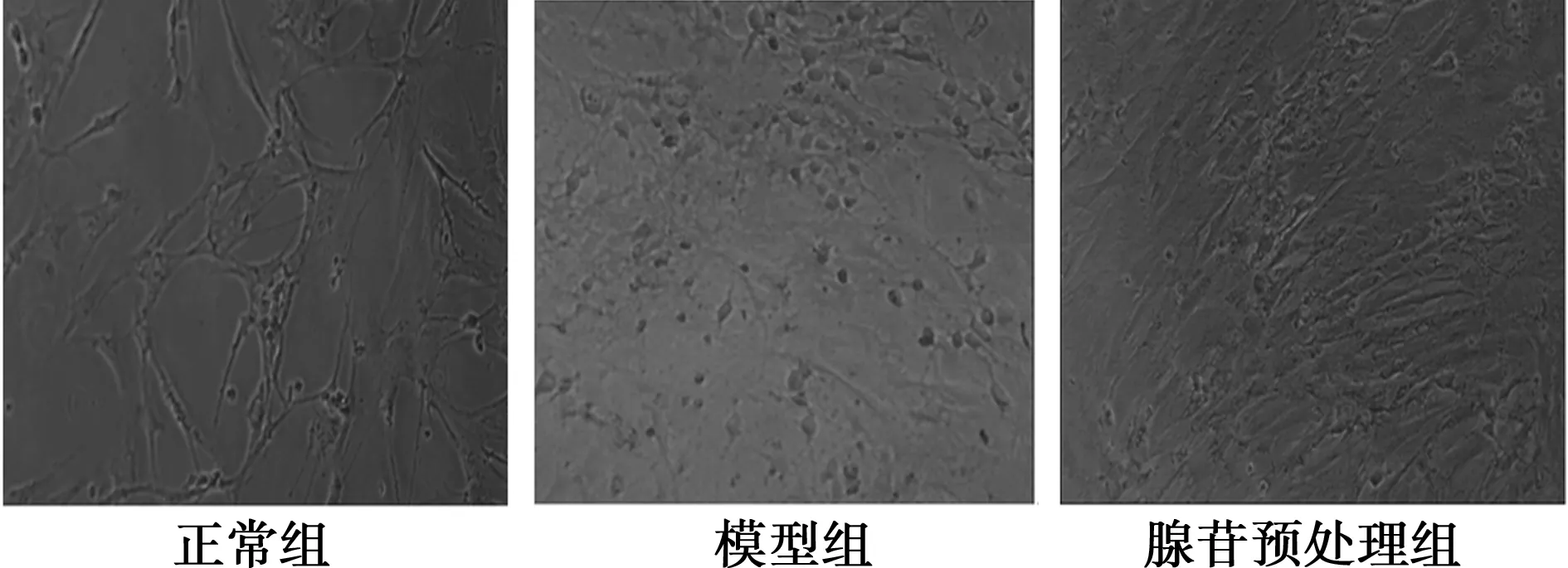
图2 各组星形胶质细胞缺氧复氧后的形态学改变(×100)

图3 各组GLT-1免疫荧光结果(×200)

图4 各组细胞在氧糖剥夺5 h复氧糖24 h后GLT-1的表达
3 讨 论
近年研究表明,缺血后的血流恢复在某些情况下能导致进一步的组织损伤和功能障碍,这种恢复血流灌注后的有害情况称为缺血再灌注损伤(IRI)〔6〕。虽然目前人们对其病理机制进行了深入研究发现,其病理过程是一个多因素、多机制,涉及复杂的时间和空间的级联反应。脑缺血再灌注损伤机制复杂,炎症反应在其中的作用越来越受到重视。脑缺血再灌注损伤的最早反应是局部白细胞迁移、炎性细胞因子出现和增多。另外,炎症反应会加大梗死核心区周围区域神经细胞损伤。在此过程中,趋化因子是调节白细胞迁移和小神经胶质细胞活化的关键因素。能在脑中持续表达的趋化因子极少,CX3CL1 为其中之一〔7〕。它对中性粒细胞、淋巴细胞及单核细胞均有趋化作用。研究表明,仅基质细胞衍生因子和CX3CL1可在中枢神经系统持续表达〔8〕。趋化因子与炎症过程密切相关,能吸引炎性细胞在炎症区域聚集,参与调控白细胞迁移,在炎症中诱导性表达。有人提出趋化因子能增加血脑脊液屏障通透性,使炎性细胞及因子在病灶处聚集,加重脑损伤。生理状态时小鼠的CX3CL1几乎仅存在于大脑,其特异性受体CX3CR1 在脑中也呈高表达,CX3CL1 及受体主要分布于大脑皮质、海马、基底神经节、纹状体及嗅球,主要表达于皮质板层Ⅱ、Ⅲ、Ⅴ、Ⅵ及海马CA1 区胶质细胞和神经元上,在脑干、小脑仅少量表达〔9〕。CX3CL1是目前发现唯一不依赖黏附因子而介导炎性细胞及炎症介质黏附于内皮细胞的趋化因子,能加快炎性因子渗出,促进炎症级联反应发生,独特的结构和生物特性使其可能在缺血再灌注损伤中起重要作用〔10〕。脑缺血再灌注损伤中的炎症反应在缺血再灌注损伤过程十分复杂〔11〕,其特点是血脑脊液屏障崩裂导致白细胞穿透血脑屏障并在损伤区异常聚集黏附。在缺血1~48 h 内出现明显的中性粒细胞浸润和聚集,2~15 d单核细胞浸润明显。缺血再灌注时缺血处血管内皮细胞出现功能障碍,各种趋化因子及炎症介质表达增加,白细胞在缺血处聚集,且与微血管内皮细胞间黏附性增强,白细胞贴壁、嵌塞并游出微血管外,释放大量氧自由基和炎性因子,导致神经元继发性损伤。除炎性细胞因子和黏附分子外,趋化因子及其受体在白细胞聚集进入缺血性损伤部位中发挥关键作用〔12〕。缺乏CX3CR1 不会诱发脑缺血后小胶质细胞的神经毒性,而是显著降低了脑缺血的损伤和炎症反应。
兴奋性氨基酸毒性是脑缺血再灌注损伤的另一重要因素。谷氨酸是中枢神经系统内的主要兴奋性神经递质,对维持正常脑功能至关重要,但过高浓度的谷氨酸又具有很强的神经毒性。研究表明,谷氨酸的兴奋性毒性是脑缺血再灌注损伤的重要机制之一〔13〕。因此,降低脑缺血再灌注时细胞外液中谷氨酸的浓度,是减轻神经元损伤的重要策略。脑内细胞外没有谷氨酸代谢酶,脑内细胞外谷氨酸的稳态主要依靠高亲和力兴奋性氨基酸转运体系统(EAATs)维持〔14〕。目前,已经克隆出5种高亲和力谷氨酸转运体,包括EAAT1(GLAST)、EAAT2、EAAT3(EAAC1)、EAAT4、EAAT5。EAAT2主要分布在星形胶质细胞膜上,又称为胶质细胞GLT-1〔15〕。GLT-1在清除突触间隙的谷氨酸、维持细胞外液谷氨酸浓度处于低水平、防止其兴奋性毒性方面发挥重要作用。研究发现,GLT-1表达上调在脑缺血预处理诱导的脑缺血耐受中发挥重要作用,提示GLT-1的功能异常在缺血性脑损伤中发挥重要作用,调制GLT-1的表达和功能、增强其摄取谷氨酸的能力,有可能成为脑缺血类疾病预防和治疗研究的新靶点〔16〕。
腺苷用于脑缺血再灌注损伤的预处理作用效果好,价格便宜,且腺苷预处理方面已取得了一定的成果〔17〕。腺苷能抑制EAA的释放,降低细胞膜对钙离子的通透性,抑制炎性细胞黏附和浸润,抑制血小板聚集,减轻自由基引起的血管内皮损伤,是一种内源性神经保护剂,腺苷的作用是通过特异性腺苷受体调节的,腺苷受体分为A1、A2、A3三种〔18〕。缺血预处理时用药物阻断A1受体或ATP通道能阻断缺血耐受的形成。A1R在脑缺血中具有神经保护作用原代培养的皮质或海马神经元细胞,在糖-氧剥夺的条件下给予A1R选择性激动剂环己基处理后,其细胞损伤明显减轻,而A1R特异性拮抗剂可加重同一缺氧模型所诱导的细胞损伤〔19〕。同样,在脑缺血的动物模型中也有类似发现。这些都提示A1R对脑缺血再灌注损伤具有保护作用。本实验腺苷通过抑制CX3CL1的释放及上调GLT-1的表达,产生脑保护效应。
1 石荷洁,霍 星.趋化因子Fractalkine在脑缺血再灌注损伤中的作用〔J〕.新乡医学院学报,2014;22(1):11-3.
2 龚俭雪.脑缺血预处理通过 p38 MAPK介导 GLT-1 蛋白表达上调而诱导脑缺血耐受〔D〕.石家庄:河北医科大学,2011.
3 邢 东,董 辉,朱明霞.体外培养大鼠皮层神经元和星形胶质细胞氧糖剥夺后 DDR1的表达情况〔J〕.陕西医学杂志,2014;2(2):133-6.
4 黄素素,张云云,孙 波,等.大鼠皮质星形胶质细胞氧糖剥夺后Slit2,Robo1 的表达研究〔J〕.中风与神经疾病杂志,2012;29(1):4-8.
5 李晋辉,李德渊,陈大鹏,等.整合素β8在星形胶质细胞氧糖剥夺后对TGF-质细胞的活化影响〔J〕.中国当代儿科杂志,2014;16(1):73-6.
6 Lin C,Wang N.Rho kinases and ischemic cerebrovascular diseases〔J〕.2014;8(1):3-5.
7 Kim E,Yang J,Beltran CD,etal.Role of spleen-derived monocytes/macrophages in acute ischemic brain injury〔J〕.J Cerebral Blood Flow Metab,2014;9(1):14-6.
8 Limatola C,Ransohoff RM.Modulating neurotoxicity through CX3CL1/CX3CR1 signaling〔J〕.Fron Cellular Neurosci,2014;8(10):19-20.
9 Briones TL,Woods J,Wadowska M.Chronic neuroinflammation and cognitive impairment following transient global cerebral ischemia:role of fractalkine/CX3CR1 signaling〔J〕.J Neuroinflamm,2014;11(1):13-6.
10 Rosito M,Lauro C,Chece G,etal.Transmembrane chemokines CX3CL1 and CXCL16 drive interplay between neurons,microglia and astrocytes to counteract pMCAO and excitotoxic neuronal death〔J〕.Front Cellular Neurosci,2014;8(11):25-30.
11 周美君.大鼠脑缺血再灌注后炎症介质FKN,MCP-1,TNF-α表达变化的研究〔D〕.长沙:中南大学,2012.
12 王 莹,管业秋,李文媛,等.神经干细胞移植对脑缺血再灌注损伤大鼠CXC趋化因子1和2及其趋化因子受体2表达的影响〔J〕.新乡医学院学报,2012;29(1):13-7.
13 魏秀娥,荣良群,张清秀,等.Rho激酶抑制剂盐酸法舒地尔对脑缺血再灌注损伤大鼠海马谷氨酸6受体表达及神经细胞凋亡的影响〔J〕.中华行为医学与脑科学杂志,2013;22(9):776-9.
14 Gong J,Gong S,Zhang M,etal.Cerebral ischemic preconditioning reduces glutamate excitotoxicity by up-regulating the uptake activity of GLT-1 in rats〔J〕.Aminoacids,2014;46(6):1537-45.
15 Yang ZB,Zhang Z,Li TB,etal.Up-regulation of brain-enriched miR-107 promotes excitatory neurotoxicity through down-regulation of glutamate transporter-1 expression following ischaemic stroke〔J〕.Clin Sci,2014;127(12):679-89.
16 Wang X,Zhang M,Yang SD,etal.Pre-ischemic treadmill training alleviates brain damage via GLT-1 mediated signal pathway after ischemic stroke in rats〔J〕.Neuroscience,2014;9(11):13-5.
17 李 杨.腺苷及其受体对缺血性脑损伤的影响〔J〕.医学信息,2014;10(12):14-6.
18 王皓香.腺苷受体A1与A2A相互作用对缺血性脑损伤的影响〔D〕.重庆:重庆医科大学,2012.
19 王皓香,范文辉,刘 斌,等.腺苷受体A1与A(2A)相互作用对小鼠大脑中动脉缺血/再灌注损伤区谷氨酸转运体GLT-1表达的影响〔J〕.实用临床医药杂志,2012;16(3):1-5.
〔2015-09-30修回〕
(编辑 苑云杰/曹梦园)
王 洁(1987-),女,硕士,医师,主要从事脑血管疾病研究。
R3
A
1005-9202(2017)02-0288-04;
10.3969/j.issn.1005-9202.2017.02.013

